Иммунный статус при хронических гепатитах
Читинская государственная медицинская академия
При этом не в полной мере выяснены вопросы, касающиеся состояния системы иммунитета в зависимости от клинических факторов – наличия репликации, активности процесса, стадии и длительности заболевания, наличия сопутствующей патологии, генотипа HCV, что может иметь важное практическое значение [1].
Таким образом, многие аспекты иммунного ответа при гепатите С остаются невыясненными, в том числе в зависимости от стадии фиброза печени и длительности заболевания, хотя это актуально как в теоретическом, так и в практическом плане.
Цель исследования: изучить некоторые показатели иммунного статуса больных хроническим вирусным гепатитом С в зависимости от ряда клинических характеристик заболевания.
Диагноз хронического вирусного гепатита С выставлен на основании клинико-лабораторных данных и обнаружения рибонуклеиновой кислоты (РНК) HCV методом полимеразной цепной реакции (ПЦР). Длительность заболевания до 5 лет выявлена у 66,7%, свыше 5 лет – у 33,3%. Первая степень биохимической активности процесса определялась у 55,0% больных хроническим вирусным гепатитом С (ХВГС), вторая – у 45,0%. Стадия заболевания по Metavir F0-F1 была диагностирована у 43,5% (30); F2 – у 42,0% (29); F3-F4 – у 14,5% (10).
Группу контроля составили 9 здоровых человек в возрасте от 27 до 42 лет, средний возраст 34,0±2 лет. Женщин было 66,7% , мужчин – 33,3%. От всех обследованных получено добровольное информированное согласие на участие в исследовании.
Кровь для иммунологического обследования получали путем пункции локтевой вены в строго стерильных условиях на 2-3-и сутки стационарного лечения. Взятие крови осуществляли в утренние часы (8-9 часов) строго натощак. Для иммунофенотипирования кровь забирали в пробирку VACUTAINER (BD), содержащую динатриевую соль ЭДТА объемом 2,5 мл.
Определение показателя лимфоцитарно-тромбоцитарной адгезии (ЛТА) проводили по методу, предложенному Ю.А. Витковским и соавт. (1999) [2]. Свежую гепаринизированную кровь обследуемых больных наслаивали на градиент урографин-фикол (плотность 1,077) и выделяли лимфоциты. Собирали интерфазное кольцо, содержащие клетки и кровяные пластинки, однократно промывали фосфатно-солевым буфером (рН 7,4) и центрифугировали при 1000 об/мин в течение 3-4 минут. Надосадочную жидкость сливали, осадок микроскопировали в камере Горяева. Показатель ЛТА выражали числом лимфоцитарно-тромбоцитарных коагрегатов на 100 клеток (норма – 13-15%). Степень адгезии (ЛТИ) определяли как число кровяных пластинок, адгезированных на поверхности одного лимфоцита (норма – 3,0±0,3).
Статистическая обработка полученных результатов осуществлялась с использованием пакета анализа Microsoft Excel. Она включала описание выборки, нахождение средней арифметической, среднеквадратического отклонения и ошибки средней арифметической, определялись частоты встречаемости признаков, группировка данных. Достоверность различий определялась по t-критерию Стьюдента.
Результаты и их обсуждение. Установлено, что у всех больных хроническим вирусным гепатитом С изменены показатели иммунограммы, по сравнению с контролем, при этом аналогичные закономерности определялись вне зависимости от стадии фиброза печени (табл. 1). Общими изменениями, по сравнению с контролем, явились значимое повышение относительного и абсолютного количества лимфоцитов, субпопуляций CD3+, CD3+CD4+, активированных Т-лимфоцитов (CD3+HLA-DR+), активированных Т-хелперов (CD3+CD4+HLA-DR+), активированных Т-киллеров (CD3+CD8+HLA-DR+). Одновременно отмечено снижение, по сравнению с контролем, процента и количества субпопуляций лимфоцитов CD19+ и CD3-CD16+CD56+. Повышенным оказался и иммунорегуляторный индекс (CD4+/CD8+).
В табл. 2 представлены средние показатели иммунограммы больных хроническим вирусным гепатитом в зависимости от степени активности процесса, в сравнении с контролем. Изменения иммунограммы аналогичны описанным выше, при этом значимых отличий между первой и второй степенью активности не зарегистрировано.
Изменения показателей иммунограммы у больных хроническим вирусным гепатитом С в зависимости от длительности заболевания представлены в табл. 3. Выявлено, что чем продолжительнее стаж болезни, тем значимо больше становилось активированных Т-лимфоцитов (р
Список использованных источников:
1. Баранов А.В. Эпидемиологические факторы и клинико-иммунологические аспекты патогенеза хронического гепатита С: Автореф. дис. … докт. мед. наук. – М., 2009. – 47 с.
2. Феномен лимфоцитарно-тромбоцитарного розеткообразования/ Ю.А. Витковский, Б.И. Кузник, А.В. Солпов// Иммунология. – 1999. – № 4. – С. 35-37.
3. Агрегация тромбоцитов, лимфоцитарно-тромбоцитарная адгезия и группы крови АВ0 у больных гриппом A(H1N1)/2009/ Е.Е. Гергесова, Ю.А. Витковский, А.В. Солпов// ЭНИ Забайкальский медицинский вестник. – 2011. – № 1. – С. 4-9.
4. Марченко Л.И. Оценка иммунологической реактивности больных хроническим вирусным гепатитом С// Матер. VI Росс. съезда врачей-инфекционистов. – СПб., 2003. – С. 381.
6. Хронический гепатит С/ И.И. Орлова, З.М. Зайнудинов, Б.С. Каганов// Вопросы современной педиатрии. – 2004. – Т. 3, № 4. – С. 37-47.
7. Семененко Т.А. Клеточный иммунный ответ при гепатите С// Вирусные гепатиты. – 2000. – № 1. – С. 11-17.
8. Скляр Л.Ф. Система цитокинов и показатели оксидативного стресса при хроническом гепатите С с учетом иммунокорригирующей терапии: дис. … канд. мед. наук. – Владивосток, 2006. – 270 с.
Самарский государственный медицинский университет
Хронический вирусный гепатит С (ХВГС) на сегодняшний день остается важной проблемой среди инфекционных болезней как в нашей стране, так и во всем мире. Особенно настораживает тот факт, что заболеваемость хроническим вирусным гепатитом молодеет. Широкое распространение гепатита С, большей частью среди молодого, наиболее трудоспособного населения, латентность его течения, выраженность неблагоприятных исходов – цирроза печени и гепатоцеллюлярной карциномы – придают этой патологии характер важной общемедицинской проблемы [1].
Важная роль в развитии хронического течения вирусных гепатитов принадлежит иммунной системе. В патогенезе, течении и исходах парентеральных гепатитов ведущая роль отводится иммунным механизмам [2].
В развитии и исходах ХВГ решающее значение имеет состояние организма ребенка, в частности, его иммунной системы.
Особенности взаимоотношений с иммунной системой предопределяют как разнообразие клинических форм заболевания, так и исходов ХВГ. Иммунодиагностика при всех процессах имеет значение для изучения этиопатогенеза заболевания, прогнозирования обострения, для выбора метода лечения и оценки его эффективности [3].
Целью являлось изучение иммунологических особенностей хронического вирусного гепатита С у детей и подростков в зависимости от фазы заболевания и оценка состояния клеточного и гуморального звена иммунитета.
Материалы и методы исследования. Учитывая данные, полученные при клинико-биохимическом обследовании детей и подростков, нами проведено исследование состояния иммунной системы у больных с ХВГС. Мы исследовали состояние клеточного и гуморального звена иммунитета у 90 детей и подростков с хроническим вирусным гепатитом С. Больные были в возрасте от 7 месяцев до 18 лет. В соответствии с поставленным диагнозом больные ХВГС были разделены на две фазы: репликативная и вне фазы репликации. У 51 пациента с ХВГС наблюдалась фаза репликации.
Диагноз ставился в соответствии с современными требованиями, с учетом классификации хронических гепатитов (Лос-Анджелес, 1994) [4].
В соответствии с поставленными задачами были проведены клинические наблюдения и исследования с применением общеклинических, биохимических, инструментальных, иммунологических методов, позволяющих получить наиболее полную и объективную информацию о наблюдаемых детях, больных ХВГ. Верификация диагноза проводилась методом ПЦР и ИФА.
Полученные в ходе работы данные, регистрировались в индивидуальных картах с одновременным кодированием для последующей компьютерной обработки. Для оформления результатов исследований применялись пакеты из системы Microsoft Office 2010 и CorelDraw 13.
Результаты исследования. По литературным данным в настоящее время ведется активное изучение патологии хронических вирусных гепатитов (ХВГ) с клинико-иммунологических позиций. В основе патогенеза ХВГ лежат глубокие нарушения иммунного ответа с дисбалансом количественного и качественного состава иммунокомпетентных клеток, с нарушением их функциональной активности и клеточной кооперации.
В иммунном статусе больных детей и подростков регистрировались признаки комбинированной иммунной недостаточности.
При анализе иммунограммы мы определили дисбаланс хелперного и супрессорного звеньев иммунитета. Недостаток супрессоров усиливает выработку антител и образование иммунных комплексов, что вызывает аутоиммунные поражения.
Многими исследователями было отмечено, что иммунные нарушения при ХВГС, в основном, характеризуются дефектами Т-клеточного звена иммунитета, как количественного, так и качественного состава Т-клеток. Результаты определения показателей общего иммунного статуса в сыворотке крови детей и подростков, больных хроническим вирусным гепатитом С представлены в табл. 1.
Таблица 1. Иммунологические показатели крови у детей и подростков, больных ХВГС в репликативную фазу и вне фазы репликации
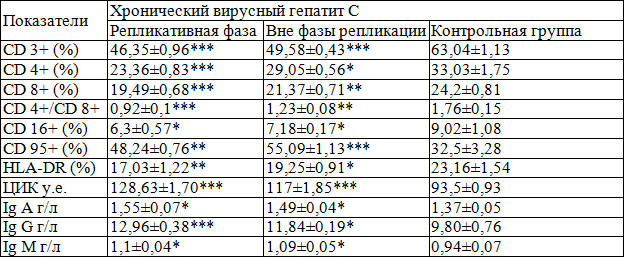
Примечание. Уровни достоверности различия с контролем: *- р
Список использованных источников:
1. Макашова В.В., Яковенко М.А., Флоряну А.И., Токмалаев А.К. и др. Особенности иммунитета у больных хроническим гепатитом С// Эпидемиология и инфекционные болезни. –2009. – №2. – С. 58-62.
2. Нагоев Б.С., Понежева Ж.Б. Некоторые аспекты иммунопатологии при хронических гепатитах// Эпидемиология и инфекционные болезни – 2009. – №6. – С. 45-48.
3. Хаитов Р.М., Пинегин Б.В. Оценка иммунного статуса человека в норме и при патологии// Иммунология –2001. – №4 – С. 4-6.
5. Ивашкин В.Т., Мамаев С.Н., Лукина Е.А. Особенности иммунного ответа у больных хроническим вирусным гепатитом С// Российский журнал гастроэнтерологии, гепатологии, колонопроктологии. - 2002. - ТД1. - 3. - С. 24-29.
6. Наследникова И.О., Белобородова Е.В., Рязанцева Н.В. Иммунорегуляторные цитокины и хронизация вирусного гепатита С: клинико-лабораторные параллели // Клин. мед. - 2005. - Том 83, №9. - С. 40-44.
7. Идрисова А.С. Клинико-иммунологические особенности хронического гепатита С у детей Ставропольского края: Дис. … канд. мед. наук. - Ставрополь, 2006. - 146 с.
8. Бадья С.А. Прогностическое значение клинико-иммунологических показателей при вирусном гепатите С: Автореф. дис. … канд. мед. наук. – СПб., 2000, 21 с.
9. He S.Y., Chuang L., Xue B.D. Protection or damage: a dual role for the virus-specific cytotoxic T lymphocyte response in hepatitis В and С infection// Curr Opin Microbiol. - 2000 Aug - 3(4) - Р. 387-392.
10. Тюренкова Н.В. Клинико-эпидемиологическая характеристика острого и хронического гепатита С с учетом иммунологических показателей и лечения: Автореф. дис. … канд. мед. наук. - СПб., 2003. - 25 с.
11. Leroy V., Vigan I., Mosnier J.F. Phenotypic and functional characterization of intrahepatic T lymphocytes during chronic hepatitis С// Hepatology. - 2003 Oct -38(4) - p. 829-841.
12. Горячева Л.Г. НВ- и НС-вирусные инфекции у детей, инфицированных в раннем возрасте: Автореф. дис. … канд. мед. наук. - М., 2005.
13. Neau-Cransac M., Foucher J., Ledinghen V.D. Modifications of T-lymphocyte subsets before and during interferon and ribavirin treatment for chronic hepatitis С infection// Viral Immunol. - 2005 -18(1) - Р. 197-204.
14. Гусев Д.А. Хронический гепатит С: течение, прогноз и лечение больных в военно-медицинских учреждениях: Автореф. дис. … д-ра мед. наук. – СПб., 2006.
15. Ивашкин В.Т. Взаимодействие вирусов гепатита В и С с клетками иммунной системы макроорганизма// Клиническая лабораторная диагностика. – 2001. № 7. С. 45-48.

Исследования, указывающие на роль цитокинов в функционировании головного мозга, могут дать основу для понимания патофизиологии нарушений психического здоровья при персистирующих инфекциях у предрасположенных к подобным реакциям пациентов. Поиск связи психических нарушений при хронических вирусных гепатитах с состоянием иммунного статуса нам представляется актуальной целью исследования.
Материалы и методы исследования
Из исследования были исключены пациенты с противовирусным лечением в анамнезе, с тяжелой сопутствующей патологией, которая могла бы оказать влияние на поражение печени, исключались больные, злоупотребляющие лекарственными препаратами, с наличием алкогольного анамнеза или факта внутривенного употребления опиатов в настоящий момент.
Определение содержания CD3+, CD4+, CD8+, CD22+, CD56+, CD95+ несущих лимфоцитов проводили иммуноцитохимическим методом с использованием набора реагентов фирмы Dako (Дания). Определение концентрации IFN-g, TNF-a, IL-2, IL-4, IL-10 и IL-12 в супернатантах культивированных мононуклеаров проводили с использованием твердофазного иммуноферментного метода по инструкциям производителя тест-систем (Procon, Россия; Cytimmune, США).
Изучение показателей гуморального иммунитета включало в себя определение концентраций сывороточных иммуноглобулинов А, М, G путем использования метода радиальной иммунодиффузии в агаровом геле по Манчини, а также определение содержания в сыворотке крови циркулирующих иммунных комплексов (ЦИК) методом преципитации раствором полиэтиленгликоля.
Для выявления и оценки непсихотических психических нарушений использовали следующие опросники и шкалы: стандартизированный многофакторный опросник для исследования личности (СМИЛ), шкалу самооценки уровня тревожности (разработана Ч.Д. Спилбергегом и адаптирована Ю.Л. Ханиным), опросник Бека.
Для статистического анализа использовали непараметрические методы. Проводилась проверка на нормальности распределения данных. При оценке различий между качественными характеристиками независимых выборок использовался критерий хи-квадрат Пирсона с поправкой Йейтса на непрерывность. При сравнении независимых выборок применяли критерий Манна-Уитни. Для определения взаимосвязи между переменными вычисляли коэффициенты корреляции Спирмена. Критический уровень значимости при проверке статистических гипотез принимался равным - 0,05. Результаты представлены в виде среднего с указанием стандартной ошибки (M±m).
Результаты исследования и их обсуждение
Для оценки связи состояний психической дезадаптации, выявленной у больных с ХВГ, с цитокиновой продукцией мононуклеаров, больные были разделены на две группы: группа с уровнем Т-баллов менее 50 и группа с показателями Т-баллов выше 50, выявляющими группу риска для развития невротических нарушений. Анализ связи цитокинпродуцирующей способности проводился по всем шкалам индивидуально-психологического профиля СМИЛ и теста реактивной и личностной тревожности Спилбергера-Ханина. При этом был обнаружен высокий уровень как базального, так и стимулированного синтеза ИФН-γ в два раза у больных с высокими значениями по шкале депрессии и у больных с высокой реактивной тревожностью. Индекс стимуляции ИФН-γ был выше в два раза у пациентов с повышенными значениями шизоидности и гипомании. Базальный уровень ФНО-α был в два раза выше в группе пациентов с высокими значениями по шкале ипохондрии. В то же время базальный и стимулированный уровни ФНО-α были значительно снижены у пациентов с наиболее выраженным депрессивным типом личности. При анализе наиболее значимых провоспалительных цитокинов в условиях ХВГ констатирована связь конституциональной продукции противовоспалительных цитокинов - ИЛ-2 и ИЛ-6 с показателями психического статуса. Так, статистически значимо выявлены повышенные уровни ИЛ-2 при истерическом типе личности. Для ИЛ-6 высокие значения преобладали в группе больных с депрессивными чертами личности. При этом ФГА-индуцированная продукция ИЛ-6 оказалась статистически значимо более низкой в группах больных с высокими значениями Т-баллов, по шкалам гипомании, психастении и шизоидности. При исследовании противовоспалительных цитокинов ИЛ-4 и ИЛ-10 был выявлен высокий базальный уровень ИЛ-4 и индекс стимуляции у больных с проявлением черт шизоидности и гипомании. Высокий индекс стимуляции ИЛ-10 обнаружен у пациентов, склонных к ипохондрическим реакциям в условиях стресс-факторов.
Кроме сравнительного анализа, соотношение психического статуса и показателей иммунной системы исследовалось методом корреляций по Спирмену. В результате были выявлены взаимосвязи между показателями, определяющими тип личности и уровень реактивной и личностной тревоги с фенотипическими маркерами лимфоцитарного состава периферической крови. Так, отрицательные корреляции были определены между относительным содержанием CD3 лимфоцитов и шкалами ипохондрии и гипомании. Абсолютное содержание CD3+клеток, характеризующих содержание зрелых лимфоцитов, положительно связано с формированием реактивной тревожности. При исследовании CD4+хелперов/индукторов и иммунорегуляторного индекса (соотношение CD4+/CD8+) и их взаимосвязи с конституционально-личностными особенностями определились обратные корреляции со шкалой гипомании. CD8+киллеров/супрессоров положительно взаимосвязаны с уровнем реактивной тревожности. Лимфоциты экспрессирующие CD56+(натуральные киллеры) положительно коррелировали со шкалой депрессии индивидуально-психологического теста СМИЛ, а также с показателями шкалы депрессии БЕКА.
Была выявлена взаимосвязь между уровнем цитокинов, определяемых в супернатантах мононуклеаров, и выраженностью психоэмоциональных характеристик. В частности, проводилась оценка взаимосвязи провоспалительных цитокинов и шкал невротической триады. Выявлены высокие положительные коэффициенты корреляций между шкалой депрессии и базальным уровнем ИФН-γ и ФГА-индуцированным (r =0,5; р

Цель исследования.
Оценить изменение иммунологических показателей у крыс с хроническим токсическим гепатитом под влиянием адопции аллогенного ликвора, обладающего различной степенью иммунотропной активности.
Материал и методы исследования.
В работе приведены данные, полученные от 32 крыс линии Brown Norway, весом 160-180г. Оперативное вмешательство осуществлялось под гексеналовым наркозом (доза - 70мг./кг., внутрибрюшинно). Для воспроизведения модели хронического токсического гепатита (ХТГ) был использован гелиотрин, вводимый внутрибрюшинно в дозе 50 мг/кг массы тела один раз в неделю в течение 35 дней [2]. Адопция цереброспинальной жидкости (ЦСЖ) в III желудочек мозга проводилась раз в сутки согласно стандартной стереотопографии на аппарате WPI (Berlin, Germany) [6]. Количественное определение показателей иммунного статуса проводили с использованием набора дифференцировочных маркеров (Sandoz Pharma AG, Switzerland). Статистическая обработка результатов проводилась с расчетом критерия Стъюдента, различия считали достоверными при значении p≤0,05.
Полученные результаты и их обсуждение.
В проведенных ранее экспериментах было показано, что крысы Brown Norway (BN) с ХТГ имеют достоверно сниженные показатели иммунного статуса по сравнению с нормальными показателями интактных крыс. Примечательно, что при двукратном (в среднем) снижении количества клеток оцениваемых лейкоцитарных элементов, процентное соотношение показателей иммунограммы не изменялось. Вероятно, число всех типов клеток лейкоцитарного звена уменьшилось за счет генерализованного угнетения метаболической функции печени и последующего подавления центральных звеньев иммунорегуляции, что подтверждается исследованиями отдельных авторов [10]. В этой связи, проведено три серии экспериментов направленных на определение степени вовлеченности иммунокомпетентного микроокружения гипоталамуса в механизмы супрессирования иммунной системы при ХТГ.
Задачей первой экспериментальной группы крыс являлось изучение влияния адопции аллогенного ликвора, полученного от интактных крыс линии Sprague Dawley (SD) на показатели иммунного статуса при ХТГ. Полученные данные свидетельствуют, что ни один из оцениваемых показателей, за исключением общего пула лимфоцитов, каких-либо значимых количественных изменений не претерпел, количество нейтрофилов, мононуклеаров, В-лимфоцитов, Т-лимфоцитов, NK-клеток и лейкоцитов в целом незначительно колебалось в ту или иную сторону. Лишь абсолютное число лимфоцитов в периферической крови животных изучаемой группы достоверно возросло на 9% в сравнении с их количеством в крови контрольной группы крыс с ХТГ, но без манипуляций с составом ЦСЖ. (табл.1).
Таблица 1. Влияние адопции аллогенного ликвора на иммунный статус крыс с ХТГ
показатели иммунитета (×10 6 /L)
крысы с ХТГ (контроль)
ХТГ + адопция интактной ЦСЖ
ХТГ + адопция ЦСЖ от крыс с ХТГ
крысы без ХТГ + адопция ЦСЖ от крыс с ХТГ
Примечания: во всех сравниваемых группах n = 8
a - достоверно по отношению к контрольной группе крыс
b - достоверно по отношению к группе крыс с адопцией аллогенной интактной ЦСЖ
* - достоверно по отношению к группе интактных крыс
Таким образом, исследованиями продемонстрировано, что аллогенная адопция ЦСЖ полученной от интактных крыс, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ. По данным ряда авторов, стимуляция центральных звеньев иммунорегуляции ведет к избирательной модуляции нарушенных звеньев периферической иммунной системы, возвращая супрессированные либо гиперактивированные механизмы реализации иммунных процессов к физиологически нормальным значениям [5]. Казалось бы, внутрижелудочковое введение нормальной ЦСЖ, имеющей физиологичный состав иммунотропных компонентов и обладающей способностью модулировать подавленную активность центра поддержания иммунного гомеостаза, должно ослабить интенсивность иммуносупрессии у крыс с токсическим гепатитом, однако этого не произошло. Отсутствие какого-либо воздействия адопции ЦСЖ на активность иммунитета экспериментальной группы крыс, возможно, обусловлено неспособностью периферической иммунной системы прореагировать на смену вектора центральной эфферентной импульсации (в условиях "искусственной оптимизации" состава ЦСЖ), за счет тотального подавления анаболических (пластических) процессов в организме реципиентов ЦСЖ, имеющих печеночную дисфункцию.
Результаты, полученные во второй серии экспериментов, направленных на изучении роли ликвора полученного от аллогенных крыс-доноров, на которых за 14 дней до забора ЦСЖ была воспроизведена аналогичная модель ХТГ, демонстрируют, что животные изучаемой группы с ХТГ (реципиенты ЦСЖ) подверглись значительному снижению показателей иммунного статуса, вследствие адопции ликвора. Так, количество лейкоцитов в изучаемой группе было достоверно снижено в сравнении с контрольной группой крыс с ХТГ (без адопции ЦСЖ) и в сравнении с группой крыс (первой экспериментальной серии) с ХТГ и с адопцией ЦСЖ от интактных животных линии SD. Аналогичные изменения были характерны и в отношении нейтрофилов и клеток мононуклеарного ряда. Общий пул лимфоцитов, включая Т- и В-популяции и натуральные киллеры, также подвергся значительному снижению числа клеток в периферической крови. Анализ показателей иммунограммы позволяет предполагать, что адопция аллогенной ЦСЖ в гипоталамическое ликворное микроокружение крыс реципиентов ЦСЖ ведет к угнетению активности иммуноцитов периферической крови за счет сбоя центральных механизмов поддержания иммунного гомеостаза. Указанное подавление иммунитета крыс реципиентов ликвора, полученного от особей с моделью патологии усугубленной с течением времени, возможно, обусловлено замещением собственного ликвора, донорским ликвором, с составом биоактивных субстанций (главным образом цитокинов) истощенным моделью токсического гепатита более прогрессировавшего у крыс доноров ЦСЖ. Таким образом, адопция "декомпенсированного" ликвора от крыс с прогрессировавшей с течением времени моделью токсического гепатита индуцирует ускорение повреждения функций периферической иммунной системы реципиентов ЦСЖ, за счет экспериментально спровоцированной дезрегуляции механизмов поддержания иммунного гомеостаза в гипоталамусе, как результат адопции "декомпенсированного" (истощенного) ликвора. С другой стороны, возможен и иной механизм снижения активности периферической иммунной системы. По утверждению ряда авторов, угнетение периферических иммунных процессов может являться результатом компенсаторного действия центральных иммунотропных импульсов, направленных на предотвращение цитокиновой гиперсекреции в условиях патологии [4;9].
В третьей серии экспериментов оценивалось влияние адопции аллогенной ЦСЖ от крыс с моделью ХТГ на состояние иммунной системы изначально интактных крыс. Анализ полученных данных позволяет судить о том, что аллогенная адопция ЦСЖ от крыс с моделью патологии ведет к повышению показателей иммунограммы у крыс реципиентов ЦСЖ. В частности, общее количество лейкоцитов повысилось на 13% в сравнении с тем же показателем у интактных крыс. Число нейтрофилов, клеток мононуклеарного ряда и общий пул лимфоцитов также статистически значимо возросли. Среди клеток лимфоцитарного ряда достоверное увеличение клеточности имело место среди В-популяции лимфоцитов и натуральных киллеров. В то же время, общее число Т-лимфоцитов и, в частности, их хелперная и эффекторная субпопуляции не проявили значимого увеличения, однако тенденция к повышению числа клеток наблюдалась для обеих оцениваемых субпопуляций Т-клеток. Таким образом, показано, что центральное введение ЦСЖ, полученной от доноров с моделью гепатита, стимулирует рост показателей активности периферической иммунной системы. Возможным механизмом действия адоптированной ЦСЖ является адаптационное усиление интенсивности иммунорегуляторных импульсов со стороны центра поддержания иммунного гомеостаза в гипоталамусе. Указанная интенсификация иммуностимулирующих гипоталамических импульсов, возможно, обусловлена составом адоптированной ЦСЖ, свидетельствующим о глубоком подавлении активности периферической иммунной системы, вызванном моделью токсического гепатита в организме донора ЦСЖ. Вероятно, обедненный цитокиновый состав адоптированной ЦСЖ индуцирует компенсаторное повышение концентрации цитокинов в ЦСЖ и, следовательно, периферической крови реципиентов ликвора, т.е. происходит активация иммунной системы экспериментальной группы крыс без ХТГ, обусловленная искусственно спровоцированной ложной афферентной сигнализацией в центр поддержания иммунного гомеостаза. Предложенная гипотетическая схема стимуляции иммунитета изначально интактных крыс реципиентов ЦСЖ согласуется с утверждением отдельных авторов о том, что введение различных иммунологически активных субстанций в ІІІ желудочек мозга позволяет изменять вектор иммунотропных влияний гипоталамуса в желаемом направлении [7;8].
Заключение.
- Адопция аллогенной интактной ЦСЖ в гипоталамическое ликворное микроокружение, не оказывает значимого влияния на показатели активности иммунной системы крыс с моделью ХТГ.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, смоделированным за 14 дней до адопции, ведет к угнетению активности иммуноцитов периферической крови за счет интенсификации сбоя центральных механизмов поддержания иммунного гомеостаза у крыс реципиентов ликвора с аналогичной моделью ХТГ, вызванной позднее.
- Адопция аллогенной ЦСЖ, полученной от крыс с ХТГ, индуцирует компенсаторное повышение количества иммуноцитов периферической крови у изначально интактных реципиентов ликвора, т.е. имеет место активация иммунной системы крыс без ХТГ, обусловленная ложной активирующей афферентной сигнализацией в центр поддержания иммунного гомеостаза.
Иммунитет (от лат. immunitas – неприкосновенность) — это главный инструмент защиты организма человека от вредных воздействий, и, прежде всего, от инфекций. Важной функцией является также надзор за состоянием внутренней среды организма, борьба с патологически измененными собственными клетками, например, при онкологических заболеваниях.
Иммунологический статус – это состояние иммунной системы у конкретного пациента, в настоящий момент времени .
Иммунограмма представляет собой исследование показателей клеточного и гуморального иммунитета и служит методом оценки иммунологического статуса. Иммунограмма – это, по сути, развернутый общий анализ крови. Однако в общем анализе крови просто приводится количество лимфоцитов и моноцитов – основных клеток системы иммунитета. А в иммунограмме дается подробная характеристика этим клеткам, что позволяет выявить нарушения иммунитета.
Цель исследования иммунного статуса. Исследование позволяет диагностировать иммунодефицитные состояния, а также лимфопролиферативные заболевания. Кроме того, с помощью данного анализа оценивается распространенность и тяжесть заболевания, прогнозируется дальнейшее течение. На основании сведений об иммунитете можно скорректировать проводимое лечение и оценить его эффективность.
Однозначно исследование показано пациентам с :
- хроническими инфекционными заболеваниями (ВИЧ, гепатиты В и С, герпес, ВПЧ);
- инфекциями, передаваемыми половым путем (ИППП);
- частыми простудными заболеваниями (бронхиты, синуситы, отиты);
- хроническими тонзиллитами, гайморитами,
- аллергией (крапивница, бронхиальная астма, атопический дерматит, поллиноз);
- болезнями щитовидной железы (аутоиммунный тиреоидит);
- аутоиммунными заболеваниями (сахарный диабет, системная красная волчанка, рассеянный склероз и др.);
- злокачественными новообразованиями иммунной системы (лимфолейкоз, лимфогрануломатоз, миелома).
Нужно ли выполнять исследование здоровым людям?
Это исследование полезно проводить не только пациентам, страдающим тем или иным заболеванием, но и просто здоровым людям, для возможности сделать вывод о наличии изменений в иммунном статусе , вызванных конкретным заболеванием . При обнаружении существенных отклонений иммунного статуса от нормы в двух и более показателях, даже при отсутствии симптомов болезни, пациент относится к группе повышенного риска развития иммунопатологии. Таким лицам рекомендуется проводить более углубленные анализы иммунного статуса и проконсультироваться у высококвалифицированногоспециалиста-иммунолога.
В нашем центре в лаборатории иммунологии и клеточной биотехнологии иммунограмма выполняется методом проточной цитометрии с использованием моноклональных антител, сертифицирвоанных для in vitro диагностики (IVD). Исследование иммунного статуса включает определение основных субпопуляций лимфоцитов:
Базовое исследование:
T-лимфоциты (CD45 + CD3 + ), Т-хелперы (CD3 + CD4 + ),
Цитотоксические Т-лимфоциты (CD3 + CD8 + ),
активированные Т-лимфоциты (CD3 + HLA-DR + ),
ЕК-клетки (CD3 – CD16 + /CD56 + ),
ЕКТ-клетки (CD3 + CD16 + /CD56 + ),
иммунорегуляторный индекс (соотношение CD4/CD8),
фагоцитарный индекс, фагоцитарное число
Расширенное исследование
Базовое исследование
В1-лимфоциты (CD19 + CD5 + ),
ЕК-клетки (CD3 – CD16 + /CD56 + ),
ЕКТ-клетки (CD3 + CD16 + / CD56 + ),
Т-регуляторные клетки (CD4 + CD25 hi CD127 – )
Исследование CD4/CD8:
T-лимфоциты (CD3 + ), Т-хелперы (CD3 + CD4 + ), цитотоксические Т-лимфоциты (CD3 + CD8 + ), иммунорегуляторный индекс (соотношение CD4/CD8)


Каким образом выполняется анализ ? Для проведения анализа у пациента забирают кровь из вены в объеме до 5 мл . Прием пищи перед забором крови, прием лекарственных препаратов (например, антибиотиков, гормонов), наличие простудного или иного заболевания у пациента не являются ограничением для сдачи анализа.
Стоимость исследования:
По всем вопросам обращайтесь в регистратуру РНПЦ эпидемиологии и микробиологии по тел. +375(17) 268-04-41.
Прейскурант цен на оказание платных медицинских услуг гражданам Беларуси (по состоянию на 14.05.2019): раздел 3 "Иммунологические исследования"
Расшифровка результатов. Полноценная расшифровка результатов осуществляется лечащим врачом или специалистом-иммунологом.
Анализ иммунограммы возможен только в комплексе с клиническим данными и анамнезом пациента и более информативен в динамике.
Читайте также:


