Хронического гепатита с полиморфизма генов

Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности, с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы исследования
Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3 ± 10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3 ± 7,9 лет, не имеющих заболеваний печени.
В настоящем исследовании мы проанализировали однонуклеотидную замену (SNP) в гене IL-28В (rs12979860) у 190 человек (90 доноров без хронических заболеваний печени и 100 пациентов с ХГС).
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2 = 0,61; р = 0,44) и составили соответственно 42 и 36 % (рисунок). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 и 8 % (χ2 = 0,35; р = 0,55). В обеих группах преобладали гетерозиготы СТ (χ2 = 0,79; р = 0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2 = 0,64; р = 0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2 = 4,55; р = 0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
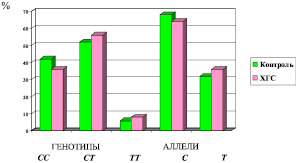
Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
Воронежская государственная медицинская академия им. Н.Н. Бурденко
Хронический вирусный гепатит С продолжает оставаться актуальной проблемой современной инфектологии. По данным Всемирной организации здравоохранения (ВОЗ), около 3% населения планеты, или около 300 миллионов человек, инфицировано гепатитом С.
Уровень инфицированности в различных регионах мира колеблется от 0,6–1,4% в США, до 4–5% в африканских странах. В России регистрируется до трех миллионов инфицированных (около 2% населения) [2]. По частоте вирусный гепатит С (ВГС) стоит на одном из первых мест среди всех инфекций, передающихся парентеральным путем [2, 3, 11]. Хронический гепатит С (ХГС) является одной из причин формирования цирроза печени и гепатоцеллюлярной карциномы [11, 12]. В последние годы в России регистрируют более 6,5 тысяч случаев первичного рака печени, причиной которого, является гепатит С [2, 7]. По этой причине ХГС - ведущая причина трансплантации печени в России и в мире [1, 11]. Проблема усугубляется тем, что в течение длительного времени для большинства инфицированных типично длительное бессимптомное течение, вплоть до цирроза печени [9].
Цель работы: изучить влияние полиморфизма гена IL-28В (rs12979860 и rs8099917) на эффективность проводимой комбинированной ПВТ у больных ХГС.
Материалы и методы. За период с 2010 по 2011 г. на базе БУЗ Областной клинической инфекционной больницы г. Воронежа обследовались и лечились 36 пациентов (19 мужчин и 17 женщин) с диагнозом ХГС. Все пациенты обследовались согласно общепринятым стандартам. Этиологическая верификация диагноза проводилась на основании обнаружения в сыворотке крови РНК вируса гепатита С с помощью полимеразной цепной реакции (ПЦР). ПЦР-диагностика проводилась в режиме real-time, чувствительность использованных тест-систем (РНК HCV Амплисенс) составляла 50 копий/мл. Всем больным проводилось определение генотипа НСV. Из числа обследованных больных генотип 1в обнаруживался у 25 пациентов, 3а был зафиксирован у 11 человек. При необходимости у больных проводилось количественное определение РНК HCV в крови. Количество вируса в сыворотке крови наблюдалось в широких пределах от 2,9х103 до 3,7х106.Также определялись серологические маркеры (а-HCV-IgG, а-HCV-IgM) с использованием иммуноферментного анализа (ИФА).
Средний возраст больных составил 54,1±18,7 лет. Продолжительность болезни, по данным эпидемиологического анамнеза, составил от 1 до 13 лет.
В биохимическом исследовании крови у всех больных ХГС показатели сывороточных аминотрансфераз были выше нормы. Большинство пациентов (72,2%) имели уровень аланинаминотрансферазы (АЛТ) до 3 норм. Показатели АЛТ до 5 норм выявлены у 22,2% пациентов. Высокая активность АЛТ (более 5 норм) была обнаружена только у 5,5% пациентов. У всех исследуемых больных регистрировались различные сопутствующие соматические заболевания. Чаще всего отмечалась патология желудочно-кишечного тракта (хронический панкреатит, дуоденит, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки). Эта группа заболеваний выявлена у 83,3% больных ХГС. Патология желчевыводящих путей, такие как, дискинезия желчевыводящих путей и хронический холецистит наблюдались у 75% пациентов. Болезни сердечно-сосудистой и эндокринной систем встречалась у 58,3% и 11,1% соответственно. При ультразвуковом исследовании у всех больных наблюдались гепатомегалия и диффузные изменения печени.
Всем больным была выполнена пункционная биопсия печени (ПБП) по Mengini дважды (до и после лечения противовирусными препаратами). Проводился морфологический анализ полученных гистологических препаратов, оценивая параметры активности гепатита по R.G. Knodell с соавторами (1981) [10] и фиброза по V. Desmet (1995) [6] с использованием систем METAVIR. Минимальная степень активности (1–3 балла) была зарегистрирована у 66,7% пациентов, низкая степень активности (4–8 баллов) наблюдалась у 27,8% больных, умеренная степень активности (9–12 баллов) выявлялась реже – в 5,5% случаев. Гистологическая активность более 13 баллов выявлено не было. У большинства больных фиброз отсутствовал или был слабо выражен. С фиброзом 0 баллов наблюдалось 52,8% пациентов. Слабый фиброз был выявлен у 22,2%, умеренный и тяжелый фиброз наблюдался в 8,3% случаев. Цирроз печени выявлен у 16,6% исследуемых больных. Помимо этого, у 30,6% (11 пациентов) дополнительно была проведена фиброэластометрия ткани печени на аппарате Fibroscan FS-502 (Echosens, Франция) с выявлением стадии фиброза по шкале Metavir. Из них степень фиброза F0 была выявлена у 63% пациентов, F2 – у 27,3%, F4 – у 9% больных.
Помимо общеклинических методов обследования, у всех больных проводилось полное серологическое обследование на маркеры вирусных гепатитов В, D, HIV с использованием методов ИФА, проводилось определение содержания α-фетопротеина, концентрации железа и меди в сыворотке крови. У всех больных в анамнезе была проведена комбинированная ПВТ (20 пациентов получали лечение с использованием препаратов интерферона короткого действия и 16 человек – пегилированные интерфероны). Обе схемы лечения включали в комплексную терапию рибавирин. Длительность терапии составила 24 и 48 недель в зависимости от генотипа HCV. Достижение устойчивого вирусологического ответа (УВО) оценивалось как показатель эффективности терапии. УВО – неопределяемый уровень РНК HCV в сыворотке крови через 24 недели после прекращения терапии [5]. Всем пациентам было проведено определение полиморфизма гена IL-28В (rs12979860 – генотипы CC, CT, TT и rs8099917 – генотипы TT, TG, GG) с помощью ПЦР в режиме реального времени. Все больные исследуемых групп были рандомизированы по основным клинико-лабораторным показателям.
При статистической обработке результатов исследования, имеющих нормальное распределение, количественные признаки выражались как М±s (среднее ± стандартное отклонение). Во всех выборках проверяли гипотезу нормальности распределения по критерию Колмогорова-Смирного. Для оценки достоверности различий выборок использовали непараметрический критерий Манна-Уитни. Все различия считались достоверными при значении р
Список использованных источников:
1. Влияние полиморфизма интерлейкина 28В на раннюю кинетику HCV у больных, получающих противовирусную терапию после ортотопической трансплантации печени/ В.Е. Сюткин и др.// Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2011. - №6. – С. 49–55.
2. Дерябин П.Г. Распространение гепатита С в России становится социальной проблемой// СанЭпидемКонтроль. – 2009. - №4. – С. 34-38.
3. Исаков В.А. Современная терапия хронического вирусного гепатита С: какая длительность комбинированной терапии оптимальна и почему?// Клиническая гастроэнтерология и гепатология. – 2009. - №2. – С. 9-12.
4. Роль полиморфизма гена интерлейкина 28В в оценке эффективности противовирусной терапии хронического гепатита С / Т.Н. Лопаткина, И.С. Кудлинский// Клиническая гепатология. – 2011. - №2. – С. 28-38.
5. Современные схемы лечения больных хроническим гепатитом С/ В.Т.Ивашкин и др. - Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2012. - №1. – С. 36–44.
6. Классификация хронического гепатита: диагностика, определение степени тяжести и стадии течениям V. Desmet, M. Gerber, J.H. Hoofnagle / Российский журнал гастроэнтерологии, гепатологии, колопротологии. – 1995. № 2. - Р. 38-45.
7. Deuffic–Burban S. Impact of pegylated interferon and ribavirin on morbidity and mortality in patients with chronic hepatitis C and normal aminotransferases in France// Hepatology. – 2009. - №50. – P. 1351-1359.
8. Development of novel treatment for hepatitis C D.P. Webster et al. / Lancet. – 2010. - №45. – P. 349-355.
9. Empirically calibrated model of hepatitis C virus infection in the United States J. Salomon et al.// Am J Epidemiol. – 2002. - №156. – P. 761-773.
10. Formulation and application of numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis/ R.G. Knodell, K.G. Ishak// Hepatology. – 1981. - №1. - Р. 431-435.
11. Global epidemiology of hepatitis C virus infection/ C. Shepard, L. Finelli, M. Alter// Lancet. – 2005. №5. – P. 558-567.
12. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide/ J. Perz, G. Armstrong, L. Farrington// Hepatology. – 2006. - №45. – P. 529-538.
Проведен сравнительный анализ частоты встречаемости аллелей и генотипов rs281437 гена ICAM-1 и ассоциации с прогрессирующим течением хронического гепатита С в московской популяции.
Comparative analysis of the degree of incidence Проведен сравнительный анализ частоты встречаемости of alleles and rs281437 genotypes of ICAM-1 gene, and association with progressing clinical course of chronic C hepatitis in Moscow population, was done.
.jpg)
Несмотря на большое количество исследований, посвященных оценке генетически детерминированных рисков развития фиброза и цирроза печени (ЦП) у больных хроническим гепатитом С (ХГС), до настоящего времени не выявлено определенной взаимосвязи между конкретными генетическими маркерами неблагоприятного исхода данного заболевания. Поскольку фиброз печени наиболее быстрыми темпами прогрессирует у пациентов с выраженным воспалением в печени, проявляющимся высоким индексом гистологической активности, особый интерес вызывают генетические детерминанты, предопределяющие ход иммунологических реакций.
Как известно, в патогенезе развития воспаления при хронических вирусных гепатитах ключевую роль играют клеточные иммунные реакции. При инфицировании вирусом гепатита В (HBV) и вирусом гепатита С (HCV) регистрируется повышенная экспрессия на гепатоцитах детерминант МНС 1-го класса, необходимых для адекватного представления антигенов, а также — межклеточных адгезивных молекул, которые играют важную роль в активации Т-клеток и их миграции в ткани-мишени [1].
В инициации иммунологических реакций важную роль играет система межклеточной адгезии ICAM-1 (CD54)/LFA-1 (CD11a/CD18). ICAM-1 (intercellular adhesion molecule-1, молекула межклеточной адгезии 1-го типа, принадлежащая к суперсемейству иммуноглобулинов) инициирует движение иммунорегуляторных клеток и взаимодействие иммунокомпетентных клеток между собой [2, 3]. Лигандами для ICAM-1 являются лейкоцитарный интегрин LFA-1 (Lymphocyte Function-Associated Antigen-1), опосредующий адгезию между клетками и клеткой к экстрацеллюлярному матриксу, и Мас-1, опосредующий адгезию гранулоцитов [4, 5]. Сигналом для активации адгезивных молекул, в частности, ICAM-1/LFA-1, является распознавание детерминант МНС на поверхности антиген-презентирующих клеток наивными Т-клетками. В последующем эффекторные Т-клетки (Т-хелперы и цитотоксические лимфоциты) мигрируют в очаг воспаления и взаимодействуют с клетками-мишенями [3].
Экспрессия ICAM-1 постоянна и регистрируется на различных клетках (лимфоциты, моноциты, эозинофилы, тканевые макрофаги, фибробласты, эндотелий, тимусный эпителий, скелетные миоциты и др.). При возникновении воспалительного процесса в ответ на действие цитокинов (ИЛ-1, ИФН-γ) их экспрессия становится избыточной в клетках-мишенях [2, 6, 7]. Изменения уровня экспрессии молекулы ICAM-1 на мембране клеток наблюдаются при активации иммунной системы при воспалительных процессах. Экспрессия ICAM-1 повышается при различных патологических процессах. Так, в 2014 г. показана связь полиморфизмов rs5491, rs281432, и rs281437 гена ICAM-1 с развитием атеросклероза коронарных сосудов, а также с повышенными уровнями триглицеридов, аполипопротеина A и В в китайской популяции больных [8]. Выявлена связь полиморфизмов rs5491 (K56M) и rs5498 (K469E) гена ICAM-1 с развитием у детей астмы и повышенной экспрессией белка ICAM-1 [9, 10]. В различных этнических группах выявлена связь полиморфизмов rs5498 (К469E) и rs1799969 (R241G) гена ICAM-1 с болезнью Бехчета [11]. В 2013 году был показан значимый вклад SNP R241 G в сочетании с SNP K469E гена ICAM-1 в развитие первичных опухолей головного мозга у населения Турции [12]. Кроме того, показана ассоциация полиморфизмов гена ICAM-1 с тяжестью течения малярии [13] и афтозного стоматита [14].
В доступной научной литературе имеются единичные исследования, касающиеся ассоциативных связей полиморфного гена ICAM-1 с течением хронических вирусных гепатитов. Так, при хронической HBV-инфекции показано, что полиморфизмы rs5498 (К469E) и rs1799969 (R241G) гена ICAM-1 ассоциировались с восприимчивостью к HBV и формированию ЦП в исходе хронического гепатита В [15]. Ранее было показано, что при ХГС значительно увеличиваются сывороточные концентрации и экспрессия ICAM-1 на гепатоцитах [16, 17].
В 2013 г. опубликована работа, показавшая ассоциацию rs281437 гена ICAM-1 с тяжелым фиброзом печени у больных ХГС, инфицированных 4-м генотипом HCV, в то же время не было выявлено связи полиморфизмов rs5498 и rs12979860 данного гена со степенью выраженности фиброза печени. Показано, что у пациентов с Т-аллелью rs281437 риск развития тяжелого фиброза приблизительно в 13 раз выше по сравнению с пациентами с C-аллелью (OR = 13,0; CI: 1,32–128,11, P = 0,028) [18].
Учитывая актуальность поиска генетических предикторов неблагоприятного течения заболевания, наличие патогенетической взаимосвязи хронического вирусного гепатита С с особенностями экспрессии ICAM-1, целью настоящего исследования была оценка роли полиморфизма rs281437 гена ICAM-1 в развитии прогрессирующего течения ХГС у представителей московской популяции (европеоидной расы).
- 93 взрослых больных ХГС со стадиями фиброза печени F0-F1 (мужчины/женщины — 56/37, средний возраст — 37 ± 1 год);
- 124 взрослых больных ХГС со стадиями фиброза печени F2-F3 (мужчины/женщины — 81/45, средний возраст — 39 ± 1 год).
Кроме того, в исследование включены 11 спонтанных реконвалесцентов HCV (мужчины/женщины — 7/4, средний возраст — 41 ± 6 лет) и 271 больной ЦП различной этиологии: 146 больных ЦП HCV-этиологии (ЦП HCV, мужчины/женщины — 90/56, средний возраст — 51 ± 1 год); 55 больных ЦП HBV-этиологии (ЦП HBV, мужчины/женщины — 38/17, средний возраст — 51 ± 2 года); 36 больных алкогольным ЦП (ЦП А, мужчины/женщины — 32/4, средний возраст — 48 ± 2 года); 34 больных криптогенным ЦП (ЦП кр, мужчины/женщины — 22/12, средний возраст — 52 ± 2 года). В группу больных ЦП HBV-этиологии включены пациенты с моноинфекцией HBV и 24 (44%) пациента с ЦП смешанной этиологии (HBV + HCV, HBV + HDV, HBV + HCV + HDV). Для проведения популяционно-генетического анализа в группу контроля включено 202 здоровых донора (мужчины/женщины — 109/93, средний возраст — 56 ± 2 года). Критериями невключения в исследование были наличие ВИЧ-инфекции, психических заболеваний и тяжелой соматической патологии. Проведение генетического анализа пациентам выполнялось после подписания информированного согласия.
Статистический анализ включал в себя сравнение частот аллелей и генотипов между различными группами с использованием критерия χ 2 Пирсона и оценку OШ с расчетом для него 95%-го ДИ.
Впервые проведен анализ распространения аллелей и генотипов rs281437 гена ICAM-1 в московской популяции больных с хронической HCV-инфекцией (F0-F4). На первом этапе проанализирована частота встречаемости носительства аллелей и генотипов rs281437 гена ICAM-1 у больных ХГС с различными стадиями фиброза печени с учетом (F0-F4) и без учета больных (F0-F3) с формированием ЦП в сопоставлении с группой контроля (рис. 1).
Как показано на рисунке, в московской популяции больных ХГС и здоровых доноров встречаются, преимущественно, носители аллели С и генотипов СС/СТ исследуемого полиморфизма. Сравнительный анализ не выявил достоверных различий в частоте встречаемости аллелей и генотипов rs281437 гена ICAM-1 у больных ХГС F0-F3 и ХГС F0-F4 при сопоставлении с группой контроля здоровых лиц (p > 0,05).
Следующим этапом исследования был анализ частоты встречаемости носительства аллелей и генотипов rs281437 гена ICAM-1 у больных ЦП различной этиологии в сопоставлении с группой контроля (рис. 2).
Как и в группах больных ХГС с различными стадиями фиброза печени, контрольной группе, так и в группах больных ЦП вне зависимости от этиологии заболевания более 90% пациентов являются носителями аллели С rs281437 гена ICAM-1 и, соответственно, носителями генотипов СС/СТ rs281437 гена ICAM-1. Проведенный анализ не выявил различий в частоте встречаемости аллелей и генотипов rs281437 гена ICAM-1 между больными ЦП различной этиологии и группой контроля (как в целом между группой с ЦП и группой контроля, так и в сравнении с группами с различной этиологией заболевания).
В настоящее время известны неблагоприятные факторы прогрессирующего течения ХГС, а именно длительность инфицирования, мужской пол, наличие стеатоза печени, злоупотребление алкоголем. Учитывая отсутствие достоверных различий в распределении аллелей и генотипов исследуемого полиморфизма среди больных ХГС и ЦП различной этиологии при сравнении с группой контроля, в дальнейшем анализ был проведен в группах больных с хронической HCV-инфекцией, разделенных с учетом наличия или отсутствия неблагоприятного фактора, а также — в группах больных с различными исходами заболевания (спонтанные реконвалесценты и больные ЦП в исходе ХГС), а также с минимальным и выраженным фиброзом печени (табл. 1 и 2).
При сравнении частоты носителей аллелей и генотипов rs281437 гена ICAM-1 у спонтанных реконвалесцентов HCV достоверно чаще регистрировалась аллель Т и гетерозиготный генотип СТ по сравнению с больными ЦП в исходе ХГС (табл. 1). Напротив, у больных ЦП HCV-этиологии значимо чаще регистрируется генотип СС исследуемого полиморфизма гена ICAM-1. Генотип ТТ выявлялся только у больных ЦП в исходе ХГС. В то же время гомозиготы ТТ rs281437 гена ICAM-1 значимо чаще выявлены в группе больных ХГС с минимальным фиброзом (F0-F1) по сравнению с группой больных с фиброзом печени ≥ 2 по шкале METAVIR. Учитывая полученные результаты, в группе больных ХГС F0-F1 были выделены пациенты с давностью наблюдения более 10 лет (n = 20) и проведено сравнение частоты встречаемости носителей аллелей и генотипов rs281437 гена ICAM-1 в этой подгруппе с группой больных ЦП HCV-этиологии: генотип СС — 93 (64%) и 13 (65%), генотип СТ — 45 (31%) и 6 (30%), генотип ТТ — 8 (5%) и 1 (5%), аллель С — 138 (94%) и 19 (95%), аллель Т — 53 (36%) и 7 (35%) соответственно, р > 0,05, что демонстрирует отсутствие достоверных различий.
В исследуемых группах больных как с ХГС, так и с ЦП различной этиологии достоверно чаще регистрировался мужской пол больных (p 0,05).
Противоречие с исследованием N. M. Rizk, 2013 г., которое показало значимость аллели Т rs281437 гена ICAM-1 у больных ХГС, инфицированных 4-м генотипом, с тяжестью фиброза печени, возможно, обусловлено проведением нашего исследования на популяции больных, инфицированных 1-м, 2-м и 3-м генотипами HCV.
Исследование продемонстрировало, что в московской популяции преобладают носители аллели С и генотипов СТ/ТТ rs281437 гена ICAM-1. Аллель Т исследуемого полиморфизма достоверно ассоциировался только со стеатозом печени у больных ХГС и с женским полом больных ЦП HCV-этиологии. Полученные результаты требуют дальнейшего уточнения клинической роли выявленных различий, поскольку стеатоз печени является независимым фактором прогрессии как воспаления, так и фиброза печени при ХГС. Кроме того, отдельно необходимо в дальнейшем детально оценить влияние аллели Т rs281437 гена ICAM-1 на формирование ЦП у больных ХГС женского пола.
Работа выполнена в рамках гранта Президента Российской Федерации для поддержки молодых российских ученых — докторов наук (конкурс — МД-2013).
Литература
- Monzón G. C., Buey G. L., Sánchez G. A. et al. Tissue expression of antigenic recognition and intercellular adhesion molecules in chronic viral hepatitis // Rev Esp Enferm Dig. 1993, Nov; 84 (5): 301–309.
- Blaheta R. A., Scholz M., Hailer N. P. et al. Adhesion and penetration properties of human lymphocytes acting on allogeneic vascular endothelial cells // Immunology. 1994: 81: 538–545.
- Мешкова Р. Я. Руководство по иммунопрофилактике для врачей. Учебное пособие. Смоленск: ГМА, 1998. 133 с. ISBN 5–87349–042–2.
- Gorina R., Lyck R., Vestweber D., Engelhardt B. β2 integrin-mediated crawling on endothelial ICAM-1 and ICAM-2 is a prerequisite for transcellular neutrophil diapedesis across the inflamed blood-brain barrier // J Immunol. 2014 Jan 1; 192 (1): 324–37. doi: 10.4049/jimmunol.1300858.
- Wang D., Zeng Q., Song R. et al. Ligation of ICAM-1 on human aortic valve interstitial cells induces the osteogenic response: A critical role of the Notch1-NF-κB pathway in BMP-2 expression // Biochim Biophys Acta. 2014, Nov; 1843 (11): 2744–2753. doi: 10.1016/j.bbamcr.2014.07.017.
- Dustin M. L., Rothlein R., Bhan A. K. et al. Induction by IL 1 and interferon-gamma: tissue distribution, biochemistry, and function of a natural adherence molecule (ICAM-1) // J Immunol. 1986, Jul 1; 137 (1): 245–254.
- Goh Q., Dearth C. L., Corbett J. T. et al. Intercellular adhesion molecule-1 expression by skeletal muscle cells augments myogenesis // Exp Cell Res. 2014, Sep 30. pii: S0014–4827 (14)00437–6. doi: 10.1016/j.yexcr.2014.09.032.
- Yang M., Fu Z., Zhang Q. et al. Association between the Polymorphisms in Intercellular Adhesion Molecule-1 and the Risk of Coronary Atherosclerosis: A Case-Controlled Study // PLoS One. 2014, Oct 13; 9 (10): e109658. doi: 10.1371/journal.pone.0109658.
- Puthothu B., Krueger M., Bernhardt M., Heinzmann A. ICAM1 amino-acid variant K469 E is associated with paediatric bronchial asthma and elevated sICAM1 levels // Genes Immun. 2006, Jun; 7 (4): 322–326.
- Li Y. F., Lin C. C., Tai C. K. Interaction of intercellular adhesion molecule 1 (ICAM1) polymorphisms and environmental tobacco smoke on childhood asthma // Int J Environ Res Public Health. 2014, Jun; 11 (6): 6504–6516.
- Zou J., Guan J. L. Intercellular adhesion molecule-1 polymorphisms in patients with Behçet disease: a meta-analysis // Mod Rheumatol. 2014, May; 24 (3): 481–486. doi: 10.3109/14397595.2014.887988.
- Yilmaz U., Zeybek U., Kahraman O. T. et al. Investigation of ICAM-1 and β3 integrin gene variations in patients with brain tumors // Asian Pac J Cancer Prev. 2013; 14 (10): 5929–5934.
- Dunstan S. J., Rockett K. A., Quyen N. T. et al. Variation in human genes encoding adhesion and proinflammatory molecules are associated with severe malaria in the Vietnamese // Genes Immun. 2012, Sep; 13 (6): 503–508. doi: 10.1038/gene.2012.25.
- Alkhateeb A., Karasneh J., Abbadi H. et al. Association of cell adhesion molecule gene polymorphisms with recurrent aphthous stomatitis // J Oral Pathol Med. 2013 Nov; 42 (10): 741–746. doi: 10.1111/jop.12100.
- Zhang X. Q., Hong X. J., Bai X. J. Susceptibility to active decompensated cirrhosis is associated with polymorphisms of intercellular adhesion molecule-1 (ICAM-1) in chronic HBV carriers // Viral Hepat. 2008, Mar; 15 (3): 173–178. doi: 10.1111/j.1365–2893.2007.00931.x.
- Warakomska I., Wiczkowski A., Kepa L. et al. Serum intercellular adhesion molecule ICAM-1 concentration in interferon alpha treated patients with chronic viral C hepatitis // Wiad Lek. 2004; 57 (11–12): 641–646.
- Fukuda Y., Nakano I., Katano Y. et al. Serum levels of soluble intercellular adhesion molecule-1 and soluble vascular cell adhesion molecule-1 in asymptomatic carriers of hepatitis C virus // J Int Med Res. 1998, Dec; 26 (6): 313–318.
- Rizk N. M., Derbala M. F. Genetic polymorphisms of ICAM 1 and IL28 as predictors of liver fibrosis severity and viral clearance in hepatitis C genotype 4 // Clin Res Hepatol Gastroenterol. 2013, Jun; 37 (3): 262–268. doi: 10.1016/j.clinre.2012.09.012.
К. Р. Дудина* , 1 , доктор медицинских наук
К. А. Царук**
С. А. Шутько*, кандидат медицинских наук
О. О. Знойко*, доктор медицинских наук
Д. Д. Абрамов***, кандидат биологических наук
Н. О. Бокова*, кандидат медицинских наук
К. С. Скрупский*
Н. Д. Ющук*, доктор медицинских наук, профессор, академик РАМН
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
**ГКУЗ ИКБ № 1 ДЗМ, Москва
***ФГБУ ГНЦ Институт иммунологии ФМБА России, Москва
Полный текст:
Актуальность. Поиск у конкретного больного предикторов агрессивного течения хронического гепатита С (ХГС), в том числе с помощью генетических исследований, представляется актуальной задачей. Быстрый темп прогрессирования фиброза при ХГС ассоциируется с полиморфизмом ряда генов, кодирующих компоненты ренин-ангиотензиновой системы и вовлеченных в формирование эндотелиальной дисфункции и окислительного стресса.
Цель – разработка прогностической модели оценки вероятности быстрого прогрессирования фиброза у больных ХГС на основании комбинации изученных генетических маркеров и клинико-демографических параметров.
Таратина Олеся Валериевна – кандидат медицинских накнаук, научный сотрудник, отделение гастроэнтерологии, доцент кафедры гастроэнтерологии факультета усовершенствования врачей.
129110, Москва, ул. Щепкина, 61/2–9, +7 (926) 245 66 59
Самоходская Лариса Михайловна – кандидат медицинских наук, доцент, заведующая отделом лабораторной диагностики Медицинского научно-образовательного центра.
119991, Москва, Ленинские горы, 1
Краснова Татьяна Николаевна – кандидат медицинских наук, доцент кафедры внутренних болезней, факультет фундаментальной медицины.
119991, Москва, Ленинские горы, 1
Мухин Николай Алексеевич – доктор медицинских наук, профессор, академик РАН, заведующий кафедрой внутренних болезней, факультет фундаментальной медицины.
119991, Москва, Ленинские горы, 1
4. Asselah T, Bièche I, Paradis V, Bedossa P, Vidaud M, Marcellin P. Genetics, genomics, and proteomics: implications for the diagnosis and the treatment of chronic hepatitis C. Semin Liver Dis. 2007;27(1):13–27. doi: 10.1055/s-2006-960168.
6. European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2016. J Hepatol. 2017;66(1):153–94. doi: 10.1016/j.jhep.2016.09.001.
7. Powell EE, Edwards-Smith CJ, Hay JL, Clouston AD, Crawford DH, Shorthouse C, Purdie DM, Jonsson JR. Host genetic factors influence disease progression in chronic hepatitis C. Hepatology. 2000;31(4):828–33. doi: 10.1053/he.2000.6253.
8. Bataller R, North KE, Brenner DA. Genetic polymorphisms and the progression of liver fibrosis: a critical appraisal. Hepatology. 2003;37(3): 493–503. doi: 10.1053/jhep.2003.50127.
9. Самоходская ЛМ, Игнатова ТМ, Абдуллаев СМ, Краснова ТН, Некрасова ТП, Мухин НА, Ткачук ВА. Прогностическое значение комбинации аллельных вариантов генов цитокинов и гемохроматоза у больных хроническим гепатитом С. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2007;17(2):50–6.
10. Huang H, Shiffman ML, Friedman S, Venkatesh R, Bzowej N, Abar OT, Rowland CM, Catanese JJ, Leong DU, Sninsky JJ, Layden TJ, Wright TL, White T, Cheung RC. A 7 gene signature identifies the risk of developing cirrhosis in patients with chronic hepatitis C. Hepatology. 2007;46(2):297–306. doi: 10.1002/hep.21695.
11. Семенова НА, Рязанцева НВ, Новицкий ВВ, Бычков ВА, Чечина ОЕ. Роль полиморфизма гена IL6-174C/G в развитии хронической HCV-инфекции. Бюллетень сибирской медицины. 2010;(5):93–6.
12. Romero-Gomez M, Eslam M, Ruiz A, Maraver M. Genes and hepatitis C: susceptibility, fibrosis progression and response to treatment. Liver Int. 2011;31(4):443–60. doi: 10.1111/j.1478-3231.2011.02449.x.
13. Fontana RJ, Litman HJ, Dienstag JL, Bonkovsky HL, Su G, Sterling RK, Lok AS; HALT-C Trial Group. YKL-40 genetic polymorphisms and the risk of liver disease progression in patients with advanced fibrosis due to chronic hepatitis C. Liver Int. 2012;32(4):665–74. doi: 10.1111/j.1478-3231.2011.02686.x.
14. do O NT, Eurich D, Schmitz P, Schmeding M, Heidenhain C, Bahra M, Trautwein C, Neuhaus P, Neumann UP, Wasmuth HE. A 7-gene signature of the recipient predicts the progression of fibrosis after liver transplantation for hepatitis C virus infection. Liver Transpl. 2012;18(3):298–304. doi: 10.1002/lt.22475.
16. Таратина ОВ, Краснова ТН, Самоходская ЛМ, Лопаткина ТН, Ткачук ВА, Мухин НА. Значение полиморфизма генов ренинангиотензиновой системы в прогрессировании фиброза печени у больных хроническим гепатитом С. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2014;24(2):69–77.
17. Таратина ОВ, Краснова ТН, Самоходская ЛМ, Лопаткина ТН, Ткачук ВА, Мухин НА. Полиморфизм генов эндотелиальной дисфункции и скорость прогрессирования фиброза печени при хроническом гепатите С. Терапевтический архив. 2014;86(4):45–51.
18. King LY, Johnson KB, Zheng H, Wei L, Gudewicz T, Hoshida Y, Corey KE, Ajayi T, Ufere N, Baumert TF, Chan AT, Tanabe KK, Fuchs BC, Chung RT. Host genetics predict clinical deterioration in HCV-related cirrhosis. PLoS One. 2014;9(12):e114747. doi: 10.1371/journal.pone.0114747.
20. Mueller JL, King LY, Johnson KB, Gao T, Nephew LD, Kothari D, Simpson MA, Zheng H, Wei L, Corey KE, Misdraji J, Lee JH, Lin MV, Gogela NA, Fuchs BC, Tanabe KK, Gordon FD, Curry MP, Chung RT. Impact of EGF, IL28B, and PNPLA3 polymorphisms on the outcome of allograft hepatitis C: a multicenter study. Clin Transplant. 2016;30(4):452–60. doi: 10.1111/ctr.12710.
21. Самоходская ЛМ, Балацкий АВ, Садекова ОН, Таратина ОВ, Колотвин АВ. Молекулярно-генетический анализ предрасположенности человека к мультифакторным заболеваниям. М.: Изд-во МГУ; 2011. 388 c.
22. Yee LJ. Host genetic determinants in hepatitis C virus infection. Genes Immun. 2004;5(4): 237–45. doi: 10.1038/sj.gene.6364090.
23. Richardson MM, Powell EE, Barrie HD, Clouston AD, Purdie DM, Jonsson JR. A combination of genetic polymorphisms increases the risk of progressive disease in chronic hepatitis C. J Med Genet. 2005;42(7):e45. doi: 10.1136/jmg.2005.032557.
24. Pradat P, Trepo E, Potthoff A, Bakshi R, Young B, Trepo C, Lagier R, Moreno C, Lemmers A, Gustot T, Degre D, Adler M, Wedemeyer H. The cirrhosis risk score predicts liver fibrosis progression in patients with initially mild chronic hepatitis C. Hepatology. 2010;51(1):356–7. doi: 10.1002/hep.23223.
25. Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. Best Pract Res Clin Gastroenterol. 2011;25(2):195–206. doi: 10.1016/j.bpg.2011.02.005.
26. Таратина ОВ, Краснова ТН, Самоходская ЛМ, Сагинова ЕА, Мухин НА, Ткачук ВА. Роль структурного полиморфизма генов ренин-ангиотензиновой системы и эндотелиальной дисфункции в прогрессировании фиброза печени при хроническом гепатите С. В: Варфоломеев СД, ред. Постгеномные исследования и технологии. М.: МАКС Пресс; 2011. с. 347–76.
27. Таратина ОВ, Самоходская ЛМ, Краснова ТН, Мухин НА. Связь полиморфизма генов ренин-ангиотензиновой системы и эндотелиальной дисфункции с формированием и тяжестью портальной гипертензии у больных хроническим гепатитом С. Альманах клинической медицины. 2016;44(6):698–712. doi: 10.18786/2072-0505-2016-44-6-698-712.
28. Patin E, Kutalik Z, Guergnon J, Bibert S, Nalpas B, Jouanguy E, Munteanu M, Bousquet L, Argiro L, Halfon P, Boland A, Müllhaupt B, Semela D, Dufour JF, Heim MH, Moradpour D, Cerny A, Malinverni R, Hirsch H, Martinetti G, Suppiah V, Stewart G, Booth DR, George J, Casanova JL, Bréchot C, Rice CM, Talal AH, Jacobson IM, Bourlière M, Theodorou I, Poynard T, Negro F, Pol S, Bochud PY, Abel L; Swiss Hepatitis C Cohort Study Group; International Hepatitis C Genetics Consortium; French ANRS HC EP 26 Genoscan Study Group. Genome-wide association study identifies variants associated with progression of liver fibrosis from HCV infection. Gastroenterology. 2012;143(5):1244–52.e1–12. doi: 10.1053/j.gastro.2012.07.097.
29. Marcolongo M, Young B, Dal Pero F, Fattovich G, Peraro L, Guido M, Sebastiani G, Palù G, Alberti A. A seven-gene signature (cirrhosis risk score) predicts liver fibrosis progression in patients with initially mild chronic hepatitis C. Hepatology. 2009;50(4):1038–44. doi: 10.1002/hep.23111.
30. De Minicis S, Brenner DA. NOX in liver fibrosis. Arch Biochem Biophys. 2007;462(2):266–72. doi: 10.1016/j.abb.2007.04.016.
31. Bataller R, Schwabe RF, Choi YH, Yang L, Paik YH, Lindquist J, Qian T, Schoonhoven R, Hagedorn CH, Lemasters JJ, Brenner DA. NADPH oxidase signal transduces angiotensin II in hepatic stellate cells and is critical in hepatic fibrosis. J Clin Invest. 2003;112(9):1383–94. doi: 10.1172/JCI18212.
32. De Minicis S, Seki E, Oesterreicher C, Schnabl B, Schwabe RF, Brenner DA. Reduced nicotinamide adenine dinucleotide phosphate oxidase mediates fibrotic and inflammatory effects of leptin on hepatic stellate cells. Hepatology. 2008;48(6):2016–26. doi: 10.1002/hep.22560.
33. Lambeth JD. NOX enzymes and the biology of reactive oxygen. Nat Rev Immunol. 2004;4(3): 181–9. doi: 10.1038/nri1312.
34. de Mochel NS, Seronello S, Wang SH, Ito C, Zheng JX, Liang TJ, Lambeth JD, Choi J. Hepatocyte NAD(P)H oxidases as an endogenous source of reactive oxygen species during hepatitis C virus infection. Hepatology. 2010;52(1): 47–59. doi: 10.1002/hep.23671.
35. Dinauer MC, Pierce EA, Bruns GA, Curnutte JT, Orkin SH. Human neutrophil cytochrome b light chain (p22-phox). Gene structure, chromosomal location, and mutations in cytochrome-negative autosomal recessive chronic granulomatous disease. J Clin Invest. 1990;86(5):1729–37. doi: 10.1172/JCI114898.
36. Bataller R, Sancho-Bru P, Ginès P, Brenner DA. Liver fibrogenesis: a new role for the renin-angiotensin system. Antioxid Redox Signal. 2005;7(9–10):1346–55. doi: 10.1089/ars.2005.7.1346.
37. Paizis G, Tikellis C, Cooper ME, Schembri JM, Lew RA, Smith AI, Shaw T, Warner FJ, Zuilli A, Burrell LM, Angus PW. Chronic liver injury in rats and humans upregulates the novel enzyme angiotensin converting enzyme 2. Gut. 2005;54(12):1790–6. doi: 10.1136/gut.2004.062398.
38. Lubel JS, Herath CB, Burrell LM, Angus PW. Liver disease and the renin-angiotensin system: recent discoveries and clinical implications. J Gastroenterol Hepatol. 2008;23(9):1327–38. doi: 10.1111/j.1440-1746.2008.05461.x.
39. Friedman SL. Evolving challenges in hepatic fibrosis. Nat Rev Gastroenterol Hepatol. 2010;7(8):425–36. doi: 10.1038/nrgastro.2010.97.
41. Wei HS, Li DG, Lu HM, Zhan YT, Wang ZR, Huang X, Zhang J, Cheng JL, Xu QF. Effects of AT1 receptor antagonist, losartan, on rat hepatic fibrosis induced by CCl(4). World J Gastroenterol. 2000;6(4):540–5. doi: 10.3748/wjg.v6.i4.540.
42. Yang L, Bataller R, Dulyx J, Coffman TM, Ginès P, Rippe RA, Brenner DA. Attenuated hepatic inflammation and fibrosis in angiotensin type 1a receptor deficient mice. J Hepatol. 2005;43(2):317–23. doi: 10.1016/j.jhep.2005.02.034.
43. Yoshiji H, Kuriyama S, Noguchi R, Yoshii J, Ikenaka Y, Yanase K, Namisaki T, Kitade M, Yamazaki M, Tsujinoue H, Fukui H. Combination of interferon-beta and angiotensin-converting enzyme inhibitor, perindopril, attenuates the murine liver fibrosis development. Liver Int. 2005;25(1):153–61. doi: 10.1111/j.1478-3231.2005.01038.x.
44. Terui Y, Saito T, Watanabe H, Togashi H, Kawata S, Kamada Y, Sakuta S. Effect of angiotensin receptor antagonist on liver fibrosis in early stages of chronic hepatitis C. Hepatology. 2002;36(4 Pt 1):1022. doi: 10.1053/jhep.2002.32679.
45. Rimola A, Londoño MC, Guevara G, Bruguera M, Navasa M, Forns X, García-Retortillo M, García-Valdecasas JC, Rodes J. Beneficial effect of angiotensin-blocking agents on graft fibrosis in hepatitis C recurrence after liver transplantation. Transplantation. 2004;78(5):686–91. doi: 10.1097/01.TP.0000128913.09774.CE.
46. Yoshiji H, Noguchi R, Fukui H. Combined effect of an ACE inhibitor, perindopril, and interferon on liver fibrosis markers in patients with chronic hepatitis C. J Gastroenterol. 2005;40(2):215–6. doi: 10.1007/s00535-004-1523-6.
47. Yoshiji H, Noguchi R, Ikenaka Y, Kaji K, Aihara Y, Douhara A, Yamao J, Toyohara M, Mitoro A, Sawai M, Yoshida M, Morioka C, Fujimoto M, Uemura M, Fukui H. Combination of branchedchain amino acid and angiotensin-converting enzyme inhibitor improves liver fibrosis progression in patients with cirrhosis. Mol Med Rep. 2012;5(2):539–44. doi: 10.3892/mmr.2011.676.
48. Corey KE, Shah N, Misdraji J, Abu Dayyeh BK, Zheng H, Bhan AK, Chung RT. The effect of angiotensin-blocking agents on liver fibrosis in patients with hepatitis C. Liver Int. 2009;29(5):748–53. doi: 10.1111/j.1478-3231.2009.01973.x.
49. Abu Dayyeh BK, Yang M, Dienstag JL, Chung RT. The effects of angiotensin blocking agents on the progression of liver fibrosis in the HALT-C Trial cohort. Dig Dis Sci. 2011;56(2):564–8. doi: 10.1007/s10620-010-1507-8.
51. Jeunemaitre X. Genetics of the human renin angiotensin system. J Mol Med (Berl). 2008;86(6): 637–41. doi: 10.1007/s00109-008-0344-0.
52. Forrest EH, Thorburn D, Spence E, Oien KA, Inglis G, Smith CA, McCruden EA, Fox R, Mills PR. Polymorphisms of the renin-angiotensin system and the severity of fibrosis in chronic hepatitis C virus infection. J Viral Hepat. 2005;12(5):519–24. doi: 10.1111/j.1365-2893.2005.00630.x.
53. Codes L, Asselah T, Cazals-Hatem D, Tubach F, Vidaud D, Paraná R, Bedossa P, Valla D, Marcellin P. Liver fibrosis in women with chronic hepatitis C: evidence for the negative role of the menopause and steatosis and the potential benefit of hormone replacement therapy. Gut. 2007;56(3):390–5. doi: 10.1136/gut.2006.101931.
| 1. Study design | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 2. Table 1. Clinical and demographic characteristics of patients with chronic hepatitis C virus infection in the groups with “slow” and “rapid” progression of liver fibrosis | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 3. Table 2. Distribution of alleles and genotypes of the studied genes in patients with chronic hepatitis C virus infection with various rates of fibrosis progression and in the comparison group | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 4. Table 3. Positive and negative prognostic values of genotyping of one polymorphic locus in terms of the rate of progression of liver fibrosis in patients with chronic hepatitis C virus infection | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 5. Table 4. Combined effect of the studied genetic factors on the rate of liver fibrosis progression in patients with chronic hepatitis C virus infection | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 6. Table 5. Combined effect of the studied genes and clinical parameters on the rate of liver fibrosis progression in patients with chronic hepatitis C virus infection | |
| Тема | |
| Тип | Исследовательские инструменты |
| Метаданные | |
| 7. Table 6. Significance levels of selected clinical and genetic predictors of rapid progression of liver fibrosis in patients with chronic hepatitis C virus infection | |
| Тема | |
| Тип | Исследовательские инструменты |
|
Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
| |


