Герпесвирусы строение антигенная структура
ВПГ вызывает герпетическую инфекцию, или простой герпес, характеризующийся везикулезными высыпаниями на коже, слизистых оболочках, поражением ЦНС и внутренних органов, а также пожизненным носительством (персистенцией) и рецидивами болезни.
Таксономия. Семейство Herpesviridae. Род Simplexvirus.
Вирус вызывает литические инфекции фибробластов, эпителиальных клеток и латентные инфекции нейронов.
Культивирование. Для культивирования вируса применяют куриный эмбрион (на оболочке образуются мелкие плотные бляшки) и культуру клеток, на которой он вызывает цитопатический эффект в виде появления гигантских многоядерных клеток с внутриядерными включениями.
Антигенная структура. Вирус содержит ряд антигенов, связанных как с внутренними белками, так и с гликопротеидами наружной оболочки. Последние являются основными иммуногенами, индуцирущими выработку антител и клеточный иммунитет. Существует два серотипа: ВПГ 1 типа и ВПГ 2 типа.
Резистентность. Вирус нестоек, чувствителен к солнечным и УФ-лучам.
Эпидемиология. Источник инфекции — больной.
ВПГ-1 и ВПГ-2 передаются преимущественно контактным путем (с везикулярной жидкостью, со слюной, половых контактах), через предметы обихода, реже — воздушно-капельным путем, через плаценту, при рождении ребенка.
Оба типа вирусов могут вызывать оральный и генитальный герпес. ВПГ-1 чаще поражает слизистые оболочки ротовой полости и глотки, вызывает энцефалиты, а ВПГ-2 — гениталии (генитальный герпес).
Патогенез. Различают первичный и рецидивирующий простой герпес. Чаще вирус вызывает бессимптомную или латентную инфекцию.
Первичная инфекция. Везикула —проявление простого герпеса с дегенерацией эпителиальных клеток. Основу везикулы составляют многоядерные клетки. Пораженные ядра клеток содержат эозинофильные включения. Верхушка везикулы через некоторое время вскрывается, и формируется язвочка, которая вскоре покрывается струпом с образованием корочки с последующим заживлением.
Минуя входные ворота эпителия, вирусы проходят через чувствительные нервные окончания с дальнейшим передвижением нуклеокапсидов вдоль аксона к телу нейрона в чувствительных ганглиях. Репродукция вируса в нейроне заканчивается его гибелью. Некоторые вирусы герпеса, достигая ганглионарных клеток, способны приводить к развитию латентной инфекции, при которой нейроны не гибнут, но содержат в себе вирусный геном. Большинство людей (70-90 %) являются пожизненными носителями вируса, который сохраняется в ганглиях, вызывая в нейронах латентную персистирующую инфекцию.
Латентная инфекция чувствительных нейронов является характерной особенностью нейротропных герпесвирусов ВПГ. В латентно инфицированных нейронах около 1 % клеток в пораженном ганглии несет вирусный геном.
Клиника. Инкубационный период 2—12 дней. Болезнь начинается с возникновения на пораженных участках зуда, появления отека и пузырьков, заполненных жидкостью. ВПГ поражает кожу (везикулы, экзема), слизистые оболочки рта, глотки (стоматит) и кишечника, печень (гепатиты), глаза (кератит) и ЦНС (энцефалит). Рецидивирующий герпес обусловлен реактивацией вируса, сохранившегося в ганглиях. Он характеризуется повторными высыпаниями и поражением органов и тканей.
Генитальная инфекция является результатом аутоинокуляции из других пораженных участков тела; но наиболее часто встречающийся путь заражения — половой. Поражение проявляется в образовании везикулы, которая довольно быстро изъязвляется.
Вирус простого герпеса проникает во время прохождения новорожденного через родовые пути матери, вызывая неонаталъный герпес. Неонатальный герпес обнаруживается на 6-й день после родов. Вирус диссеминирует во внутренние органы с развитием генерализованного сепсиса.
Иммунитет. Основной иммунитет— клеточный. Развивается ГЗТ. NK-клетки играют важную роль в ранней противомикробной защите. Организм пораженного реагирует на гликопротеины вируса, продуцируя цитотоксические Т-лимфоциты, а также Т-хелперы, активирующие В-лимфоциты с последующей продукцией специфических антител.
Гликопротеины вызывают образование вируснейтрализующих антител. Вирус - нейтрализующие антитела подавляют межклеточное распространение вирусов.
Микробиологическая диагностика. Используют содержимое герпетических везикул, слюну, соскобы с роговой оболочки глаз, кровь, спинномозговую жидкость. В окрашенных мазках наблюдают гигантские многоядерные клетки, клетки с увеличенной цитоплазмой и внутриядерными включениями .
Для выделения вируса исследуемым материалом заражают клетки HeLa, Нер-2, человеческие эмбриональные фибробласты.
Рост в культуре клеток проявляется округлением клеток с последующим прогрессирующим поражением всей культуры клеток. Заражают также куриные эмбрионы, у которых после внутримозгового заражения развивается энцефалит. Выделенный вирус идентифицируют в РИФ и ИФА с использованием моноклональных антител.
Серодиагностику проводят с помощью РСК, РИФ, ИФА и реакции нейтрализации по нарастанию титра антител больного. ИБ также способен выявлять типоспецифические антитела.
При экспресс-диагностике в мазках-отпечатках из высыпаний, окрашенных по Романовскому-Гимзе, выявляются гигантские многоядерные клетки с внутриядерными включениями. Для идентификации вируса используют также амплификацию генов вирусной ДНК в реакции ПЦР.
Лечение. Для лечения применяют препараты интерферона, индукторы интерферона и противовирусные химиотерапевтические препараты (ацикловир, видарабин).
Профилактика. Специфическая профилактика рецидивирующего герпеса осуществляется в период ремиссии многократным введением инактивированной культуральной герпетической вакцины.
Герпесвирусы
Не бойся собаки брехливой, а бойся молчаливой.
- Персистенция как патогенетическая стратегия.
- Классические и новые герпесвирусы человека.
- Первичные и оппортунистические инфекции.
- Внутриутробные и перинатальные инфекции.
- Онкогенность.
- Проблемы вакцинации и этиотропной терапии.
Семейство Herpetoviridae включает более 80 вирусов человека и животных — от устриц до обезьян. Многие из них сохраняют верность своим хозяевам, избирательно инфицируя определенные виды животных. Во всяком случае, за исключением обезьяньего герпесвируса В, герпесвирусы животных не опасны для людей, что обеспечивает антропонозный характер герпетической патологии человека.
Название семейства происходит от греческого слова herpein — ползти, расползаться. Дело в том, что для герпетических поражений слизистых оболочек и кожи характерны везикулезные высыпания, которые лопаются с образованием расползающихся эрозий. Именно из очага лабиального герпеса (губной лихорадки) был выделен первый вирус этого семейства — вирус простого герпеса.
Герпесвирусы имеют ряд общих признаков, главными из которых являются строение вириона, структура геномной молекулы (ДНК) и ее стратегия в зараженных клетках. Вирион герпесвирусов представляет собой довольно крупные (для вирусов) частицы (150—250 нм в диаметре), которые состоят из нуклеокапсида (кор) кубической симметрии и наружной оболочки (суперкапсид) (рис. 1).
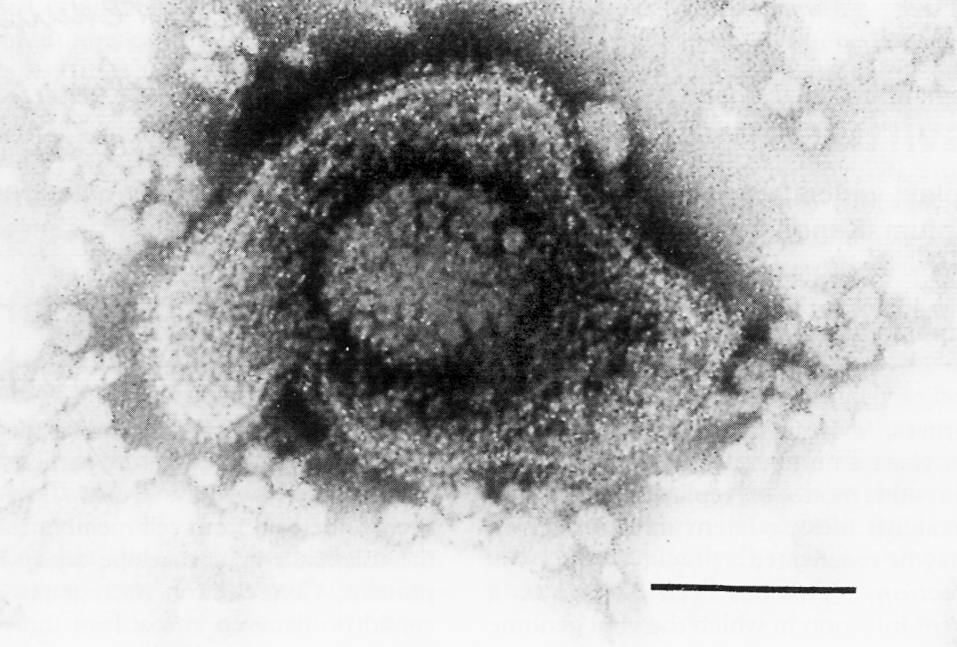
Рис. 1. Вирион вируса простого герпеса, тип 1
Между ними находится аморфный слой — тегамент (англ. оболочка, покров), содержащий белки, необходимые для инициации репликативного процесса. Нуклеокапсид имеет около 100 нм в диаметре и, как любят подчеркивать вирусологи, построен из 162 капсомеров. Репликация происходит в ядре, здесь же собираются нуклеокапсиды. Суперкапсид образуется из модифицированных вирусом фрагментов ядерной и цитоплазматической мембран. Герпесвирусы практически не отличимы друг от друга под электронным микроскопом, но их легко разграничить по антигенным особенностям вирионных белков и степени гомологии ДНК. Согласно этим критериям, родственные связи между большинством герпесвирусов выражены слабо.
Геном представлен двухспиральной линейной молекулой ДНК. Она устроена своеобразно и кроме уникальных последовательностей включает прямые и инвертированные повторы, позиции которых меняются при репликации вируса (ДНК-изомерия). Значение такого рода перетасовок не известно, но они, безусловно, способствуют мутационным изменениям и в целом — эволюции генома. По крайней мере, согласно рестрикционному анализу (сравнение фрагментов, полученных при расщеплении ДНК специфическими эндонуклеазами — рестриктазами), штаммы, выделенные из разных источников (например, от людей, не имевших между собой контактов), различаются по нуклеотидному профилю ДНК. Необычность герпесвирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом.
Генетическая емкость ДНК позволяет синтезировать 70—100 белков, из которых не менее половины относятся к неструктурным (участвуют в репродукции вируса), а остальные включаются в состав вириона (структурные белки). Широкий набор вирусспецифеских ферментов определяет относительную независимость герпесвирусов от клетки-хозяина, создавая возможность для антивирусных воздействий. Герпетические инфекции (особенно простой герпес) лучше других поддаются химиотерапии, основанной на подавлении уникальных герпесвирусных ферментов — ДНК-полимеразы (ацикловир, ганцикловир, фоскарнет) и ферментов, обеспечивающих кэппинг вирусной мРНК (рибавирин). Новые надежды возлагают на инактивацию вирусспецифической тирозин-протеинкиназы и антисмысловые нуклеотиды.
Репликация герпесвирусов представляет собой хорошо упорядоченный процесс и напоминает воспроизведение других крупных ДНК-вирусов. Литический (продуктивный) цикл начинается с прикрепления вирионов к чувствительным клеткам благодаря высокоизбирательному взаимодействию клеточных рецепторов и суперкапсидных гликопротеинов. Кор освобождается от суперкапсида и транспортируется в ядро, где происходит реализация генетической программы вируса. Последовательность событий включает транскрипцию и трансляцию сверхранних, ранних и поздних генов. Экспрессия пяти сверхранних генов, запускаемая белками тегамента, инициирует активацию дюжины ранних генов, продукты которых необходимы для репликации вирусной ДНК. Вслед за этим в работу включаются остальные (поздние) гены, кодирующие белки вириона. Нуклеокапсидные частицы собираются в ядре и, почкуясь через участки ядерной и плазматической мембран, в которые предварительно включаются и гликозилируются вирусные белки, обретают суперкапсид. Часть зрелых вирионов высвобождается из клеток, но многие, не завершая почкования, связываются с соседними клетками, возбуждая очередной репликативный цикл. Внутриядерная локализация виропласта (место, где образуются нуклеокапсиды) и вирусиндуцированное слияние контактирующих клеток определяют характерную картину цитопатического эффекта — формирование многоядерных клеток (симпласт) с внутриядерными ацидофильными включениями (рис. 2). Нежизнеспособность симпласта ведет к множественной гибели втягиваемых в его построение клеток. Патогенетически важно и то, что внутри симпласта вирус не доступен для антител.

Рис. 2. Многоядерная клетка с внутриядерными включениями из очага кожных поражений при простом герпесе
Известно восемь герпесвирусов человека, которые по биологическим особенностям разделены на три подсемейства — альфа, бета и гамма (см. таблицу).
| Подсе-мейство | Цикл роста | Цито- патичность | Персис-тенция | Род | Официальное название | Общеупотре-бительное название |
| Αльфа | Короткий | Цитолитический эффект | Нейроны | Simplexvirus | Герпесвирус человека 1 Герпесвирус человека 2 | Вирус простого герпеса, тип 1 Вирус простого герпеса, тип 2 |
| Varicello-virus | Герпесвирус человека 3 | Вирус ветряной оспы/опоясывающего герпеса | ||||
| Бета | Длинный | Цитомегалический эффект | Железы, почки | Cytomegalovirus | Герпесвирус человека 5 | Цитомегаловирус |
| Лимфопроли-феративный эффект | Лимфоидная ткань | Roseolovirus | Герпесвирус человека 6 Герпесвирус человека 7 | Герпесвирус человека, тип 6 Герпесвирус человека, тип 7 | ||
| Гамма | Вариабельный | Лимфопроли-феративный эффект | Лимфоидная ткань | Lympho-cryptovirus | Герпесвирус человека 4 | Вирус Эпстайна—Барр |
| Rhadinovirus | Герпесвирус человека 8 | Герпесвирус человека, тип 8 |
Альфа-вирусы прекрасно размножаются в эпителиальных клетках и фибробластах человека и животных. Цитомегаловирус (бета) медленно реплицируется в фибробластах человека, неохотно выделясь из них. К бета-вирусам отнесены также герпесвирусы 6 и 7, хотя их особенностью является поражение Т-лимфоцитов, и по этому признаку они лучше подходят к лимфотропным гамма-вирусам. Гамма-вирусы культивируются в В- (вирус Эпстайна—Барр) и Т-лимфоцитах (герпесвирус 8). Они не убивают, а вынуждают размножаться свои мишени, реально претендуя на участие в развитии опухолей, прежде всего лимфопролиферативных заболеваний. Острая деструктивная патология наиболее характерна для альфа-вирусов.
Семейство сложных ДНК-геномных вирусов, паразитов человека, животных, пресмыкающихся, рыб, которые вызывают у своих хозяев острые и хронические, инфекционные и опухолевые заболевания. Диаметр вириона варьирует в пределах 150-200 нм. Выделяют три подсемейства герпесвирусов: Alphaherpesvirinae, Betaherpesvirinae, Gammaherpesvirinae. Сравнительная характеристика основных представителей подсемейств и вызываемые заболевания представлены в таблице 14.

-
Более 80 курсов для обучения Всего 20 минут в день на занятия Персональный преподаватель
лабиальный герпес, стоматит, конъюнктивит, энцефалит и др., генитальный герпес, ветряная оспа, опоясывающий лишай
в слюнных железах, почках
в лимфоидной ткани
инфекционный мононуклеоз, лимфома Беркитта, назокарцинома
В состав семейства включены также неклассифицированные вирусы герпеса 6, 7 и 8 типов.
Вирус герпеса человека типа 6 (ВГЧ-6) выделен из моноцитов периферической крови от пациентов с лимфопролиферативными заболеваниями. Диаметр вириона ВГЧ-6 — 150-200 нм. Выделяют 2 варианта изолятов ВГЧ-6 (А и В). В западной части Европы с большей частотой выделяют вариант ВГЧ-6В. Он подобно ВИЧ инфицирует CD4+ Т-лимфоциты-хелперы.
Выявлена роль ВГЧ-6 в злокачественной трансформации лимфоцитов при лимфомах и лимфогранулематозе. Кроме того, ВГЧ-6 может вызывать развитие острых гепатитов у взрослых и детей, а также выраженную экзантему у детей раннего возраста. У взрослых он вызывает синдром хронической усталости. В США ВГЧ-6 выявляется 60% детей первого года жизни и у 80-90% взрослых лиц.
Вирус герпеса человека типа 7 (ВГЧ-7) выделен из CD4+ Т-лимфоци-тов здоровых людей и от людей с синдромом хронической усталости. В США частота встречаемости ВГЧ-7 до 85%. Это Т-лимфотропный вирус, обладающий способностью инфицировать CD4+ Т-лимфоциты и незрелые Т-клетки. Полагают, что путь передачи может быть вертикальный от матери к ребенку, а также горизонтальный через слюну. Отличается от ВГЧ-6 тем, что инфицирование ВГЧ 7 типа возникает в более позднем возрасте.
Вирус герпеса человека типа 8 (ВГЧ-8) выделен от больных с саркомой Капоши. Инфицирует CD19+ В-лимфоциты. Предполагается, что он также может вызывать развитие опухолей. Относится к роду Rhadinovirus подсемейства Gammaherpesvirinae. Близок по свойствам вирусу Эпштейна-Барр. Содержит около 80 типов. Подразделяется на 4 генотипа. Передается контактным, половым путем и с препаратами крови. Интенсивность передачи через кровь ниже, чем ВИЧ.
Наиболее широко известны заболевания человека, вызываемые 1 и 2 серотипами альфагерпесвирусов. Выделяют локализованные формы (офтальмогерпес, герпетический стоматит, кожный герпес, генитальный герпес и др.) и генерализованные герпетические инфекции новорожденных и взрослых. Для локальных форм характерно хроническое рецидивирующее течение. Отдельные генерализованные случаи могут протекать по типу медленных инфекций и энцефалитов.
Одной из важнейших характеристик патогенеза герпетической инфекции является ЦПД на клетки-мишени, сопровождающееся прогрессирующей дегенерацией значительной их части. Формы ЦПД вирусов простого герпеса весьма разнообразны и зависят как от свойств штаммов самого вируса, так и от вида инфицируемых ими клеток.
Проявления ЦПД при герпетической инфекции:
– образование симпластов, которые представляют собой единую массу цитоплазмы, включающую от 2-5 до 20 ядер;
– образование гигантских клеток;
– образование специфических внутриядерных включений;
Пути передачи: со слюной (при поцелуях); спермой при половых контактах; во время родов при прохождении плода по родовым путям; внутриутробное заражение — при дефектах амниотической оболочки или проникновении через нее.
Для проникновения вируса необходима прямая инокуляция на слизистые оболочки. Герпесвирусы не способны проникать через неповрежденную кожу.
Патогенез. После проникновения в эпителий возбудитель интенсивно в нем размножается, запуская литический, продуктивный тип инфекции. Гистологические изменения характеризуются очаговой дегенерацией эпителия. Клетки увеличиваются в размерах, округляются или образуют гигантские клетки, затем погибают, образуя очаги некроза.
Латентная герпетическая инфекция. Мигрируя из первичного очага, возбудитель проникает в сенсорные ганглии (ВПГ-1 — в тройничные, ВПГ-2 — в поясничные узлы), где латентно циркулирует.
Рецидивы или клинически периодические проявления заболевания наблюдаются не у всех инфицированных. Пусковые механизмы рецидивов: переохлаждение, менструация, избыточная инсоляция, нарушение питания, стрессовые ситуации.
Лабораторная диагностика герпетической инфекции. Для диагностики используют изоляцию вируса из клинического материала и методы экспресс-диагностики.
Вирусы выделяют из везикул, смывов крови, слюны, мочи, биоптатов на куриных эмбрионах и лабораторных животных. О количестве вируса судят по развитию характерного ЦПД или развитию типичной симптоматики герпетической инфекции у зараженных животных.
Чаще используют методы экспресс-диагностики.
Метод флюоресцирующих антител (МФА) основан на изучении препаратов в люминесцентном микроскопе при введении в состав комплекса антиген-антитело хромогена (ФИТЦ и др.), индуцирующего свечение определенного цвета. Исследование длится 1-3 часа.
Иммунопероксидазный метод аналогичен МФА, однако при получении конъюгата используют фермент, чаще пероксидазу хрена.
Метод встречного иммуноэлектрофореза и иммуноблоттинга представляет собой одновременный электрофорез АГ и АТ в геле навстречу друг другу с противоположно заряженных полюсов, что позволяет проводить анализ в течение 30-90 минут.
Метод молекулярной гибридизации нуклеиновых кислот для детекции герпесвирусной ДНК основывается на использовании меченых ДНК-зондов.
Метод ПЦР способен амплифицировать единичную молекулу ДНК в исследуемом материале. Используют в основном для детекции и идентификации всех типов вирусов герпеса. Наиболее часто используется для выявления генома вирусов 4-8 типов.
Иммуноэлектронная микроскопия очень эффективна в случае невозможности использования других методов.
1. При лечении герпетической инфекции на первый план выдвигается химиотерапия. Наибольшее применение получили препараты на основе ацикловира — аномальные нуклеозиды (зовиракс, фамцикловир (фамвир), ванцикловир, герпивир и др.). Ацикловир — специфическое антигерпетическое средство, подменяет действие вирусной тимидинкиназы и угнетает ДНК-поли-меразу. Ацикловир применяют как перорально, внутривенно, так и в виде аппликаций.
2. В последнее время в лечении герпесвирусных инфекций большое внимание уделяется интерферону (используют как α-, так и β-интерфероны) и его индукторам. Неовир (производства Германии) обладает противовирусным и иммуномодулирующим действием. Используется для лечения больных с нарушениями иммунной системы. Циклоферон (производства России) — индуктор интерферона и иммуномодулятор. Аналог неовира.
Местное лечение. При эрозиях используют мазевые аппликации: оксолиновая мазь (0,25-3,0%), теброфен (0,52,0%), аплизарин (2-5%), гевизом-мазь (Венгрия), крем с β-интерфероном.
Профилактика рецидивов. Герпетическая инактивированная вакцина (включает ВПГ 1 и 2 типов) оказывает иммуностимулирующий и десенсибилизирующий эффекты. Курс состоит из 5 внутрикожных инъекций по 0,2 мл через 3-4 дня, его повторяют через 6-12 месяцев.
Гамма-глобулины (специфические и неспецифические) используют как иммуностимуляторы и при заместительной терапии в виде внутримышечных инъекций по 1,5-3,0 мл через день в течение 5-10 дней.

Дата публикации: 29.06.2019 2019-06-29
Статья просмотрена: 257 раз
Герпесвирусные инфекции — актуальная проблема современной медицины. Возбудители широко распространены среди населения планеты и способны инфицировать большинство органов человеческого организма, вызывая латентную, острую или хроническую форму инфекции. Из-за большого количества поражаемых клеточных мишеней герпетическая инфекция имеет различные клинические проявления — от кожного высыпания до возникновения злокачественных образований, пораженния органов и систем.
Особая значимость изучения герпесвирусных инфекций связана с появлением ВИЧ-инфицированных людей. Доказано, что вирусы герпеса могут активировать ВИЧ, находящийся в стадии провируса, и являются фактором прогрессирования ВИЧ-инфекции и его перехода в терминальную стадию [6].
При инфицировании герпесвирусами человек является носителем вируса в течение всей жизни. Заражение других людей может происходить в период обострения как вертикальным (трансплацентарно), так и горизонтальным (контактно-бытовым, воздушно-капельным, половым) путем.
Семейство Herpesviridae, насчитывает более 80 представителей, имеющих общее строение и ряд общих антигенов. Для них характерна сферическая форма и наличие 4 структурных компонентов: сердцевины, капсида, внутренней оболочки (tegument), внешней оболочки (envelope). Размер вириона колеблется от 100 до 300 нм. Сердцевина представлена двунитевой молекулой ДНК.
Вирусный геном упакован в капсид правильной икосаэдральной формы, состоящий, в среднем, из 162 капсомеров. Вирус покрыт липидсодержащей оболочкой с определяющимися в ее структуре белковыми выступами. Так же для них характерно наличие суперкапсида, образованного компонентами ядерных мембран и пронизывающих его гликопротеинов — белками ядерной мембраны, зараженных клеток. Между суперкапсидом и нуклеокапсидом расположен покровный слой тегумена, представленный глобулярными белками. Герпесвирусы (ГВ) термонеустойчивы, быстро инактивируются под действием факторов окружающей среды.
В составе вирионов обнаружено более 30 белков (гликопротеидов), семь из которых (gB, gC, gD, gE, gF, gG и gX) находятся на поверхности и вызывают образование вирус-нейтрализующих антител. Шесть гликопротеидов входят в состав капсида. Многие десятки белков, в том числе тимидинкиназа, являются неструктурными и образуются в ходе жизненного цикла вируса, например, ДНК-полимераза [7].
Проникновение ГВ в клетку хозяина является сложным процессом, который включает в себя прикрепление вирионов к клеточным рецепторам, эндоцитоз и слияние мембран вирионов и клетки. В результате капсид освобождается от белков внешней оболочки, а комплекс ДНК-белок вируса проникает в ядро. Вирионная ДНК выходит в нуклеоплазму и транскрибируется клеточной РНК-полимеразой. Различают сверхраннюю, раннюю и позднюю транскрипцию. В результате происходит ряд последовательных процессов: процессинг мРНК, синтез кодируемых продуктов и частичный обратный транспорт их в ядро, репликация ДНК и формирование дочерних молекул. Образовавшиеся в ядрах клеток незрелые капсиды, путем почкования, проникают через ядерную мембрану в цитоплазму. В цистернах эндоплазматического ретикулума заканчивается формирование зрелых капсидов и внешней оболочки вируса, с последующим транспортом к поверхности и выходом их из клетки.
Уникальным биологическим свойством всех ГВ человека является их способность к персистенции и латенции в организме инфицированного человека. Персистенция представляет собой непрерывное и цикличное размножение (репликацию) вируса в инфицированных клетках тропных тканей, что является причиной развития инфекционного процесса. Латенция ГВ клинически себя не проявляет, а диагностируется только при наличии специфических IgG против вируса в невысоких титрах, а сам вирус в этот период в периферической крови не определяется даже таким высоко-чувствительным методом, как ПЦР. В состоянии латенции нарушается полный цикл репродукции вируса, и он находится в клетках хозяина в виде субвирусных структур.
Опираясь на особенности структуры генома, репродукции и действия на клетки вирусы герпеса подразделяют на подсемейства: Alphaherpesvirinae, Веtaherpesvirinae и Gammaherpesvirinae [5].
Alphaherpesvirinae — широко распространенные вирусы, отличающиеся высокой цитопатической активностью для человека. Характеризуются быстрой репликацией (4–8 часов), способностью к цитолизу и бессимптомным персистированием в клетках нервной системы.
Сюда относят вирус герпеса 1-го и 2-го типа (род Simplexvirus) и вирус 3-го типа (род Varicellovirus). Представители рода Simplexvirus являются наиболее изученными среди всех герпесвирусов. Более 90 % населения земного шара инфицировано вирусом простого герпеса (ВПГ), а 20 % из них имеют проявления инфекции. ВПГ-1 типа вызывает герпетический гингивостоматит, герпетический кератит и т. д. ВПГ-2 типа является возбудителем в основном генитального герпеса, герпетического менингоэнцефалита, вызывая демиелинизацию нервных волокон и герпес новорожденных [8,9].
Вирусная инфекция способна протекать как в виде моноинфекции, вызванной ВПГ-1 или ВПГ-2, так и в сочетанной форме. В исследованиях Зубрицкого М. Г. была установлено, что ВПГ-1 и ВПГ-2 играют роль в возникновении сахарного диабета I и II типов, что проявляется наличием признаков хронического воспаления в поджелудочной железе и внутриядерных вирусных включений в ее клетках [4].
Ветряная оспа и опоясывающий лишай — острые инфекционные заболевания, вызываемые вирусом герпеса человека 3-го типа, является ДНК-содержащим вирусом. Первичная инфекция протекает как ветряная оспа (папулезно-везикулярная сыпь, сопровождающаяся лихорадкой), а при персистенции вируса в чувствительных ганглиях, возникают ее рецидивы — в форме опоясывающего лишая, проявляющегося невралгиями и высыпаниями по ходу нервных стволов [6,8].
Веtaherpesvirinae — проявляют менее выраженную цитопатичность, чем другие представители семейства. К патогенным для человека видам относят представителей родов Cytomegalovirus (вирус герпеса 5 типа) и Roseolovirus (вирус герпеса 6 и 7 типов). Отличаются медленной репликацией, основными очагами латенции являются моноциты и их предшественники, эндотелиальные клетки сосудов микроциркуляторного русла, альвеолярные макрофаги, Т-лимфоциты и стромальные клетки костного мозга [9].
Вирус герпеса 5 типа является возбудителем цитомегаловирусной инфекции (ЦМВИ), характеризующейся многообразием форм (от бессимптомных до генерализованных), морфологически проявляющейся образованием в слюнных железах, висцеральных органах и ЦНС цитомегалов — гигантских клеток с типичными внутриядерными и цитоплазматическими включениями.
ЦМВ может поражать практически все органы и ткани, вызывая как выраженные клинические состояния (интерстициальная пневмония, типичные поражения внутренних органов, включая мозг, почки, печень, органы иммунной системы), так и бессимптомное носительство. Особенный тропизм вирус проявляет к иммунокомпетентным клеткам. При персистенции ЦМВ выделяют две стадии: стадию продуктивной репликации и стадию латенции. Обе стадии не являются стабильными в течение жизни человека, сменяя одна другую. Реактивация ЦМВИ обычно не сопровождается какими-либо симптомами и для организма человека протекает незаметно.
Инфекции, вызываемые вирусом герпеса человека 6-го типа (ВГЧ-6), связывают с различными лимфопролиферативными иммуносупрессивными заболеваниями, некоторыми заболеваниями ЦНС. ВЧГ-6 впервые выделен в 1986 из лимфоцитов больных ВИЧ-инфекцией. Заражение ВЧГ-6 происходит преимущественно в первые два года жизни ребенка.
Иммуносупрессия развивается только при сочетанной инфекции с ВИЧ, ВЧГ-7 и ВЭБ, для которых ВЧГ-6 является кофактором, а также у больных СПИДом. У иммунодефицитных больных ВЧГ-6 может быть причиной лихорадки, снижения функции и отторжения трансплантата, пневмонии, гепатита, поражений ЦНС [1].
Отечественными исследователями установлено, что ВГЧ-6 и ВГЧ-7 могут запускать в организме человека аутоиммунные процессы, активировать продукцию противовоспалительных цитокинов: ФНО-альфа, ИЛ-6 и ИЛ-1в, таким образом, играя ведущую роль в патогенезе рассеянного склероза. Установлено, что ВГЧ-6 является кофактором прогрессивной мультифокальной лейкоэнцефалопатии.
Gammaherpesvirinae — патогены для небольшой группы хозяев, способны размножаться в лимфоидных тканях. Способствуют развитию злокачественному перерождению клеток, пожизненно персистируя в В-лимфоцитах или находясь в латентном состоянии. Патогенными для человека являются рода Lymphocryptovirus (вирус герпеса 4 и 8 типов) [9].
Наиболее часто ВГЧ-4 вызывает инфекционный мононуклеоз (вирус Эпштейна-Барра). Заболевание проявляется лихорадкой, ангиной, увеличениями лимфатических узлов, печени, селезенки, редко поражениями в форме гепатита и менингита. С ним связывают развитие лимфомы Беркитта. Предполагается, что вирус может способствовать трансформации В-лимфоцитов и индуцированию образования лимфобластных клеточных линий. Для него характерно пожизненная персистенция, иммунодепрессивная активность, индукция опухолевых и аутоиммунных процессов [3].
В 1995 году был выделен геном, который имел выраженную гомологию к вирусу Эпшетейна-Барра. Данный вирус отнесли к вирусу герпеса 8 типа (ВГЧ-8), который в настоящее время вирус мало изучен. По строению он сходен с другими герпесвирусами. Этот вирус выступает как этиологический агент, провоцирующий развитие одной из форм первичной лимфомы.
Несмотря на многообразие герпесвирусов, патогенными для человека являются 8 основных типов. Они поражают многие системы и органы человеческого организма — центральную нервную систему, вызывая возникновение энцефалитов, энцефаломиелитов, органов зрения (кератит, увеит), печени (гепатит новорожденных), слизистых оболочек (стоматиты, язвы, поражения гениталий) и кожного покрова (экзема, везикулярные сыпи), лимфатическую и т. д., инфицируя их клеточные элементы — глиальные клетки, эритроциты, моноциты, макрофаги, лимфоциты, эпителиальные и дендритные клетки. Это в свою очередь может приводить к таким тяжелым последствиям как — менингоэнцефалит (ВПГ-2), лимфопролиферативные заболевания (ВПГ-4), рассеянный склероз (ВГЧ-6 и -7), саркому Капоши (ВГЧ-8) и др. [2].
Изучение особенностей вирусов герпеса, особенностей строения и физиологии ускоряет диагностику инфекционных заболеваний, способствует правильному подбору противовирусных препаратов.
Читайте также:


