Диагностика вирусных инфекций экспресс метод
а) определение вирусного антигена в исследуемом материале с помощью диагностических противовирусных сывороток в реакциях: РИФ, ИФА, РИА, встречного иммуноэлектрофореза (ВИЭФ), реакции пассивной гемагглютинации (РПГА), реакции торможения гемагглютинации (РТГА) и др.;
б) обнаружение включений в пораженных клетках макроорганизма с помощью световой или люминесцентной микроскопии;
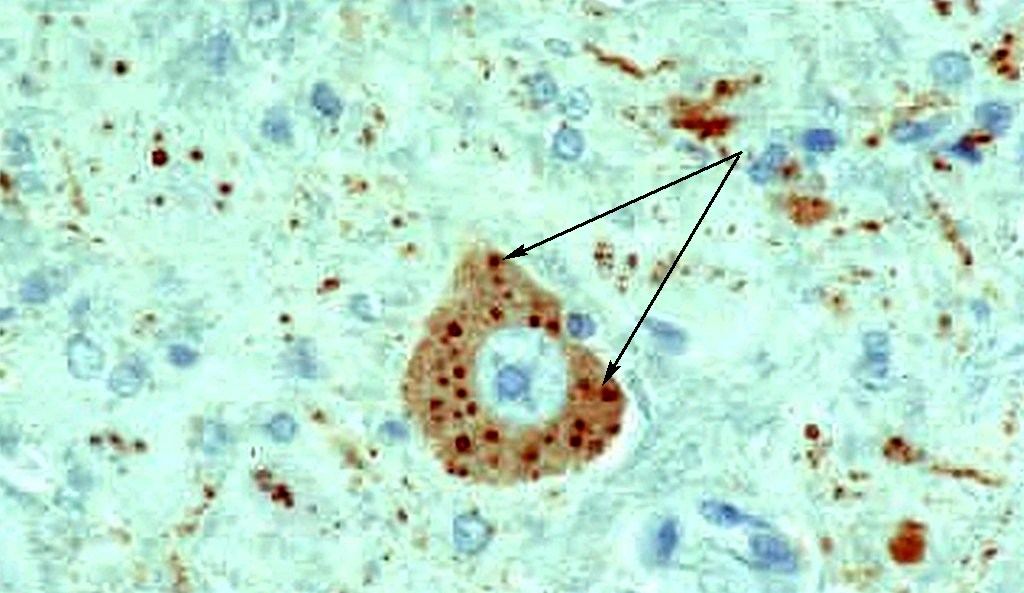
в срезе гиппокампа.
Окраска по Муромцеву.
Окраска по Граму
в) обнаружение вирионов в патологическом материале с помощью электронной микроскопии или ИЭМ.
г) обнаружение геномов вируса молекулярно-генетическими методами: ПЦР; молекулярная гибридизация нуклеиновых кислот с помощью меченых зондов.
2. Вирусологический метод
1. Забор исследуемого материала.
2.Выбор по принципу цитотропизма и получение чувствительной тест-системы, определение ее жизнеспособности.
3. Заражение выбранной системы.
4.Индикация вируса на основании обнаружения его нуклеиновой кислоты, антигенов, гемагглютинина, ЦПД, включений.
5. Идентификация и титрование вируса проводится на основании:
а) определения антигенов вируса с помощью иммунологических реакций (РИФ, ИФА, РПГА, РСК, РН, ВИЭФ и др.); б) патогистологического исследования органов и тканей; в) ЦПД; г) клинических симптомов, биологических проб (кератоконьюнктивальная и др.).
Вирусологический метод (схема)
Исследуемый материал (фекалии, носоглоточные смывы, секционный материал и др.)
Обработка антибиотиками для подавления бактериальной и грибковой
микрофлоры, центрифугирование, фильтрация






Индикация вирусов по следующим феноменам






Отставание в развитии,
оболочек эмбриона, РГА
ЦПД, образование бляшек, РИФ, РГадс, интерференция
в тканях, включения


Титрование выделенного вируса; выбор рабочей дозы.
Титр вируса - максимальное разведение вируссодержащего материала, в котором еще наблюдается ожидаемый эффект (ЦПД, РГА, гибель животного).


Идентификация выделенного вируса в реакциях нейтрализации, РТГадс, РСК, подавление бляшкообразования и др. с диагностическими сыворотками. Вид (тип) вируса определяется по нейтрализации специфического эффекта вируса соответствующей иммунной сыворотокой.
Примечание: титрование и идентификация вируса проводится с использованием одного и того же феномена.
Вирусы - облигатные внутриклеточные паразиты, не способные размножаться ни в одной из бесклеточных сред. Для их культивирования используются: 1) куриные эмбрионы; 2) культуры клеток (тканей, органов); 3) лабораторные животные.
Инфекционные болезни — это заболевания, вызванные проникновением в организм бактерий, грибков или вирусов. Самая важная часть диагностики инфекций — это определение возбудителя и его концентрации. Для этих целей используются разнообразные лабораторные методы, которые позволяют выяснить, чем именно и как давно атакован организм, а в некоторых случаях — спрогнозировать эффективность лечения тем или иным препаратом.
Особенности диагностики инфекционных заболеваний
В клинической практике данный тип заболеваний встречается очень часто. Именно они, по данным Всемирной организации здравоохранения, становятся причиной 26% всех смертей. В список самых распространенных инфекционных заболеваний входят инфекционная пневмония и другие воспалительные заболевания дыхательных путей, гепатит, ВИЧ, туберкулез, малярия, воспаления органов половой системы и мочевыводящих путей, гистоплазмоз, ротавирусные инфекционные заболевания, ветряная оспа, герпес, вирус папилломы человека и еще несколько десятков болезней. Хотя бы раз в жизни каждый из нас сталкивается с инфекционными заболеваниями и необходимостью быстрой постановки диагноза.
Все инфекционные болезни делятся на пять типов — прионные, вирусные, бактериальные, протозойные и грибковые поражения. Далее будут рассмотрены последние четыре типа как наиболее распространенные. Разные возбудители иногда могут вызывать одно и то же заболевание. В частности, пневмония может быть результатом как вирусной, так и бактериальной инфекции. Лечение зависит не от проявлений, а от возбудителя болезни. Противовирусные препараты бесполезны в борьбе с бактериями и грибками, антибиотики не действуют на вирусы. Поэтому основная задача лабораторной диагностики инфекционных заболеваний — выявление типа возбудителя.
Способы лабораторной диагностики инфекционных болезней можно разделить на два типа: неспецифические и специфические методы.
К неспецифическим относятся общий анализ крови и исследование соотношения ее белковых фракций, печеночные пробы, общий анализ мочи и кала. Эти методы не дают информации о виде возбудителя, но позволяют узнать, в какой мере болезнь затронула органы и системы организма, что именно в их работе нарушено и насколько далеко зашел процесс.
Специфические — вирусологический и бактериологический методы, микроскопическое исследование возбудителей, анализы на антигены и антитела — направлены непосредственно на обнаружение возбудителя.
Современная медицина располагает множеством методов выделения возбудителей бактериальной инфекции:
Бактериоскопический . Исследуется окрашенный специальным образом мазок.
Бактериологический . Биоматериал высеивается в питательную среду, и через некоторое время специалист исследует колонию бактерий, выросшую в ней.
Биологический . Направлен на определение патогенности микроорганизмов.
Серологический . Выявляет антитела и антигены в сыворотке крови — особые вещества, которые вырабатываются организмом при контакте с возбудителем определенной болезни.
Чаще всего для исследований используют кровь или сыворотку крови, реже — слюну, мочу, кал, клетки эпителия (мазок и соскоб) и другой биоматериал.
В лабораторной диагностике вирусных заболеваний используются:
Вирусологическое исследование . Световая и электронная микроскопия дает возможность выявить наличие вирусных включений и сами вирусы и идентифицировать их.
Серологическое исследование для обнаружения антител и антигенов. Этот метод дает возможность быстро выявить агрессора, как и в случае с бактериальными инфекциями. Для диагностики используются разнообразные способы исследования материала — реакции гемадсорбции, гемагглютинации или метод непрямой иммунофлюоресценции. Имунноблоттинг, в частности, позволяет выявлять антитела сразу к нескольким инфекциям и считается современным и точным диагностическим методом.
Молекулярно-генетические методы . Последнее слово в лабораторной диагностике. Позволяют обнаружить вирус даже тогда, когда его концентрация ничтожно мала — то есть на самых ранних стадиях. Самым известным из этих методов является ПЦР, при которой фрагмент вируса многократно копируется до тех пор, пока специалист не получит достаточно материала для определения типа вируса и его изначальной концентрации.
Для выявления вирусов обычно требуется сделать анализ крови.
Так называют инфекции, вызванные простейшими паразитами, например, амебами. Малярия, амёбиаз, токсоплазмоз, лямблиоз, трихомониаз, сонная болезнь — вот неполный список самых распространенных протозойных инфекций. Лабораторная диагностика таких заболеваний включает в себя следующие методы:
Микроскопический . Простейшие паразиты выявляются путем исследования под микроскопом окрашенных образцов биоматериала. Самый простой и надежный метод для многих возбудителей.
Культуральный . Посев биоматериала в питательную следу для дальнейшего исследования размножившихся простейших. У этого метода есть существенный недостаток: результатов нужно ждать долго, сам процесс может занять не менее 5-6-ти дней.
Серологический . Используют редко ввиду малой информативности.
Аллергический . Также не является распространенным. Кожные аллергопробы делают для того, чтобы подтвердить лейшманиоз и токсоплазмоз. Это вспомогательный диагностический метод.
В качестве биоматериала для исследований в основном используется кровь, иногда — – кал или моча.
Микроскопическое исследование . Препарат окрашивается и рассматривается под мощным микроскопом. Посредством иммунофлюоресцентной микроскопии исследуется проба, помеченная флюоресцеинами — специальным красителем. Наиболее быстрый способ выявления грибка по сравнению с другими методами.
Культуральный . Происходит посев пробы на питательную среду и дальнейшее исследование полученной в результате колонии грибков.
Серологический . Используется для выявления грибковых поражений, однако для микозов он считается не особенно точным.
Гибридизация нуклеиновых кислот . Самый современный способ выявления грибковых инфекций, его применяют для идентификации основных возбудителей системных микозов. Из культуры извлекается РНК и вносится особым способом помеченная молекула ДНК. Если в пробе наличествует один из основных патогенных грибков, ДНК объединится с его РНК, создав легко различимую структуру. Несомненным преимуществом метода является возможность определить инфекцию на самых ранних стадиях.
Биоматериалом для исследований являются клетки кожи, волос и ногтей, клетки слизистых оболочек (мазок или соскоб), мокрота, моча, секрет простаты, сперма, грудное молоко.
Современные методики диагностики инфекций позволяет выявить их на начальном этапе, Чем раньше болезнь будет обнаружена, тем проще ее вылечить. Поэтому сдавать анализы на инфекции желательно регулярно, даже если вы ни на что не жалуетесь и не замечаете никаких перемен в самочувствии.

Перед сдачей биоматериала для исследований иногда требуется определенная подготовка. Так, кровь обычно сдают с утра, натощак, а перед забором мазка не рекомендуется принимать душ. Эти требования очень важны: они обеспечивают точность результата, поэтому узнайте у врача заранее о подготовительных мерах и точно следуйте всем его рекомендациям.
С целью лабораторной диагностики вирусных инфекций используют три группы методов:
1. Быстрые (экспресс) методы - прямое обнаружение возбудителя в клиническом материале (от больного).
2. Вирусологический метод - выделение вируса из клинического материала и его идентификация.
3. Серологический метод - определение прироста (динамики) антител к вирусу (за определенный период заболевания) в парных сыворотках больного.
Выбор метода зависит от биологических свойств вируса, периода
заболевания, а также технической оснащенности лаборатории.
Быстрый (экспресс) метод. Основан на быстром обнаружении и
идентификации вируса, его антигенов или включений в биосубстратах (мазках-отпечатках, биоптатах, эпителий осадка, лейкоцитах, гистологических срезах, секционном материале):
а) серологический метод - определение вирусного антигена в исследуемом материале с помощью диагностических противовирусных сывороток в экспресс-реакциях: иммунофлюоресценция (ИФ), иммуноферментный анализ (ИФА), радиоиммунный анализ (РИА), встречный мммуноэлектрофорез (ВИЭФ), иммунная электронная микроскопия (ИЭМ), реакция прямой и обратной пассивной гемагглютинации (РПГА, РОПГА), реакция торможения обратной пассивной гемагглютинации (РТОПГА);
б) микроскопический метод - обнаружение элементарных частиц или включений вирусов с помощью световой, люминесцентной или электронной микроскопии:
в) молекулярная гибридизация - гибридизация комплементарных нитей ДНК или РНК (вируса и зонда).
Вирусологический метод. Основан на культивировании вирусов на
чувствительных клеточных системах (культуре клеток, курином эмбрионе,
1. Забор исследуемого материала.
2. Выбор и получение чувствительной тест-системы, определение ее жизнеспособности.
3. Заражение ее по принципу цитотропизма.
4. Индикация (обнаружение) вируса.
5. Идентификация вируса проводится на основании:
а) определения антигенов вируса в тест-системе с помощью серологических реакций (ИФ, ИФА, РПГА, РТГА, РСК, РН, ВИЭФ и др.);
б) патогистологического исследования органов и тканей;
в) клинических симптомов;
г) биологических проб (кератоконъюнктивальная и др.). Оценка метода: относится к ранним высокочувствительным методам исследования. Недостатки: сложность интерпретации результатов при выделении персистирующих вирусов; техническая сложность. Серологический метод. Основан на нарастании титра (прироста) антител за определенный период заболевания в парных сыворотках больных или переболевших людей - с помощью набора вирусных диагностикумов. Парные сыворотки - две сыворотки, взятые от одного больного в начале заболевания и через 1-4 недели. Серологические реакции (РПГА, РСК, РТГА, РН, ИФА и др.) ставят одновременно с двумя сыворотками для определения и сравнения их титров. Для ранней диагностики заболевания определяют наличие IgM в сыворотке (в непрямой ИФ и ИФА).
3.3. Лабораторная диагностика вирусных гепатитов
В настоящее время известны несколько типов вирусных гепатитов: гепатит А (гА) (синоним: инфекционный гепатит, эпидемический гепатит, болезнь Боткина); гепатит В (гВ) (синоним: сывороточный гепатит); гепатит ни А ни В (синоним гепатит С); гепатит дельта (синоним гепатит Д); гепатит Е.
I. Гепатит А (гА). Лабораторная диагностика гА основывается либо на выявлении самого возбудителя (метод иммунной электронной микроскопии - ИЭМ), его антигенов (радиоиммунный, иммуноферментный, иммунофлюоресцентный метод - РИА, ИФА, ИФ), или антител к вирусу гА (РИА, ИФА).
Для ранней диагностики заболевания, а также выявления источников инфекции, используется определение антигена вируса гА в фекалиях больных, где он появляется за 7-10 дней до клинических симптомов и в первые дни заболевания.
Из определяемых в настоящее время специфических маркеров гА важнейшими являются антитела класса Ig M к вирусу гА, которые появляются в сыворотке крови и слюне уже в начале заболевания и сохраняются в течение 3-6 месяцев. Обнаружение антител класса Ig M к вирусу гА однозначно свидетельствует о гепатите А и используется для диагностики заболевания, в том числе и бессимптомных случаев инфекции и выявления источников инфекции в очагах.
Антитела к вирусу гА класса Ig G выявляются с 3-4-й недели заболевания и сохраняются длительно, что позволяет оценить состояние иммунитета населения, динамику специфического гуморального иммунитета. Вирус гепатита А в материале от больного можно выявить методом иммунной электронной микроскопии. В основе метода лежит смешивание суспензии вируса с антисывороткой, отделение иммунных комплексов и исследование их в электронном микроскопе.
II. Гепатит В (гВ). В организме людей, зараженных вирусом гВ, с разной частотой и на разных этапах могут выявляться серологические маркеры: поверхностный HBs Ag и сердцевинный НВс Ад и НВе Ад, а также антитела к ним (anti-HBc, anti-HBe, anti-HBs). Динамика их появления представлена на рис. 1.
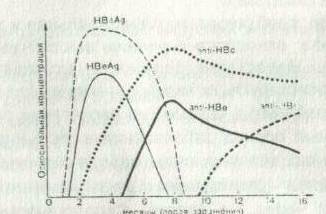
Рис. 1. Динамика появления серологических маркеров гВ
Все антигены и соответствующие им антитела могут служить индикаторами инфекционного процесса.
Наличие HBs Ag, НВс Ag и anti-HBc класса Ig M свидетельствует об остром периоде инфекции. В период реконвалесценции - это НВс-антитела класса Ig G и выявляются они совместно с Hbs-антителами. Длительное присутствие НВе Ад и HBs Ад в крови - неблагоприятный признак, свидетельствующий о формировании хронического процесса. При формировании длительного носительства постоянно определяется HBs Ag. Для обнаружения антигенов и антител используют РПГА, РИА и ИФА. Для обнаружения Hbs Ag широко используется РОПГА - реакция обратной пассивной гемагглютинации с обязательным положительным контролем на HBs Ag.
III. Гепатит С (гС). Вызывается РНК-содержащим вирусом, который относится к Flaviviridae. Диаметр вирионов 30-60 нм, чувствительны к обработке хлороформом. Позитивная одноцепочечная РНК кодирует синтез трех структурных и пяти неструктурных белков. Гепатит С по клинико-биохимическим признакам сходен с гепатитом В. У 50% инфицированных лиц заболевание переходит в хроническую форму, а у 20% хронических больных развивается цирроз печени. Механизм передачи вируса гепатита С в основном парентеральный. Лабораторная диагностика гС основана на определении антител к вирусу гС методами ИФА или РИА.
VI. Возбудитель гепатита дельта (гепатит Д). РНК-содержащий, дефектный вирус, способный реплицироваться в организме хозяина лишь при обязательном участии вируса-помощника, роль которого выполняет вирус гВ. Оболочку вируса-дельта формирует HBs Ag. Присоединение дельта-инфекции к гВ ведет к развитию тяжелых злокачественных форм болезни, хронических форм заболевания с ранним формированием цирроза печени. Лабораторная диагностика гепатита Д проводится путем обнаружения маркеров вируса гВ и дельта-вирусной инфекции, HBs Ag, anti-HBc (Ig M) и дельта Ag. Последние тестируются при помощи ИФА и РИА. Наибольшее диагностическое значение имеют антидельта IgM, которые обнаруживаются в течение всего заболевания.
V. Гепатит Е. Широко распространен в тропических и субтропических странах, распространение заболевания проходит водным путем. Вирион диаметром 27-32 нм содержит однонитчатую РНК, по физико-химическим свойствам схож с вирусами семейства Caliciviridae. Лабораторная диагностика основана на определении AT в сыворотке крови ИФА.


ОРВИ и грипп имеют респираторные симптомы и общие. Их можно распознать по катаральным признакам со стороны дыхательных путей и общей симптоматике, характерной для большинства заболеваний.
Современные методы диагностики данной группы заболеваний
Различают несколько видов диагностики, которые различаются по особенностям проведения и методу выявления возбудителя. Это:
- экспресс-методы;
- серологическая диагностика;
- вирусологическая диагностика.
Первая группа - экспресс-методики. Это быстрый способ подтвердить или исключить наличие болезни. Используется метод флюоресценции и ПЦР. Рассмотрим их подробнее.
Изучение флюоресцирующих антител - МФА. Способ основан на определении антигенов к вирусу в эпителиальных клетках носовой слизистой, на конъюнктиве (если есть глазные поражения). Антитела при действии антигена реагируют специфическим свечением, которое легко заметить при микроскопическом исследовании. Этот параметр считается маркером диагностики и является основой для подтверждения результата. Способ имеет диагностическую ценность начиная с 3 и заканчивая 5 днем заболевания. Чувствителен к таким антигенам: вирус гриппа типа А, В, вирус парагриппа, аденовирусы и возбудитель РС-инфекции. Это удобный и быстрый метод, не требующий особых ресурсов, который часто применяется в ходе диагностики.

Метод полимеразно-цепной реакции базируется на основе обнаружения участков нуклеиновых кислот генетического материала вируса и определении их групповой принадлежности по этому критерию. Методика имеет высокую диагностическую ценность, является современным и качественным способом подтверждения заболевания. Считается “золотым стандартом” диагностики, так как не дает ложных результатов и является специфическим для определения конкретных патогенов, широко применяется в стационарных и амбулаторных условиях.
Вирусологические методики основаны на чистом выделении вирусных микроорганизмов и их конкретных штаммов, за чем следует их прикрепление к клеточным культурам в лабораторных условиях. Далее следует определение вида вируса с помощью ПЦР или других реакций. Метод требует значительных ресурсов, довольно длительный и трудоемкий. Его ценность заключается в получении эпидемиологических данных и основе для научных работ. То есть, детальное изучение вируса, частоты его распространения позволяет прогнозировать эпидемическую картину, создавать вакцины. Для исследования берется мазок из носа и носоглотки. Материал пригоден в течении 3-5 дня заболевания. С помощью вирусологических методов можно определить такие возбудители:
Серологические методы диагностики - это ретроспективное исследование, которое дает точные данные относительно стадии процесса, степени активности и типа возбудителя. Используется для эпидемиологических целей.
Для анализа используется сыворотка крови, в которой необходимо определить количество и виды антител. Используется известный антиген вируса. При возникновении реакции с материалом пациента формируются иммунные комплексы антиген-антитело, что подтверждает диагноз. Для диагностики также важен прирост титра антител, для чего используются парные сыворотки.
Результат имеет высокую точность и может определиться даже если все другие методы не дали результата, так как имеет высокую чувствительность. особенно важно использование метода для стертых форм с минимальными клиническими проявлениями. Сыворотки для анализа берутся в начале болезни, а также через 10-14 дней после её завершения. Используется метод для подтверждения наличия в организме таких возбудителей: вирусы гриппа А, В, возбудители парагриппа, аденовирусы и РС-вирусы.

Наличие вируса гриппа можно подтвердить с помощью РТГА - реакции торможения геммааглютинации. Метод основан на свойстве снижения гемагглютинирующих способностях вируса, если в крови есть антитела к нему. Для этого используется кровь с эритроцитами, антиген. Препараты крови берутся парными, в начале болезни, и в период выздоровления. Метод имеет высокую диагностическую ценность, точный и чувствительный.
Виды исследуемого материала и особенности сдачи
Для диагностики используются смывы из носа, мазки из носовых ходов, носоглотки, а также препараты крови.
Забор мазка и смыва проводит медицинский персонал. Он следит за тем, чтобы препараты строго соответствовали должной локализации. Забор проходит в чистых условиях, стерильными инструментами и в стерильную тару. До того, как взять мазки пациента просят высморкаться, чтобы очистить носовые ходы от слизи. Зонд вводится легко, на глубину 2-3 см. Проводится стандартное движение по нижней части носового хода и под раковиной носа. Необходимо, чтобы забор происходит в современной клинике, где есть возможность правильно хранить и транспортировать собранный материал в короткий срок до лаборатории.
Мазок из глотки берется по похожей методике, чтобы затронуть те участки слизистой, на которой скапливается возбудитель. Перед забором необходимо легко прополоскать рот, чтобы взятый материал был чистым. Желательно забирать материал на 3-й день после начал болезни.
Нормы и отклонения от них, расшифровка результатов
Экспресс-тест дает результаты сразу после диагностики, его расшифровка не вызывает трудностей, так как определяет наличие вируса или его отсутствие в организме.
Серологические реакции более сложные и могут расшифровываться по разному: наличие антител класса М говорит об острой стадии процесса, антитела G формируются при хроническом течении.
Сроки готовности результатов
Результаты исследования готовы на 1-2 день после сдачи. Экспресс-тест дает результат сразу. Серологические методы требуют больше затрат времени для сравнения титров антител. Более быстрые методы важны для диагностического процесса, а те, что более затратны - для эпидемиологического и научного исследования.

Скорость диагностики зависит от правильности сдачи препаратов, условий лаборатории, качества реактивов.
Вовремя сданный анализ позволяет точно и быстро определить диагноз. Это - залог правильного и эффективного лечения. Если болезнь запустить, она грозит осложнениями, которые особенно опасны, если у человека грипп. Это актуально для детей, пожилых людей, беременных женщин и лиц с дефицитом иммунной системы, ведь осложнения чаще всего проявляются у них.
Лаборатория АО "СЗЦДМ" предлагает услуги, обеспечивающие комплексное и преемственное лабораторное обследование пациента
Диагностика В медицинских центрах АО "СЗЦДМ" проводят качественные диагностические исследования всего организма
Лечение Наши медицинские центры ориентированы на обслуживание пациентов в амбулаторном режиме и объединены единым подходом к обследованию и лечению пациентов.
Реабилитация Реабилитация - это действия, направленные на всестороннюю помощь больному человеку или инвалиду для достижения им максимально возможной полноценности, в том числе и социальной или экономической.
Выезд на дом Внимание! Действует акция "Выезд на дом - 0 рублей"
Профосмотры АО "СЗЦДМ" проводит профилактические осмотры работников, которые включают в себя - комплексы лечебных и профилактических мероприятий, проводимых для выявления отклонений в состоянии здоровья, профилактики развития и распространения заболеваний.

Сельское хозяйство — область хозяйственной деятельности человека с наиболее быстрой отдачей прибыли. Однако в данной сфере по-прежнему остро стоит проблема высокой степени зараженности аграрных культур фитопатогенами. Исправить сложившуюся ситуацию можно различными способами, в том числе посредством массовой молекулярной диагностики вирусных и бактериальных инфекций растений при помощи специальных методов.
В растениеводстве размер прибыли зависит многих факторов. В их число входят научный, технический и организационный уровни выращивания сельскохозяйственных культур и климатические условия. Большое значение имеет эффективность борьбы с различными вредителями — животными, насекомыми и сорняками, а также микроорганизмами — грибками, бактериями, вирусами и вироидами. Обычно вирусы не беспокоят конечного потребителя, поскольку они не опасны для здоровья. Однако эти инфекционные агенты могут негативно повлиять на урожайность культур или привести к полной гибели посевов.
Вирусные и вироидные инфекции злаковых, овощных, плодовых, ягодных и декоративных культур встречаются повсеместно. Заражение обычно происходит при проникающем ранении клеточной стенки с помощью насекомых и других вредителей либо механически — инвентарем или оборудованием. При этом проводимое массово оздоровление растений через получение апикальной меристемы не гарантирует 100-процентного освобождения от вирусов и вироидов. Именно этот фактор в совокупности с отсутствием доступной диагностики привел к широкому распространению вироида на картофеле в 80-х годах прошлого века за пределами природных очагов этого заболевания в России.
Вирусные и вироидные инфекции причиняют значительный ущерб урожаю, причем наиболее вредны смешанные варианты. Например, заражение картофеля вирусом X приводит к потере урожая на 10 процентов, а совместное инфицирование агентами X и Y — на 50–70 процентов. Чаще всего от данной проблемы страдают предприятия, культивирующие многолетние растения. Так, массовое поражение кокосовых пальм, которые начинают плодоносить лишь на 7–9 годы жизни, вироидом каданг-каданг нанесло экономике Филиппин и острову Гуам катастрофический ущерб от потери 30 млн деревьев. Сегодня растения, зараженные вирусами и вироидами, не лечат, а при постановке диагноза их выбраковывают. В случае карантинной инфекции культуры подлежат уничтожению. Поэтому для предотвращения большого ущерба от распространения заболеваний необходимы решения, позволяющие точно и быстро определить, здоровое или больное растение будет выращиваться в хозяйстве.
Очевидно, что эффективность борьбы с инфекциями многократно выше на начальных стадиях их развития, поэтому окончательный и наиболее точный диагноз о наличии вирусов и вироидов должен ставиться на молекулярном уровне. Диагностика подобных заболеваний является ключевым звеном в производстве оздоровленного семенного материала. Помимо сертификации семян и посадочных растений в массовых масштабах она применяется для контроля оздоровления культур от вирусов, фитосанитарного мониторинга посевов, селекции и карантинной проверки импортируемого семенного материала. При этом методы диагностики на молекулярном уровне не зависят от природы инфицированного организма. Для анализа требуется минимальное количество клеточного сока листовой ткани или проростков.
Повсеместный мониторинг зараженности посевного и полевого материала сельскохозяйственных культур вирусами возможен только на основе простых, надежных, доступных высокоспецифичных и высокочувствительных экспресс-методов. Они должны быть применимы для определения широкого круга вирусов, значительно различающихся по морфологии, структуре и физико-химическим свойствам, и позволять проводить быструю диагностику в полевых условиях без специальных навыков и оборудования. Поэтому одним из главных коммерческих требований, предъявляемых ко всем современным способам внелабораторной иммунодиагностики в медицине, ветеринарии и сельском хозяйстве, является полная готовность набора к тестированию. Он должен включать все необходимые реагенты. Для проведения анализа необходимо лишь добавить анализируемый растительный экстракт образца, что инициирует иммунохимические взаимодействия и формирование регистрируемого сигнала в контрольной и аналитической областях. Идеально в подобных тест-системах использование меток, позволяющих осуществлять обнаружение инфекции путем простого визуального считывания без применения каких-либо проявляющих компонентов. В целях дальнейшего повышения чувствительности технологии могут быть использованы как флуоресцентные маркеры, так и разные усилители регистрируемого сигнала.
Данным требованиям отвечает быстро развивающаяся современная аналитическая технология иммунохроматографического анализа, или ИХА, широкого спектра биологически активных соединений различной природы на тест-полосках. В силу простоты и скорости анализа она постепенно вытесняет традиционные твердофазные методы ИФА. Быстрые и легкие в использовании аналитические иммунохроматографические тест-системы, или ИХТС, позволяют проводить высокочувствительные полуколичественные измерения без специальных навыков и оборудования в полевых условиях. Являясь эффективным средством диагностирования, подобные экспресс-тесты дают возможность в течение нескольких минут визуально определить и оценить содержание диагностически важных фитопатогенов.
Основным компонентом ИХТС является мультимембранная тест-полоска, на которую в определенных зонах нанесены иммунореагенты. Эти первичные антитела, связанные с флуоресцентным красителем или меченные окрашенными наночастицами коллоидного золота, способные связываться с определяемым вирусом. При нанесении клеточного экстракта зараженного растения инфекционный агент капиллярными силами перемещается вместе с фронтом жидкости вдоль полоски. Попав в зону первичных меченых антител, он образует с ними иммунохимические комплексы, которые продолжают мигрировать дальше. Достигнув зоны фиксированных в виде поперечной линии первичных антител, комплекс патогена и меченых антител концентрируется за счет образования тройного комплекса, включающего первичные тела. В аналитической зоне связанные с патогеном частицы коллоидного золота концентрируются, и формируется окрашенная линия. При отсутствии вируса в экстракте у здорового растения меченые первичные антитела свободно проходят через тестовую черту, и цветная полоса в аналитической области не появляется. Она возникает дальше по полоске, где в виде поперечной контрольной линии фиксированы вторичные, антивидовые антитела. Эта зона служит внутренним индикатором определения рабочего состояния иммунокомпонентов. Таким образом, при анализе зараженного растения вирусом видны две красные поперечные линии в аналитической и контрольной зонах, а при проверке здоровой культуры — одна контрольная полоса. Чувствительность определения содержания вируса находится в диапазоне 1–30 нг/мл, время анализа составляет 5–15 мин. Для подавляющего большинства вирусов этого порога вполне достаточно, однако при желании чувствительность можно увеличить с помощью реакции серебряного усиления. В этом случае время анализа будет равняться 30–40 мин.
Тест-полоски предназначены для быстрого качественного определения вирусов в экстрактах из заболевших растений в полевых условиях. Наиболее эффективно они могут быть использованы для оценки зараженности, например, при сертификации элитного и репродукционного семенного картофеля, существенно дополняя его визуальный анализ. Кроме того, полоски можно применять для экспресс-исследования импортируемого семенного и товарного картофеля на карантинные и другие особо вредоносные вирусы, а также в личных, подсобных, мелких фермерских хозяйствах, в которых сегодня сосредоточено основное производство данной культуры в России. ИХТС незаменимы в чрезвычайных обстоятельствах, когда необходимо срочно определить природу фитопатогенов, в частности при эпифитотиях и биотерроризме. К подобным текст-полоскам были разработаны технические условия и регламент, а также инструкции по их созданию и производству.
В последние годы на зарубежном рынке появились иммунохроматографические тесты для определения вирусов растений различных производителей — Adgen, Central Science Laboratory, Agdia, EnviroLogiх и других. По сравнению с перечнем коммерческих тест-систем на основе ИФА данный список пока невелик и включает наборы для диагностики около 50 инфекций — ризомании сахарной свеклы, шарки сливы, тристецы цитрусовых, Y-вируса картофеля, огуречной мозаики, бронзовости томатов и других важнейших патогенов сельскохозяйственных культур. Выпускаются мультиспецифичные тест-полоски для одновременного определения в одном образце нескольких вирусов картофеля. Энергично включились в развитие и поддержку массовой молекулярной диагностики заболеваний растений государство и частный бизнес в Индии, Китае и Бразилии. Серьезным показателем надежности диагностических тест-систем на основе ИХА является включение этого метода в диагностические протоколы ЕРРО, или Европейской организации защиты растений, для определения ряда карантинных объектов.
Использование тест-полосок полностью не решает проблему массового и постоянного контроля за семенами. Так, практика интенсивного культурного растениеводства в западных странах опирается на тотальную сертификацию исходного материала и систематический контроль его качества со стороны аккредитованных инспекций без ущерба для дисциплинированных собственников. В России система подтверждения соответствия оригинального, или предбазисного, сырья предусматривает его обязательную проверку на зараженность возбудителями наиболее вредоносных вирусных и бактериальных болезней в специальных испытательных лабораториях, аккредитованных для выполнения такого рода работ. Формирование цивилизованного рынка семенного материала в России вызвало необходимость коренного улучшения системы его сертификации. В силу этого перспективы развития безвирусного семеноводства прямо зависят от обязательного регулярного применения эффективных методов лабораторной и полевой диагностики вирусных и вироидной инфекций.
Однако основная проблема в России — отсутствие тотального систематического контроля качества сертифицированных семян и исходного посадочного материала для повсеместного культивирования со стороны аккредитованных служб. Положение усугубляется тем, что далеко не полный контроль карантинная служба РФ осуществляет даже в крупных семеноводческих хозяйствах, в то время как в производстве сельхозпродукции значительную часть занимают предприятия мелких собственников. Чтобы включить эти компании в культурное ведение агробизнеса, нужно сначала снабдить их необходимым доступным инструментом отслеживания качества покупаемого и выращиваемого растительного материала, а затем уже вести систематический контроль культуры хозяйствования.
актуальной проблемой молекулярной диагностики выступаетодновременное выявление множества патогенов вирусной и вироидной природы сельскохозяйственных растений. Мультипараметрическое исследование обычно производят на молекулярных чипах. В зависимости от плотности нанесения детекторов их классифицируют на чипы низкой концентрации для анализа единиц и десятков мишеней и высокой плотности — для выявления нескольких миллионов целей, которыми являются вирусные антигены. Для аграрной отрасли вполне подойдут иммуночипы первой категории.
Поскольку сельхозпроизводители специализированы по объектам производства и сбыта, экономически целесообразно разрабатывать диагностический иммуночип для определения местных, районированных инфекций конкретной аграрной культуры. На практике для того или иного растения в конкретной зоне или даже стране опасность представляет небольшое число патогенов различной природы — около 10–20 разновидностей. В частности, для картофеля на территории РФ максимально опасны семь вирусных, одна вироидная и две бактериальные инфекции. Для их определения уже были разработаны диагностикумы, в которых используются поликлональные антитела. Более сложная ситуация складывается с выявлением грибковых патогенов. Для их идентификации лучше применять моноклональные антитела. В этом случае более эффективно обратиться к достоинствам ДНК-чиповой технологии молекулярной диагностики или технологии ПЦР, когда в одном анализе можно получить практически полную информацию о зараженности растения грибками с учетом их штаммового разнообразия. В перспективе для каждой сельскохозяйственной культуры необходимо создать иммуночипы, позволяющие одновременно определять наиболее опасные инфекции вирусного, бактериального и грибкового происхождения. После этого станет возможной разработка макрочипа для установления всех или большей части экономически важных фитопатогенов, поражающих районированные растения, для отдельных регионов России.
На современном этапе для сокращения расходов на практическую молекулярную диагностику в процессе получения суперэлитных семян следует проводить ее в два этапа. На первом экономически выгоднее осуществить частичный скрининг семенного материала мультиплексными иммуночипами или тест-полосками. На этой стадии с меньшими убытками можно оценить долю явно зараженных семян и растений. Если их количество составляет 25 процентов и более от общего объема сырья, то необходимо всю анализируемую партию изучить с помощью тест-полосок или иммуночипа. Главная задача данного этапа — определить явно инфицированные экземпляры и убрать их из последующего размножения.
На второй стадии оставшиеся семена и растения необходимо диагностировать более мощными комбинированными технологиями: ОТ, ПЦР и дотИФА, либо ОТ и ПЦР в реальном времени, либо ДНК-чип и дотИФА. Данные методики позволяют обнаруживать одиночные молекулы РНК вирусов, вироидов и бактерий в анализируемой пробе, однако подобные исследования осуществляются только в лабораторных условиях, требуют большего количества времени, специального оборудования и наличия квалифицированного персонала.
В нашей стране исторически сложилась затратная практика овоще- и плодоводства, требующая государственных субсидий. Данный факт объясняется доступностью просторов сельскохозяйственных угодий России. Например, при меньшей в 2–5 раз урожайности картофеля отечественные сельхозпроизводители снабжают население страны данным продуктом за счет возделывания его на больших площадях, чем в Западной Европе. Экстенсивное ведение сельского хозяйства, когда потребности в сельхозпродукции удовлетворяются не с помощью увеличения урожайности, а за счет возможности использовать территории большой страны, государству экономически невыгодно. Однако переход на интенсивную схему требует повышения производительности труда и сокращения потерь урожаев от различных инфекций.
Необходимость массового внедрения и использования доступных систем диагностики инфекций растений на молекулярном уровне в нашей стране сегодня вполне очевидна. Подобные технологии помогут не только повысить урожайность культур, возделываемых сельхозпроизводителями, но и сформировать отечественный рынок качественного и безвирусного семенного материала.
Читайте также:


