Что такое липидная оболочка вируса
Как вирус проникает в клетку
Юрий Александрович Чизмаджев, чл.-корр. РАН, д. х. н., проф. кафедры биофизики МГУ,
заведующий лабораторией биоэлектрохимии Института электрохимии им.А.Н.Фрумкина РАН.
Как известно, клетка содержит огромное количество мембранных образований — от изолированных везикул до непрерывной сети эндоплазматического ретикулума. И вся эта система находится в состоянии постоянной перестройки, которая включает множественные акты слияния и деления. Так, в аппарате Гольджи белок упаковывается в контейнеры-везикулы, которые сливаются с плазматической мембраной. Это завершает процесс экзоцитоза. Другой пример — слияние синаптической мембраны и секреторных пузырьков с нейромедиаторами, в результате чего и происходит передача нервного импульса, одного из основных переносчиков информации.
Доставка крупных частиц внутрь клетки осуществляется посредством эндоцитоза. Клетка заглатывает частицы из внешней среды, которые обволакиваются участком плазматической мембраны, образуется впадина, перемычка разрушается, и контейнер оказывается внутри клетки. Его разборка — это уже другая история, а нам остается подчеркнуть, что и эндоцитоз, и экзоцитоз опосредованы множеством белков, чьи природа и механизм действия не вполне установлены.
Кроме “полезного” слияния клетка сплошь и рядом переживает случаи слияния “вредного”. Например, когда ее атакует вирус, которому достаточно сказать: “Сезам, откройся!”, и липидная оболочка вируса сливается с плазматической мембраной. При этом формируется так называемая пора слияния, и вирусная ДНК или РНК начинают хозяйничать внутри клетки. Справедливости ради надо отметить, что уникальную способность вирусов “вскрывать сейфы” уже используют во благо организму. В генной терапии подбирают безвредные вирусы-взломщики, к которым пришивают полезный ген, способный помочь больной клетке.
Разобраться в физическом механизме слияния биологических объектов чрезвычайно трудно. Как всегда, в подобных случаях на помощь приходят модельные системы. Обращаясь в недавнее прошлое, следует подчеркнуть, что в середине 80-х были достигнуты впечатляющие успехи в изучении механизма слияния липидных бислоев [1]. Однако к середине 90-х выяснилось: интермедиаты этого процесса, принятые в теоретических моделях, имеют настолько высокую энергию, что его расчетная скорость, вопреки экспериментальным данным, ничтожно мала. Кроме того, хотя было доказано, что специальные белки играют ключевую роль в ходе слияния, оставалось неясным, что же они делают. Решению этих задач были посвящены экспериментальные и теоретические работы нашей лаборатории, которые проводились во второй половине 90-х.
Путь вируса в клетку
Мир вирусов весьма разнообразен. Общее для них то, что любой наследственный материал (в форме ДНК или РНК) бережно упакован в защитный скафандр из белков. Вирусные частицы (вирионы) отличаются по форме и размерам. Так, диаметр сферических вирионов — от 20 до 300 нм. Некоторые вирусы имеют дополнительную липидную оболочку, в которую включены специализированные белки, способствующие слиянию мембран. Такие вирусы называются оболочечными. Требования к липидно-белковой оболочке двойственны. С одной стороны, она должна уберечь наследственный материал от превратностей судьбы, а с другой — легко разрушаться, когда вирус начинает активную жизнь внутри клетки-жертвы.
Оболочечные вирусы проникают в клетку двумя путями. В первом случае вирус связывается с рецепторами клеточной поверхности, затем в результате эндоцитоза, везикулы, содержащие вирион, отпочковываются. В таком состоянии вирус упакован в дополнительную оболочку, образованную клеточной мембраной. От второй оболочки он освобождается при слиянии везикулы с эндосомой, в которой кислая среда активирует белки слияния и тем самым способствует объединению мембраны вириона с эндосомальной. В результате наследственный материал попадает в цитоплазму и может добраться до ядра. На первых стадиях этого процесса, включая проникновение в эндосому, вирус играет пассивную роль. Здесь используется обычный механизм эндоцитоза, причем доверчивая клетка даже не знает, какую опасность таит в себе этот “подарок судьбы”. И только оказавшись в эндосоме, вирус активируется и берет всю игру на себя, вызывая слияние своей оболочки с эндосомальной мембраной. Именно так действует всем известный вирус гриппа.
Два пути проникновения оболочечного вируса в клетку.
Слева — эндоцитоз и слияние в эндосоме: 1 — вирус, 2 — эндосома, 3 — ядро.
Справа — слияние с плазматической мембраной.
Другие вирусы, например вирус иммунодефицита человека (HIV), не нуждаются для активации в низких рН и проникают в клетку более простым путем, в ходе которого их оболочки сразу сливаются с плазматической мембраной, и наследственный материал оказывается к клетке. Теперь ему остается только добраться до ядра.
Таким образом, в любом случае ключевое событие в битве оболочечного вируса с клеткой — слияние его липидной оболочки с плазматической или лизосомальной мембраной. Именно этой важнейшей стадии инфицирования клетки и посвящен наш рассказ. Конкретно речь пойдет о вирусе гриппа А. Благодаря особенностям своего строения он оказался наиболее удобным объектом для экспериментального изучения механизма слияния.
Этот оболочечный вирус имеет примерно сферическую форму с диаметром около 0.13 мкм. В его центральной части находятся молекулы РНК и ряд белков, необходимых вирусу на первых стадиях жизни в клетке. Сердцевина вириона окружена оболочкой из белка М1, следом за ней располагается липидная мембрана. Белковая оболочка, утопленная в липидной мембране, напоминает рыболовную сеть, которая крепится на сваях. Размер ячеек в белковой сети примерно 4 ґ 4 нм 2 , так что такая крупная “рыба”, как комплекс РНК-белок, пройти сквозь них не может. Липидная оболочка формируется из плазматической мембраны инфицированной клетки при отпочковывании синтезируемого вируса. В этой мембране заякорены три белка: нейраминидаза (Н), ионный канал М2 и гемагглютинин (ГА). При закислении среды благодаря ионному каналу внутри вириона понижается рН, что приводит к разрушению белковой оболочки М1. Одновременно активируется гемагглютинин, главная составляющая “машины слияния”. В ходе ее работы мембраны вируса и клетки смыкаются, и в цитоплазму открывается путь для чужеродного генетического материала.
Схема вириона гриппа:
ГА — гемагглютинин, М2 — ионный канал, Н — нейраминидаза, М1 — белковая оболочка.
На поверхности вирусной оболочки гемагглютинин присутствует в виде тримеров. Каждая его молекула состоит из двух субъединиц: ГА1, обеспечивающей первичный контакт с клеткой-мишенью, и ГА2, отвечающей за слияние. В исходном, нейтральном, состоянии (при рН7) все тримеры ориентированы примерно перпендикулярно к поверхности мембраны, их протяженность
13 нм. Каждая молекула гемагглютинина прочно заякорена в своей мембране и, что очень важно, имеет в своем составе короткий (25 аминокислот) пептид, который при рН7 спрятан внутри тримера и локализован недалеко от основания белка. После уменьшения pH с 7 до 5 молекулы гемагглютинина глобально перестраиваются, и пептид слияния не просто выходит на свободу, а перемещается в самый верхний конец молекулы и проникает в мембрану жертвы.
Структура гемагглютинина в исходном (рН7) и в активном (рН5) состояниях.
Цветом отмечен пептид слияния, который в кислой среде меняет свою конформацию.
В нейтральной среде молекула гемагглютинина напоминает пружину, зажатую защелкой, роль которой играет пептид слияния, спрятанный в “гидрофобный карман” тримера. Но стоит снизить рН до 5, как пептид выходит из заточения и молекула ГА может перейти в новое конформационное состояние. Выделяющаяся при этом энергия, судя по измерениям, довольно велика, но еще не достаточна для сближения мембран клетки и вируса. Чтобы решить эту задачу, молекулы гемагглютинина действуют не поодиночке, а коллективно. Как показали эксперименты, в ходе взаимодействия вируса с клеткой-мишенью образуются розетки из шести—восьми тримеров, внутри каждой из которых находятся изогнутые липидные участки с радиусом
10 нм. С помощью электронно-микроскопических и электрофизиологических исследований удалось обнаружить такие локальные вспучивания, получившие название димплов [2].
Именно здесь, на верхушках димплов, начинается перестройка липидов, приводящая к образованию поры слияния. Теоретическая модель этого процесса [3] состоит в следующем: белки слияния, изгибая мембраны, не только сближают их, но и обеспечивают энергией, облегчая образование монослойной перемычки — сталка; липиды из удаленных монослоев деформируются без больших энергетических затрат. В результате образуются новые промежуточные структуры — низкоэнергетические интермедиаты, обеспечивающие слияние.
Образование димплов между мембранами эритроцитов и клеток, экспрессирующих гемагглютинин.
Вверху — граница мембран эритроцита и клетки, экспрессирующей ГА, рН 7.4;
внизу — то же, но рН 4.9 — видно большое количество контактных областей (цветная стрелка).
На врезке показана схема контакта.
Под слиянием клеток, вирусов или клеточных органелл понимается объединение ограниченных мембранами водных объемов и самих мембран. Для наблюдения за этим процессом используют растворимые в липиде флуоресцентные метки. Если такая метка изначально содержится в клетках А, то появление ее в клетках В говорит о слиянии. Правда, бывают случаи, когда происходит так называемое полуслияние, т.е. объединяются только внешние монослои клеток, сближенные в области локального контакта. Чтобы различить случаи полу- и полного слияния, в клетки А вводят водорастворимый краситель. Его перетекание из одних клеток в другие свидетельствует о полном слиянии с образованием поры, через которую осуществляется связь. Так в эксперименте изучают массовое слияние, например в суспензии вирусов и клеток. Однако возможности этой методики ограничены, с ее помощью трудно разобраться в деталях процесса, включая образование локального контакта, появление поры и ее развитие. Подобные задачи можно решать только с использованием более точного метода, позволяющего следить за одиночными объектами, т.е. с помощью методов флуоресцентной микроскопии и современной электрофизиологии. Впервые это было сделано при изучении экзоцитоза в тучных клетках с использованием микроэлектронной техники.
Однако вирусные частицы настолько малы, что непосредственно применить к ним микроэлектронную технику нельзя. И тут на помощь пришла генная инженерия. На основе фибробластов получены клетки (названные HAb2), которые содержат на своей плазматической мембране молекулы гемагглютинина. Они оказались прекрасной моделью вирусной частицы с диаметром порядка 10 мкм, на которой можно проводить электрические измерения.
Схема эксперимента по слиянию клетки HAb2 с эритроцитом,
мембрана которого окрашена флуоресцирующим липидным зондом.
В ходе развития поры слияния краска распространяется по мембране HAb2.
Электрический сигнал измеряется с помощью электродов и усилителя тока,
а перетекание зонда — с использованием флуоресцентного видеомикроскопа.
В типичном опыте по слиянию клетки HAb2 и эритроцита при закислении окружающего раствора до рН5 образуется пора. Через нее протекает емкостной ток, который заряжает эритроцит. Его изменение во времени отражает расширение поры слияния. Одновременно из мембраны эритроцита в мембрану HAb2 перетекает краситель. Сопоставляя две кривые (проводимости и интенсивности флуоресценции) в зависимости от времени, замечаем, что вторая значительно отстает от первой. Предполагается, что эта временная задержка вызвана белковой розеткой из тримеров гемагглютинина, которая образует своеобразный заслон потоку липидного зонда. Первичная пора слияния образуется в области липидных димплов. Следовательно, изменяя липидный состав мембран, можно воздействовать на весь процесс. При сближении липидных бислоев может образоваться перемычка между близлежащими монослоями (так называемый сталк), зародыш будущей поры. Вероятность его образования существенно зависит от липидного состава. Например, введение в монослои лизофосфатидилхолина (LPC), даже в небольших концентрациях, полностью ингибирует слияние. Эксперименты в системе HAb2—эритроцит показали, что лизофосфатидилхолин здесь столь же эффективен, как и в модельных липидных системах. Иными словами, пора слияния после введения LPC не возникает вообще, хотя, судя по появлению флуоресценции, монослои объединяются.
| Кривые проводимости поры (цветная) и интенсивности флуоресценции. Вверху — контроль, внизу — та же система, но с добавкой лизофосфатидилхолина. По оси ординат — проводимость, по оси абсцисс — время. |
Схема процесса слияния.
После понижения рН образуется розетка слияния (1),
которая способствует образованию локального мембранного контакта (2)
и перемычки, которая затем превращается в пору слияния (3, 4).
Однако любая модель всегда отличается от реального объекта. Мембрана клетки HAb2 имеет другой липидный состав, нежели мембрана вириона, различна и плотность гемагглютинина, а клетка HAb2 не содержит белков М1 и М2. Разработанная в нашей лаборатории методика позволяет изучать слияние одиночного вириона с бислойной липидной мембраной [5]. В нейтральную среду (буферный раствор с рН7) впрыскиваются вирионы, часть которых адсорбируется на бислое. После этого к плоской мембране прижимается микропипетка, заполненная раствором с рН5. Поскольку кончик пипетки имеет радиус
1 мкм, весьма вероятно, что внутри него, на липидном пятачке, окажется один или несколько вирионов, в мембрану которых включен флуоресцентный зонд в концентрации самогашения. Низкое рН внутри пипетки инициирует слияние, и зонд диффундирует в бислой. Возникающее при этом разбавление приводит к флуоресценции, которую можно регистрировать.
Схема экспериментальной установки. Подробности в тексте.
Электрические измерения показали, что наряду с латеральным потоком зонда возникает флуктуирующий электрический ток, который течет через пору слияния и какие-то проводящие структуры в мембране вируса. Специальными опытами доказано, что дело обстоит именно таким образом [6]. В этих экспериментах ионные каналы М2 блокировались амантадином, а закисление внутри вириона достигалось уменьшением рН (до 5) в нижнем отсеке ячейки. Очевидно, что при такой постановке опыта сразу после слияния протоны из нижнего отсека должны устремиться внутрь вириона через открывающуюся пору, что разрушит белковую оболочку из М1 даже при заблокированных каналах М2. Действительно, в этих условиях возникает электрическая активность, точно такая же, как при открытых М2 каналах. Значит, таким способом можно следить не только за эволюцией поры слияния в липидной мембране, но и за разрушением белкового каркаса. Это чрезвычайно существенно, так как выход генетического материала вируса в цитоплазму лимитируется обеими защитными оболочками — белковой и липидной.
Итак, сочетая методы электронной микроскопии и электрофизиологии, удалось обнаружить локальные мембранные контакты (димплы). Введение лизолипида ингибирует биологическое слияние, что доказывает: первым интермедиатом процесса, как и в модельных системах, служит перемычка (сталк).
Разработанная методика изучения слияния одиночных вирионов с липидными бислоями позволяет исследовать кинетику этого процесса, а модель слияния, использующая принципиально новые интермедиаты, решает проблему “энергетического кризиса”.
Выяснение роли липида и белка в таком процессе имеет не только познавательный интерес. В перспективе это важно для разработки новых методов антивирусной терапии.
Результаты были получены в ходе исследований, поддержанных грантами РФФИ:
№93-04-20590, №96-04-50779, №99-04-48427 и №02-04-48287.
1. Черномордик Л.В., Меликян Г.Б., Чизмаджев Ю.А. // Биол. мембраны. 1987. Т.4. С.117—164.
2. Frolov V.A., Cho M.-S., Bronk P. et al. // Traffic. 2000. ?1. P.6.
3. Kuzmin P.I., Zimmerberg J., Chizmadzhev Yu.A. et al. // PNAS. 2001. V.98. P.7235—7240.
4. Chernomordik L.V., Frolov V.A., Leikina E. et al. // The Journal of Cell Biology. 1998. V.140. P.1369—1382.
5. Максаев Г.И.,Самсонов А.В., Липатов А.С. и др. // Биол. мембраны. 2000. Т.17. С.312—323.
6. Максаев Г.И., Михалев И.И., Фролов В.А. // Биол. мембраны. 2001. Т.18. С.489—495.

Обработанная холодной плазмой вода может стать смертельным оружием для бактерий, грибков и вирусов. Авторы разработки — группа российских ученых — предполагают, что она сможет уничтожить и новый коронавирус, вызывающий COVID-19. Использовать жидкость можно как для обработки медицинских масок и различных поверхностей, так и для распыления в воздухе. В отличие от спиртовых растворов и хлорки, она совершенно безопасна для человека и не имеет запаха, а ее стоимость в случае запуска в производство составит порядка ста рублей за тысячу литров.

Магнит для вируса
В связи с распространением SARS-CoV-2 важно максимально беречь себя от инфекции, поступающей из внешней среды. Имеется в виду как воздушное пространство, так и поверхности, на которых может оседать вирус. Сегодня к основным дезинфицирующим средствам, удаляющим патоген, относят растворы на основе спирта и хлорки. Однако их применение связано с рядом неудобств: сильный запах, влияние на здоровье и самочувствие. Обработка же поверхностей ультрафиолетом занимает долгое время.
Работает технология следующим образом. Установка производит холодную плазму — газ из заряженных и незаряженных частиц. Он поступает в обычную воду, после чего она приобретает особые свойства: атомы теряют часть электронов и в итоге не могут соединиться в молекулу H2O в силу законов физики.

Такая нестабильность молекул воды приводит к возникновению различных форм кислорода и водорода и их всевозможных соединений. Получившиеся активные частицы повреждают и клеточные мембраны патогенной микрофлоры, и оболочки вирусов. Наиболее важную роль в процессе играет метастабильный атомарный кислород, сохраняющий свое состояние только при определенных условиях — когда электронов меньше, чем нужно. Он легко вступает в реакцию с биологическими молекулами, включая ДНК, РНК и отдельные белки.
Кроме агрессивного кислорода у полученной жидкости есть еще одно оружие для войны с вирусами — хлорноватистая кислота. Дело в том, что в обычной хлорированной воде из-под крана содержится небольшое количество хлорноватистого натрия (соли), добавляемого на станциях водоканалов.
— При обработке воды плазмой соль распадается, — пояснил один из ученых, Дмитрий Балаболин. — Это приводит к образованию хлорноватистой кислоты. Науке уже известно, что одна десятая процента соли такой кислоты в воде препятствует размножению коронавируса. Сама же кислота гораздо активнее своей соли. Это позволяет предположить, что такая жидкость не только остановит размножение, но и убьет патоген.
Количество хлорноватистой кислоты в полученной жидкости можно увеличить, если брать очищенную от примесей воду и добавлять определенное количество поваренной соли. Сейчас ученые используют менее одного ее килограмма на тысячу литров.

Сто рублей за тысячу литров
Правда, как именно жидкость подействует на конкретный возбудитель COVID-2019, пока точно не известно. Проверка будет произведена в ближайшее время.
— Методика получения такой воды с дезинфекционными свойствами в принципе перспективна, — считает завлабораторией биотехнологии и вирусологии Новосибирского государственного университета, член-корреспондент РАН Сергей Нетесов. — Но она требует ряда доработок и должна обязательно сопровождаться простой методикой количественного определения содержания в ней активных ионов и молекул. Также необходимо проверить действие такой воды именно на вирусах, которые имеют липидную оболочку. К ним относится и коронавирус.
В силу относительной простоты производства цена жидкости будет небольшой — около ста рублей за тысячу литров. Однако ряд специалистов считает, что, несмотря на дешевизну, особых перспектив у новой разработки нет.

— Та же перекись водорода гораздо более сильный и стабильный окислитель, чем соединения синглетного кислорода, полученные в обработанной холодной плазмой воде, — заявил руководитель лаборатории геномной инженерии МФТИ Павел Волчков. — Перекись доступна и дешево стоит, для ее производства не нужно специальное оборудование.
На данный момент ученые занимаются оформлением патента на изобретение и подготовкой серийного производства.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
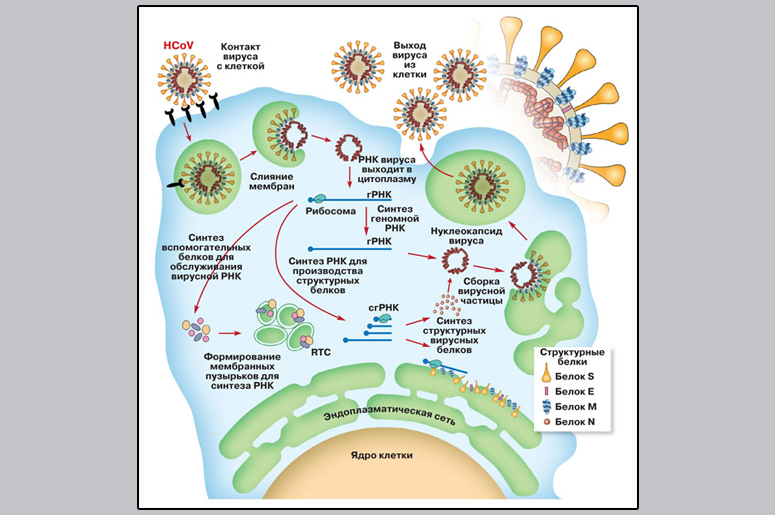
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.
Читайте также:


