Что такое эндогенный ретровирус

Фенотип определяется не только набором генов, но и регуляторными областями генома, формирующими профиль генетической экспрессии в различных тканях. В исследовании, проведенном в двух лабораториях ИБХ, а также нескольких других учреждениях, показано влияние провируса, встроенного в ДНК человека, на экспрессию важного для работы мозга гена, отвечающего за синтез нейромедиаторов. Не исключено, что это сыграло существенную роль в эволюции человека.
Изучение генетических особенностей, отличающих людей и их ближайших родственников — шимпанзе, — не только интересно с эволюционной точки зрения, но и может пролить свет на этиологию некоторых заболеваний человека. Учитывая практически полную идентичность кодирующих белок генов у высших приматов, принято считать, что основные отличия обусловлены различной регуляцией работы генов (например, в результате мутаций в регуляторных областях ДНК), нежели генами как таковыми. С этой точки зрения мобильные элементы как источники геномной нестабильности, обладающие значительным регуляторным потенциалом, вызывают большой интерес.
Среди представителей группы ретроэлементов HERV-K (HML-2) обнаружено 133 копии, специфичные только для генома человека. Выбор пал на ЭРВ еще и потому, что расположение регуляторных элементов, необходимых для транскрипции вирусной РНК (таких как промотор, энхансер и сигнал полиаденилирования), точно известно, и все они сосредоточены в определенных участках провируса — а именно, длинных концевых повторах (long terminal repeat, LTR). И эти регуляторные элементы могут служить не только нуждам ретровируса, но и оказывать влияние на гены, находящиеся поблизости.
Для изучения энхансерной активности длинных концевых повторов было отобрано шесть вставок ЭРВ, находящихся на расстоянии до пяти тысяч пар нуклеотидов от промоторов известных генов человека (считалось, что на таком расстоянии энхансерный эффект может проявиться с наибольшей вероятностью). Способность LTR усиливать активность промоторов соседних генов изучали в экспериментах с использованием репортерных конструкций. Обнаружилось, что только три из шести исследуемых LTR существенно увеличивали экспрессию репортерного гена. И лишь в одном случае из трех наблюдалась корреляция между энхансерной активностью LTR в экспериментах с репортерным геном и экспрессией соседнего гена. Им оказался ген PRODH — подробнее о нем будет сказано ниже.
Кроме того, в клетках, в которых наблюдалась наибольшая энхансерная активность, эндогенная копия LTR была гипометилирована, то есть находилась в активном состоянии. Это означает, что наблюдаемый в репортерных экспериментах энхансерный эффект может проявляться и в естественных условиях и быть причиной высокой транскрипционной активности соседнего гена. Как можно догадаться, в случае с шимпанзе вставка эндогенного ретровируса перед геном PRODH отсутствует, и эксперименты с репортерными конструкциями подтверждают, что промотор шимпанзе значительно уступает по силе человеческому, содержащему ретровирусный энхансер.
Ген PRODH, оказавшийся под влиянием ретровирусного энхансера, кодирует ключевой фермент катаболизма пролина — пролиндегидрогеназу. Согласно литературным данным, этот ген необходим для нормального функционирования центральной нервной системы: мутации или делеции этого гена связывают с риском развития шизофрении и других психических нарушений. Это можно объяснить тем, что в нервной системе фермент PRODH может участвовать в синтезе нейромедиаторов — например, глутамата. Исследования транскрипционной активности показали, что наиболее активно PRODH транскрибируется в мозге, и особенно в гиппокампе. В этом же отделе LTR-энхансер был гипометилирован. А в экспериментах с первичными культурами нейрональной ткани было показано, что промотор и ретровирусный энхансер гена PRODH обеспечивают нейрон-специфическую экспрессию репортерного флуоресцентного гена, — то есть LTR является тканеспецифическим энхансером и способен активировать экспрессию гена PRODH в нервной ткани. Стоит также отметить, что транскрипционная активность PRODH в мозге человека в среднем выше, чем у шимпанзе, что скорее всего является результатом появления такого энхансера.
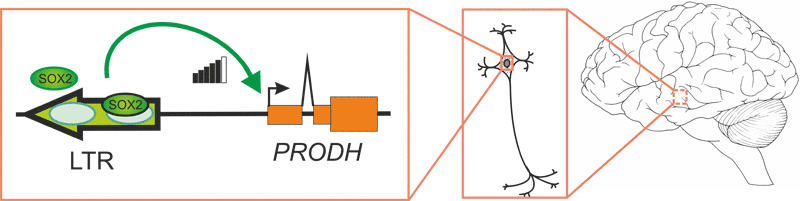
Схема транскрипционной регуляции гена PRODH ретровирусным энхансером. Человек-специфичный энхансер, образованный в результате встраивания эндогенного ретровируса, активирует промотор гена PRODH в мозге. Энхансерная активность длинного концевого повтора ЭРВ обусловлена связыванием с транскрипционным фактором SOX2.
Выступление первого автора публикации в PNAS — Марии Сунцовой — на семинаре Совета молодых ученых ИБХ, прошедшем 19 декабря 2013 года.
Чтобы понять, какие транскрипционные факторы (ТФ) участвуют в регуляции энхансерной активности LTR, в его нуклеотидной последовательности был проведен поиск мотивов узнавания ТФ; там обнаружилось два сайта связывания с фактором SOX2 (см. рисунок). И действительно: добавление SOX2 ведет к усилению энхансерного эффекта. Стоит отметить, что SOX2 экспрессируется на высоком уроне именно в гиппокампе, где он может связываться с LTR.
Таким образом, встраивание энхансерно-активного эндогенного ретровируса перед геном PRODH могло активировать его экспрессию, что, в свою очередь, могло повлиять на баланс нейромедиаторов в мозгу. И это могло отразиться на развитии центральной нервной системы и поведении в ходе эволюции человека.
| СТАТЬИ | КНИГИ | ФОРУМ | ГОСТЕВАЯ КНИГА | ССЫЛКИ | ОБ АВТОРЕ |
|---|
Об авторе : Михаил Васильевич Супотницкий - кандидат биологических наук.
Эндогенные ретроэлементы появляются в геноме человека как следствие вызванных экзогенными ретровирусами эпидемических (эпизоотических — если иметь ввиду наших отдаленных предков) процессов. Однако патология, возникающая в результате их активности уже в геноме человека, не относится учеными к инфекционной, а их распространение по виду Homo sapiens , не считается эпидемией. Причина тут в том, что понимание инфекционных и эпидемических процессов у нас ограничено представлениями о циклических инфекциях (эпидемиях), развивающихся в масштабах времени, воспринимаемых человеком на бытовом уровне. Процессы, растягивающиеся во времени на периоды, выходящие за эти рамки, а тем более начавшиеся в эволюционно предшествующих видах, распадаются на отдельные явления без понимания причинно-следственных связей между ними.

Эпидемиология не-LTR-ретроэлементов . Эти древние ретроэлементы составляют до 34 % генома современного вида человека. Два представителя семейства встречаются в геноме человека в очень больших количествах. Это короткие вставочные элементы (SINE) и длинные терминальные вставочные повторы (LINE). Наиболее активны из представителей SINE — Alu- и MIR-повторы; из LINE — автономные L1 и L2 последовательности.
LINE-1 (L1) распространяются по геному человека — одна новая вставка на каждые 10—250 индивидуумов. L1-транспозоны вызывают у людей болезни по разным механизмам, включающим неправильную гомологичную рекомбинацию участков ДНК хромосом; прямые вставки L1 в гены; обеспечение вставок других ретротранспозонов в гены. Перемещение по геному человека L1 вызывает не менее двух видов гемофилии, APC/аденоматозный полипоз кишечника, мышечную дистрофию, бета-глобин/бета-талассемию, RP 2/пигментированный ретинит, CYBB /хронический гранулематоз и др. наследственные болезни [4] .
Продолжается распространение в популяциях современного вида человека Alu-элементов . Их количество в геноме растет, и они встраиваются во все новые сайты с частотой примерно одно новое встраивание на 100—200 новорожденных, увеличивая риск развития патологических процессов, наследуемых по законам Менделя. Среди них нейрофиброматоз, ахолинэстеразомия, гемофилия А и В, семейная гипокальйурическая гиперкальцемия, рак молочной железы, Х-связанная агаммаглобулинемия, Х-связанный тяжелый комбинирован комбинированный иммунодефицит, бранхио-ото-ренальный синдром, болезнь Хангтингтона, синдром Киндлера и др. [5].
Всего же исследования вставок ретротранспозонов, выполненные в последние годы, позволили выявить до 14 генетических болезней, возникших недавно или de novo в результате вставок L1; и, как минимум, 21 болезнь, вызванную вставками Alu .
Вставочный полиморфизм — разное пропорциональное присутствие HERV в различных популяциях людей. Вставочнополиморфные HERV с большей вероятностью вовлечены в патологические процессы, чем HERV, присутствующие у всех представителей вида. Во-первых, они недавно (т. е. в пределах 6 млн лет) вставились в геном современного вида человека (его эволюционных предков) и поэтому могут вызывать разрушение его генов, с которыми интегрировались. Энхансерные элементы ретровирусных LTR могут влиять на экспрессию генов, прилегающих к HERV, даже при наличии некоторой дистанции между ними. Во-вторых, HERV, недавно интегрировавшиеся с геномом человека, с большей вероятностью содержат функциональноактивные гены, способны модулировать клеточную пролиферацию и иммунные реакции. В третьих, их присутствие только у отдельных индивидуумов повышает возможность того, что они усилят свою патогенность таким же образом, как это делают экзогенные ретровирусы [6].
HERV вызывают патологические процессы у людей по следующим механизмам: 1) разрушают гены в участках собственной интеграции; 2) подавляют или стимулируют иммунные ответы; 3) модулируют синтез белков, оказывающих патологическое действие на клетки [6].
Если изменить масштаб времени с жизни отдельного человека, до жизни его как вида, т. е. до временных интервалов, в которые дают о себе знать эволюционные процессы, то распространение по геному человека эндогенных ретроэлементов можно рассматривать как циклические эпидемии, развивающиеся в рамках сверхмедленных в нашем ощущении времени, циклов. Болезни, возникающие в результате таких эпидемий, целесообразно выделить в новый класс — болезни эндогенной ретровирусной активности .
Для эпидемических процессов, вызываемых эндогенными ретроэлементами, можно выделить следующие стадии:
межзпидемическая стадия — в результате эпидемии (эпизоотии) нециклического типа у части выживших представителей данного вида произошла эндогенизация экзогенного ретровируса;
предэпидемическая стадия — в изолированных, практикующих инбридинг популяциях, по мере размножения особей, носителей нового эндогенного ретровируса, происходит увеличение его копий. Через обратную транскрипцию генерируются новые генетических элементы. В географически обособленных популяциях появляются первые особи с наследуемыми генетическими дефектами;
стадия развития эпидемии — в распространение новых генетических элементов вовлекаются панмиксные популяции вида, что приводит к нарастанию пластичности генома. В результате пролиферации транспозируемых элементов с каждым новым поколением происходит увеличение количества особей вида, страдающих наследственными болезнями;
стадия разгара эпидемии — скорость пролиферации транспозируемых элементов и распространение генетических дефектов в панмиксных популяциях достигают максимума, рост числа гомозиготных носителей мутаций. Из-за чрезмерной пластичности генома возможна гибель панмиксного вида и/или появление его подвидов среди географически обособленных популяций;
стадия угасания пандемии — скорость пролиферации по виду (подвиду) транспозируемых элементов снижается ниже того порогового уровня , когда темпы мутационных замен нуклеотидов делают невозможным существование активно транспозирующихся ретроэлементов. Рост числа гетерозиготных носителей мутантных аллелей;
постэпидемическая стадия — следы былых катастроф генома в виде дефектных и неспособных к транспозиции ретроэлементов.
Использованная литература
Nelson P. N., Hooley P., Roden D. et al. // Clin. Exp. Immunol. — 2004. — Vol. 138 . — P. 1–9 .
Katzourakis A., Pereira V., Tristem M. // J. Virol. — 2007. — Vol. 81, № 19. — P. 10712–10717.
Deininger P., Batzer M. // Genome Res. — 2002. — Vol. 12. — P. 1455—1465.
Ostertag E. M., Kazazian H. // Annu. Rev. Genet . — 2001. — Vol . 35. — P . 501 – 538.
Аст Г. // В мире науки. — 2005. — № 7. — С. 37–43.
Moses A. E., Adelowo K. A., Nwankwo E. A. // Niger Postgrad. Med. J. — 2001. — Vol. 8, № 2. — P. 74 – 77.
Супотницкий М. В. Болезни эндогенной ретровирусной активности // Энвайронментальная эпидемиология . — 2009. — Том 3, № 2. — С. 151 – 156.
Наши внутренние паразиты
Птичий вирус лейкоза оказался очень странным ретровирусом. В то время ученые проверяли наличие вируса, обследуя кровь курицы на предмет белков вируса. Иногда они обнаруживали белки птичьего вируса лейкоза у совершенно здоровых птиц, которые никогда не заболевали раком. Что еще более странно, у птиц, несущих в себе вирусные белки, могли появляться здоровые цыплята, которые также обладали этими белками.
Робин Вайс, вирусолог, работавший в то время в Университете Вашингтона, задался вопросом, могло ли случиться так, что вирус стал неотъемлемой и при этом безопасной частью ДНК курицы. Он и его коллеги подвергали клетки здоровых кур воздействию химических веществ, вызывающих мутацию, и радиации, чтобы выяснить, можно ли таким образом высвободить вирусы из их укрытия. Как они и ожидали, мутировавшие клетки начали воспроизводить вирусы птичьего лейкоза. Другими словами, эти здоровые куры не просто несли вирусы в некоторых своих клетках; генетическая инструкция по производству вирусов была вживлена во все их клетки, а потом передана ими по наследству своим потомкам.
Эти скрытые вирусы не ограничивались одной отдельно взятой породой кур. Вайс и другие ученые обнаружили вирус птичьего лейкоза (ВПЛ) у многих пород, что увеличивало шансы на то, что вирус является древним компонентом птичьей ДНК. Чтобы выяснить, как давно ВПЛ инфицировал предков современных кур, Вайс вместе со своими коллегами отправился в джунгли Малайзии. Там они поймали банкивскую джунглевую курицу (red jungle fowl), ближайшего дикого родственника домашней. Банкивская джунглевая курица несла в себе тот же ВПЛ, обнаруженный Вайсом. В последующие экспедиции он обнаружил, что у других видов джунглевых кур не было этого вируса.
Из этого исследования родилась гипотеза о том, как ВПЛ слился воедино с курами. Тысячи лет назад вирус поражал предков современных домашних кур, вызывая опухоли. Но по меньшей мере с одной из птиц случилось что-то иное. Вместо того чтобы наградить птицу раком, вирус был подавлен иммунной системой птицы. Не причиняя ей вреда, вирус распространялся по ее организму, пока не достиг половых органов. Когда инфицированная птица спаривалась, ее яйца тоже несли в себе вирусную ДНК.
По мере того как инфицированный эмбрион рос, все его клетки при делении также приобретали ДНК вируса. Когда цыпленок вылуплялся, он был уже инфицирован. А так как ВПЛ теперь был частью его генома, то он передавал его и своим потомкам. Вирус оставался тихим пассажиром от поколения к поколению в течение тысяч лет. Но при определенных условиях вирус мог возобновить свою активность, вновь формировать опухоли и начать распространяться среди птиц. Ученые поняли, что этот новый вирус является единственным в своем классе. Они назвали его эндогенным ретровирусом; эндогенный — значит производимый внутри. Вскоре им удалось обнаружить эндогенные ретровирусы в геномах и млекопитающих. На самом деле вирусы населяют геном практически всех групп позвоночных — от рыб и рептилий до млекопитающих.
Некоторые из обнаруженных ретровирусов вызывают рак, но далеко не все. Некоторые, кажется, плотно взяты под контроль своими носителями. Определенные эндогенные ретровирусы, носителями которых являются мыши, не могут поражать клетки мышей, но с успехом распространяются среди крыс.
Другие эндогенные ретровирусы оказались неполноценными, подвергшись мутации, которая лишила их возможности переходить в обычную форму. Они все еще были способны копировать свой генетический материал, который вновь включался в геном носителя. Ученые также обнаружили вирусы, настолько измененные мутациями, что они неспособны делать вообще ничего. Все, что им осталось, — это служить балластом в геноме своего носителя.
Обнаруживая эндогенные ретровирусы в других биологических видах, ученые не могли не поискать их в нашей ДНК. В конце концов, мы страдаем от многих заболеваний, вызываемых ретровирусами. Вирусологи предпринимали безуспешные попытки выделения ретровирусов из человеческих клеток. Однако во время сканирования человеческого генома им удалось обнаружить неопровержимые доказательства их присутствия в некоторых сегментах. Многие из сегментов, несущих в себе гены ретровирусов, напоминали сходные сегменты у обезьян, что наводило на мысли, что ретровирусы инфицировали наших предков тридцать миллионов лет назад, а может быть, и раньше. Но некоторые сегменты ДНК человека, несущие в себе напоминание о ретровирусах, не имеют аналогов у других видов. Возможно, что они образовались около миллиона лет назад путем внедрения ДНК ретровирусов в геном наших предков.
Чтобы проверить это, Тьерри Хайдман (Thierry Heidmann), исследователь из Института Густава Руси (Gustave Roussy Institute) в Вильжуиве, Франция, попытался вернуть к жизни человеческий эндогенный ретровирус. Исследовав геномы разных людей, он нашел слегка отличающиеся версии ретровирусного сегмента ДНК. Предположительно, эти различия появились в тот момент, когда ретровирус был заключен в генах древних людей. У их потомков череда мутаций поразила различные части ДНК вируса.
С помощью этого метода Хайдману удалось использовать мутировавшие последовательности генов, находящихся в геноме современных людей, чтобы определить, как выглядела изначальная версия ДНК ретровируса. Затем он синтезировал фрагмент ДНК согласно полученной генетической последовательности. Внедрив ее в человеческую клетку, Хайдману удалось попасть в стихотворный размер. Клетки, зараженные этим сконструированным вирусом, производили новые вирусы, способные находить себе носителей. Другими словами, оригинальная генетическая последовательность принадлежала живому и функциональному вирусу. В 2006 году Хайдман назвал его Феникс, в честь мифической птицы, возродившейся из пепла.
Эндогенные ретровирусы могут быть опасными паразитами, но ученые нашли несколько приносящих нам пользу. Когда оплодотворенная яйцеклетка формирует плод, часть его клеток становятся плацентой, которая предназначена для передачи зародышу питательных веществ. Клетки внешнего слоя плаценты сплавляются воедино, разделяя ДНК и другие молекулы. Хайдман и другие исследователи обнаружили, что эндогенные ретровирусы человека играют в этом процессе решающую роль. Клетки верхнего слоя плаценты используют ген для формирования белковой оболочки, связывающей их вместе. В один из самых интимных моментов, когда новая жизнь начинается путем слияния двух других, вирусы обеспечивают наше выживание. Нет деления на нас и них — есть только всеобъемлющее непрекращающееся смешение генов.
Полный текст:
Современная трансплантология испытывает острейший недоста-ток в донорских органах. Для решения проблемы был предложен подход, основанный на использовании органов и тканей животных для пересадки человеку (ксенотрансплантация). Однако широкому развитию этого направления препятствует риск передачи человеку зоонозных инфекционных заболеваний. По эконо-мическим и этическим критериям, а также благодаря сходству по анатомическим и физиологическим параметрам, свинья является наиболее оптимальным источником органов для ксенотрансплантации. В геноме свиньи содержатся эндогенные ретровирусы (PERV) типа А которые могут инфицировать клеточные линии человека in vitro. Специально для биомедицинских целей, в том числе ксенотрансплантации, в Институте цитологии и генетики СО РАН была выведена селекционная группа сибирских миниатюрных свиней. Цель работы заключалась в анализе числа копий PERV A у сибирских миниатюрных свиней, пород-основателей ландрас и крупная белая, а также диких кабанов. Число копий PERV определяли методом абсолютного количественного анализа с использованием красителя SYBR Green. В качестве стандарта использовали образец с известным числом копий, который получали методом конечных разведений. Число копий PERV А в калибровочных образцах ДНК сибирских миниатюрных свиней составило 2.4, 3.6 и 4.9 копии PERV А на клетку, что хорошо совпадает с данными других авторов. Медиана числа копий PERV A на клетку составила 4.5 у сибирских миниатюрных свиней, 1.3 у ландрасов, 1.0 у представителей крупной белой породы и 0.8 у диких кабанов. Достоверные различия в числе копий ретровируса обнаружены между миниатюрными свиньями и дикими кабанами. Таким образом, геном сибирских миниатюрных свиней содержит значительное число копий потенциально патогенных для человека ретровирусов PERV типа А. Для ксенотрансплантации необходимо отбирать животных с наименьшим числом ретровирусов в геноме. Метод количественного определения числа копий PERV А с исполь-зованием красителя SYBR Green позволяет выявить таких животных и проводить селекцию сибирских миниатюрных свиней на уменьшение этого показателя.
1. Aitnazarov R.B., Nikitin S.V., Knyazev S.P., Yudin N.S. The saturation of genome of the pig by porcine endogenous retroviruses: the influence of heredity and environment. Innovatsii i prodovolstvennaya bezopasnost = Innovations and food security. 2014;2:41-49. (in Russian)
2. Aitnazarov R.B., Yudin N.S., Nikitin S.V., Ermolayev V.I., Voevoda M.I. Identification of whole genomes of endogenous retroviruses in Siberian miniature pigs. Rus. J. Genetics: Applied Research. 2014;4(6):523-525. DOI 10.1134/S2079059714060021.
3. Akiyoshi D.E., Denaro M., Zhu H., Greenstein J.L., Banerjee P., Fishman J.A. Identification of a full-length cDNA for an endogenous retrovirus of miniature swine. J. Virology. 1998;72(5):4503-4507.
4. Bosch S., Arnauld C., Jestin A. Study of full-length porcine endogenous retrovirus genomes with envelope gene polymorphism in a specificpathogen- free Large White swine herd. J. Virology. 2000;74(18): 8575-8581.
5. Denner J. Recombinant porcine endogenous retroviruses (PERV-A/C): a new risk for xenotransplantation? Archives Virology. 2008;153(8): 1421-1426. DOI 10.1007/s00705-008- 0141-7.
6. Denner J. How active are porcine endogenous retroviruses (PERVs)? Viruses. 2016;8(8):E215. DOI 10.3390/v8080215.
7. Ekser B., Cooper D.K., Tector A.J. The need for xenotransplantation as a source of organs and cells for clinical transplantation. Intern. J. Surgery. 2015;23:199-204. DOI 10.1016/j.ijsu.2015.06.066.
8. Frühauf J.H., Mertsching H., Giri S., Frühauf N.R., Bader A. Porcine endogenous retrovirus released by a bioartificial liver infects primary human cells. Liver International. 2009;29(10):1553-1561. DOI 10.1111/j.1478-3231.2009.02087.x.
9. Godehardt A.W., Rodrigues Costa M., Tönjes R.R. Review on porcine endogenous retrovirus detection assays–impact on quality and safety of xenotransplants. Xenotransplantation. 2015;22(2):95-101. DOI 10.1111/xen.12154.
10. Herring C., Quinn G., Bower R., Parsons N., Logan N.A., Brawley A., Elsome K., Whittam A., Fernandez-Suarez X.M., Cunningham D., Onions D., Langford G., Scobie L. Mapping full- length porcine endogenous retroviruses in a large white pig. J. Virology. 2001;75(24): 12252-12265.
11. Karlas A., Irgang M., Votteler J., Specke V., Ozel M., Kurth R., Denner J. Characterisation of a human cell-adapted porcine endogenous retrovirus PERV-A/C. Ann. Transplantation. 2010;15(2):45-54.
12. Kimsa M.C., Strzalka-Mrozik B., Kimsa M.W., Gola J., Nicholson P., Lopata K., Mazurek U. Porcine endogenous retroviruses in xenotransplantation – molecular aspects. Viruses. 2014;6(5):2062-2083. DOI 10.3390/v6052062.
13. Le Tissier P., Stoye J.P., Takeuchi Y., Patience C., Weiss R.A. Two sets of human-tropic pig retrovirus. Nature. 1997;389(6652):681-682.
14. Lee D., Kim N.Y., Bae G.E., Lee H.J., Kwon M., Kim S.S., Lee H.T., Yang J.M., Kim Y.B. Transmissible infection of human 293T cells with porcine endogenous retroviruses subgroup А from NIH-miniature pig. Transplantation Proceed. 2008;40(10):3742-3745. DOI 10.1016/j.transproceed.2008.09.035.
15. Lee D., Lee J., Yoon J.K., Kim N.Y., Kim G.W., Park C., Oh Y.K., Kim Y.B. Rapid determination of PERV copy number from porcine genomic DNA by real-time polymerase chain reaction. Animal Biotechnol. 2011;22(4):175-180. DOI 10.1080/10495398.2011.595294.
16. Li Z., Ping Y., Shengfu L., Yangzhi Z., Jingqiu C., Youping L., Hong B. Variation of host cell tropism of porcine endogenous retroviruses expressed in chinese Banna minipig inbred. Intervirology. 2006;49(4): 185-191.
17. Liu G., Li Z., Pan M., Ge M., Wang Y., Gao Y. Genetic prevalence of porcine endogenous retrovirus in chinese experimental miniature pigs. Transplantation Proceed. 2011;43(7):2762-2769. DOI 10.1016/j.transproceed.2011.06.061.
18. Ma Y., Yang Y., Lv M., Yan Q., Zheng L., Ding F., Wu J., Tian K., Zhang J. Real-time quantitative polymerase chain reaction with SYBR green I detection for estimating copy numbers of porcine endogenous retrovirus from Chinese miniature pigs. Transplantation Proceed. 2010;42(5):1949-1952. DOI 10.1016/j.transproceed. 2010.01.054.
19. Mang R., Maas J., Chen X., Goudsmit J., van der Kuyl A.C. Identification of a novel type C porcine endogenous retrovirus: evidence that copy number of endogenous retroviruses increases during host inbreeding. J. General Virology. 2001;82(Pt. 8):1829-1834.
20. Marcucci K.T., Argaw T., Wilson C.A., Salomon D.R. Identification of two distinct structural regions in a human porcine endogenous retrovirus receptor, HuPAR2, contributing to function for viral entry. Retrovirology. 2009;6(3):1-15. DOI 10.1186/1742-4690-6-3.
21. Mazurek U., Kimsa M.C., Strzalka-Mrozik B., Kimsa M.W., Adamska J., Lipinski D., Zeyland J., Szalata M., Slomski R., Jura J., Smorag Z., Nowak R., Gola J. Quantitative analysis of porcine endogenous retroviruses in different organs of transgenic pigs generated for xenotransplantation. Current Microbiology. 2013;67(4):505-514. DOI 10.1007/s00284-013- 0397-3.
22. Morozov V.A., Morozov A.V., Rotem A., Barkai U., Bornstein S., Denner J. Extended microbiological characterization of Göttingen minipigs in the context of xenotransplantation: detection and vertical transmission of hepatitis E virus. PLoS One. 2015;10(10):e0139893. DOI 10.1371/journal.pone.0139893.
23. Nakaya Y., Shojima T., Yasuda J., Imakawa K., Miyazawa T. Epigenetic regulation on the 5’- proximal CpG island of human porcine endogenous retrovirus subgroup A receptor 2/GPR172B. Microbes Infect. 2011;13(1):49-57. DOI 10.1016/j.micinf.2010.09.014.
24. Niebert M., Tonjes R.R. Evolutionary spread and recombination of porcine endogenous retroviruses in suiformes. J. Virology. 2005;79(1): 649-654.
25. Nikitin S.V., Yudin N.S., Knyazev S.P., Aitnazarov R.B., Kobzev V.F., Bekenev V.A., Savvina M.A., Ermolaev V.I. Frequency of chromosomes carrying endogenous retroviruses in the populations of domestic pig and wild boar. Genetika = Genetics (Moscow). 2008;44(6):789- 797. (in Russian)
26. Quereda J.J., Herrero-Medrano J.M., Abellaneda J.M., García-Nicolás O., Martínez-Alarcón L., Pallarés F.J., Ramírez P., Muñoz A., Ramis G. Porcine endogenous retrovirus copy number in different pig breeds is not related to genetic diversity. Zoonoses Public Health. 2012; 59(6):401-407. DOI 10.1111/j.1863-2378.2012.01467.x.
28. Sedlak R.H., Jerome K.R. Viral diagnostics in the era of digital polymerase chain reaction. Diagnostic Microbiology Infectious Disease. 2013;75(1):1-4. DOI 10.1016/j.diagmicrobio.2012.10.009.
29. Shimatsu Y., Yamada K., Horii W., Hirakata A., Sakamoto Y., Waki S., Sano J., Saitoh T., Sahara H., Shimizu A., Yazawa H., Sachs D.H., Nunoya T. Production of cloned NIBS (Nippon Institute for Biological Science) and α-1, 3-galactosyltransferase knockout MGH miniature pigs by somatic cell nuclear transfer using the NIBS breed as surrogates. Xenotransplantation. 2013;20(3):157-164. DOI 10.1111/xen.12031.
30. Specke V., Rubant S., Denner J. Productive infection of human primary cells and cell lines with porcine endogenous retroviruses. Virology. 2001;285(2):177-180.
31. Tikhonov V.N. Laboratornye mini-svin’i, genetika i mediko-biologicheskoe ispolzovanie [Laboratory Mini-pigs: Genetics and Biomedical Use]. Novosibirsk, SB RAS Publ., 2010. (in Russian)
32. Yang L., Güell M., Niu D., George H., Lesha E., Grishin D., Aach J., Shrock E., Xu W., Poci J., Cortazio R., Wilkinson R.A., Fishman J.A., Church G. Genome-wide inactivation of porcine endogenous retroviruses (PERVs). Science. 2015;350(6264):1101-1104. DOI 10.1126/science.aad1191.
33. Yu P., Zhang L., Li S.F., Cheng J.Q., Lu Y.R., Zeng Y.Z., Li Y.P., Bu H. A rapid method for detection of the copy number of porcine endogenous in swine. J. Rapid Methods Automation Microbiology. 2007; 15:199-205.
34. Yu P., Zhang P., Zhang L., Li S.F., Cheng J.Q., Lu Y.R., Li Y.P., Bu H. Studies on long-term infection of human cells with porcine endogenous retrovirus. Acta Virologica. 2009;53(3):169-174.
35. Yudin N.S., Aitnazarov R.B., Ermolaev V.I. Porcine endogenous retroviruses: what are the risks of infection transmission in xenotransplantation? Rus. J. Genet. Appl. Res. 2011;1(6):532-539. DOI 10.1134/S207905971106013X.
36. Zhang P., Yu P., Wang W., Zhang L., Li S., Bu H. An effective method for the quantitative detection of porcine endogenous retrovirus in pig tissues. In Vitro Cellular & Develop. Biology – Animal. 2010; 46(5):408-410. DOI 10.1007/s11626-009-9264-8.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


