Чем отличаются рнк содержащие вирусы от ретровирусов

Считалось, что из всех РНК-содержащих вирусов только ретровирусы способны синтезировать ДНК на матрице своей РНК и встраиваться в геном хозяйской клетки. Как выяснилось, другие РНК-содержащие вирусы тоже умеют это делать, хотя у них нет генов, необходимых для обратной транскрипции (синтеза ДНК на матрице РНК). Встраивание этих вирусов в хромосомы хозяина происходит благодаря своеобразной кооперации с уже обжившимися в хозяйском геноме ретровирусами.
До сих пор считалось, что такие вирусы не могут встраивать свой наследственный материал в геном хозяина (или, точнее, что это может происходить лишь исключительно редко, в силу стечения ряда маловероятных обстоятельств; необходимо помнить, что в биологии почти нет абсолютно строгих правил такого рода — любой догматизм здесь противопоказан).
В 1997 году швейцарские биологи установили, что в хромосомах мышей после заражения РНК-содержащим вирусом LCMV (lymphocytic choriomeningitis virus) систематически обнаруживаются фрагменты вирусного генома, а именно гены вирусного гликопротеина (GP) и нуклеопротеина (NP). Как происходит синтез ДНК на матрице вирусной РНК при отсутствии у вируса LCMV обратной транскриптазы, никто не знал.
Исследователи заражали мышиные клетки вирусом LCMV до тех пор, пока не получили две линии клеток, содержащих в своем геноме вирусные гены. Затем из этих клеток были выделены и размножены фрагменты геномной ДНК, включающие гены LCMV, вместе с прилегающими участками.
Оказалось, что в обеих линиях произошло встраивание в хозяйский геном вирусного гена GP. В одной линии клеток вирусный ген встроился в 7-ю хромосому, в другой — в 10-ю. Самое главное, что в обоих случаях к встроенному вирусному гену непосредственно прилегает нуклеотидная последовательность ретротранспозона IAP.
Это позволило ученым предположить, что обратная транскрипция вирусного генома и последующее встраивание получившейся ДНК в хозяйский геном были осуществлены благодаря деятельности ферментов, кодируемых ретротранспозоном IAP.
Чтобы проверить это предположение, исследователи вводили активные копии мышиного ретротранспозона IAP в клетки других видов млекопитающих (человека, зеленой мартышки, собаки и китайского хомячка), у которых интеграция генов LCMV в геном никогда не наблюдалась. В качестве контроля использовались клетки, в которые не вводили дополнительных генов или вводили ген зеленого светящегося белка. Затем все эти клетки заражали вирусом LCMV и смотрели, будет ли синтезироваться ДНК на матрице вирусной РНК.
В клетках всех четырех видов животных, в которые был введен ретротранспозон IAP, гены вируса LCMV подвергались обратной транскрипции (в среднем в 70% клеток). В контрольных клетках этого не произошло ни разу. Таким образом, IAP действительно необходим для встраивания генов LCMV в хозяйский геном, причем ретротранспозон успешно справляется с этой работой не только в клетках своего природного хозяина — мыши, но и в клетках других животных.
Используя в экспериментах разные варианты ретротранспозона IAP, исследователи установили, что для успешного встраивания LCMV необходимо наличие в составе IAP неповрежденных генов pol и gag (каждый из этих генов кодирует по несколько белков; обратная транскриптаза кодируется геном pol; см. схему строения ретровируса).
Вирус LCMV может проникать в семенники мышей, где активно работают ретротранспозоны IAP. Теоретически LCMV мог бы встроиться в геном сперматозоида и стать наследственным, но до сих пор этого не произошло: в геномах мышей, не зараженных вирусом LCMV, не удалось обнаружить никаких фрагментов генома LCMV, несмотря на целенаправленный поиск.
Авторы отмечают, что полученные ими результаты необходимо учитывать при разработке новых методов генной терапии, основанных на создании искусственных РНК-содержащих вирусов с нужными пациенту генами. Ведь в геноме человека тоже есть немало эндогенных ретровирусов. Правда, почти все они неактивны, но некоторые, возможно, частично сохранили активность. Эти эндогенные ретровирусы теоретически могут обеспечить встраивание геномов искусственных РНК-содержащих вирусов в человеческие хромосомы, что может привести к плохо предсказуемым последствиям. Поэтому все новые терапевтические РНК-вирусы должны проходить предварительную проверку на способность встраиваться в хозяйский геном.
Источник: Markus B. Geuking, Jacqueline Weber, Marie Dewannieux, Elieser Gorelik, Thierry Heidmann, Hans Hengartner, Rolf M. Zinkernagel, Lars Hangartner. Recombination of Retrotransposon and Exogenous RNA Virus Results in Nonretroviral cDNA Integration // Science. 2009. V. 323. P. 393–396.
РНК - вирус представляет собой вирус , который имеет РНК (рибонуклеиновая кислота) в качестве своего генетического материала . Это нуклеиновой кислоты , как правило , одноцепочечной РНК ( оцРНК ) , но может быть двухцепочечной РНК (дцРНК). Известные заболевания человека , вызываемые вирусами РНК включают Эбола hemorrhoragic лихорадка , SARS , Бешенство , простуду , грипп , гепатит С , лихорадки Западного Нила , полиомиелит и корь .
Международный комитет по таксономии вирусов (ICTV) классифицирует РНК -содержащие вирусы , как те , которые принадлежат к группе III , IV группы или группы V по классификации Балтимор системы классификации вирусов и не рассматривают вирусы с ДНК интермедиатами в их жизненном цикле , как РНК - вирусы. Вирусы с РНК в качестве своего генетического материала , которые также включают в себя промежуточные продукты ДНК в их цикле репликации называются ретровирусы , и включают в себя группу VI классификации Балтимор. Известный ретровирус человека включает в себя ВИЧ-1 и ВИЧ-2 , причина заболевания СПИДА .
Другой термин для РНК -содержащих вирусов , которые явно исключает ретровирусов ribovirus .
содержание
Характеристики
РНК - вирусы могут быть дополнительно классифицированы по смыслу или полярности их РНКА в отрицательную смысле и положительный смысл , или двусмысловые РНК - вирусы. Положительно смысл вирусной РНК аналогична мРНК и , таким образом , могут быть немедленно переведены клеткой - хозяином. Отрицательные чувства вирусной РНК является комплементарной мРНК и , следовательно , должны быть преобразованы в положительной смысловой РНК с помощью РНК-зависимой РНК - полимеразы перед переводом. Таким образом , очищенный РНК вируса позитивно-смысловой может непосредственно вызвать инфекцию , хотя это может быть менее заразным , чем весь вирусной частицы. Очищенная РНК вируса отрицательного смысла не заразна сам по себе , как это должно быть расшифровано в положительном смысловой РНК; каждый из вирионов может быть переписана несколько положительно смысловых РНК. Двусмысловые РНК - вирусы похожи на вирусы РНК отрицательного смысла, за исключением того, что они также переводят гены от положительной цепи.
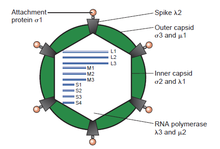
В (DS) вирусы двунитевой РНК представляют собой разнородную группу вирусов , которые широко варьировать в диапазоне хозяина (человека, животных, растений, грибов и бактерий ), генома номера сегмента ( от одного до двенадцати) и вириона организации ( номер триангуляции , капсида слои, шипы, башни и т.д.). Члены этой группы включают ротавирусы , известный во всем мире как наиболее распространенной причиной гастроэнтерита у детей младшего возраста, а также picobirnaviruses , известные во всем мире , как наиболее часто встречающийся вирус в фекальных образцах как людей , так и животных , с или без признаков диареи. Вирус КЛО является экономически важным патогеном крупного рогатого скота и овец. В последние годы значительный прогресс был достигнут в определении, на атомных и subnanometeric уровнях структуры ряда ключевых вирусных белков и вириона капсид нескольких вирусов дсРНК, выделяя значительные параллели в структуре и репликативные процессы многих эти вирусы.
РНК - вирусы , как правило , имеют очень высокие мутационные цены по сравнению с ДНК - вирусами , так как вирусный РНК - полимераза не хватает корректуру способности ДНК - полимераз . Это одна из причин , почему это трудно сделать эффективные вакцины для профилактики заболеваний , вызываемых вирусами РНК. Ретровирусы также имеют высокую частоту мутаций , даже если их ДНК промежуточные интегрируют в геном хозяина (и, таким образом , при условии размещения ДНК корректуры один раз интегрированной), так как ошибки в процессе обратной транскрипции встроены в обе нити ДНК до интеграции. Некоторые гены РНК вируса являются важными для вирусных циклов репликации и мутация не допускаются. Например, область вируса гепатита С геном , который кодирует основной белок высоко консервативен , так как она содержит структуру РНК , участвующих в внутреннем сайте рибосомного входа .
копирование
РНК-вирусы животных классифицируются по ICTV. Есть три отдельные группы РНК-вирусов, в зависимости от их генома и способа репликации:
- Двухцепочечные РНК-вирусы (III группа) содержат от одного до дюжины различных молекул РНК, каждый из кодирования для одного или нескольких вирусных белков.
- Положительно смысловые оцРНК вирусы (группы IV) имеют их геном непосредственно использованы в качестве мРНК, с принимающими рибосомыперевод его в один белок , который модифицирован путем хозяина и вирусных белков , чтобы сформировать различные белки , необходимые для репликации. Один из них включает в себя РНК-зависимой РНК - полимеразы (РНК - репликазы), который копирует вирусной РНК с образованием двухцепочечной репликативной формы. В свою очередь , это дсРНК управляет формированием новой вирусной РНК.
- Отрицательно смысл оцРНК вирусы (группа V) должны иметь свой геном скопированный с помощью РНК-репликазы с образованием положительной смысловой РНК. Это означает, что вирус должен принести вместе с ним РНК репликазы фермента. Молекула РНК положительной смысл тогда действует как вирусной мРНК, которая транслируется в белки принимающими рибосом.
Ретровирусы (VI группы) имеют одноцепочечной РНК - геном , но, в общем, не считаются РНК -содержащих вирусов , поскольку они используют промежуточные продукты ДНК для репликации. Обратные транскриптазы , вирусный фермент , который происходит от вируса себя после того, как она без покрытия, преобразует вирусной РНК в комплементарные нити ДНК, которая копируется , чтобы произвести двухцепочечную молекулу вирусной ДНК. После того, как эта ДНК интегрирована в геном хозяина с помощью вирусного фермента интегразы , экспрессия генов , кодируемых может привести к образованию новых вирионов.
классификация
Классификация вирусов РНК, оказалось трудной задачей. Это отчасти из-за высокой частоты мутаций эти геномы подвергаются. Классификация основана главным образом, от типа генома (двухцепочечный, или отрицательный положительным однонитевой) и числа генов и организации. В настоящее время существует 5 порядков и 47 семейств РНК-содержащих вирусов, признаваемые. Есть также много нераспределенных видов и родов.
Относящиеся к но отличаются от РНК - вирусов являются вироидов и РНК спутниковые вирусы . Они в настоящее время не классифицируются как РНК - вирусы и описаны на своих страницах.
Изучение нескольких тысяч вирусов РНК показал наличие по крайней мере , пяти основных таксонов: в levivirus и группы родственников; пикорнавирус супергруппа; альфавирус супергруппа плюс флавивирус супергруппа; вирусы дцРНКа; и католита вирусы прядей. Лентивирусов группа , как представляется, базальная для всех остальных РНК -содержащих вирусов. Следующее крупное подразделение лежит между picornasupragroup и остальными вирусами. Вирусы дцРНК , по всей видимости, произошли от + ве РНК предка и минусу РНК -содержащих вирусов из вирусов внутри дцРНК. Ближайший reltion к минусу скрученных РНК вирусов являются Reoviridae .
Это единственная самая большая группа РНК-содержащих вирусов с 30 семей. Делались попытки сгруппировать эти семьи в высших порядках. Эти предложения были основаны на анализе РНК-полимеразы и все еще находятся на рассмотрении. На сегодняшний день предложение, предложенное не было широко принято из-за сомнения по поводу пригодности одного гена, чтобы определить таксономию кладов.
Предложенная классификация положительно прядей РНК-вирусов на основе РНК-зависимой РНК-полимеразы. Три группы были признаны:
- Bymoviruses, comoviruses, nepoviruses, nodaviruses, пикорнавирусы, potyviruses, sobemoviruses и подмножество luteoviruses (свекла вирус западных желтеет и вирус Скручивание листьев картофеля) -The пикорнавирусы, как группы (Picornavirata).
- Carmoviruses, dianthoviruses, флавивирусов, пестивирусов, statoviruses, tombusviruses, одноцепочечные РНК бактериофаги, вирус гепатита С и подмножество luteoviruses (желтой карликовости ячменя вирус) -The flavi, как группы (Flavivirata).
- Альфавирусы, carlaviruses, furoviruses, hordeiviruses, potexviruses, rubiviruses, tobraviruses, tricornaviruses, tymoviruses, яблоко хлоротичного вирус пятна листьев, свекла желтеет вирус и гепатит Е вирус-альфа, как группы (Rubivirata).
Альфа , как супергруппы может быть дополнительно разделен на три клады : рубите-подобный, tobamo-подобный, и tymo-подобные вирусы.
Дополнительная работа определила пять групп положительных одноцепочечной РНК вирусов, содержащих четыре, три, три, три, и один заказ (ы), соответственно. Эти четырнадцать порядков содержат 31 семейства вирусов (в том числе 17 семей вирусов растений) и 48 родов (в том числе 30 родов вирусов растений). Этот анализ предполагает, что альфавирусы и флавивирусы могут быть разделены на два семейство-в Togaviridae и Flaviridae, соответственно, но предполагают, что другие таксономические задания, такие как пестивирусы, вирус гепатита С, rubiviruses, вирус гепатита Е, и arteriviruses, могут быть неправильными. В коронавирус и toroviruses, как представляется, отдельные семьи в различных заказов и не отличаются роды того же семейства, в настоящее время классифицируются. В luteoviruses, как представляется, две семьи, а не один, а яблоко вирус хлоротичное пятнистость листьев, кажется, не быть клостеровирус, но новый род Potexviridae.
Эволюция пикорнавирусах на основе анализа их РНК - полимеразы и геликаз , как представляется , дата дивергенции эукариот . Их предполагаемые предки включают бактериальную группа II ретроэлементы , семейство HtrA протеаз и ДНК бактериофагов .
Partitiviruses связаны и, возможно, произошли от totivirus предка.
Hypoviruses и barnaviruses по-видимому, разделяют родословную с potyvirus и sobemovirus линий соответственно.
Этот анализ также показывает, что вирусы дцРНКа не тесно связаны друг с другом, но вместо того, чтобы принадлежать к четырем дополнительным классам-Birnaviridae, Cystoviridae, Partitiviridae и Reoviridae - и один дополнительному заказу (Totiviridae) одного из классов положительных вирусов оцРНКа в же подтип, как положительно прядей РНК-вирусов.
Одно исследование предположило, что есть два больших клада: один включает в Caliciviridae, Flaviviridae и Пикорнавирусов семьи и второй, который включает в себя Alphatetraviridae, Birnaviridae и Cystoviridae, Nodaviridae и Permutotretraviridae семьи.
Эти вирусы имеют различные типы генома , начиная от одной молекулы РНК до восьми сегментов. Несмотря на их разнообразие кажется , что они , возможно, возникли в членистоногих и диверсифицируют оттуда.
Ряд спутниковых вирусов - вирусы , которые требуют помощи другого вируса , чтобы завершить свой жизненный цикл - также известны. Их таксономии выделялось еще предстоит урегулировать. Следующие четыре рода были предложены для положительных чувственных одноцепочечных РНК спутниковых вирусов , которые заражают растения - Albetovirus , Aumaivirus , Papanivirus и Virtovirus . Семейство - Sarthroviridae , который включает в себя род Macronovirus - был предложен для положительном смысле одноцепочечных РНК спутниковых вирусов, поражающих членистоногих .
Вирусы группы III-дцРНК
Есть двенадцать семей и ряд присвоенных в родах и видов, признанных в этой группе.
Группа IV-позитивно-смысловые вирусы оцРНК
Есть три порядка и 34 семей, признанных в этой группе. Кроме того, существует целый ряд неклассифицированных видов и родов.
Группа V-отрицательные чувства вирусы оцРНКа
С Exeption от вируса гепатита D , эта группа вирусов были помещены в один фила - Negarnaviricota . Этот тип был разделен на две subphyla - Haploviricotina и Polyploviricotina . В подтипа Haploviricotina четыре класса в настоящее время признаются: Chunqiuviricetes , Milneviricetes , Monjiviricetes и Yunchangviricetes . В подтипа Polyploviricotina два класса признаны: Ellioviricetes и Insthoviricetes .
Шесть классов, семь порядков и двадцать четыре семьи в настоящее время признаются в этой группе. Ряд присвоенных в видов и родов еще не классифицированы.
чЙТХУБН, ЛБЛ Й ЧУЕН ЦЙЧЩН ПТЗБОЙЪНБН, УЧПКУФЧЕООЩ ОБУМЕДУФЧЕООПУФШ Й ЙЪНЕОЮЙЧПУФШ. пУОПЧОПК ПУПВЕООПУФША ЧЙТХУОПЗП ЗЕОПНБ СЧМСЕФУС ФП, ЮФП ОБУМЕДУФЧЕООБС ЙОЖПТНБГЙС Х ЧЙТХУПЧ НПЦЕФ ВЩФШ ЪБРЙУБОБ ЛБЛ ОБ дол, ФБЛ Й ОБ тол. зЕОПН дол-УПДЕТЦБЭЙИ ЧЙТХУПЧ ДЧХИОЙФЕЧПК (ЙУЛМАЮЕОЙЕ УПУФБЧМСАФ РБТЧПЧЙТХУЩ, ЙНЕАЭЙЕ ПДОПОЙФЕЧХА дол), ОЕУЕЗНЕОФЙТПЧБООЩК Й РТПСЧМСЕФ ЙОЖЕЛГЙПООЩЕ УЧПКУФЧБ. х ЧЙТХУПЧ, РТЙОБДМЕЦБЭЙИ Л ТПДБН Poxvirus Й Hepadnavirus ЗЕОПН РТЕДУФБЧМЕО ДЧХНС ГЕРПЮЛБНЙ дол ТБЪОПК ДМЙОЩ. зЕОПН ВПМШЫЙОУФЧБ тол-УПДЕТЦБЭЙИ ЧЙТХУПЧ ПДОПОЙФЕЧПК (ЙУЛМАЮЕОЙЕ УПУФБЧМСАФ ТЕПЧЙТХУЩ Й ТЕФТПЧЙТХУЩ, ПВМБДБАЭЙЕ ДЧХОЙФЕЧЩНЙ ЗЕОПНБНЙ) Й НПЦЕФ ВЩФШ УЕЗНЕОФЙТПЧБООЩН (РТЕДУФБЧЙФЕМЙ ТПДПЧ Retrovirus , Orthomyxovirus , Arenavirus Й Reovirus ) ЙМЙ ОЕУЕЗНЕОФЙТПЧБООЩН.
чЙТХУОЩЕ тол Ч ЪБЧЙУЙНПУФЙ ПФ ЧЩРПМОСЕНЩИ ЖХОЛГЙК РПДТБЪДЕМСАФУС ОБ ДЧЕ ЗТХРРЩ. л РЕТЧПК ЗТХРРЕ ПФОПУСФУС тол, УРПУПВОЩЕ ОЕРПУТЕДУФЧЕООП ФТБОУМЙТПЧБФШ ЗЕОЕФЙЮЕУЛХА ЙОЖПТНБГЙА ОБ ТЙВПУПНЩ ЮХЧУФЧЙФЕМШОПК ЛМЕФЛЙ, Ф.Е ЧЩРПМОСФШ ЖХОЛГЙЙ Йтол Й Нтол. йИ ОБЪЩЧБАФ РМАУ-ОЙФЙ тол Й ПВПЪОБЮБАФ ЛБЛ +тол (РПЪЙФЙЧОЩК ЗЕОПН). пОЙ ЙНЕАФ ИБТБЛФЕТОЩЕ ПЛПОЮБОЙС (`ЫБРПЮЛЙ') ДМС УРЕГЙЖЙЮЕУЛПЗП ТБУРПЪОБЧБОЙС ТЙВПУПН.
х ДТХЗПК ЗТХРРЩ ЧЙТХУПЧ тол ОЕ УРПУПВОБ ФТБОУМЙТПЧБФШ ЗЕОЕФЙЮЕУЛХА ЙОЖПТНБГЙА ОЕРПУТЕДУФЧЕООП ОБ ТЙВПУПНЩ Й ЖХОЛГЙПОЙТПЧБФШ ЛБЛ Йтол. фБЛЙЕ тол УМХЦБФ НБФТЙГЕК ДМС ПВТБЪПЧБОЙС Йтол, Ф.Е. РТЙ ТЕРМЙЛБГЙЙ РЕТЧПОБЮБМШОП УЙОФЕЪЙТХЕФУС НБФТЙГБ (+тол) ДМС УЙОФЕЪБ -тол. фБЛПК ФЙР тол ПРТЕДЕМСАФ ЛБЛ НЙОХУ-ОЙФШ Й ПВПЪОБЮБАФ -тол (ОЕЗБФЙЧОЩК ЗЕОПН). х ЧЙТХУПЧ ЬФПК ЗТХРРЩ ТЕРМЙЛБГЙС тол ПФМЙЮБЕФУС ПФ ФТБОУЛТЙРГЙЙ РП ДМЙОЕ ПВТБЪХАЭЙИУС НПМЕЛХМ: РТЙ ТЕРМЙЛБГЙЙ ДМЙОБ тол УППФЧЕФУФЧХЕФ НБФЕТЙОУЛПК ОЙФЙ, Б РТЙ ФТБОУЛТЙРГЙЙ ПВТБЪХАФУС ХЛПТПЮЕООЩЕ НПМЕЛХМЩ Йтол. нПМЕЛХМЩ +тол РТПСЧМСАФ ЙОЖЕЛГЙПООПУФШ, Б -тол ОЕ РТПСЧМСАФ ЙОЖЕЛГЙПООЩЕ УЧПКУФЧБ Й ДМС ЧПУРТПЙЪЧЕДЕОЙС ДПМЦОЩ ФТБОУЛТЙВЙТПЧБФШУС Ч +тол.
йУЛМАЮЕОЙЕ УПУФБЧМСАФ ТЕФТПЧЙТХУЩ, ЛПФПТЩЕ УПДЕТЦБФ ПДОПОЙФЕЧХА +тол, УМХЦБЭХА НБФТЙГЕК ДМС ЧЙТХУОПК тол-ЪБЧЙУЙНПК дол-РПМЙНЕТБЪЩ (ПВТБФОПК ФТБОУЛТЙРФБЪЩ). рТЙ РПНПЭЙ ЬФПЗП ЖЕТНЕОФБ ЙОЖПТНБГЙС РЕТЕРЙУЩЧБЕФУС У тол ОБ дол, Ч ТЕЪХМШФБФЕ ЮЕЗП ПВТБЪХЕФУС дол-РТПЧЙТХУ, ЙОФЕЗТЙТХАЭЙК Ч ЛМЕФПЮОЩК ЗЕОПН.
фБЛ ЦЕ ЛБЛ Й Х РТПЮЙИ ЖПТН ЦЙЪОЙ ОХЛМЕЙОПЧЩЕ ЛЙУМПФЩ ЧЙТХУПЧ РПДЧЕТЦЕОЩ НХФБГЙСН. жЕОПФЙРЙЮЕУЛЙ НХФБГЙЙ ЧЙТХУОПЗП ЗЕОПНБ РТПСЧМСАФУС ЙЪНЕОЕОЙСНЙ Ч БОФЙЗЕООПК УФТХЛФХТЕ, ОЕУРПУПВОПУФЙ ЧЩЪЩЧБФШ РТПДХЛФЙЧОХА ЙОЖЕЛГЙА Ч ЮХЧУФЧЙФЕМШОПК ЛМЕФЛЕ, ФЕТНПУФБВЙМШОПУФША, ЙЪНЕОЕОЙЕН ТБЪНЕТБ Й ЖПТНЩ ВМСЫЕЛ, ПВТБЪХЕНЩИ РПД БЗБТПЧЩН РПЛТЩФЙЕН. вПМШЫЙОУФЧХ НХФБГЙК РТЙУХЭЙ ТЕЧЕТУЙЙ Л ДЙЛПНХ ФЙРХ, РТЙЮЕН ЛБЦДБС НХФБГЙС ЙНЕЕФ ИБТБЛФЕТОХА ЮБУФПФХ ТЕЧЕТУЙК, ЛПФПТХА НПЦОП ФПЮОП ЙЪНЕТЙФШ. х ЧЙТХУПЧ ЧЩДЕМСАФ УРПОФБООЩЕ Й ЙОДХГЙТПЧБООЩЕ НХФБГЙЙ.
уЛПТПУФШ УРПОФБООПЗП НХФБЗЕОЕЪБ Ч дол-ЗЕОПНБИ ЪОБЮЙФЕМШОП ОЙЦЕ (10 -8 - 10 -11 ОБ ЛБЦДЩК ЧЛМАЮЕООЩК ОХЛМЕПФЙД), ЮЕН Х тол-ЗЕОПНОЩИ (10 -3 - 10 -4 ОБ ЛБЦДЩК ЧЛМАЮЕООЩК ОХЛМЕПФЙД). вПМЕЕ ЧЩУПЛБС ЮБУФПФБ УРПОФБООЩИ НХФБГЙК УЧСЪБОБ У ОЙЪЛПК ФПЮОПУФША ТЕРМЙЛБГЙЙ тол-ЗЕОПНПЧ, ЛПФПТБС ЧЕТПСФОП УЧСЪБОБ У ПФУХФУФЧЙЕН Х тол-ТЕРМЙЛБЪ ЛПТТЕЛФЙТХАЭЕК БЛФЙЧОПУФЙ, УЧПКУФЧЕООПК ЖЕТНЕОФБН, ТЕРМЙГЙТХАЭЙН дол. оБЙВПМЕЕ ЮБУФП УРПОФБООЩЕ НХФБГЙЙ ОБВМАДБАФУС Х ТЕФТПЧЙТХУПЧ, ЮФП УЧСЪБОП У ВПМЕЕ ЧЩУПЛПК ЮБУФПФПК УВПЕЧ Ч ПВТБФОПК ФТБОУЛТЙРГЙЙ, ОЕ УРПУПВОЩИ Л УБНПЛПТТЕЛГЙЙ.
йОДХГЙТПЧБООЩЕ НХФБГЙЙ Х ЧЙТХУПЧ РПМХЮБАФ РТЙ ДЕКУФЧЙЙ ТБЪМЙЮОЩИ ИЙНЙЮЕУЛЙИ Й ЖЙЪЙЮЕУЛЙИ НХФБЗЕОПЧ, ЛПФПТЩЕ РПДТБЪДЕМСАФ ОБ ДЕКУФЧХАЭЙЕ in vivo Й in vitro .
чЙТХУОЩЕ НХФБГЙЙ ЛМБУУЙЖЙГЙТХАФ РП ЙЪНЕОЕОЙСН ЖЕОПФЙРБ Й ЗЕОПФЙРБ. рП ЖЕОПФЙРЙЮЕУЛЙН РТПСЧМЕОЙСН НХФБГЙЙ ЧЙТХУПЧ ТБЪДЕМСАФ ОБ ЮЕФЩТЕ ЗТХРРЩ:
- нХФБГЙЙ, ОЕ ЙНЕАЭЙЕ ЖЕОПФЙРЙЮЕУЛПЗП РТПСЧМЕОЙС.
- мЕФБМШОЩЕ НХФБГЙЙ, Ф.Е. РПМОПУФША ОБТХЫБАЭЙЕ УЙОФЕЪ ЙМЙ ЖХОЛГЙА ЦЙЪОЕООП ЧБЦОЩИ ВЕМЛПЧ Й РТЙЧПДСЭЙЕ Л ХФТБФЕ УРПУПВОПУФЙ Л ТЕРТПДХЛГЙЙ.
- хУМПЧОП МЕФБМШОЩЕ НХФБГЙЙ, Ф.Е. НХФБГЙЙ У РПФЕТЕК УРПУПВОПУФЙ УЙОФЕЪЙТПЧБФШ ПРТЕДЕМЕООЩК ВЕМПЛ ЙМЙ У ОБТХЫЕОЙЕН ЕЗП ЖХОЛГЙЙ ФПМШЛП Ч ПРТЕДЕМЕООЩИ ХУМПЧЙСИ.
- нХФБГЙЙ, ЙНЕАЭЙЕ ЖЕОПФЙРЙЮЕУЛПЕ РТПСЧМЕОЙЕ, ОБРТЙНЕТ ЙЪНЕОЕОЙЕ ТБЪНЕТПЧ ВМСЫЕЛ РПД БЗБТПЧЩН РПЛТЩФЙЕН ЙМЙ ФЕТНПУФБВЙМШОПУФЙ.
рП ЙЪНЕОЕОЙА ЗЕОПФЙРБ НХФБГЙЙ РПДТБЪДЕМСАФ ОБ ФПЮЕЮОЩЕ (МПЛБМЙЪХАЭЙЕУС Ч ЙОДЙЧЙДХБМШОЩИ ЗЕОБИ) Й ЗЕООЩЕ (ЪБФТБЗЙЧБАЭЙЕ ВПМЕЕ ПВЫЙТОЩЕ ХЮБУФЛЙ ЗЕОПНБ).
ъБТБЦЕОЙЕ ЧЙТХУБНЙ ЮХЧУФЧЙФЕМШОЩИ ЛМЕФПЛ ОПУЙФ НОПЦЕУФЧЕООЩК ИБТБЛФЕТ, Ф.Е. Ч ЛМЕФЛХ РТПОЙЛБЕФ УТБЪХ ОЕУЛПМШЛП ЧЙТЙПОПЧ. рТЙ ЬФПН ЧЙТХУОЩЕ ЗЕОПНЩ Ч РТПГЕУУЕ ТЕРМЙЛБГЙЙ НПЗХФ ЛППРЕТЙТПЧБФШУС ЙМЙ ЙОФЕТЖЕТЙТПЧБФШ. лППРЕТБФЙЧОЩЕ ЧЪБЙНПДЕКУФЧЙС НЕЦДХ ЧЙТХУБНЙ РТЕДУФБЧМЕОЩ ЗЕОЕФЙЮЕУЛЙНЙ ТЕЛПНВЙОБГЙСНЙ, ЗЕОЕФЙЮЕУЛПК ТЕБЛФЙЧБГЙЕК, ЛПНРМЕНЕОФБГЙЕК Й ЖЕОПФЙРЙЮЕУЛЙН УНЕЫЙЧБОЙЕН.
зЕОЕФЙЮЕУЛБС ТЕЛПНВЙОБГЙС ЮБЭЕ ЧУФТЕЮБЕФУС Х дол-УПДЕТЦБЭЙИ ЧЙТХУПЧ ЙМЙ тол-УПДЕТЦБЭЙИ ЧЙТХУПЧ У ЖТБЗНЕОФЙТПЧБООЩН ЗЕОПНПН (ЧЙТХУ ЗТЙРРБ). рТЙ ЗЕОЕФЙЮЕУЛПК ТЕЛПНВЙОБГЙЙ РТПЙУИПДЙФ ПВНЕО НЕЦДХ ЗПНПМПЗЙЮОЩНЙ ХЮБУФЛБНЙ ЧЙТХУОЩИ ЗЕОПНПЧ.
зЕОЕФЙЮЕУЛБС ТЕБЛФЙЧБГЙС ОБВМАДБЕФУС НЕЦДХ ЗЕОПНБНЙ ТПДУФЧЕООЩИ ЧЙТХУПЧ У НХФБГЙСНЙ Ч ТБЪОЩИ ЗЕОБИ. рТЙ РЕТЕТБУРТЕДЕМЕОЙЙ ЗЕОЕФЙЮЕУЛПЗП НБФЕТЙБМБ ЖПТНЙТХЕФУС РПМОПГЕООЩК ЗЕОПН.
лПНРМЕНЕОФБГЙС РТПЙУИПДЙФ ЛПЗДБ ПДЙО ЙЪ ЧЙТХУПЧ, ЙОЖЙГЙТХАЭЙИ ЛМЕФЛХ, Ч ТЕЪХМШФБФЕ НХФБГЙЙ УЙОФЕЪЙТХЕФ ОЕЖХОЛГЙПОБМШОЩК ВЕМПЛ. оЕНХФБОФОЩК ЧЙТХУ, УЙОФЕЪЙТХС РПМОПГЕООЩК ВЕМПЛ, ЧПУРПМОСЕФ ПФУХФУФЧЙЕ ЕЗП Х НХФБОФОПЗП ЧЙТХУБ.
Информация
Добавить в ЗАКЛАДКИ| Поделиться: |
РНК вируса репликацияВероятно, вирус-сателлит сам кодирует свой собственный структурный белок, так как серологически он не родствен ВНТ. В растениях, зараженных ВНТ, не удалось обнаружить антигены, которые были бы серологически родственны ВС [1413], однако результаты опытов нельзя считать окончательными, так как свободные белковые субъединицы могут и не реагировать с антисывороткой, специфичной в отношении интактного вируса. Более веским доводом в пользу предположения, что ВС кодирует специфический структурный белок, служит отсутствие серологической связи между ВС и ВНТ, как отмечалось выше, хотя ВНТ и способствует репликации вируса-сателлита. Анализ пептидов триптического гидролизата продуктов синтеза in vitro показал, что при этом образуется материал, сходный со структурным белком ВС.[ . ] У некоторых РНК-содержащих вирусов в геноме закодированы РНК-зависимые транскриптазы (обратные транскриптазы). Поэтому репликация генома РНК-содержащих вирусов катализируется собственной обратной транскриптазой, которая упаковывается в капсиде при каждой репликации вирусов в клетке-хозяине. Такие РНК-содержащие вирусы получили название ретровирусов (от лат. retro — возврат назад).[ . ] Среди мелких РНК-содержащих вирусов животных больше всего известно о репликации вируса полиомиелита, обычно изучаемой на линии клеток человека (клетки HeLa), растущих, в суспензионной культуре. Сразу же после заражения клеток вируслая РНК высвобождается из своей оболочки. Новые вирусоспецифичдыс белки, необходимые для образования вируса, синтезируются также вскоре после заражения. В их число входит РНК-полимераза, которая, вероятно, функционально сходна с ферментом, обнаруженным у РНК-содержащих бактериофагов. Синтез большей части вирусной РНК и белка оболочки вируса происходит между 2,5 и 5 ч после заражения. В зараженной клетке образуется двухцепочечная форма вирусной РНК, и количество ее растет экспоненциально в течение первых нескольких часов после заражения. Эксперименты с мечеными предшественниками позволили установить, что синтез одной молекулы РНК вируса полиомиелита в клетках HeLa занимает около 1 мин. Вирусная РНК функционирует в качестве информационной РНК в полирибосомах, которые в зараженных клетках HeLa отличаются значительно большими размерами, чем в незараженных. По-видимому, эта вирусная PIIK функционирует как полицистронпая информационная PIIK. Вирусоспецифичные полирибосомы прикрепляются в зараженной клетке к какой-то большой, содержащей липиды структуре. Изучение вируса полиомиелита in vivo выявило, что по меньшей мере 10 различных полипептидов, пе входящих в состав оболочки, и 4 полипептида вирусной оболочки кодируются вирусной РНК [1702]. Полностью сформированные (зрелые) вирусные частицы начинают появляться приблизительно через 2,5 ч после заражения. Вслед за этим происходит быстрое (в течение 2—3 мин) включение вновь синтезированной вирусной РНК в зрелые вирусные частицы. В то же время для включения вирусного белка требуется в среднем около 20 мин. Это позволяет предполагать, что в процессе репликации вируса образуется пул вирусного белка, используемого при формировании вирусных частиц.[ . ] ДНК-содержащие вирусы имеют либо собственные ферменты репликации (в капсиде), либо в их геноме закодирована информация о синтезе вирусных ферментов, обеспечивающих репликацию вирусной нуклеиновой кислоты. Количество этих ферментов различно в применении к разным вирусам. Например, в геноме бактериального вируса Т4 закодирована информация о синтезе около 30 вирусных ферментов. Далее геном крупных вирусов кодирует нуклеазы, разрушающие ДНК клетки-хозяина, ,а также белки, воздействие которых на клеточную РНК-полимеразу сопровождается тем, что «обработанная таким образом РНК-полимераза транскрибирует на разных стадиях вирусной инфекции разные вирусные гены. Напротив, малые по размерам ДНК-содержащие вирусы в большей мере зависят от ферментов клеток-хозяев. Например, синтез ДНК аденовирусов обеспечивается клеточными ферментами.[ . ] Возбудитель — Rabdovirus carpio, РНК-содержащий, имеет пулевидную форму, размером (105—125) х (70—85) нм. Он представлен одним серотипом. Среди полевых изолятов имеет авирулентные штаммы. Вирус размножается в первично трипсинизированных культурах клеток гонад карпа и в перевиваемых линиях клеток рыб — ЕРС, FHM и др. Оптимальная температура для репликации вируса в культуре тканей 20—23 °С. Он обнаружен в крови, асцитной жидкости, почках, печени, селезенке, слизистой кишечника, мускулатуре, головном мозге.[ . ] Возбудитель — рабдовирус, РНК-содержащий, со спиральной симметрией, имеет пальцевидную форму, размер (180—240) х (60— 75) нм. Покрыт гладкой оболочкой. На его плоском конце иногда различают отросток длиной 80—90 нм. Вирус хорошо культивируется на перевиваемых линиях клеток рыб FHM и RTG-2 (культура фибропластов из яичников радужной форели), а также карповой линии ЕРС. Репликация вируса в клетках происходит при температурах 10—21 °С, достигая титра 105—106«5 ТЩЬ/мл.[ . ] Если двухцепочечная форма вирусной РНК имеет отношение к репликации вируса, то можно было бы, очевидно, ожидать, что в клетке она будет появляться раньше, чем иитактный вирус. Экспериментально, однако, это еще не было показано. Возможно, что продемонстрировать это вообще довольно трудно. С помощью заР удалось обнаружить двухцепочечную форму РНК ВЖМТ в листьях китайской капусты через 3 дня после заражения, тогда как серологические тесты не позволяли выявить присутствие вируса вплоть до 5-го дня [1379]. Этот результат почти несомненно отражает относительную чувствительность использованных методов. Применяя 32Р для обнаружения не только двухцепочечной РНК, но ВЖМТ, мы сумели выявить вирус на 2-й день после заражения, а двухцепочечную форму РНК лишь на 3-й день. Судя по содержанию РНК в клетках, можно думать, что очень небольшого количества двухцепочечной РНК достаточно для образования значительных (возможно, в 1000 раз больших) количеств вирусной РНК и эролых вирусных частиц. Задержка во времени между образованием двухцепочечной РНК и первым появлением зрелого вируса в клетке, по всей вероятности, невелика, не более нескольких минут. С другой стороны, минимальное время, необходимое для того, чтобы выявить включение 32Р в отдельные компоненты вируса, составляет 30—60 мин. Если для исследования используются ткани листа, то лшпь небольшая часть клеток оказывается инфицированной в начале периода включения 32Р; остальные клетки заражаются в значительной мере асинхронно, так что это заражение растягивается иногда на несколько дней. Таким образом, почти неизбежно первым моченым вирусным продуктом, обнаруживаемым после заражения, будет свободная одноцепочечная вирусная РНК или полный вирус, а не двухцепочечная вирусная РНК.[ . ] Бесклеточные системы с успехом используются при изучении репликации вирусов животных и бактерий. Предпринималось много попыток приспособить их также и для изучения вирусов растений. Были испробованы: 1) системы, включающие клеточные оргапеллы, окруженные мембранами; 2) неочищенные системы, не содержащие таких оргаиелл; 3) системы, содержащие частично очищенные ферменты и нуклеиновые кислоты из инфицированных растений; 4) бесклеточные системы, полученные не из растений, а из других организмов (обычно из бактерий) и содержащие в качестве информационной РНК рибонуклеиновую кислоту фитопатогенных вирусов.[ . ] Некоторое время предполагали, что явление рекомбинации ограничено только вирусами, содержащими в качестве генетического материала ДНК. Аналогичные эксперименты с вирусами растений малочисленны вследствие технических трудностей, на которые наталкиваются попытки предпринять подобного рода опыты. Тем не менее Бесту удалось получить данные, свидетельствующие о рекомбинации между штаммами вируса броязовости томатов 1185—188, 190, 191].[ . ] До самого последнего времени считалось неразумным проводить аналогии между вирусами, поражающими различные крупные группы организмов. Однако достижения молекулярной биологии продемонстрировали единство основных механизмов синтеза нуклеиновых кислот и белка в природе. Поэтому, прежде чем анализировать довольно скудцыо экспериментальные данные о размножении вирусов растений, мы кратко рассмотрим основные особенности репликации некоторых РНК-содержащих бактериофагов и вирусов животных. Даже в отношении этих вирусов детали процесса репликации изучены еще далеко не достаточно.[ . ] Анализ ВТМ и ВЖМТ из обработанных растений показал, что 8-азагуаиин включается в РНК вирусной частицы, замещая часть (несколько процентов) остатков гуанина [1174, 1176, 1177]. Вирусные препараты, содержащие аналог, были менее инфекциопны, чем нормальный вирус, и мы предположили, что ингибирующий эффект может быть обусловлен (по крайней мере частично) образованием стерильных вирусных частиц. В свете современных данных о репликации вирусов весьма маловероятпо, чтобы такой процесс лежал в основе ингибирования. Более вероятно, что аналог препятствует функционированию репликативной формы вирусной РНК или влияет па эффективность матричной функции вирусной РНК, однако пока этот вопрос не исследован.[ . ] Общий механизм, описанный выше, гораздо труднее согласовать с тем, что нам известно о вирусах, содержащих РНК. Их репликация осуществляется за счет Р Н К - з а в и с и м о г о синтеза РНК. Существование такого процесса в нормальных клетках пока не известно. Однако в препаратах ДНК-зави-симой РНК-полимеразы из Micrococcus lysodeikticus [1258] и из Azoiobacler vinelandii [1021] выявлена активность РНК-зависимой РНК-полимеразы, причем в этой системе актиномицин D не влиял на синтез РНК. Возможно, РНК-содержащие вирусы образовались из фрагментов информационной РНК клетки-хозяина, которые каким-то образом приобрели капсидный белок и способность к специфической саморепликации.[ . ] Работа с этими аналогами была начата еще до того, как появилась какая-либо возможность прошшиуть в глубь процесса репликации вируса. Трудно было представить, каким образом можно заблокировать синтез вирусной РНК, не вызвав повреждения клетки вследствие нарушения синтеза клеточных РНК. Однако теперь известно, что вирусные РНК реплицируются на РНК-матрице. Данных о том, что такой РНК-зависимый синтез РНК происходит в пезаражепной клетке, не имеется. Таким образом, по крайней мере в принципе возможно блокировать синтез вирусной РНК, не влияя на синтез клеточных РНК.[ . ] Мозаичное заболевание листьев китайской капусты, инфицированной ВЖМТ, обычно развивается при участии серии штаммов этого вируса. Мы предложили следующие гипотезы, объясняющие природу этого мозаичного заболевания [347]: 1) инфекционный вирус передвигается из ипокулирован-ного листа к зопе делящихся клеток, расположенных ниже апикальной меристемы. С помощью тестов на инфекционность было установлено, что частицы ВЖМТ присутствуют в этой зоне у системно инфицированных растений (Фаэд и Мэтьюз, неопубликованные данные); 2) вирус мутирует с образованием штаммов, оказывающих различное действие на хлоропласта клеток инфицированных растений. В полученном нами изоляте ВЖМТ мы наблюдали различные штаммы вируса, причем все попытки получить препарат, содержащий только один штамм повторным пассивированием через некроз, были безуспешны; 3) репликация первой молекулы РНК, инфицирующей данную клетку, предотвращает репродукцию других штаммов в этой клетке. При делении первой инфицированной клетки исходный штамм вируса передается дочерним клеткам, и таким образом формируется клон клеток, содержащих только один штамм вируса. Клоны образовавшихся при этом клеток дают начало островкам ткани, которые видны невооруженным глазом, а также слоям клеток, обнаруживаемым с помощью микроскопа в участках с уже развившимися симптомами мозаичного заболевания. Результаты наблюдений за развитием этого заболевания и окончательным распределением клеток, инфицированных различными штаммами вируса, свидетельствуют в пользу предположения о том, что отдельные островки ткани, наблюдаемые в инфицированных ВЖМТ листьях, представляют собой клоны клеток, происшедших от одной клетки или довольно небольшой группы клеток, зараженных каким-то одним вирусным штаммом на ранней стадии онтогенеза листа.[ . ] Подводя итоги, можно сказать, что самые различные факты, такие, как сохранение инфекционное™ после линьки, наличие латентного периода, способность к заражению в течение длительного срока и присутствие вируса в гемолимфе и клетках тела насекомого, свидетельствуют о том, что многие циркулирующие вирусы размножаются в тлях-переносчиках. В настоящее время наиболее убедительные данные получены для вирусов некротического пожелтения салата-латука, пожелтения жилок осота и скручивания листьев картофеля. Остается, однако, точно установить фат’ размножения вируса в переносчике. Для некоторых вирусов возможно получить биохимические доказательства репликации вируса в организме тли; для этого можно было бы инфицировать тлей, затем подкармливать их па здоровом растительном материале, меченном 32Р, и попытаться выделить из них меченый вирус или меченую двухцепочечпуго вирусную РНК.[ . ] Такое распределение генетического материала между несколькими компонентами должно иметь какое-то преимущество для выживания. Вероятнее всего, преимущество подобной многокомпонентной системы заключается в ее большей генетической гибкости по сравнению с вирусами, у которых весь генетический материал заключен в одном фрагменте. Известно, что у некоторых РНК-содержащих вирусов животных, в частности у реовиру-сов (гл. Многокомпонентные вирусы растений можно рассматривать как своего рода морфологический вариант такой системы, т. е. системы, в которой генетический материал разделен на несколько фрагментов. У вирусов, для которых характерно присутствие нескольких фрагментов РНК в одной частице, вероятно, происходит перераспределение генетического материала в процессе репликации. Кроме того, у таких вирусов возможны отбор и перераспределение генетического материала также па других стадиях жизненного цикла, например при передаче вируса, его проникновении в клетку и в процессе перемещения по растению.[ . ] Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|

