Бетадин вирус папилломы человека

Сейчас часто начали диагностировать у пациентов вирус папилломы человека (ВПЧ) и после этого стал возникать извечный вопрос, что делать?
Для начала, хотелось бы немного рассказать о нем: определение вируса папилломы человека.
Если обобщить, то ВПЧ – инфекция может находиться в следующих формах:
Как проявляется ВПЧ – инфекция?
Основным симптомом инфекции вызванной вирусом папилломы человека является образование так называемых остроконечных кондилом.
Внешне остроконечные кондиломы похожи на обычные бородавки. Они могут иметь небольшие размеры (от нескольких миллиметров до сантиметра), розоватую или телесного цвета окраску, гладкую или слегка бугристую поверхность.
Чаще всего остроконечные кондиломы образуются в области наружных половых органов.
У женщин остроконечные кондиломы могут возникать вблизи клитора, на малых и больших половых губах, во влагалище и на шейке матки. В случае раздражения кондилом, располагающихся близко к входу во влагалище, возможно появление зуда и незначительного кровотечения во время полового акта.
У мужчин остроконечные кондиломы образуются на половом члене и мошонке.
Как правило, остроконечные кондиломы безболезненны. В некоторых случаях в области кондилом ощущается легкий зуд и дискомфорт.
Когда нужно обратиться к врачу?
Обязательно обратитесь к врачу, если вы заметили у себя на коже образования (бородавки, выросты) похожие на остроконечные кондиломы. Врач назначит вам необходимые обследования, которые помогут установить точную причину болезни и исключить другие заболевания, передающиеся половым путем.
Диагностика ВПЧ?
Для подтверждения диагноза папилломавирусной инфекции используется метод ПЦР (полимеразной цепной реакции), который позволяет определить ДНК вируса и точно установить, каким типом вируса заражен человек.
В современных диагностических лабораториях определяется тип вируса, его количество (вирусная нагрузка) и интеграция вируса в геном. В начале статьи приведена информация, которая показывает, что наиболее опасны ВПЧ высокого онкогенного риска (ВОР). Имеет значение кроме типа вируса, определение и его количества. От этого зависит тактика лечения. Интеграция вируса в геном клетки, к сожалению, в наших лабораториях не определяется. Этот анализ важен в ранней диагностике дисплазии эпителия шейки матки и неинвазивной карциномы.
Очень важно, чтобы все поняли, даже если ПЦР анализ выявит у вас онкогенные формы ВПЧ, это не означает, что у вас уже есть рак шейки матки или что вы неминуемо заболеете им в ближайшее время, так как, далеко не во всех случаях ВПЧ приводит к развитию рака. От момента заражения до появления предрака могут пройти годы.
Для того чтобы определить вызвал ли ВПЧ изменение клеток шейки матки и есть ли риск развития рака нужно обязательно пройти тщательное гинекологическое обследование, которое включает в себя обязательно :
- Кольпоскопию (осмотр шейки матки аппаратом, напоминающим микроскоп и позволяющий осматривать под увеличением от 8 до 20 крат).
- Цитологический мазок (ПАП тест), который используется для определения диспластических изменений в клетках шейки матки.
- Бактериоскопическое исследование выделений из влагалища. Часто ВПЧ-инфекция сочетается с другими инфекциями передающимися половым путем (примерно в 20% случаев), поэтому может быть необходимо дополнительное дообследование для определения хламидиоза, микоплазмоза, уреаплазмоза и трихомониаза.
- Прицельная биопсия – взятие кусочка ткани шейки матки в случаи наличия дисплазии или подозрения на злокачественную опухоль шейки матки.
Лечение ВПЧ
Поскольку полного излечения от папилломавирусной инфекции в настоящее время достичь невозможно (наряду с этим часто наблюдается спонтанное, самопроизвольное излечение), лечат проявления ВПЧ, а не присутствие вируса в организме. При этом эффективность различных методов лечения составляет 50-70 %, а в четверти случаев заболевание вновь проявляет себя уже спустя несколько месяцев после окончания лечения. Вопрос о целесообразности лечения каждой пациентки решается врачом индивидуально. При этом необходимо избегать факторов, снижающих иммунитет (переохлаждение, сильные эмоциональные стрессы, хроническое переутомление, авитаминоз). Существуют исследования, которые говорят о профилактическом эффекте ретиноидов (бета-каротин и витамин А), витамина С и микроэлементов, таких как фолаты, в отношении заболеваний, вызванных ВПЧ.
Среди методов лечения проявлений ВПЧ инфекции (остроконечных кондилом и папиллом) чаще всего используются:
- Деструктивные методы - это местное лечение, направленное на удаление кондилом. Различают физические (криодеструкция, лазеротерапия, диатермокоагуляция, электрохирургическое иссечение) и химические (трихлоруксусная кислота, ферезол, солкодерм) деструктивные методы, а также хирургическое удаление кондилом. Цитотоксические препараты - подофиллин, подофиллотоксин (кондилин), 5-фторурацил. Женщинам детородного возраста на время лечения рекомендуют надежную контрацепцию или отказ от половой жизни.
- Имунологические методы Наиболее часто для лечения ВПЧ-инфекции используются интерфероны (лаферон, лаферобион, альфарекин, реаферон, виферон). Они представляют собой семейство белков, которые вырабатываются клетками иммунной системы в ответ на стимуляцию вирусами. Отдельно стоит препарат Алокин-альфа, который стимулирует выработку собственного интерферона и активирует клеточный иммунитет.
- Специфические противовирусные препараты (цидофовир, панавир, алпиразин). Известный противовирусный препарат ацикловир (зовиракс) не оказывает действие на ВПЧ. Из местных (влагалищных) препаратов противовирусным действием обладает Эпиген интим спрей и Бетадин.
Профилактика ВПЧ
Может быть неспецифическая и специфическая.
Неспецифическая включает предотвращение заражения ВПЧ половым путем, здоровый образ жизни с целью укрепления работы иммунной системы и сбалансированное питание включающее в себя бета-каротин, витамин А, витамина С и фолиевую кислоту.
Специфическая профилактика – вакцинация.
Вакцины для профилактики ВПЧ содержат органические вещества, структура которых похожа на структуру живых вирусов ВПЧ. Эти вещества ни в коем случае не могут вызвать болезнь.
После введения вакцины в организме человека начинают вырабатываться клетки иммунной системы, которые препятствуют внедрению ВПЧ в организм.
В настоящее время существует два типа вакцин против ВПЧ: квадривалентная Гардасил (Gardasil) и бивалентная Церварикс (Cervarix).
Церварикс предотвращает заражения ВПЧ 16 и 18, которые вызывают 70% всех случаев рака шейки матки и рака заднего прохода.
Гардасил, кроме защиты от ВПЧ 16 и 18 типов, предоставляет защиту ещё и от ВПЧ 6 и 11 типов, вызывающих 90% случаев бородавок на половых органах.
Гардасил и Церварикс защищают от заражения людей, которые еще не заражены ВПЧ соответствующего типа. Они не могут устранить вирус из организма человека, если он уже проник в него и не могут вылечить болезни (например, остроконечные кондиломы или дисплазию шейки матки) которые вирус уже успел спровоцировать. Именно по этой причине, прививки против ВПЧ рекомендуется делать в детском и подростковом возрасте, до начала половой жизни.
Таким образом, вакцина Гардасил защищает от заражения ВПЧ 6, 11, 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки, рака влагалища и наружных половых органов у женщин, а также для профилактики рака заднего прохода и остроконечных кондилом у мужчин и женщин. Вакцина Церварикс защищает от заражения ВПЧ 16 и 18 типов и рекомендуется для профилактики рака и дисплазии шейки матки у женщин и рака заднего прохода у мужчин и женщин.
По состоянию на 2013 год вакцины зарегистрирована более, чем в 125 странах мира, почти в 20 странах входят в национальные календари прививок, в мире распространено 111 миллионов доз препарата.

Во времена мрачного Средневековья суровые рыцари, отправляясь в многолетние походы, не находили ничего лучшего, как надевать на своих прекрасных дам металлический пояс верности, запирать его на замок, а ключ вешать себе на шею, чтобы быть уверенным в том, что без их дозволения ничего не произойдет. Если вдуматься, крайне полезное изобретение, чтобы уберечь себя и даму от вероятных инфекций и прочих неприятностей. Прекрасные дамы наверняка знали, каким образом выходить из сложного положения, однако до нас сведения об этом не дошли – вероятно, для того, чтобы мужчины по-прежнему чувствовали себя хозяевами положения.
Прошло много веков, и можно с уверенностью сказать, что металлические оковы на чресла окончательно вышли из моды. Однако вероятность получить какую-нибудь вагинальную инфекцию посредством интимных отношений преследует каждую молодую женщину. Что делать – при всем ее доверии к партнеру обилие бактериальных и вирусных инфекций делает возможным заражение инфекционным вагинитом в любую минуту. Кроме того, крайне живучим оказывается вирус папилломы человека, который, как доказали ученые, часто приводит к раку шейки матки. Опасность вагинальных инфекций заключается в том, что проходят они в большинстве случаев достаточно незаметно – без резких болей, повышения температуры и других неприятных симптомов, которые заставляют нас обращаться к врачу. Однако их последствия бывают весьма неприятными – воспаления органов малого таза, мочевого пузыря, внутренних половых органов, что в конце концов пагубно скажется на здоровье женщины.
А бактериальный вагиноз может стать серьезной причиной на пути у запланированного счастья материнства, и об этом тоже не следует забывать. Как же защитить себя от коварных инфекций и вирусов? Ну, разумеется, не надевая никаких средневековых украшений! Прелесть нашей жизни в том, что в любой момент с нами может случиться самое прекрасное на свете – любовь, и кого из нас в этот момент остановят гипотетические инфекции?

Вооружаться будем новым препаратом Бетадином, который является мощным антисептиком, способным в рекордные сроки сокрушить все возможные вирусы и бактерии, вплоть до грозного вируса папилломы человека, вызывающего рак шейки матки, и герпетической инфекции. Вагинальные свечи содержат в себе микродозы йода, которые гарантированно устраняет возбудителей инфекции.
Механизм действия Бетадина достаточно прост – йод вступает в контакт с белками бактериальной стенки и образует йодамины, которые нарушают жизнедеятельность бактерий, вирусов, грибковых инфекций, обрекая их на быструю погибель. Учеными доказано, что йод – сильнейший окислитель, и действие Бетадина основано именно на этой его особенности. Благодаря неглубокому проникновению в ткани слизистой оболочки, препарат создает условия для восстановления кислой среды, в который живут верные защитники женского здоровья – лактобациллы. Они развиваются только в кислой среде, которая неизбежно меняется в тот момент, когда в ней начинают хозяйничать враждебные вирусы и бактерии.
Бетадин создает оптимальные условия для восстановления микрофлоры, нормализуя кислотность вагинальной среды, и в этом принципиальное отличие этого препарата от других, применяемых в гинекологии, лекарственных средств. Применять его можно как профилактическое и лечебное средство против всех вирусных и бактериальных заболеваний, передающихся половым путем, поскольку препарат обладает и противовирусным эффектом, и бактерицидным действием.
Верный союзник Бетадин уверенно стоит на страже женского здоровья, словно храбрый рыцарь, и не пропустит ни бактерий, ни вирусов, которые могли бы огорчить его прекрасную даму.
Группа вирусов ВПЧ входит в семейство папилломавирусов, которое включает 5 родов, порядка 43 разновидностей и почти 170 типов, именно ВПЧ является причиной образования бородавок. Существует его прямая взаимосвязь связь с раком шейки матки: в 92% случаев заболевания раком обнаруживается этот вирус.

Основные направления в исследовании — это определение вирусной нагрузки, то есть количественный показатель и определение типа вируса методом ПЦР.
По сути, папиллома — это доброкачественная опухоль, но она таит в себе и опасности. Во-первых, возможно повреждение ее целостности, приводящее к формированию рубцов, редко к заражению крови. Не рекомендуется удалять механически папилломы самостоятельно, это может привести к генерализации процесса и распространению папиллом по всему телу. Самая главная опасность папиллом заключается в том, что они вирусные. Большинство видов ВПЧ не представляют угрозу для здоровья и жизни человека, но ВПЧ 16 и 18 типа могут спровоцировать развитие злокачественных образований. Доброкачественные папилломы, как правило, доставляют много неприятностей человеку. Они могут увеличиваться до больших размеров, могут образовываться в области половых органов. Некоторые виды ВПЧ вызывают предраковые заболевания.
ВПЧ может передаваться различными путями. При контактно-бытовом способе передачи вирус через кожу при рукопожатиях и использовании средств личной гигиены, после примерки чужой одежды и нижнего белья, при посещении общественных бассейнов и саун. Особо опасным считается половой путь передачи вируса, так как при этом существует высокий риск заражения ВПЧ онкогенного типа. Вероятность передачи вируса половым путем намного выше, если у партнера есть остроконечные кондиломы. ВПЧ может передаваться от матери к ребенку во время родов, крайне редко это происходит во время беременности. При этом чаще всего у детей развивается папилломатоз гортани, опасный серьезными нарушениями дыхательной функции. Возможно заражение ребенка от матери при кормлении грудью.

Медикаментозное лечение вируса проводится с помощью лекарственных препаратов, которые воздействуют на причину заболевания, а также восстанавливают функцию иммунной системы. Существуют различные схемы внутривенного введения лекарств, врачи, как правило, назначают лечение индивидуально, стандартных схем нет. Какие препараты обычно назначают? Циклоферон, Интерферон альфа, Панавир, Ингарон. Таблетированные формы противовирусных препаратов: Изопринозин, Ликопид, Лавомакс, Алпизарин. Свечи: Генферон, Бетадин, Виферон. Мази: Оксолиновая мазь, San Fen Zhong мазь, Стефалин, Салициловая мазь. Витамины: Аевит, Алфавит.
Полностью избавиться от ВПЧ при современном уровне фармацевтической промышленности еще невозможно, но можно предупредить заражение инфекцией и для этого проводится вакцинация таким препаратом, как Гардасил. В некоторых странах эти прививки уже являются обязательными, в России сделать вакцинацию можно добровольно. При выборе такого способа профилактики ВПЧ необходимо пройти предварительное обследование на определение наличия вируса в организме. В состав вакцин входят синтетически модифицированные белки, сходные со структурой вируса. Введение в организм этих белков активизирует работу иммунной системы и приводит к выработке антител, защищающих от развития ВПЧ после проникновения возбудителя в организм. Разработчики вакцины советуют ставить препарат девочкам и мальчикам от 10 до 12 лет. Связано это с тем, что в этом возрасте половых контактов в подавляющем большинстве случаев нет, а иммунная система работает в полную силу, что способствует хорошей ответной реакции на препарат.
Самым опасным типом ВПЧ, вызывающий злокачественные образования считаются следующие: ВПЧ-16; ВПЧ-18; ВПЧ-31, 33, 45, 56, 58; ВПЧ-51, 59, 68; ВПЧ-35, 39, 52.
Наиболее часто рак шейки матки вызывается вирусом папилломы человека 16 и 18 типов, они же вызывают рак половых органов. ВПЧ 16 в 50% случае является причиной рака гортани.
ВПЧ передается половым путем, и при этом сами половые контакты становятся основной причиной заражения папиллома вирусом. Расскажем об этом подробнее.
Папилломы, расположенные на половом члене являются признаком папилломавирусной инфекции, следственно заражение половым путем вполне логично. Инкубационный период при ВПЧ длится от 1 до 12 месяцев. При этом сами папилломы могут совсем не вырастать, и только при снижении функции иммунной системы может произойти начало их образования. Поэтому обнаружение ВПЧ в организме на ранних стадиях развития заболевания возможно исключительно с помощью специальных анализов. В настоящее время, ВПЧ является одним из самых распространенных заболеваний и риск заражения партнера при незащищенном половом акте является практически 100%.
Все разновидности ВПЧ по степени риска возникновения злокачественного перерождения можно разделить на следующие: низкой степени риска, средней степени риска и высокой степени онкогенного (канцерогенного) риска.
Остроконечные кондиломы в области гениталий, как правило, не вызываются вирусом с высокой степень онкогенности. Плоскоклеточные папилломы являются злокачественными новообразованиями. Пациенты, у которых диагностируются плоскоклеточные папилломы находятся в группе повышенного риска и требуют незамедлительного лечения.
Если у пациента обнаружен ВПЧ онкогенной группы, для профилактики появления онкологических процессов в организме необходимо уделять внимание иммунной системе, регулярно сдавать анализы и наблюдаться у врача.

Если в организме женщины обнаружен ВПЧ, но при этом нет внешних проявлений в виде образования папиллом, то рожать можно спокойно и не волноваться. Если есть остроконечные кондиломы в области гениталий, то существует очень высокий риск заражения ребенка ВПЧ во время прохождения по родовым путям. Первый самостоятельный вдох ребенка может произойти прямо в родовых путях, вирус попав в горло малыша приводит к разрастанию папиллом на его голосовых складках. Поэтому при наличии генитальных папиллом и активной формы ВПЧ показано кесарево сечение.
По статистическим данным, в 85 % случаев ВПЧ после заражения устраняется организмом самостоятельно, благодаря хорошей работе иммунной системы. Этот процесс может длиться от нескольких месяцев до нескольких лет. Иногда пребывание вируса в организме человека можно не обнаружить даже при медицинском обследовании. Полностью подтвердить наличие ВПЧ можно при наличии образований на коже — папиллом.
- Избегать кожных повреждений и своевременно их лечить, так как даже микроскопические повреждения — это отличные возможности для инфекции попасть в организм.
- Поддерживайте чистоту тела и соблюдайте личную гигиену.
- Поддерживайте свою иммунную систему на должном уровне, регулярно принимайте витамины.
- Все препараты, направленные на повышение функции иммунной системы, необходимо принимать только по назначению врача.
- Если у вас на теле есть папилломы — обратитесь к врачу и удалите их.
Удалить папиллому можно медикаментозно. Но наиболее эффективным методом принято считать хирургическую методику, лазерную хирургию и электрохирургическое удаление. Обычный хирургический метод удаления применяется не часто, после него часто возникают рецидивы возникновения образований. Удаление с помощью лазера считается самым лучшим в мире, при этом удаление безболезненно и безопасно, не оставляет после себя шрамов и рубцов. Радиохирургическое удаление производят под местной анестезией, результат достаточно хороший и стойкий. 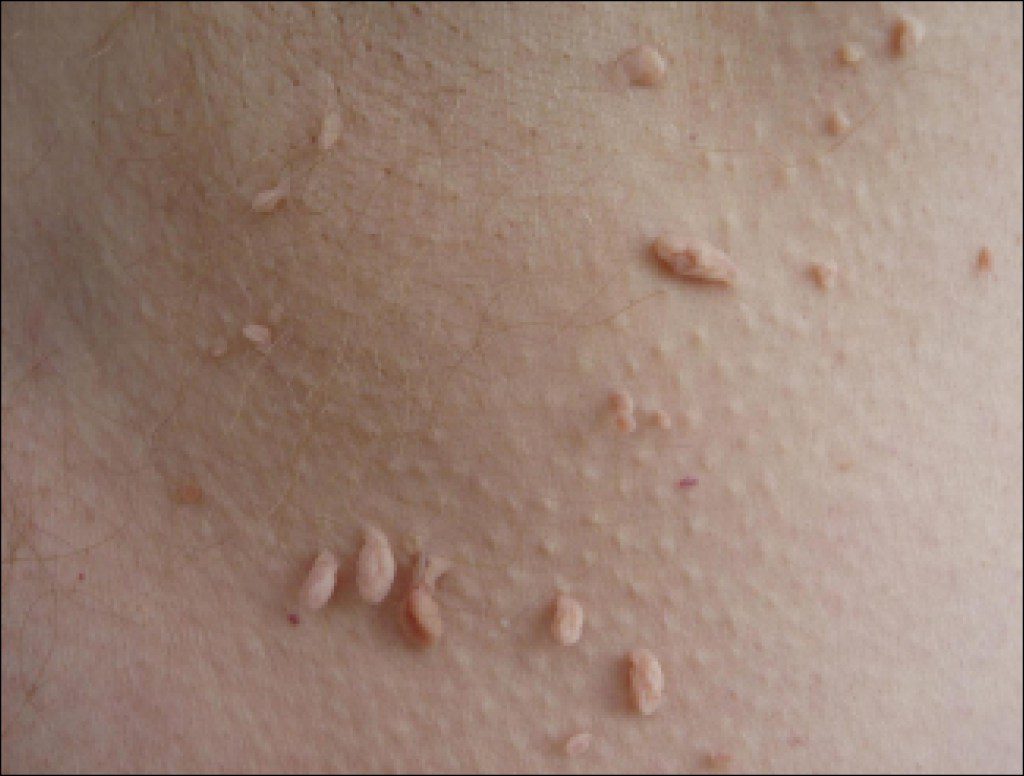
Чаще всего папилломы локализуются в области подмышек и в паху, рядом с половыми органами. Нередко образования встречаются под молочными железами, на шее, веках.
Папилломатоз гортани — весьма тяжёлое заболевание, при котором нарушается голосообразование и дыхательная функция. В детском возрасте распознают симптомы заболевания в возрасте от одного до пяти лет. Если вы отмечаете хриплый голос у ребенка, кашель, затруднение дыхания или ощущение кома в горле, необходимо сразу показать его врачу.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Новосибирская государственная медицинская академия, Новосибирск,
Городская клиническая больница № 34, Новосибирск
О дним из наиболее часто встречающихся заболеваний, передающихся половым путем, является папилломавирусная инфекция гениталий, возбудителем которой является вирус папилломы человека (ВПЧ) [1,2]. Вопросам диагностики и лечения данной патологии посвящено много публикаций, в которых отмечена высокая контагиозность, тенденция к росту частоты встречаемости ВПЧ и способность инициировать злокачественные процессы нижних отделов половых путей женщины [3]. Несмотря на множество предложенных локальных методов лечения, остается высокой частота рецидивирования патологического процесса, что диктует необходимость поиска лекарственных средств, повышающих эффективность лечения [4]. Наиболее типичные проявления папилломавирусной инфекции делятся на экзофитные, к которым относятся остроконечные кондиломы, и эндофитные, к которым относятся плоские, инвертирующие кондиломы. Генитальные кондиломы располагаются на слизистой малых половых губ, влагалища, шейки матки, устья уретры [5]. Пациентки с данной патологией входят в группу риска по возникновению осложнений течения беременности, родов, пороков развития плода и плаценты, осложнений после малых гинекологических операций [6].
Биологически активное вещество препарата – поливинилпирролидон йода, свободный йод которого вступает в реакцию с –SH и –OH группами аминокислот (окислительное повреждение), что изменяет структуру белков вирусов, грибов, цитоплазматических мембран бактерий [7].
Целью настоящей работы явилось изучение эффективности Бетадина в комплексном лечении папилломавирусного поражения слизистой влагалища и шейки матки.
Материал и методы исследования
Вирус папилломы человека, попадая в организм женщины, не всегда сразу приводит к развитию заболевания, – это происходит при наличии предрасполагающих факторов. Определенные трудности в диагностике вызывает возможность спонтанной регрессии или рецидивирования клинических признаков, что связано с особенностями микро- и макроорганизма.
Среди жалоб при папилломавирусной инфекции жжение встречалось в 81,5% случаев, зуд – в 66,7%, бели – в 92,6% случаев. При микробиологическом обследовании моноинфекция наблюдалась в 3 случаях (11,1%), в большинстве же случаев была диагностирована смешанная бактериально–вирусная инфекция: ВПЧ в сочетании с Mobiluncus spp. (18,5%), в сочетании с Bacteroides spp. (33,3%), в сочетании с Gardnerella vaginalis (37,1%).
Критериями излеченности являлись отсутствие клинических проявлений, нормализация кольпоскопической картины и количества лейкоцитов в мазках по Граму, отсутствие признаков папилломавирусной инфекции в цитологических мазках, отрицательные анализы ДНК–ПЦР на ВПЧ. На основании анализа клинических данных установлено, что уменьшение жжения, зуда, количества белей к 5–м суткам отмечалось в первой группе у 73,3% пациенток, во второй группе у 41,7% пациенток. К 7–м суткам лечения отмечалось отсутствие клинических симптомов у всех пациенток первой группы и у 66,7% пациенток второй группы. При кольпоскопии в динамике отмечена нормализация кольпоскопической картины к 7,3±1,9–м суткам у пациентов первой группы и к 10,1±2,0–м суткам у пациенток второй группы, причем к 5–м суткам у 41,6% пациенток второй группы было констатировано присоединение бактериальной инфекции (появление гнойного налета на дефектах слизистой), чего не наблюдалось у пациенток первой группы. Динамическое снижение количества лейкоцитов в мазках по Граму происходило к 6–м суткам у 66,7% пациенток первой группы и у 33,3% пациенток второй группы, а нормализация количества лейкоцитов к 8–м суткам лечения у всех пациенток первой группы и у 58,3% пациенток второй группы. Косвенные признаки папилломавирусной патологии цитологически в первой группе исчезали к 8,2±1,6–м суткам (р Литература:
1. Прилепская В.Н. Заболевания шейки матки. – М., 2000. – 435 с.
2. Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. – М., 1995. – 317 с.
3. Краснопольский В.И., Радзинский В.Е., Буянова С.Н., Манухин И.Б., Кондриков Н.И. Патология влагалища и шейки матки. М.: Медицина, 1997. – 128с.
4. Anderson M.C. et al. Intergrated Colposcopy, Chapman & hall Medicak. 1996.II.
5. Berhard C., Mougin C., Lab M. New approaches to the patjgenesis of human papilloma induced anogenital lesion. The role of co–factors and coinfection // J. Eur. Acad. Dermatol. Venereol.–1994.–№ 3.–Р.237–250.
6. Cirelli R., Tyring S.K. Interferons in human papillomavirus infections // Antiviral.Res.–1994.–№ 24 (2–3).–Рю191–204.
Galloway D.A. Human papillomavirus vaccines: a warty problem // Infect. Agents Dis.–1994.–№ 3 (4).–Р.187–193.
7. Kawana R. et al.: Inactivation of human viruses by polividone–iodine in comparison with other antiseptics. Dermatology 1997; 195 Suppl 2:29–35.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Ключевые слова: рак шейки матки, папилломавирусная инфекция, противовирусный эффект, повидон-йод, Бетадин.
Для цитирования: Дубровина С.О., Красильникова Л.В., Ардинцева О.А. и др. Влияние повидон-йода на эрадикацию высокоонкогенных типов ВПЧ у женщин с поражением шейки матки. РМЖ. Мать и дитя. 2018;2:156-161. DOI: 10.32364/2618-8430-2018-1-2-156-161.
The article discusses the actual problem associated with human papillomavirus (HPV) of diseases of the uterine cervix in the reproductive age. Cervical cancer (CC) is the third most common gynecological cancer. At the present, there is a tendency to its rejuvenation. Each year, about 500,000 new cases of cervical cancer are detected worldwide, 90% of which occurs in developing countries. According to the WHO, in 2015 in Russia, 16710 new cases of cervical cancer were registered. 6,628 patients died from the progression of the malignant process of this localization in 2015. The incidence rate in 2015 was 15.1 per 100 thousand population. More than 100 HPV genotypes have been identified in the female reproductive tract. 13 types of HPV are recognized as high oncogenic (13HR), causing cancer. Considering the increase in the incidence of CC, options for management of patients with papilloma viral infection are observed. An analysis of the effectiveness of povidone-iodine in the comprehensive treatment of papilloma viral lesions of the mucous membrane of the vagina and uterine cervix was carried out. Povidone-iodine, widely used in clinical practice as an antiseptic, has been shown to have cytotoxic effects. Besides, povidone-iodine significantly suppresses cell proliferation at a low concentration corresponding to 20 μM I2. Experiments with fresh samples of human blood have shown that the antiproliferative activity of povidone-iodine is preserved in a high degree of blood plasma. These data indicate that povidone-iodine can be a potent agent for use in the development of anti-tumor tactics.
Key words: cervical cancer, papilloma viral infection, antiviral effect, povidone-iodine, Betadine.
For citation: Dubovina S.O., Krasilnikova L.V., Ardintseva O.A. et al. Povidone-iodine effect on the eradication of highly oncogenic HPV types in women with lesions in the uterine cervix. Russian Journal of Woman and Child Health. 2018;1(2):156–161.
В статье обсуждается проблема ассоциированных с вирусом папилломы человека заболеваний шейки матки в репродуктивном возрасте. Рассмотрено влияние повидон-йода на эрадикацию высокоонкогенных типов ВПЧ.
На сегодняшний день в женском репродуктивном тракте идентифицировано более 100 генотипов ВПЧ. 13 типов ВПЧ (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68) признаны высокоонкогенными (13HR), вызывающими рак. Тем не менее другие типы ВПЧ также могут быть связаны с развитием рака. По данным N. Munoz, два дополнительных типа ВПЧ — 73 и 82 — следует считать канцерогенными. G. Halec et al. на основании систематического обзора продемонстрировали, что 26, 53, 66, 67, 68, 70, 73 и 82 типы ВПЧ могут быть онкогенными [7]. Одна из наиболее важных проблем заключается в том, что диагностика на основе полимеразной цепной реакции (ПЦР), используемая в эпидемиологических исследованиях, имеет ограничения. Во-первых, метод ПЦР обнаруживает не только высокоонкогенные, но и другие типы ВПЧ. Во-вторых, некоторые ПЦР-тесты с использованием консенсусных праймеров показали несогласованные результаты в определении типов ВПЧ, т. к. чувствительность детекции у некоторых типов ВПЧ ниже, чем у других. Типы ВПЧ с низким риском, такие как 6, 11, 40, 42, 43, 44 и 54, связаны с генитальными бородавками и аногенитальными поражениями низкого уровня риска [8]. ВПЧ 16 и 18 типов с высоким риском вместе составляют порядка 70% случаев РШМ, в то время как ВПЧ 6 и 11 типов с низким риском ответственны за 90% генитальных бородавок [9].
Иммунная система играет важную роль в контроле развития рака. Геном ВПЧ кодирует два онкопротеина — Е6 и Е7, способные инактивировать белки р53, и ретинобластомы (pRB) — регуляторы пролиферативной активности клеток. Они необходимы для возникновения и поддержания злокачественного клеточного фенотипа [10]. Адаптивный иммунный ответ защищает от ВПЧ-индуцированных заболеваний [11]. Прогрессирование заболеваний, вызванных ВПЧ, связано с отсутствием сильного ВПЧ-специфического ответа CD4+ и CD8+ Т-клеток. Химиотерапия или лучевая терапия влияет на иммунную регуляторную активность и в сочетании с вакцинацией потенцирует эффективный локальный ВПЧ-специфический Т-клеточный иммунитет в опухолевых моделях мышей. Успешное лечение ВПЧ-индуцированных поражений может быть достигнуто с помощью низкодозированного циклофосфамида, изменяющего местный иммунитет. С учетом важности локального микроокружения в персистенции ВПЧ-индуцированных поражений и опухолей эффективными могут быть методы лечения, способные на местном уровне сместить баланс иммуноэффекторов, таких как ингибиторы циклооксигеназы-2, за счет продукции простагландина Е2 и трансформирующего фактора роста β [12].
В карциноме вульвы выделяют два отдельных канцерогенных пути, один из которых связан с ВПЧ 16 типа. Это четвертый по распространенности инвазивный гинекологический рак, который поражает в основном пожилых женщин и чаще встречается в западных странах [13]. Прогностические факторы течения заболевания включают наличие или отсутствие метастазов в лимфатических узлах, а также размер опухоли и ее рецидивы. Рецидив (гематогенные метастазы) отмечается у 40% пациенток. Прогностическая роль ВПЧ при раке вульвы обсуждается, некоторые исследования показали лучшую выживаемость женщин с ВПЧ-положительными опухолями вульвы, другие — нет [14].
Важным вопросом остается организация скрининговых программ. Такие программы эффективно проводятся в Новой Зеландии. В национальных рекомендациях по программе скрининга РШМ принято всем женщинам в возрасте от 20 до 69 лет, которые когда-либо имели половой акт, назначать цитологический мазок шейки матки в течение 3 лет. Если это первичный скрининговый мазок или с момента предыдущего исследования прошло более 5 лет, рекомендуется второй мазок повторить через год после первого, а затем через 3 года. После введения данной скрининговой программы значительно снизилась заболеваемость РШМ, составляющая в настоящее время 5,4 на 100 тыс. женщин [15]. Помимо этого, в Новой Зеландии было выполнено масштабное исследование по распределению генотипов ВПЧ в образцах шейки матки. Материал был собран у женщин, имеющих высокоонкогенные типы ВПЧ (в 2009–2011 гг.) или страдающих инвазивным РШМ (в 2004–2010 гг.). Наиболее распространенными типами ВПЧ, вызывающими неоплазии шейки матки (цервикальная интраэпителиальная неоплазия — CIN 2 и 3), были типы ВПЧ 16 (51%), 52 (19%), 31 (17%),
33 (13%) и 18 (12%). При этом наблюдалась тенденция к увеличению показателей инфицирования ВПЧ типов 16 и 18 по сравнению с другими генотипами ВПЧ у женщин в возрасте 20–29 лет. Наиболее распространенными генотипами ВПЧ, связанными с инвазивным РШМ, явились ВПЧ 16 (51%), 18 (21%), 31 (4%), 45 (3%) и 52 (3%) [16]. В 2008 г. в Новой Зеландии была внедрена Национальная программа иммунизации женщин четырехвалентной вакциной против ВПЧ (генотипы 6, 11, 16, 18).
Позже, в 2013–2016 гг., выполнено исследование, показавшее снижение доли цервикальной интраэпителиальной неоплазии (CIN 2), связанной с HPV 16/18, в когорте молодых новозеландских женщин, что может быть связано с внедрением национальной программы вакцинации против ВПЧ. Это исследование имело важное значение, поскольку это первые документированные данные об изменении генотипа ВПЧ у женщин с поражениями шейки матки после начала программы вакцинации [17].
ВПЧ 16 типа является наиболее распространенным во всем мире генотипом, выявленным у пациенток с инвазивным РШМ, за ним следует ВПЧ 18 типа. Восемь генотипов ВПЧ (16, 18, 31, 33, 35, 45, 52 и 58) приводят к более высоким уровням прогрессирования РШМ [18]. В клинических рекомендациях Японского общества акушерства и гинекологии и Японской ассоциации акушеров и гинекологов представлен алгоритм ведения пациенток с CIN, который включает генотипирование ВПЧ для определения степени риска прогрессирования в CIN 3 [19]. Однако связь между генотипом ВПЧ и прогнозом развития ракового процесса остается спорной. Одни исследования показали, что ВПЧ 18-позитивные опухоли связаны с плохим прогнозом [20]. Другие авторы утверждают, что китайские и британские пациентки с опухолями, ассоциированными с ВПЧ 16 и/или 18 типа, имеют лучшую выживаемость, в то время как в Тайване получены благоприятные результаты для ВПЧ 58- и 31-положительных опухолей [21]. Напротив, иные ученые не обнаружили ассоциаций между генотипом ВПЧ и прогнозом РШМ в популяциях русских и корейцев [22]. Цитологическое исследование шейки матки, выполненное в трех медицинских учреждениях Японии, продемонстрировало, что ВПЧ 18-положительные опухоли были связаны с плохой выживаемостью женщин. Более длительное наблюдение (102 мес.) подтвердило, что ВПЧ 16-положительные опухоли коррелируют с лучшей выживаемостью по сравнению с ВПЧ 18-положительными опухолями. Эти противоречивые результаты могут быть частично обусловлены географическими различиями в распространенности типа ВПЧ [23].
Понимание особенностей персистенции ПВИ в эпителии шейки матки и связанного с ней процесса развития заболеваний данной области определяет тактику терапии повреждений шейки матки, ассоциированных с ВПЧ. Методов лечения ВПЧ гениталий много, однако частота рецидивов этого заболевания высока. Поэтому весьма перспективным направлением является разработка комплексной терапии с целью профилактики рецидивирования ВПЧ-ассоциированных заболеваний шейки матки. Применение повидон-
йода (например, препарата Бетадин ® ) в комплексной терапии ПВИ повышает эффективность лечения, снижает частоту бактериальной инфекции, а также частоту рецидивирования ПВИ слизистой влагалища и шейки матки.
Только для зарегистрированных пользователей
Читайте также:


