Белок помогающий при гриппе
как отличить грипп от простуды и как пережить эпидемию
Опасность гриппа недооценивают. Между тем он является одним из самых серьезных и массовых заболеваний среди прочих вирусных инфекций. Сезонный грипп, по данным Всемирной организации здравоохранения, ежегодно вызывает от 3 млн до 5 млн случаев тяжелой болезни и приводит к 250-500 тыс. смертей.
Из всех случаев инфекционных заболеваний грипп и ОРВИ составляют 95%.
Врачи постоянно предупреждают об опасности гриппа и призывают россиян делать прививки. Благодаря увеличению охвата вакцинацией почти в полтора раза за последние пять лет в России удалось снизить заболеваемость более чем в три раза. Тем не менее многие россияне не видят большой разницы между гриппом и обычной простудой и не спешат прививаться от вируса.
Чем грипп отличается от ОРВИ и ОРЗ
Как объясняет главный эпидемиолог Минздрава России Николай Брико, простуда - это бытовое народное название всех недомоганий, связанных или с переохлаждением, или с заболеванием верхних дыхательных путей, включая вирусные инфекции.
В Международной классификации болезней (МКБ 10) понятия "простуда" нет. Грипп - инфекционное заболевание, которое вызывается вирусами.
Острые респираторные заболевания и острые респираторные вирусные инфекции
Температура до 37,5-38,5 °C
Слабость и сонливость
Грипп
Температура от 38,5 °C до 40 °C
Сильные головные боли
Резь в глазах (симптом ярко выражен)
Боли в горле (симптом ярко выражен)
Кашель (симптом ярко выражен)
Озноб (симптом ярко выражен)
Слабость и сонливость (симптом ярко выражен)
Иногда дискомфорт в животе, рвота, диарея
Чем опасен грипп
Несмотря на развитие науки, человечеству до сих пор не удается полностью победить грипп. Это связано с его способностью быстро эволюционировать.
ИНТЕРЕСНЫЙ ФАКТ
Правда ли, что за день вирус гриппа может измениться сильнее, чем человеческий геном за несколько миллионов лет?
Сравнивать скорость изменения вирусных и человеческих геномов напрямую некорректно: геном человека в миллионы раз больше (3 миллиарда "букв" у людей против 13 тысяч у вируса гриппа), а цикл размножения в десятки тысяч раз длиннее (25 лет у Homo sapiens против 6 часов у гриппа). При этом относительная скорость накопления мутаций у вируса гриппа как минимум в 100 раз выше, чем у человека.
На фото: штамм вируса гриппа под электронным микроскопом
Постоянно возникающие новые штаммы позволяют патогенам обходить защиту иммунной системы человека и обеспечивают устойчивость к лекарственным препаратам.
Высокая изменчивость вируса, способная вызвать болезнь у переболевших людей, способствует возникновению пандемий (глобальных эпидемий) гриппа. Считается, что с 1500 года человечество пережило минимум 15 пандемий.
Пандемии случаются, когда человеческий вирус гриппа получает фрагменты генома от вирусов, которые обычно размножаются в других видах, например в свиньях или птицах. Такие вирусы оказываются совершенно новыми для нашего иммунитета, поэтому болезнь распространяется среди огромного количества людей.
ИНТЕРЕСНЫЙ ФАКТ
Правда ли, что свиньи являются идеальными инкубаторами для выращивания новых штаммов гриппа, так как восприимчивы ко всем его разновидностям?
Действительно, свиньи восприимчивы к собственным вирусам гриппа, а также к вирусам людей и птиц. Благодаря такой "неразборчивости", вирусы, специфичные для всех этих живых существ, в организме свиней могут встретиться и "перемешаться", создав новую разновидность.
Помимо высокой скорости мутации, грипп опасен легкой передачей. Вирусом можно заразиться через предметы обихода и воздушно-капельным путем, например при разговоре или чихании.
Но основная угроза гриппа заключается в осложнениях. На его фоне часто развиваются пневмонии, поражения сердца и сосудов, а также заболевания нервной системы, например менингит. Особенно уязвимы маленькие дети, пожилые или хронически больные люди.
Сезонный грипп
Ежегодно фиксируются сезонные эпидемии гриппа. По словам эпидемиологов, в России это период с ноября по май.
Период между инфицированием и заболеванием (инкубационный период) длится около двух дней, но может доходить и до пяти. Тяжесть болезни зависит от общего состояния здоровья, возраста, от того, контактировал ли больной с данным типом вируса ранее.
ИНТЕРЕСНЫЙ ФАКТ
Правда ли, что в замороженном виде вирусы живут вечно?
Ответить на вопрос, может ли нечто сохраняться вечно, по понятным причинам невозможно. Но в холодной воде (около 4 °C) в лабораторных условиях вирусы гриппа сохраняют активность много месяцев, и теоретически их можно хранить в замороженном виде. Однако повторяющиеся циклы заморозки-разморозки, особенно в неоптимальных условиях вне лаборатории для вирусных частиц фатальны: в каждом таком цикле выживает не больше 10%.
Вакцинация - самая надежная защита
Основным и самым эффективным методом профилактики гриппа, по мнению врачей и эпидемиологов, является вакцинация. В организм вводят частицу инфекционного агента, которая стимулирует выработку антител, предотвращающих размножение вирусов.
Когда мы вводим живую вакцину - это как тренажер. Он позволяет иммунитету накачаться, как спарринг-партнер в боксе, который в ответ не ударит
- бывший главный санитарный врач Геннадий Онищенко
Прививка снижает риск заболеть на 70-80%. Как пояснил главный эпидемиолог Минздрава России Николай Брико, даже в случае заражения привитый человек перенесет заболевание в легкой форме и без осложнений. В связи с тем, что вирус постоянно мутирует, штаммовый состав вакцин ежегодно обновляется, добавил эксперт.
Прививаться нужно в сентябре-ноябре. Иммунитет сохраняется в течение 7-9 месяцев. Если вы пропустили время вакцинации, а эпидемия уже началась, не нужно бежать в прививочный кабинет – иммунитет формируется в среднем 21 день.
Кому надо прививаться
Вакцинация рекомендуется всем лицам старше 6 месяцев, у которых нет противопоказаний.
К основным противопоказаниям относятся:
• аллергические реакции на компоненты вакцины – куриный белок;
• тяжелая реакция на введение аналогичной вакцины ранее;
• обострение хронического заболевания или инфекционное заболевание в острой стадии. В этом случае прививку можно делать через 2-3 недели после выздоровления.
ИНТЕРЕСНЫЙ ФАКТ
Правда ли, что иммунологическая память (о вирусах предыдущих эпидемий) позволяет пожилым людям успешнее бороться с новыми вирусами?
Совсем наоборот: именно люди старше 65 чаще всего становятся жертвами даже "обычного" вируса гриппа, а тем более его пандемических разновидностей – от 80 до 90% смертей от гриппа и его осложнений приходится на эту категорию. Дело в том, что с возрастом иммунная система начинает хуже справляться со своими "обязанностями", поэтому после 65 лет вакцинация от гриппа становится особенно важна. Более того, в последние годы разработаны специальные вакцины для пожилых людей, так как из-за сниженной активности иммунитета обычные вакцины могут не давать достаточной защиты.
Откуда в вакцине куриный белок
Для производства вакцин вирусные частицы впрыскивают в куриные яйца, внутри которых они хорошо размножаются. Затем вирусы собирают и инактивируют нагреванием. Для получения вакцины используют либо вирусную частицу целиком, либо ее части, либо отдельные белки вируса (прежде всего гемагглютинин и нейраминидазу).
Людям с легкой формой аллергии на белок куриных яиц перед вакцинацией необходимо проконсультироваться с врачом, людям с тяжелой аллергией делать прививку от гриппа традиционными вакцинами нельзя. Но уже разработаны технологии создания рекомбинантных вакцин от гриппа, которые в принципе не используют куриные яйца, и в некоторых странах, например в США, такие вакцины доступны на рынке.
Где можно привиться
Направление на бесплатную прививку можно получить у участкового терапевта. Если руководители предприятия заключили договор с государственным медицинским учреждением, вакцинация для сотрудников также будет бесплатной.
Кроме того, прививку можно сделать за свой счет в негосударственных медицинских центрах или по программе добровольного медицинского страхования.
Сейчас известно 39 видов коронавирусов, в каждый вид могут входить десятки и сотни штаммов. Кроме того, есть еще 10 видов — кандидатов в коронавирусы. Специалисты пока только проверяют, можно ли их считать настоящими коронавирусами. У них широкий спектр хозяев среди птиц и зверей, у которых они вызывают заболевания дыхательной системы и желудочно-кишечного тракта. К людям коронавирусы приходят от животных: вирус атипичной пневмонии 2002—2003 годов SARS-CoV пришел от подковоносых летучих мышей, от которых он перескочил в мусанга, или малайскую пальмовую куницу, а из мусанга — уже в человека. (Любителям кофе малайская пальмовая куница должна быть знакома — это тот самый зверек, без которого не было бы кофе копи-лювак: мусангам скармливают кофейные зерна, которые определенным образом ферментируются в кишечнике, изменяя вкусовые свойства; кофе из зерен, которые прогнали через мусангов, считается особо изысканным и стоит весьма немалых денег.)
Еще один человеческий коронавирус известен по вспышке ближневосточного респираторного синдрома, первые случаи которого были зарегистрированы в 2012 году в Саудовской Аравии, — он получил название MERS-CoV. Этот вирус также пришел к людям от летучих мышей с промежуточной остановкой в одногорбых верблюдах (оттого его еще называют верблюжьим гриппом, что неправильно, — коронавирусы от вирусов гриппа отличаются). Умирают от него более трети заразившихся, однако заразиться им сложно: с момента появления вируса и до начала этого года в мире зарегистрировано лишь около двух с половиной тысяч случаев.
Подозревают, что и новый вирус SARS-CoV-2 тоже пришел к нам от летучих мышей.
Наконец, есть еще четыре человеческих коронавируса, два из которых, HCoV-229E и HCoV-OC43, были известны еще до атипичной пневмонии от SARS-CoV, а два других, HCoV-NL63 и HCoV-HKU1, открыли в 2004 и 2005 годах. Все четыре не вызывают ничего серьезнее мягкой простуды; хотя коронавирусная простуда встречается довольно часто — на ее счет относят 15—30% всей простуды в мире.
Но об эпидемиологии коронавирусов мы рассказывать не будем, а вместо этого поговорим о том, как они устроены и как на них реагируют наши клетки.
Обладатели белковой короны
И белок S, и белок HE сидят в мембранной липидной оболочке. Откуда она берется? Как мы помним, наши клетки окружены мембраной и внутри них существует много мембранных органелл — клеточных органов, выполняющих разные функции и ради правильной работы отделенных от остальной клетки двуслойной липидной мембраной. Ее-то вирус и заимствует, выходя из клетки, а как именно, скажем чуть ниже. Кроме S и HE в ней сидит очень много белка М, который поддерживает и структурирует мембрану, и еще немного белка E. Под липидной оболочкой с белками мы найдем геном вируса — нить молекулы РНК, которая усажена белком N: он упаковывает вирусную РНК в компактную свернутую спираль. (Белковая оболочка вирусов, непосредственно взаимодействующая с нуклеиновой кислотой, называется капсидом.) Когда РНК попадает в клетку, то на ней сразу можно синтезировать белки, и такую РНК у вирусов обозначают плюсом.
По этим признакам коронавирусы относят к РНК-содержащим вирусам, чей геном представляет собой одну-единственную плюс-цепь РНК. Так же выглядит геном у множества других вирусов, среди которых есть риновирусы (одна из самых частых причин простуды) и вирус гепатита С. В то же время коронавирусы относят к оболочечным вирусам, у которых кроме нуклеиновой кислоты и связанного с ней структурно-защитного белка (у коронавирусов это белок N) есть еще мембранная оболочка. К оболочечным вирусам еще относятся, например, вирусы герпеса, у которых наследственная информация хранится в ДНК, и ВИЧ. Как видим, по отдельности разные молекулярные черты можно найти у множества вирусов и лишь по их сочетанию отделить одну группу вирусов от другой.
Кстати, геном в виде РНК — это, можно сказать, слабость коронавирусов. В нуклеиновых кислотах время от времени появляются мутации либо из-за внешних факторов, вроде фоновой радиации, либо из-за стандартных ошибок белков, которые эти нуклеиновые кислоты копируют. Но в клеточной ДНК мутации могут быть исправлены специальными ремонтными белками. Этим же ремонтом способны воспользоваться вирусы с геномом в виде ДНК или же те, которые геномную РНК на время копируют в ДНК (такие вирусы называются ретровирусами). А в коронавирусной РНК ошибки никак не исправляются. Мутации помогают вирусам сменить хозяина, но среди мутаций есть очень много вредных, и если вирус не может никак корректировать дефекты в ДНК, они в какой-то момент могут сделать его просто нежизнеспособным.
Любые вирусы — это, грубо говоря, лишь комок молекул, пусть и сложно устроенный. Собственного обмена веществ у вирусов нет, и размножаться за пределами клетки они не могут. Вирусам с мембранной оболочкой проникнуть в клетку проще как из-за самой мембраны, так и благодаря сидящим на ней белкам: они хорошо подходят к клеточным рецепторам. Кроме того, белки мембранной оболочки, как собственно вирусные, так и те, которые вирус прихватил у клетки вместе с куском мембраны, помогают вирусу уходить от иммунной атаки. Но из-за мембраны такие вирусы более чувствительны к разным неблагоприятным факторам, вроде обезвоживания или моющих детергентов, мембрану разрушающих. Поэтому вирусы с мембранной оболочкой лучше всего передаются от хозяина к хозяину, а сидеть на какой-то поверхности и ждать, когда их оттуда снимет потенциальный хозяин, они долго не могут. Этим они отличаются от вирусов без мембраны, которые представляют собой нуклеиновую кислоту, заключенную в белковый капсид, — они более устойчивы в окружающей среде, но проникнуть в клетку для них зачастую сложнее.
Внедрение в клетку
Разные вирусы пользуются разными клеточными белками для входа. Так, вирус атипичной пневмонии SARS-CoV и относительно безобидный HCoV-NL63 связываются с ангиотензинпревращающим ферментом 2, который помогает регулировать кровяное давление, участвует в управлении иммунитетом и играет роль еще в целом ряде процессов. Но белка одного вида для входа бывает недостаточно, поэтому, например, SARS-CoV нужен еще белок TMPRSS2 — одна из сериновых протеаз, участвующая в разных биохимических реакциях. Вирус сначала связывается с одним белком на поверхности клетки, а потом второй белок на поверхности клетки режет вирусный белок S, после чего мембраны вируса и клетки соединяются.
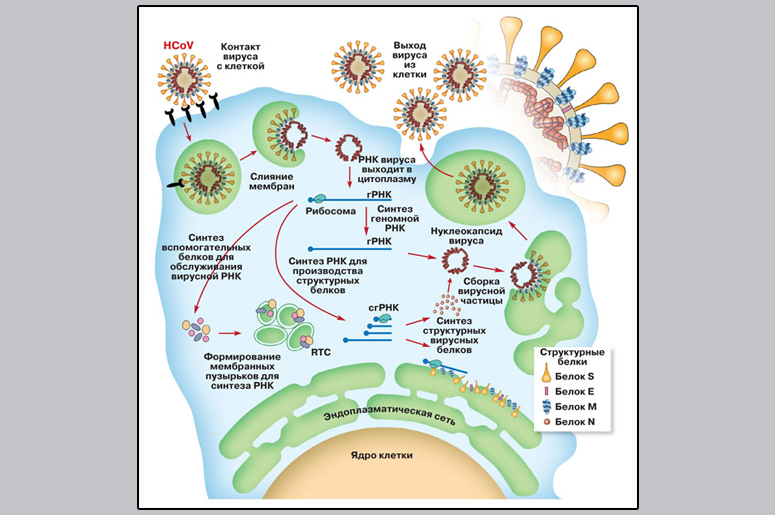
Схема жизненного цикла коронавируса. Проникнув в клетку, вирус высвобождает свою РНК, на которой рибосомы — клеточные машины для белкового синтеза — собирают вирусные белки, необходимые для формирования мембранных пузырьков и для синтеза плюс-цепи геномной РНК — гРНК. На вспомогательных мембранных пузырьках появляются вирусные белки, образующие RTC — replication transcription complex, этот комплекс выполняет репликацию (удвоение генома вируса) и транскрипцию — синтез коротких субгеномных РНК (сгРНК), предназначенных для сборки структурных вирусных белков. Структурный белок N соединяется с геномной РНК и образует нуклеокапсид вируса (геном плюс капсидный белок). На эндоплазматической сети синтезируются другие структурные белки, которые организуют вирусу липидную мембрану.
Вирус проник в клетку, и теперь он начинает копировать свой геном, то есть молекулу РНК, и синтезировать белки, нужные для копирования РНК и для формирования вирусных частиц. Кроме полных геномных РНК коронавирусы создают еще набор более коротких РНК — они синтезируются на больших геномных РНК и нужны только для синтеза белков; в вирусные частицы эти короткие РНК не попадают (точно так же ведут себя некоторые другие вирусы, которые вместе с коронавирусами объединяют в группу Nidovirales). Все вирусные РНК синтезируются в особых белковых комплексах, которые, в свою очередь, закреплены в небольших мембранных пузырьках. Эти пузырьки создает сам вирус: его белки вторгаются во внутриклеточные мембраны и фрагментируют их, создавая пузырьки-везикулы, чтобы РНК-синтезирующим комплексам было к чему пришвартоваться.
Часть насинтезированной РНК остается плавать в цитоплазме клетки — на ней синтезируется белок N, который будет упаковывать геномную вирусную РНК в спираль. Другие структурные белки, те, что потом окажутся в мембранной оболочке вируса (S, M и пр.), синтезируются на РНК, осевшей на особой внутриклеточной структуре — эндоплазматической сети, или эндоплазматическом ретикулуме (ЭР). Эндоплазматическая сеть — это огромная система мембранных канальцев, цистерн и пузырьков, на которых сидят белоксинтезирующие молекулярные машины рибосомы и собирают белки в соответствии с информацией в РНК. Готовые белки погружаются внутрь полостей ЭР, где приобретают правильную пространственную форму и потом либо переходят в клеточную цитоплазму, либо отправляются на экспорт, наружу из клетки, будучи заключены в транспортный мембранный пузырек.
Особенности внутриклеточной борьбы
О том, что у нее внутри орудует вирус, клетка может догадаться по неполадкам с внутренними мембранами — мы помним, что коронавирусы фрагментируют мембраны, чтобы дать опору своим белкам, синтезирующим РНК, и сами вирусные частицы прихватывают себе куски мембран. Кроме того, вирусные белки накапливаются в эндоплазматической сети и вызывают так называемый ЭР-стресс, то есть стресс эндоплазматического ретикулума. ЭР-стресс заставляет клетку остановить синтез белков (что, несомненно, бьет по вирусу — ведь он зависит от клеточной белоксинтезирующей машины) и активирует сигнальные молекулярные пути, которые включают программы клеточного суицида. Наконец, клетка может понять по вирусной РНК, что внутри у нее поселилась инфекция, и в ответ начать синтез интерферона первого типа. Это сигнальный белок, который выходит из клетки и оповещает всех об инфекции, в результате здоровые клетки готовятся защищаться от своей соседки, а иммунные клетки стремятся уничтожить зараженную клетку.

При неосложненном течении гриппа лихорадка держится 3-4 дня, реже 5-6 дней. Если по истечении недели температура не снижается, возможно, присоединились осложнения. Самым частым осложнением является пневмония. Из других осложнений возможны воспаления придаточных пазух носа и среднего уха.
Основной целью здравоохранения является не лечение заболеваний, а их профилактика. Это в полной мере относится к гриппу, который имеет выраженную зимнюю сезонность, высокую заразность и быстрое распространение.
Большое значение в профилактике гриппа имеет срочная изоляция больных и разобщение детей, подвергшихся риску заражения. Эпидемиологи предлагают на время эпидемии объявлять внеплановые каникулы. Эта мера значительно снижает заболеваемость гриппом в детских коллективах. Родители тоже должны внести свою лепту в противоэпидемические мероприятия и отказаться от посещения массовых мероприятий, поездок на экскурсии, походов по магазинам и гостям.
Профилактические прививки начинают делать в октябре, чтобы в организме заранее выработались защитные факторы (интерферон, макрофаги, антитела), которые предупредят развитие заболевания. Коварство вируса гриппа проявляется в его быстрой изменчивости. Он способен менять антигенную структуру и приобретать новые свойства в течение одной эпидемии. Поэтому борьба с гриппом должна быть направлена и на укрепление неспецифического иммунитета, на повышение способности организма противостоять возбудителю.
Интерферон человеческий лейкоцитарный применяется в виде раствора, который приготавливается из порошка, и закапывается в нос при угрозе заражения гриппом в течение всего эпидемического периода по 2-3-5 капель в оба носовых хода 2 раза в день детям любого возраста.
Гриппферон – капли в нос противовирусного, противовоспалительного и иммуностимулирующего действия. Рекомендуется для детей старше 1 года, по 2 – 3 капли 2 – 3 раза в день.
Виферон – свечи для ректального введения, используются 2 раза в день, утром и вечером.
Не стоит забывать о препаратах растительного происхождения, помогающих бороться с вирусами респираторных инфекций: лук, чеснок, настойка эхинацеи, аралии, заманихи, женьшеня, экстракт элеутерококка и т.д.
Огромное значение придается мероприятиям, усиливающим неспецифический, общий иммунитет организма. Сюда включаются полноценное питание, богатое белками, витаминами и микроэлементами, закаливающие процедуры, здоровый образ жизни, занятия физкультурой и спортом.
Вызывайте скорую помощь, но до приезда бригады попытайтесь помочь страдающему ребенку. Наполните ванну горячей водой, добавьте в нее питьевой соды и пусть ребенок подышит теплым влажным щелочным воздухом, находясь в ограниченном пространстве ванной комнаты. Одновременно сделайте ребенку горячие ванночки для рук и ног с температурой воды 40° С. Дайте теплое щелочное питье: молоко, в которое можно добавить чуть-чуть соды, любую минеральную гидрокарбонатную воду без газа Теплый влажный воздух помогает снять спазм мышц гортани, а щелочной пар способствует разжижению мокроты и ее отхождению. Прибывшая бригада скорой помощи сделает ингаляцию с лекарственными препаратами через волшебный аппарат – небулайзер, и ребенку сразу станет легче.
- не применяйте горчичники и растирания, содержащие эфирные масла и имеющие резкие запахи. Они способны вызвать рефлекторный спазм мышц гортани;
- не используйте мед, малиновое варенье, соки цитрусовых – у аллергиков они могут способствовать усилению отека;
- не давайте ребенку препаратов, подавляющих кашель (синекод). Помните о том, что кашель выполняет защитную функцию, и его надо не подавлять, а стимулировать.
Аденовирусную инфекцию можно распознать по выраженному насморку, влажному кашлю с обильной мокротой и покрасневшим гноящимся глазам.
Аденовирусы широко распространены по всему миру. Не обошли они стороной и нашу многострадальную родину. Заболеваемость повышается в холодное время года, и среди всех респираторных инфекций на ее долю приходится почти третья часть от всех случаев заболеваний. Не исчезает она и знойным летом, проявляясь в виде отдельных случаев. Болезнь особенно пышно цветет в детских коллективах, где вспышка может тянутся несколько месяцев подряд, переходя от одного ребенка к другому.
Заболевание начинается с повышения температуры, которая может иметь две волны и держаться до 12 –14 дней. Наряду с кашлем и насморком появляется покраснение и слезотечение глаз, отек век и гнойное отделяемое из глаз. Во время сна ресницы склеиваются, и, проснувшись, ребенок не может открыть глаза, что доставляет ему дополнительные страдания.
Вирус любит поражать аденоидную ткань, лимфатические узлы, в том числе и брюшной полости. Поэтому дети часто жалуются на боли в животе и расстройство стула. На шее и в подчелюстной области вы можете обнаружить увеличенные лимфоузлы. А, заглянув в горло, увидите гипертрофированные отечные миндалины, нередко имеющие гнойные налеты.
Пневмония при аденовирусной инфекции может быть первичной, вызываемой самим вирусом. Это чаще наблюдается у маленьких детей. А более позднее развитие пневмонии говорит о присоединении бактериальной инфекции. Из других осложнений можно назвать отиты, ангины, плевриты.
Для лечения всех респираторных инфекций, протекающих с повышением температуры, очень важно выполнять следующие условия:
• Увеличить теплоотдачу. Для этого перво-наперво снимите с малыша одноразовые подгузники, которые, закрывая почти третью часть тела, препятствуют теплоотдаче и играют роль согревающего компресса. В этом легко убедиться воочию: кожа под памперсом красная, влажная, с раздражением в паховых и ягодичных складках. Как только сняли одноразовый подгузник и просушили складочки, не поленитесь измерить температуру, и будете приятно удивлены: она снизится не менее чем на 1 градус. Не кутайте ребенка, не нагружайте его ватными одеялами и пуховыми перинами. Снимите с него плотные колготки, водолазки и свитера с высокими тугими воротами. Оботрите влажными салфетками, смоченными 1 - 2 % раствором уксуса или водкой. Наденьте легкую пижамку, ночную рубашку или футболочку с трусиками. Вся одежда должна быть из хлопчатобумажных тканей, способных активно впитывать пот, потому что следующее важное действие – заставить ребенка потеть.
Если повышение температуры сопровождается рвотой, не принуждайте ребенка принимать лекарственные препараты через рот – они тут же выйдут обратно. В таких случаях применяются свечи, введение лекарства с помощью клизмы, а при неотложных состояниях – инъекции.
Калпол, тайленол, панадол, эффералган, цефекон – все эти лекарственные препараты приготовлены на основе парацетамола, фактически это одно и то же лекарство. Это надо знать, чтобы не допустить передозировки. Превышение дозы оказывает токсическое влияние на печень и почки. Детям с заболеваниями этих органов парацетамол противопоказан.
На втором месте по частоте применения стоит нурофен детский, выпускаемый в виде суспензии и свечей. Препарат приготовлен на основе ибупрофена, который является представителем группы нестероидных противовоспалительных препаратов, и оказывает не только жаропонижающее, но и противовоспалительное и болеутоляющее действие. По сравнению с парацетамолом нурофен более эффективен, но, к сожалению, дает больше осложнений. Разрешен к применению только у детей старше 3 месяцев. Действие нурофена начинается через 30 минут, продолжается в течение 6 – 8 часов.
Очень эффективный препарат – ибуклин, состоящий из ибупрофена и парацетамола. В детской практике используются диспергируемые (растворяемые в воде) таблетки. Одна таблетка детского ибуклина содержит ибупрофена 100мг и парацетамола 125 мг. Перед употреблением 1 таблетку развести в 5 мл охлажденной кипяченой воды. Дозировка ибуклина зависит от возраста и массы тела ребенка.
Любимый многими поколениями аспирин (ацетилсалициловая кислота) применяется только у детей, старше 12 лет из-за возможного развития тяжелых осложнений.
Еще раз следует подчеркнуть необходимость обильно поить лихорадящего больного, так как в этот период увеличиваются потери воды с потом, учащенным дыханием. В результате снижается выведение жидкости через почки, моча становится концентрированной, и почечные канальцы могут забиваться солями, белком, цилиндрами, что нарушает функцию почек и может привести к осложнениям.
Основной целью здравоохранения является не лечение заболеваний, а их профилактика. Это в полной мере относится к гриппу, который имеет выраженную зимнюю сезонность, высокую заразность и быстрое распространение.
Кирилл Стасевич, биолог
Как показывают опросы, 46% наших соотечественников полагают, что вирусы можно убить антибиотиками.
Какие слабые места антибиотики находят у бактерий?
Во-первых, клеточная стенка. Любой клетке нужна какая-то граница между ней и внешней средой — без этого и клетки-то никакой не будет. Обычно границей служит плазматическая мембрана — двойной слой липидов с белками, которые плавают в этой полужидкой поверхности. Но бактерии пошли дальше: они кроме клеточной мембраны создали так называемую клеточную стенку — довольно мощное сооружение и к тому же весьма сложное по химическому строению. Для формирования клеточной стенки бактерии используют ряд ферментов, и если этот процесс нарушить, бактерия с большой вероятностью погибнет. (Клеточная стенка есть также у грибов, водорослей и высших растений, но у них она создаётся на другой химической основе.)
Во-вторых, бактериям, как и всем живым существам, надо размножаться, а для этого нужно озаботиться второй копией
Третья мишень антибиотиков — это трансляция, или биосинтез белка. Известно, что ДНК хорошо подходит для хранения наследственной информации, но вот считывать с неё информацию для синтеза белка не очень удобно. Поэтому между ДНК и белками существует посредник — матричная РНК. Сначала с ДНК снимается РНК-копия, — этот процесс называется транскрипцией, а потом на РНК происходит синтез белка. Выполняют его рибосомы, представляющие собой сложные и большие комплексы из белков и специальных молекул РНК, а также ряд белков, помогающих рибосомам справляться с их задачей.
Например, клеточная стенка бактерий — мишень для хорошо известного антибиотика пенициллина: он блокирует ферменты, с помощью которых бактерия осуществляет строительство своей внешней оболочки. Если применить эритромицин, гентамицин или тетрациклин, то бактерии перестанут синтезировать белки. Эти антибиотики связываются с рибосомами так, что трансляция прекращается (хотя конкретные способы подействовать на рибосому и синтез белка у эритромицина, гентамицина и тетрациклина разные). Хинолоны подавляют работу бактериальных белков, которые нужны для распутывания нитей ДНК; без этого ДНК невозможно правильно копировать (или реплицировать), а ошибки копирования ведут к гибели бактерий. Сульфаниламидные препараты нарушают синтез веществ, необходимых для производства нуклеотидов, из которых состоит ДНК, так что бактерии опять-таки лишаются возможности воспроизводить свой геном.
Почему же антибиотики не действуют на вирусы?
Что произойдёт, если к клеткам с вирусной инфекцией добавить, например, антибиотик, прерывающий процесс образования клеточной стенки? Никакой клеточной стенки у вирусов нет. И потому антибиотик, который действует на синтез клеточной стенки, ничего вирусу не сделает. Ну а если добавить антибиотик, который подавляет процесс биосинтеза белка? Всё равно не подействует, потому что антибиотик будет искать бактериальную рибосому, а в животной клетке (в том числе человеческой) такой нет, у неё рибосома другая. В том, что белки и белковые комплексы, которые выполняют одни и те же функции, у разных организмов различаются по структуре, ничего необычного нет. Живые организмы должны синтезировать белок, синтезировать РНК, реплицировать свою ДНК, избавляться от мутаций. Эти процессы идут у всех трёх доменов жизни: у архей, у бактерий и у эукариот (к которым относятся и животные, и растения, и грибы), — и задействованы в них схожие молекулы и надмолекулярные комплексы. Схожие — но не одинаковые. Например, рибосомы бактерий отличаются по структуре от рибосом эукариот из-за того, что рибосомная РНК немного по-разному выглядит у тех и других. Такая непохожесть и мешает антибактериальным антибиотикам влиять на молекулярные механизмы эукариот. Это можно сравнить с разными моделями автомобилей: любой из них довезёт вас до места, но конструкция двигателя может у них отличаться и запчасти к ним нужны разные. В случае с рибосомами таких различий достаточно, чтобы антибиотики смогли подействовать только на бактерию.
До какой степени может проявляться специализация антибиотиков? Вообще, антибиотики изначально — это вовсе не искусственные вещества, созданные химиками. Антибиотики — это химическое оружие, которое грибы и бактерии издавна используют друг против друга, чтобы избавляться от конкурентов, претендующих на те же ресурсы окружающей среды. Лишь потом к ним добавились соединения вроде вышеупомянутых сульфаниламидов и хинолонов. Знаменитый пенициллин получили когда-то из грибов рода пенициллиум, а бактерии стрептомицеты синтезируют целый спектр антибиотиков как против бактерий, так и против других грибов. Причём стрептомицеты до сих пор служат источником новых лекарств: не так давно исследователи из Северо-Восточного университета (США) сообщили о новой группе антибиотиков, которые были получены из бактерий Streptomyces hawaiensi, — эти новые средства действуют даже на те бактериальные клетки, которые находятся в состоянии покоя и потому не чувствуют действия обычных лекарств. Грибам и бактериям приходится воевать с каким-то определённым противником, кроме того, необходимо, чтобы их химическое оружие было безопасно для того, кто его использует. Потому-то среди антибиотиков одни обладают самой широкой антимикробной активностью, а другие срабатывают лишь против отдельных групп микроорганизмов, пусть и довольно обширных (как, например, полимиксины, действующие только на грамотрицательные бактерии).
Более того, существуют антибиотики, которые вредят именно эукариотическим клеткам, но совершенно безвредны для бактерий. Например, стрептомицеты синтезируют циклогексимид, который подавляет работу исключительно эукариотических рибосом, и они же производят антибиотики, подавляющие рост раковых клеток. Механизм действия этих противораковых средств может быть разным: они могут встраиваться в клеточную ДНК и мешать синтезировать РНК и новые молекулы ДНК, могут ингибировать работу ферментов, работающих с ДНК, и т. д., — но эффект от них один: раковая клетка перестаёт делиться и погибает.
Возникает вопрос: если вирусы пользуются клеточными молекулярными машинами, то нельзя ли избавиться от вирусов, подействовав на молекулярные процессы в заражённых ими клетках? Но тогда нужно быть уверенными в том, что лекарство попадёт именно в заражённую клетку и минует здоровую. А эта задача весьма нетривиальна: надо научить лекарство отличать заражённые клетки от незаражённых. Похожую проблему пытаются решить (и небезуспешно) в отношении опухолевых клеток: хитроумные технологии, в том числе и с приставкой нано-, разрабатываются для того, чтобы обеспечить адресную доставку лекарств именно в опухоль.
Что же до вирусов, то с ними лучше бороться, используя специфические особенности их биологии. Вирусу можно помешать собраться в частицу, или, например, помешать выйти наружу и тем самым предотвратить заражение соседних клеток (таков механизм работы противовирусного средства занамивира), или, наоборот, помешать ему высвободить свой генетический материал в клеточную цитоплазму (так работает римантадин), или вообще запретить ему взаимодействовать с клеткой.
Вирусы не во всём полагаются на клеточные ферменты. Для синтеза ДНК или РНК они используют собственные белки-полимеразы, которые отличаются от клеточных белков и которые зашифрованы в вирусном геноме. Кроме того, такие вирусные белки могут входить в состав готовой вирусной частицы. И антивирусное вещество может действовать как раз на такие сугубо вирусные белки: например, ацикловир подавляет работу ДНК-полимеразы вируса герпеса. Этот фермент строит молекулу ДНК из молекул-мономеров нуклеотидов, и без него вирус не может умножить свою ДНК. Ацикловир так модифицирует молекулы-мономеры, что они выводят из строя ДНК-полимеразу. Многие РНК-вирусы, в том числе и вирус СПИДа, приходят в клетку со своей РНК и первым делом синтезируют на данной РНК молекулу ДНК, для чего опять же нужен особый белок, называемый обратной транскриптазой. И ряд противовирусных препаратов помогают ослабить вирусную инфекцию, действуя именно на этот специфический белок. На клеточные же молекулы такие противовирусные лекарства не действуют. Ну и наконец, избавить организм от вируса можно, просто активировав иммунитет, который достаточно эффективно опознаёт вирусы и заражённые вирусами клетки.
Итак, антибактериальные антибиотики не помогут нам против вирусов просто потому, что вирусы организованы в принципе иначе, чем бактерии. Мы не можем подействовать ни на вирусную клеточную стенку, ни на рибосомы, потому что у вирусов ни того, ни другого нет. Мы можем лишь подавить работу некоторых вирусных белков и прервать специфические процессы в жизненном цикле вирусов, однако для этого нужны особые вещества, действующие иначе, нежели антибактериальные антибиотики.
Очевидно, различия между бактериальными и эукариотическими молекулами и молекулярными комплексами, участвующими в одних и тех же процессах, для ряда антибиотиков не так уж велики и они могут действовать как на те, так и на другие. Однако это вовсе не значит, что такие вещества могут быть эффективны против вирусов. Тут важно понять, что в случае с вирусами складываются воедино сразу несколько особенностей их биологии и антибиотик против такой суммы обстоятельств оказывается бессилен.
Впрочем, главный побочный эффект от антибиотиков связан как раз с тем, что они вредят мирной желудочно-кишечной микрофлоре. Антибиотики обычно не различают, кто перед ними, мирный симбионт или патогенная бактерия, и убивают всех, кто попадётся на пути. А ведь роль кишечных бактерий трудно переоценить: без них мы бы с трудом переваривали пищу, они поддерживают здоровый обмен веществ, помогают в настройке иммунитета и делают много чего ещё, — функции кишечной микрофлоры исследователи изучают до сих пор. Можно себе представить, как чувствует себя организм, лишённый компаньонов-сожителей из-за лекарственной атаки. Поэтому часто, прописывая сильный антибиотик или интенсивный антибиотический курс, врачи заодно рекомендуют принимать препараты, которые поддерживают нормальную микрофлору в пищеварительном тракте пациента.
Читайте также:


