Бактериофаг против вируса папилломы человека
Знаменитый ученый Д, Эрелль представил миру бактериофаги как естественные антибактериальные агенты и предложил использовать их для терапии — еще до открытия антибиотиков.
Бактериофаги в препаратах
Возможность исследования фагов в качестве антимикробных агентов в клинике привлекает внимание мирового врачебного и научного сообщества. Быстрое распространение мультирезистентных к антибиотикам штаммов мутантов вредоносных бактерий разожгло интерес научного сообщества к этому методу с почти 100-летней историей.
Современные биотехнологии позволяют использовать бактериофаговую терапию против большинства бактериальных инфекций. На сегодняшний день созданы лекарственные препараты на основе бактериофагов. История массового применения этих препаратов уходит корнями в трагические времена Великой Отечественной Войны (в 1940 году был создан коктейль из нескольких видов бактериофагов, борющихся с бактериями, вызывающими тяжелые раневые инфекции).
Эти препараты спасли жизни тысячам раненных солдат. Подобный опыт позволил сохранить и развить биофармацевтическое производство бактериофагов в России — сегодня наша страна мировой лидер в производстве этих лекарственных антибактериальных препаратов.
Наука и бактериофаги
В 50-90-е годы их использовали просто как очень удобный объект для исследований: многие фундаментальные открытия в молекулярной биологии, такие как генетический код, рекомбинация, репликация нуклеиновой кислоты, были сделаны на примере бактериофагов, потому что их легко культивировать и они продуцируют большое количество нуклеиновой кислоты.
Бактериофаги и фармацевтическая промышленность Запада
В тридцатых годах прошлого века крупный американский концерн основал даже клинику, где начали лечить фагами. Пропагандисты нового метода сулили исцеление от всех болезней. Однако действительность оставляла желать лучшего: научные основы такой терапии были ещё так скудны, что новое средство применяли практически вслепую. Считалось, что все фаги одинаковы и побеждают любую бактерию. Одним и тем же бактериофагом начинали лечить разные заболевания, а болезнь всё не уходила — так метод был серьёзно скомпрометирован. Мнение о малой эффективности фагов задержалось в кругах медиков на многие годы, живёт оно ещё и сегодня.
Недавно появились публикации исследователей из Рокфеллеровского университета в Нью-Йорке об успехах терапии с помощью фагов.
Кому подходят препараты бактериофагов
Препараты бактериофагов подходят для людей различных возрастных категорий, нуждающихся в профилактике и лечении бактериальных инфекций. Бактериофаги показаны даже беременным, кормящим матерям и детям с 0 лет. Ведь применение бактериофагов абсолютно физиологично.
Какие проблемы решают препараты бактериофагов
Что такое бактериофаги?
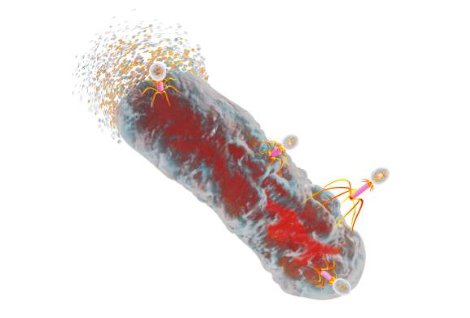
Из чего состоит бактериофаг
Преимущества бактериофагов

Бактериофаги – антибактериальные агенты и природные антисептики
Безопасны и не токсичны, не имеют побочных эффектов, применяются у новорождённых детей, беременных и кормящих женщин

Действие бактериофагов не затрагивает полезную микрофлору организма, в отличие от антибиотиков
Бактериофаги совместимы со всеми лекарственными препаратами. Применение бактериофагов не ограничивает использование других лекарств и не влияет на их эффективность

Воздействует лишь на чувствительные к ним болезнетворные бактерии, вызывающие инфекционное заболевание, разрушая их изнутри
Бактериофаги выводятся из организма естественным путем
Применение бактериофагов
Сразу после открытия сто лет назад вирусов бактерий, фаговые препараты стали использовать для борьбы с инфекционными болезнями человека. Однако благодаря открытию антибиотиков и недостатку знаний об объекте лечебный потенциал фагов не был реализован.
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Е.В. Файзуллина
Казанский государственный медицинский университет
Генитальная папилломавирусная инфекция является распространенным заболеванием, передающимся половым путем. Вирус папилломы человека (ВПЧ) — высокоспецифичная в отношении человека инфекция, обладающая способностью инфицировать эпителиальные клетки, вызываемая вирусом из семейства Papovaviridea. Инфицирование ВПЧ половых органов, так же как и кожных покровов, происходит при наличии микротравм, при этом резервуаром ВПЧ-инфекции служат уретра, бартолиниевы железы, семенная жидкость. Идентифицировано более ста видов ВПЧ, из которых 35 инфицируют урогенитальный тракт человека, вызывая поражение покровного эпителия кожи и слизистых оболочек половых органов. ВПЧ-инфекция является наиболее распространенной инфекцией, передаваемой половым путем (ИППП), которой инфицирована большая часть сексуально активного населения. Кроме этого, папилломавирусы — единственная группа вирусов, для которых доказана индукция опухолей у человека. Число инфицированных в мире за последнее десятилетие увеличилось в 12 раз (Молочков В.А., 2004).
МКБ X пересмотра, раздел А 63. Аногенитальные бородавки.
Этиология
Вирус, относящийся к роду А семейства Papovaviridea, сохраняется при температуре 50?С в течение 30 минут. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов; за онкогенные свойства вируса ответственны онкопротеины Е6 и Е7. По онкогенной активности различают ВПЧ низкой степени риска — HPV6, 11,42,43,44; средней – HPV31,33,35, 51,52, 58 и высокой — HPV16, 18,45,56 степени риска. Одним или более типами ВПЧ инфицировано не менее 50% взрослого населения, живущего активной половой жизнью, в большинстве случаев генитальная ВПЧ-инфекция у них является нераспознанной, протекающей субклинически или асимптомно. Генитальная ВПЧ-инфекция имеет высокую контагиозность; заражение при однократном половом контакте происходит примерно в 60% случаев.
Патогенез
Инвазия вируса происходит через микроповреждения тканей. ВПЧ инфицирует стволовые клетки базального слоя, которые затем являются постоянным источником инфицирования эпителиальных клеток. Вирусы инфицируют делящиеся незрелые клетки базально-клеточного слоя, находящиеся близко к поверхности, что во многом объясняет частоту инфицирования шейки матки и нижней трети влагалища и вульвы.
Вирусная ДНК включается в ядерный материал клетки хозяина. Интегрированная форма ВПЧ способна к злокачественной трансформации, поскольку вирусная ДНК начинает контролировать клеточный генетический материал для воспроизводства ВПЧ-кодированных белков. Интеграция ВПЧ высокого риска в клеточный геном хозяина усиливает продукцию двух онкопротеинов — Е6 и Е7, взаимодействующих с эндогенными клеточными регуляторными белками, ведущими к дерегуляции цикла клеточной прогрессии, что является разрешающим моментом в формировании цервикальной неоплазии, образованию плоских кондилом, невидимых вооруженным глазом (Прилепская В.Н., 1997).
Однако по мнению В.А. Молочкова и соавт. (2004), инфицирование эпителиальных клеток ВПЧ является необходимым, но не достаточным событием для развития рака. Для формирования необратимой неоплазии необходимы следующие факторы: во-первых, активная экспрессия генов Е6 и Е7, причем высокоонкогенных типов ВПЧ-16 и 18; во-вторых, индукция метаболических механизмов конверсии эстрадиола в 16-ОН; в третьих, индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Первая стадия неоплазии CIN I характеризуется активной репликацией вируса и его бессимптомным выделением. Опухолевая трансформация возникает с большей вероятностью при взаимодействии ВПЧ с другими инфекционными агентами (цитомегаловирусы, вирус простого герпеса 2 типа, С. trachomatis, микоплазма и уреаплазма).
Факторы риска
ВПЧ является необходимым, но не достаточным фактором цервикальной неоплазии. Предрасполагающими факторами риска для развития заболевания могут быть: неблагополучный социально-экономический статус и сексуальное поведение, нарушения клеточного и гуморального иммунитета, сопутствующие сексуально-трансмиссивные заболевания (гонорея, сифилис герпес, трихомониаз хламидиоз и т.д.), молодой возраст, курение, беременность, дисбиоз вагинального биотопа, гипо- и авитаминозы (Марченко Л.А., 2001).
Риск ВПЧ-инфекции наиболее высок у гомосексуалистов. Не исключены случаи перинатальной передачи инфекции младенцам, рожденным от инфицированных матерей во время родоразрешения через естественные родовые пути, за счет аспирации околоплодных вод, цервикального или вагинального секрета; случаи папилломатоза гортани, трахеи, бронхов у детей, рожденных с применением операции кесарева сечения, что, по мнению ряда авторов, свидетельствует о возможности трансплацентарной передачи инфекции и нецелесообразности применения кесарева сечения с единственной целью — предупреждения заражения новорожденного ВПЧ (Koutsky L.A., Kiviar N.B.,1999).
Течение заболевания и клинические разновидности
Инкубационный период при аногенитальных бородавках составляет от 1 до 3 месяцев. В большинстве случаев ВПЧ-инфекция не манифестирует сразу, оставаясь некоторое время асимптомной. Прогрессия ВПЧ-инфекции высокого онкогенного риска в цервикальную интраэпителиальную неоплазию и рак in situ обычно происходит в сроки от 5 до 30 лет.
1. Клинические формы (видимые невооруженным взглядом):
1.1. Экзофитные кондиломы (остроконечные типичные, паппилярные, папуловидные);
1.2. Вестибулярный паппиломатоз ( мелкие паппиломовидные образования преддверья влагалища).
2. Субклинические формы (не видимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/ или цитологическом или гистологическом исследовании):
Плоские кондиломы (типичная структура с множеством койлоцитов);
Малые формы (различные поражения метапластического эпителия с единичными койлоцитами);
Кондиломатозный цервицит/вагинит.
3. Латентные формы (отсутствие клинических, морфологических или гистологических изменений при обнаружении ДНК ВПЧ);
4. Цервикальная интраэпителиальная неоплазия (плоскоклеточные интраэпителиальные поражения):
CIN - CIN 1 — слабо выраженная дисплазия +/- койлоцитоз, дискератоз;
4.2 CIN II — выраженная дисплазия +/- койлоцитоз, дискератоз;
4.3 CIN III или CIS - тяжелая дисплазия или карцинома in situ+/- койлоцитоз, дискератоз;
4.4 Микроинвазивная плоскоклеточная карцинома.
Поверхность покрыта многослойным плоским эпителием по типу дискератоза. В подлежащей строме имеются атипичные сосуды, явления воспаления. Локализация ОК различна, в основном, в местах возможной мацерации: клитор, малые половые губы, устье уретры, влагалище, шейка матки, анус.
Манифестация генитальной ВПЧ-инфекции сопровождается появлением генитальных бородавок. Экзофитные формы остроконечных кондилом представляют из себя типичное проявление инфекции, обусловленной доброкачественными типами вируса ВПЧ6 и ВПЧ11. Эндофитные кондиломы могут быть плоскими и инвертированными, располагаются на шейке матки и имеют вид плоских или слегка возвышающихся бляшек, определяются при расширенной кольпоскопии.
Субклиническая форма болезни обнаруживается только при кольпоскопии в виде мелких плоских бородавок или устанавливается на основании характерной гистологической картины в виде койлоцитоза. Отсутствие клинических и гистологических признаков инфекции при выявлении ДНК ВПЧ свидетельствует о латентной или асимптомной инфекции.
Наружное отверстие уретры у женщин поражается в 4-8% случаев, более глубокое поражение мочеиспускательного канала вызывает явления вялотекущего уретрита.
Анальные бородавки чаще встречаются у лиц, практикующих анальный секс, и редко располагаются выше зубчатой линии прямой кишки. У лиц, практикующих орально-генитальные контакты, генитальные бородавки могут поражать губы, язык, небо.
Генитальные бородавки, как правило, бессимптомны, и часто случайно выявляются при осмотре или на основании Pap-мазка. В связи с этим вначале больные не предъявляют жалоб на связанный с ними дискомфорт. Однако, крупные, травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом. Уретральные бородавки у мужчин могут вызывать раздвоение струи мочи, обструкцию уретрального отверстия.
У больных с нарушением клеточного иммунитета (ВИЧ-инфекция, иммуносупрессивная терапия, беременность), — развиваются очень крупные генитальные бородавки — гигантская кондилома Бушке-Левенштейна, инвазивная и деструирующая опухоль, ассоциирующаяся с ВПЧ 6 и 1 1 типа.
ВПЧ-инфекция, обусловленная типами вируса высокого онкогенного риска (ВПЧ-16 и 18), является этиологическими агентами довольно гетерогенной группы заболеваний: бовеноидный папулез, цервикальная интраэпителиальная неоплазия, рак шейки матки, реже - рак влагалища, вульвы, ануса (Баткаев Э.А. с соавт., 2001; Киселев В.И., Киселев О.И., 2003).
Бовеноидный папулез ассоциируется с ВПЧ-16, а также с другими типами ВПЧ - 1, 6, 11, 18, 31-35, 39, 42, 48, 51-54 и проявляется плоскими папулами и пятнами с гладкой, бархатистой поверхностью. Заболевание обычно развивается у мужчин, имеющих много половых партнеров. У партнерш таких пациентов выявляется инфекция ВПЧ шейки матки и цервикальной интраэпителиальной неоплазии. Течение бовеноидного папулеза обычно доброкачественное. У некоторых больных бовеноидный папулез может персистировать годами, трансформируясь (особенно у лиц пожилого возраста) в плоскоклеточный рак.
Диагностика папилломавирусной инфекции
Лабораторная диагностика ВПЧ-инфекции проводится на основании цитологического, гистологического исследования биоптатов, определения антител к ВПЧ, обнаружения ДНК ВПЧ и онкобелка Е7.
Клинический осмотр наружных половых органов, вульвы, влагалища следует проводить при хорошем освещении. Для выявления субклинической генитальной ВПЧ-инфекции проводится расширенная кольпоскопия. Ложноположительные результаты при этом методе обычно являются следствием воспалительных и дискератических процессов вульвы и влагалища.
Кольпоскопия и биопсия показаны всем женщинам с цервикальной интраэпителиальной неоплазией класса II (CIN II) или класса III (CINIII), независимо от подтверждения у них наличия ВПЧ-инфекции.
Наиболее простые методы для идентификации ВПЧ — иммунологические методы: РСК, ИФА, ПИФ.
Диагностика ВПЧ-инфекции шейки матки включает тестирование по Папониколау (РАР-тест). Молекулярно-биологические методы реакция гибридизации in situ, ПЦР, ДНК-зонд. Гистологическое исследование биоптатов тканей эпителия и эпидермиса используются и при малосимптомных или асимптомных формах вирусных заболеваний гениталий. Использование молекулярно-биологических методов исследования целесообразно для доказательства наличия ВПЧ с его типированием, так как и ДНК-гибридизация, и полимеразная цепная реакция позволяют выявить онкогенные типы вируса 16 и 18.
Основным методом диагностики ВПЧ является цитологический — обнаружение койлоцитарных клеток в биоптате эпителия шейки матки (клетки МПЭ промежуточного и поверхностного типа с многоядерным строением), патогномоничные для ВПЧ.
При гистологическом исследовании генитальных бородавок обнаруживается умеренное утолщение рогового слоя с папилломатозом, паракератозом и акантозом; могут присутствовать фигуры митоза. Диагностически важным считается наличие в глубоких участках мальпигиева слоя койлоцитов — больших эпителиальных клеток с круглыми гиперхромными ядрами и выраженной перинуклеарной вакуолизацией.
Лечение
При выборе метода лечения ВПЧ-инфекции учитывается анамнез, соматический статус, предшествующая противовирусная терапия, локализация, количество, размеры остроконечных и плоских кондилом. Тактика лечения должна быть индивидуальной с учетом переносимости тех или иных методов лечения. Местное лечение АБ направлено на удаление кондилом и атипически измененного эпителия, с применением различных видов химических коагулянтов, цитостатиков и физиохирургических методов лечения. После удаления папилломатозных разрастаний для профилактики рецидива АБ необходима местная и общая терапия противовирусными препаратами, индукторами интерферона, неспецифическими иммуномодуляторами. Больных с папилломавирусной инфекцией следует предупредить, что данное заболевание является сексуально трансмиссивным, поэтому обследование и лечение необходимо проводить обоим партнерам, а на период терапии и ближайшие 6-9 месяцев рекомендовать барьерные методы контрацепции.
Местное лечение ВПЧ (данные приведены по Подзолковой Н.М. с соавт, 2007).
В течение трех лет (2006-2008 гг.) нами были обследованы и пролечены 650 женщин с аногенитальными бородавками (АБ). Данные представлены в таблице 1.
Таблица 1.
Группы пациенток по локализации и распространенности АБ
| Группа | Локализация ОК | Количество пациенток | % |
|---|---|---|---|
| 1. | Влагалище | 17 | 2,6 |
| 2. | Вульва | 173 | 23,6 |
| 3. | Влагалище + вульва | 258 | 39,7 |
| 4. | Влагалище + большие половые губы | 126 | 19,4 |
| 5. | Влагалище + вульва + большие половые губы | 76 | 11,7 |
| Всего | 650 | 100 | |
Таблица 2.
Число сеансов радиоволновой деструкции АБ, требующихся для достижения стойкой ремиссии заболевания у женщин
| Группа | 1 сеанс | 2 сеанс (10-12 дней) | 3 сеанс (14-21 день) | Более 3 сеансов | Всего | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Чел. | % | Чел. | % | Чел. | % | Чел. | % | Чел. | % | |
| 1 | 7 | 41,2 | 10 | 58,82352941 | 0 | 0 | 0 | 0 | 17 | 100 |
| 2 | 121 | 69,9 | 41 | 23,69942197 | 11 | 6,4 | 0 | 0 | 173 | 100 |
| 3 | 118 | 45,7 | 112 | 43,41085271 | 25 | 9,7 | 3 | 1,2 | 258 | 100 |
| 4 | 13 | 10,3 | 77 | 61,11111111 | 29 | 23,0 | 7 | 5,6 | 126 | 100 |
| 5 | 0 | 0,0 | 23 | 30,26315789 | 41 | 53,9 | 12 | 15,8 | 76 | 100 |
| Итого: | 650 | |||||||||
Спрей для наружного и местного применения.
В пластиковом флаконе с дозатором 15 мл средства.
Противовирусный иммуностимулирующий препарат.
Действующим веществом препарата Эпиген Интим является активированная глицирризиновая кислота, получаемая путем экстракции из растительного сырья (корня солодки).
Активированная глицирризиновая кислота обладает комплексным воздействием, которое включает иммуностимулирующее, противовирусное, противовоспалительное, противозудное и регенерирующее.
Активированная глицирризиновая кислота индуцирует выработку собственных интерферонов. Иммуностимулирующий эффект проявляется повышением числа и активности Т - лимфоцитов, уменьшением концентрации иммуноглобулина G и увеличением концентрации иммуноглобулина А и М.
Активированная глицирризиновая кислота обладает противовирусным действием на разные типы ДНК и РНК вирусов in vitro и in vivo (Varicella Zoster; вирус простого герпеса типа 1 и 2; цитомегаловирус, различные типы вируса папилломы человека, в том числе онкогенные). Активированная глицирризиновая кислота прерывает репликацию вирусов на ранних стадиях, вызывает выход вириона из капсида, тем самым не допуская его проникновение в клетки. Активированная глицирризиновая кислота инактивирует указанные вирусы в нетоксичных для нормально функционирующих клеток концентрациях. Мутантные штаммы вирусов, резистентные к ацикловиру и йодоуридину, также высокочувствительны к глицирризиновой кислоте, как и не мутантные штаммы.
Противовоспалительная активность активированной глицирризиновой кислоты сочетается со стимулирующим влиянием на гуморальные и клеточные факторы иммунитета. Активированная глицирризиновая кислота существенно тормозит выброс кининов и синтез простагландинов клетками соединительной ткани в зоне воспаления. Регенерирующее действие обусловлено улучшением репарации кожи и слизистых.
При наружном и местном применении активированная глицирризиновая кислота депонируется в очагах поражения. Системная абсорбция происходит медленно. Препарат обнаруживается в крови в следовых количествах.
лечение вирусной инфекции, вызванной вирусом папилломы человека, в том числе бессимптомное выделение вируса папилломы человека высокого онкогенного риска в составе комбинированной и комплексной терапии;
лечение вирусной инфекции, вызванной вирусом простого герпеса I и II типов в составе комплексной терапии;
лечение вирусной инфекции, вызванной вирусом Varicella Zoster (опоясывающий лишай) в составе комплексной терапии;
лечение вирусной инфекции, вызванной цитомегаловирусом в составе комплексной терапии;
профилактика рецидивов вирусных инфекций, вызванных вирусом простого герпеса I и II типов, вирусом Varicella Zoster, вирусом папилломы человека, цитомегаловирусом;
профилактика и лечение остроконечных кондилом и патологий шейки матки, вызванных вирусом папилломы человека, цитомегаловирусом;
профилактика и лечение состояний, сопровождающихся снижением местного иммунитета, в том числе неспецифического вульвовагинита, кандидозного вульвовагинита и бактериального вагиноза, в составе комплексной терапии;
при явлениях дискомфорта в области половых органов, сопровождающихся зудом, жжением и сухостью слизистых оболочек, в том числе после полового акта;
при явлениях дискомфорта в области половых органов, сопровождающихся зудом, жжением и сухостью слизистых оболочек при недостаточности функции яичников.
Повышенная чувствительность к компонентам Эпиген Интим.
Препарат разрешен к применению в течение всего периода беременности и лактации.
Насадку промывают кипяченой водой с мылом и хранят в прилагаемой полиэтиленовой упаковке. Конструкция насадки позволяет равномерно орошать шейку матки и стенки влагалища.
При использовании в условиях стационара интравагинальное орошение препаратов в зеркалах можно проводить без насадки.
Для эффективного действия перед применением препарата не требуется предварительного промывания пораженного участка.
При появлении признаков непереносимости использование препарата следует прекратить.
Состав на 100 мл препарата:
глицирризиновая кислота активированная (эквивалентно аммонию глицирризинату) 0,1 г.
Вспомогательные вещества: яблочная кислота, фумаровая кислота, аскорбиновая кислота, фолиевая кислота, пропиленгликоль, твин - 80 (полисорбат - 80), вода очищенная.
Раствор от светло-желтого цвета до светло-коричневого цвета, имеющий характерный запах.
Наружно, интравагинально и интрауретрально.
Перед употреблением баллон встряхнуть. При применении баллон держать в вертикальном положении.
При наружном применении препарат наносится на всю поражённую поверхность кожи с расстояния 4-5 см путем 1-2 нажатий клапана, что является оптимальной терапевтической дозой.
Для интравагинального применения препарата прилагается специальная насадка с распылителем. Снять клапан с баллона пульверизатора и надеть клапан насадки. Затем насадку ввести во влагалище и произвести впрыскивание путем 1-2 нажатий насадки, что является оптимальной терапевтической дозой.
При применении мужчинами, помимо наружного нанесения, препарат впрыскивается в наружное отверстие мочеиспускательного канала 1-2 нажатиями клапана пульверизатора.
При герпесвирусной инфекции I типа, опоясывающем лишае препарат рекомендуется применять 6 раз в день на очаг поражения в течение 5 дней. При упорном течении инфекционного процесса срок лечения продлевается до полного исчезновения симптомов заболевания.
При герпесвирусной инфекции II типа (генитальный герпес), цитомегаловирусной инфекции рекомендуется применять 5 раз в день в течение 14 дней наружно и интравагинально, после купирования рецидива - наружно и интравагинально 3 раза в сутки в течение 10 дней.
С целью профилактики рецидивов генитального герпеса и цитомегаловирусной инфекции препарат рекомендуется применять наружно и интравагинально с 18-20 дня менструального цикла до окончания менструации 2 раза в день утром и вечером.
При папилломавирусной инфекции препарат рекомендуется применять:
до удаления кондилом - 3 раза в сутки в течение всего периода этиотропной терапии.
на фоне деструкции - 5 раз в сутки в течение 10 дней и больше до полного заживления.
для профилактики ближайших рецидивов 3 раза в день в течение 1 месяца.
Для профилактики прогрессирования папилломавирусной инфекции рекомендуется применять до и после полового акта, а так же при возникновении провоцирующих факторов (стресс, переутомление, респираторные вирусные инфекции, нарушение микрофлоры, прием антибиотиков, цитостатиков) - 3 раза в день интравагинально и наружно в течение всего периода воздействия провоцирующих факторов.
При бактериальном вагинозе, неспецифическом вульвовагините, и кандидозном вульвовагините: препарат рекомендуется применять интравагинально 3-4 раза в день в течение 7-10 дней. При необходимости курс лечения повторить через 10 дней. При возникновении провоцирующих факторов (респираторные вирусные инфекции, прием антибиотиков, цитостатиков) - 3 раза в день интравагинально и наружно в течение всего периода воздействия провоцирующих факторов.
При явлениях дискомфорта в области половых органов, сопровождающихся зудом, жжением и сухостью слизистых оболочек: 2 раза в день (утром и вечером) в течение 2-3 недель. С целью профилактики состояний дискомфорта применять регулярно после полового акта.
В качестве профилактического противовирусного средства, препарат рекомендуется применять до и после полового акта.
Возможна индивидуальная непереносимость компонентов препарата.
В редких случаях возможны местные аллергические реакции, в том числе в виде контактного дерматита.
Не выявлено взаимодействия с основными группами лекарственных препаратов, применяемых для комплексного лечения при указанных заболеваниях (антибиотики и антисептики; противовоспалительные и обезболивающие средства).
Обнаружен синергизм при одновременном применении активированной глицирризиновой кислоты и других противовирусных препаратов, в частности, производных ацикловира, йодоуридина, интерферона и других иммуномодуляторов.
Папилломавирусы человека или вирусы папилломы человека (ВПЧ) - это группа вирусов, поражающих кожу и слизистые оболочки. Папилломавирусы человека (ВПЧ) передаются половым путем и часто встречаются у молодых людей. Большинство случаев инфекций устраняет иммунная система, но у некоторых людей развивается постоянная инфекция, вызываемая определенными типами ВПЧ, которые продолжают вызывать поломки в инфицированных клетках. Эти изменения называются "предраковыми", поскольку они могут развиться в рак шейки матки, влагалища, вульвы, анального канала, члена, головы и шеи. Инфекция другими типами ВПЧ вызывает бородавки в области гениталий или вокруг ануса.
Вакцинация направлена на предотвращение будущих инфекций ВПЧ. В настоящее время используются три вакцины против ВПЧ: двухвалентная (защищает от двух типов ВПЧ), четырехвалентная (защищает от четырех типов ВПЧ) и нонавалентная (защищает от девяти типов ВПЧ). У женщин три дозы двухвалентной или четырехвалентной вакцины против ВПЧ защищают от предраковых заболеваний шейки матки, вызванных типами ВПЧ, содержащимися в вакцине. Данные о нонавалентной вакцине, о влиянии четырехвалентной вакцины на мужчин и о влиянии вакцины против ВПЧ на людей с ВИЧ еще не были тщательно изучены. Во многих странах использование вакцин против ВПЧ остается низким. Более простой режим вакцинации или вакцинация и девочек, и мальчиков может привести к увеличению числа людей, проходящих вакцинацию.
Испытания вакцин против ВПЧ не всегда направлены на сбор данных о предраковых заболеваниях и раке по нескольким причинам. Во-первых, вакцинация против ВПЧ обычно проводится до начала половой жизни девочек, и взятие образцов из шейки матки у девочек, не практикующих секс, неэтично. Во-вторых, предраковые заболевания и рак, связанные с ВПЧ, встречаются редко и развиваются только спустя годы после возникновения ВПЧ-инфекции. В-третьих, участникам испытаний будет предложено лечение в случае развития предраковых заболеваний, поэтому прогрессирование до рака шейки матки будет происходить еще реже, даже без вакцинации. Международный комитет экспертов заявляет, что при определенных обстоятельствах уровни антител (т.е. наличие сильной реакции иммунной системы) могут быть использованы для демонстрации защиты от рака шейки матки и анального отверстия. Уровень антител после вакцинации в ходе испытаний не должен быть ниже, чем в других исследованиях на взрослых, у которых было доказано, что вакцина защищает от тяжелых заболеваний шейки матки или анального отверстия, связанных с ВПЧ.
Насколько эффективны или вредны разные режимы вакцинации против ВПЧ (т.е. число доз и сроки вакцинации) и разные вакцины против ВПЧ у женщин и мужчин?
Эти результаты основаны на данных исследований по 27 сентября 2018 года. Мы включили 20 исследований с участием 31,940 человек.
Исследования, сравнивающие две дозы вакцины против ВПЧ с тремя дозами, или сравнивающие временной интервал между ними, имеют целью изучение реакции иммунной системы, а не последствий инфекции или заболевания. Две дозы вакцины против ВПЧ приводят к аналогичным реакциям иммунной системы, что и три дозы, а более длительный интервал (до 12 месяцев) между дозами дает более сильный ответ иммунной системы, чем более короткий интервал. Нет достаточных данных для определения разницы между режимами вакцинации в отношении серьезных неблагоприятных событий и смерти.
У мужчин в возрасте от 16 до 26 лет одно исследование показало умеренную уверенность в том, что четырехвалентная вакцина против ВПЧ обеспечивает лучшую защиту от внешних половых повреждений и бородавок гениталий, чем фиктивное лечение (контроль). Одно исследование показало, что у женщин в возрасте от 16 до 26 лет нонавалентные и четырехвагинальные вакцины обеспечивают одинаковый уровень защиты от раковых заболеваний шейки матки, влагалища и вульвы (данные высокой определённости).
Имелись свидетельства того, что четырехвалентная вакцина приводила к большему числу локальных неблагоприятных явлений (таких как боль, отечность и покраснение в месте инъекций), чем контрольное лечение у мужчин, и что нонавалентная вакцина приводила к большему числу локальных неблагоприятных явлений, чем четырехвалентная вакцина у мужчин и женщин. Данные о серьезных неблагоприятных событиях и смертях в результате исследований, в ходе которых сравнивали различные типы вакцин против ВПЧ или режимы дозирования, были низкой или очень низкой определённости.
У людей, живущих с ВИЧ, вакцины против ВПЧ приводят к достаточному уровню реакции иммунной системы, но доказательства их влияния на хроническую инфекцию ВПЧ или последствия и вред, связанные с ВПЧ, ограничены.
Не было выявлено каких-либо серьезных проблем с методологическим качеством исследований для измерения инфекции и результатов заболевания, а также для оценки реакции иммунной системы. Наша уверенность в доказательствах о серьезном вреде и смертности во всех исследованиях при сравнении различных вакцин против ВПЧ и режимов вакцинации низка либо из-за их низкой частоты, либо потому, что эти данные являются косвенными, либо по обеим этим причинам. Доказательства, классифицированные как доказательства высокой степени определённости (качества или уверенности), означают, что мы были уверены в том, что дальнейшие исследования, вряд ли, изменят наши результаты. Доказательства средней степени определённости означают, что существует вероятность того, что дальнейшие исследования могут оказать существенное влияние на наши результаты, в то время как данные низкой степени определённости означают, что наша уверенность в результатах была ограничена, и дальнейшие исследования могут оказать значительное влияние на наши результаты. Очень низкая определённость (или качество) означает, что мы крайне не уверены в результатах.
Режим вакцинации против ВПЧ в две дозы у молодых женщин приводит к реакции иммунной системы, сопоставимой с режимом в три дозы. У мужчин четырехвалентная вакцина против ВПЧ оказывается эффективной в профилактике внешних поражений половых органов и бородавок. Четырехвалентные и нонавалентные вакцины против ВПЧ у молодых женщин обеспечивают одинаковый уровень защиты от предраковых заболеваний шейки матки, влагалища и вульвы, и от рака. Данные об эффективности и вреде для людей, живущих с ВИЧ, ограничены. Необходимы дальнейшие долгосрочные исследования на уровне населения для продолжения мониторинга безопасности этих вакцин, чтобы определить, в течение какого времени две дозы вакцины могут обеспечить защиту от заболеваний, связанных с ВПЧ, от рака, связанного с ВПЧ, и будет ли режим иммунизации в две дозы способствовать расширению охвата вакцинацией.
Читайте также:
- Что за вирус в западной африке
- Состояние заболеваемости вирусными гепатитами
- Что лучше для профилактики гриппа и простуды ребенку отзывы
- Почему не стоит делать прививку от гриппа ребенку
- Вирус изменил цвет a
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции

