Анализ на вирусные полиморфизмы

Определение генетического полиморфизма этого маркера имеет наибольшее значение для пациентов с генотипом 1 HCV, учитывая более низкую частоту ответа на стандартную противовирусную терапию. В некоторых исследованиях не было выявлено четкой связи между полиморфизмом IL28В и частотой устойчивого вирусологического ответа у таких пациентов [7]. Определение генотипа IL28В имеет большое значение для оценки потенциального ответа на противовирусную терапию и отбора пациентов, у которых возможны более короткие курсы лечения. В целом полиморфизм IL28В – это один из факторов, позволяющих индивидуализировать лечение хронического гепатита С [10]. В литературе есть данные о том, что полиморфизм гена IL28В ассоциирован развитием с гепатоцеллюлярной карциномы, индуцированной HCV [5]. Таким образом, представляется интересным изучение взаимосвязи полиморфизма этого гена с тяжестью поражения печени, в частности, с нарушениями функциональных печеночных проб, лабораторными тестами фиброза и регенерации печени, что поможет уточнить роль полиморфизма IL28В в патогенезе и прогрессировании ХГС.
Цель исследования – изучить взаимосвязь лабораторных маркеров цитолиза, холестаза, гиалуроновой кислоты (ГК), альфа-фетопротеина (АФП), уровня вирусной нагрузки (ВН) и генетического полиморфизма IL28B в участке rs12979860 у больных ХГC.
Материалы и методы исследования
Обследовано 100 пациентов с ХГС в фазе реактивации, госпитализированных в Пермскую краевую инфекционную клиническую больницу для начала проведения комбинированной противовирусной терапии. Средний возраст больных составил 38,3 ± 10,4 года, из них 48 мужчин и 52 женщины. Этиологическая верификация диагноза проводилась качественным и количественным определением в крови у пациентов РНК HCV с помощью полимеразной цепной реакции (ПЦР), а также серологических маркеров HCV. По генотипу HCV пациенты с ХГС разделились следующим образом: генотип 1 определен у 56 % больных, генотип 2 и 3 – у 44 %. Сопоставимая по полу контрольная группа включала 90 практически здоровых (доноров) лиц со средним возрастом 36,3 ± 7,9 лет, не имеющих заболеваний печени.
В настоящем исследовании мы проанализировали однонуклеотидную замену (SNP) в гене IL-28В (rs12979860) у 190 человек (90 доноров без хронических заболеваний печени и 100 пациентов с ХГС).
Распространенности гомозигот по аллелю С (СС) в группе здоровых и больных ХГС достоверно не отличались (χ2 = 0,61; р = 0,44) и составили соответственно 42 и 36 % (рисунок). Встречаемость патологических гомозигот ТТ в группе здоровых и больных ХГС составила соответственно 6 и 8 % (χ2 = 0,35; р = 0,55). В обеих группах преобладали гетерозиготы СТ (χ2 = 0,79; р = 0,67). Соотношение частот аллелей изучаемого маркера в исследуемых группах также не характеризовалось различием. Встречаемость патологического минорного аллеля Т в группе с ХГС составила 36 %, в группе контроля 32 % (χ2 = 0,64; р = 0,42). Полученные результаты по встречаемости генотипов и аллелей IL-28В (rs12979860) как для здоровых лиц, так и в группе ХГС среди популяции Пермского края практически не отличаются от данных других авторов. В частности, в России распространенность протективного аллеля С в популяции составляет 61–64 %, в наших исследованиях – 64 % у больных ХГС и 61 % в группе контроля [5, 10]. Таким образом, в ходе исследования не было установлено статистически значимого отличия частот генотипов и аллелей маркера IL-28В (rs12979860) между группами здоровых индивидуумов и лиц с ХГС. В группе больных ХГС частота аллеля риска Т составила 0,359, что достоверно не отличалось от его частоты 0,319 среди здоровых. Из 56 больных, инфицированных HCV-1, у 40 человек было выявлено неблагоприятное сочетание генотипов rs12979860 СТ и ТТ (35 и 5 соответственно), что значимо отличалось от группы контроля (χ2 = 4,55; р = 0,03). Таким образом, потенциальный риск развития неустойчивого вирусологического ответа при 1 генотипе HCV составил 71,4 %.
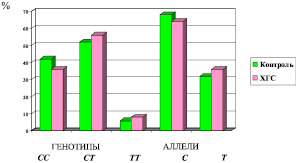
Распространенность генотипов и аллелей полиморфизма гена IL-28В (rs12979860) у больных ХГС и в группе контроля
При корреляционном анализе минорный аллель Т гена IL-28В (rs12979860) продемонстрировал достоверные взаимосвязи с функциональными печеночными тестами: АЛТ, АСТ, общим и прямым билирубином, что указывает на взаимосвязь полиморфизма гена и тяжести поражения печени. Эти данные также свидетельствуют о неблагоприятном влиянии выраженности цитолиза и холестаза на прогноз противовирусной терапии (табл. 2). Полученные результаты согласуются с данными исследования Agundez J.A. и соавт. (2009), которые выявили взаимосвязь генного полиморфизма с АЛТ, гамма-глютамилтранспептидазой, соотношением АСТ/АЛТ [3].
Взаимосвязи минорного аллеля Т гена IL-28В (rs12979860) с функциональными печеночными пробами, гиалуроновой кислотой и альфа-фетопротеином при ХГС
ОНКОЛОГИЯ

В Европейском регионе, по данным ВОЗ, смертность от рака стоит на втором месте после смертности от болезней системы кровообращения. На конец 2016 года в России насчитывалось более 3,5 миллионов онкологических больных (2,4% населения страны). Прирост за последние 10 лет составил 20,6 %. Показатель смертности сейчас составляет 202 человека на 100 тысяч населения.

В 2016 г. в Российской Федерации впервые в жизни выявлено 599 348 случаев злокачественных новообразований. Прирост данного показателя по сравнению с 2015 г. составил 1,7%.

Онкология – это раздел медицины, изучающий доброкачественные и злокачественные опухоли, механизмы и закономерности их возникновения и развития, методы их профилактики, диагностики и лечения.
Опухоль - патологическое образование, самостоятельно развивающееся в органах и тканях, отличающееся автономным ростом, полиморфизмом и атипией клеток.
Автономный рост – опухолевый рост не подлежит воздействию регуляторных механизмов (нервная и эндокринная регуляция, иммунная система и др.), т.е. не контролируется организмом.
Полиморфизм и атипия – трансформировавшись, клетки начинают размножаться быстрее, при этом происходит нарушение дифференцировки клеток, что ведет к атипии (морфологическому отличию от клеток ткани, из которой они произошли) и полиморфизму (наличию в опухоли разнородный клеток). Чем менее дифференцированные клетки в опухоли, тем быстрее и агрессивнее ее рост.
Основные исторические теории происхождения опухолей.
Теория раздражения Р. Вирхова – злокачественные опухоли чаще возникают в тех органах, где ткани чаще подвергаются травматизации.
Теория зародышевых зачатков Д. Конгейма – под влиянием определенных факторов зачатки, находящиеся в латентном состоянии, начинают расти, приобретая опухолевые свойства.
Регенерационно-мутационная теория Фишер-Вазельса – воздействие патологических факторов на регенерирующие ткани.
Вирусная теория Л.А.Зильбера – вирус, внедряясь в клетку, на генном уровне нарушает процессы регуляции деления.
Иммунологическая теория – нарушение идентификации и уничтожения трансформированных клеток иммунной системой.
Часто причиной возникновения злокачественных опухолей являются канцерогенные факторы внешней среды и образа жизни:
Особенности питания - 35%;
Инфекционные агенты - 16%;
Профессиональные канцерогены - 4-5%;
Ионизирующее излучение - 4-5%;
Наследственные факторы - 4-5%;
Ультрафиолетовое излучение - 2-3%;
Загрязнение атмосферного воздуха - 1-2%.
Само по себе воздействие канцерогенных факторов не всегда вызывает появление новообразования. Для возникновения опухоли необходимо наличие генетической предрасположенности и определенного состояния иммунной и нейрогуморальной систем.

Вирус Эпштейна-Барр (вирус герпеса человека 4-го типа) вызывает лимфому Беркитта, лимфогранломатоз, назофарингеальную карциному.
60% людей являются носителями различных типов вируса папилломы человека , снижение иммунитета стимулирует развитие вируса. Вызывает рак шейки матки и прямой кишки, гениталий, носоглотки, легких.
Т-лимфотропный вирус человека – основным проявлением его патогенной деятельности являются Т-клеточный лейкоз и Т-клеточная лимфома.
Вирус гепатита С вызывает первичный рак печени.
Ранняя – установление диагноза на стадии in situ и I клинической стадии заболевания – адекватное лечение приводит к полному выздоровлению.

Своевременная – диагноз поставлен на II и в некоторых случаях на III стадии процесса – полное излечение возможно только у части больных, у других наблюдается прогрессирование процесса.

Поздняя – диагноз установлен на III-IV стадии – малая вероятность или невозможность излечения пациента.

Среди всех видов диагностических исследований, начиная с визуального осмотра пациента врачом любой специальности и заканчивая такими высокотехнологичными методами как компьютерная томография ( КТ), магнитно-резонансная томография (МРТ), позитронно - эмиссионная томография ( ПЭТ), лабораторная диагностика занимает особое место.

Во-первых , выполнить лабораторные исследования Вы можете в любое удобное для Вас время, практически без специальной подготовки, без предварительной записи и направления врача.
Во-вторых , затратив время только на забор биоматериала, Вы продолжаете заниматься своими делами, а исследование будет происходить уже без Вашего участия.
В – третьих , большинство лабораторных исследований не являются дорогостоящими, так что имеется возможность выполнять их регулярно и с профилактической целью.
Прежде всего, не следует забывать о самых простых и доступных тестах:
Анализ крови клинический с определением СОЭ (код 416, код 419);
Анализ мочи общий (код 458);
Исследование кала на скрытую кровь (код 462).
Именно эти лабораторные тесты выявят первые признаки скрытого внутреннего кровотечения, которым часто сопровождается развитие злокачественного новообразования. Микрогематурия ( следы крови в моче) является первым и достоверным признаком рака мочевого пузыря. Скрытая ( пошедшая ферментативную обработку) кровь в кале укажет на наличие кровоточащей язвы, полипа или опухоли в желудочно-кишечном тракте. Анализ крови выявит первые признаки заболеваний кроветворной и лимфатической систем (лейкоз, лимфогранулематоз, лимфому и др.)
Если у Ваших ближайших кровных родственников имелись или имеются злокачественные новообразования, пройдите генетическое обследование на предмет носительства гена, определяющего риск развития рака.

Онкомаркеры – это вещества, чаще белковой природы, которые образуются в результате жизнедеятельности раковых клеток и появляются в крови онкологических больных. В онкологии онкомаркеры часто используются для мониторинга течения установленного заболевания и оценки эффективности проводимой терапии, но нельзя умалять роль онкомаркеров в первичной диагностике рака. Помимо известных и давно применяемых онкомаркеров за последние годы были исследованы и рекомендованы к применению новые и очень эффективные в работе тесты.
Наиболее известные и часто применяемые онкомаркеры:
РЭА - маркер рака ЖКТ и других систем организма.
ПСА - маркер рака предстательной железы.
СА 15-3 - маркер рака молочной железы.
СА-125 - маркер рака яичников и матки.
SCC - маркер рака шейки матки, прямой кишки, кожи
CYFRA- маркер рака мочевого пузыря
АФП в гинекологии - один из основных маркеров состояния плода при беременности. В онкологии - маркер первичного рака печени и яичек.
Tumor Marker 2 (TM 2) - пируваткиназа в кале

Тест на пируваткиназу обладает несколькими преимуществами и перед другими неинвазивными методами. Если при анализе кала на скрытую кровь определяется присутствие гема, то в ходе данного исследования выявляют специфичный для опухолевых клеток фермент, что позволяет обнаружить как кровоточащие, так и некровоточащие новообразования. Эта особенность обуславливает более высокую чувствительность теста (для сравнения: чувствительность теста на TM-2 составляет 92,3 %, а анализа кала на скрытую кровь – 20-35 %). В отличие от анализа кала на скрытую кровь, результат этого теста не зависит от соблюдения диеты и может быть получен при однократном взятии биоматериала, что гораздо удобнее для пациента. Кроме того, на результат анализа не влияет прием нестероидных противовоспалительных средств и витамина С, гастрит, язвенная болезнь, дивертикулез кишки и геморрой, так что ложноположительные результаты практически исключены.
Комплекс: СА 125, НЕ4 и расчет прогностического индекса ROMA
Важность определения СА125 в диагностике рака яичников несомненна. Уровень СА125 повышен более чем у 80% всех пациенток с раком яичников. Однако его чувствительность на I и II стадиях довольно низка – он повышен не более чем у 50% пациенток.
Кроме того, СА125 не является строго специфичным маркером, так как его уровень может повышаться при доброкачественных гинекологических заболеваниях, эндометриозе, при злокачественных опухолях другой локализации, у здоровых женщин репродуктивного возраста.
Повышенная продукция НЕ4 выявлена при раке яичника и эндометрия, редко - при распространенной форме аденокарциномы легких. Именно НЕ4 продемонстрировал наибольшую чувствительность для эпителиального рака яичников, особенно на ранней стадии заболевания.
Исследования показали, что уровень НЕ4 повышен уже на доклинической стадии . В тоже время при доброкачественных гинекологических заболеваниях, эндометриозе, кистозе яичников повышение уровня НЕ4 не наблюдалось.

Чувствительность НЕ4 намного выше, чем СА125. Кроме того, показано, что уровень НЕ4 повышен у примерно половины пациенток с РЯ, у которых концентрация СА125 оставалась в норме.
Алгоритм расчета риска наличия злокачественных опухолей яичника
Алгоритм учитывает значение концентраций онкомаркеров HE4 и Ca125, а также менопаузальный статус пациентки.
ROMA позволяет рассчитать вероятность эпителиального рака яичников и дает возможность разделения на группы риска на основании рассчитанного значения.
В лаборатории АО "СЗЦДМ" производится расчет индекса ROMА.
Разделение на группы высокого и низкого риска.
Женщины в пременопаузе:
ROMA > 12,9% - высокий риск обнаружения эпителиального рака яичников
ROMA 24,7% - высокий риск обнаружения эпителиального рака яичников
ROMA Новый маркер рака предстательной железы ( код 2256).
Рекомендовано использовать у мужчин с уровнем общего ПСА в диапазоне от 3 до 10 нг/мл;
В некоторых случаях заменяет трансректальную биопсию предстательной железы, но рекомендован к назначению параллельно с биопсией;
Позволяет сократить 20-30% ненужных биопсий;
Обладает высокой специфичностью.
Маркеры нейроэндокринных опухолей
Хромогранин А – гликопротеин с молекулярной массой около 49 кДа, относится к семейству хромогранинов, являющихся основным компонентом содержимого крупных оптически плотных гранул большинства нейроэндокринных клеток. При специфической стимуляции таких клеток хромогранины секретируются вместе с пептидными гормонами и нейропептидами. Хотя функции этих белков досконально не изучены, показано, что хромогранины (из которых хромогранин А является наиболее изученным) играют важную роль в процессах образования, созревания, внутриклеточной транспортировки и экзоцитоза секреторных гранул в нейроэндокринных клетках и нейронах. Кроме того, в результате ферментативного расщепления хромогранинов образуется ряд более мелких пептидов, обладающих различной биологической активностью. В качестве специфичных маркеров нейроэндокринных опухолей разного происхождения, в рамках комплексной диагностики, обычно используют их специфические продукты (катехоламины и их метаболиты – при подозрении на феохромоцитому, серотонин и его метаболит 5-ОИУК – при подозрении на карциноид, гипофизарные гормоны – при подозрении на опухоли гипофиза и т. п.). Хромогранин А является важнейшим универсальным маркером нейроэндокринной ткани и различных нейроэндокринных опухолей. Чувствительность этого показателя в качестве опухолевого маркера нейроэндокринных опухолей варьирует от 10 до 100% в зависимости от типа опухоли и стадии заболевания. Исследование хромогранина А в сыворотке крови находит клиническое применение, прежде всего, в комплексной диагностике карциноидных опухолей (несекретирующие серотонин опухоли могут сохранять способность продуцировать хромогранин А). Определение уровня хромогранина А может быть полезно в комплексной диагностике феохромоцитомы, нейробластомы, медуллярного рака щитовидной железы, опухолей, происходящих из островкового аппарата поджелудочной железы, и др. Повышение уровня хромогранина А в сыворотке коррелирует с размером, распространенностью, гистопатологическими характеристиками нейроэндокринных опухолей. Оно ярче выражено при больших, хорошо дифференцированных и метастатических опухолях.
Тест предназначен для использования в комплексной диагностике и обследованиях пациентов с характерными признаками и симптомами нейроэндокринных опухолей и не рекомендован к применению для скрининга в общей популяции или для использования в целях определения тяжести заболевания.
Меланома –самая агрессивная и смертоносная форма рака кожи. Лишь 10% больных с метастатической меланомой живут более 5 лет. По данным ВОЗ в мире ежегодно регистрируются 132 тыс новых случаев заболевания. В России за 10 лет распространенность меланомы выросла на 52%, а смертность увеличилась на 23%.

Белки семейства S100 являются маркерами потенциального повреждения мозга, маркерами злокачественной меланомы. Эти белки находятся в клетках кожи (кератиноцитах) и клетках нервной ткани.

При меланоме I степени уровень белка S100 в крови остается обычно в пределах нормы. При меланоме II - III степени данный опухолевый маркер увеличивается в крови у 4-20 % больных. При меланоме IV степени повышение концентрации онкомаркера белка S100 в крови отмечается уже в 30-90% случаев.
Повышение белка S100 в крови не может стать основанием для постановки первоначального диагноза, но является поводом направить пациента на дальнейшее обследование. Анализ на S100 делается также для наблюдения за эффективностью проводимой терапии.
Как онкомаркер тиреоглобулин используется у пациентов с удаленной щитовидной железой. После полного удаления железы и полного удаления опухоли не должно остаться никаких мест, где тиреоглобулин может вырабатываться, и поэтому его уровень должен стать очень низким, близким к нулю.

Это гормон щитовидной железы, вырабатываемый С-клетками нейроэндокринного происхождения, расположенными среди фолликулов, образованных А- и В-клетками. Щитовидная железа гормон кальцитонин вырабатывает в очень незначительных количествах, поэтому в крови его никогда не бывает много. Из С-клеток развивается опасная злокачественная опухоль щитовидной железы, которую называют медуллярным раком или С-клеточной карциномой. Устойчивая к химиотерапии и лучевой терапии, быстро и интенсивно метастазирующая, опухоль лечится только хирургически. Оперативное лечение эффективно на ранних стадиях заболевания. Крупные международные исследования показали, что при определении уровня кальцитонина у пациентов с узловыми образованиями в щитовидной железе в 1 случае из 300 был выявлен никем ранее не заподозренный медуллярный рак.
Для удобства пациентов нами разработаны комплекс-тесты, включающие наиболее актуальные клинические и биохимические тесты, а также онкомаркеры.
Комплекс-тест "ОНКОПРОФИЛАКТИКА У МУЖЧИН"
| 416 | Клинический анализ крови с морфологической оценкой патологических результатов, без СОЭ |
| 419 | Скорость оседания эритроцитов (СОЭ) |
| 458 | Общий анализ мочи |
| 178 | Фосфатаза щелочная (ЩФ) |
| 254 | РЭА |
| 253 | Альфа-фетопротеин (АФП) |
| 4402 | Комплекс ПСА: общий, связанный, свободный |
| 2117 | CYFRA 21-1 (Фрагмент Цитокератина 19) |
Комплекс-тест "ОНКОПРОФИЛАКТИКА У ЖЕНЩИН"
| 416 | Клинический анализ крови с морфологической оценкой патологических результатов, без СОЭ |
| 419 | Скорость оседания эритроцитов (СОЭ) |
| 178 | Фосфатаза щелочная (ЩФ) |
| 6366 | Комплекс: СА 125, НЕ4 и расчет прогностического индекса ROMA |
| 261 | СА 15-3 |
| 4411 | Антиген плоскоклеточной карциномы (SCC) |
Комплекс-тест "ОНКОПРОФИЛАКТИКА ЗАБОЛЕВАНИЙ ЖКТ"
| 416 | Клинический анализ крови с морфологической оценкой патологических результатов, без СОЭ |
| 419 | Скорость оседания эритроцитов (СОЭ) |
| 178 | Фосфатаза щелочная (ЩФ) |
| 462 | Исследование кала на скрытую кровь |
| 2119 | Антитела (Ig G) к Helicobacter pylori |
| 9166 | Пепсиноген I |
| 9123 | Пепсиноген II |
| 4657 | Tumor Marker 2 (TM 2) - пируваткиназа в кале |
| 253 | Альфа-фетопротеин (АФП) |
| 254 | РЭА (раково-эмбриональный антиген, англ. CEA) |
| 4599 | СА 72-4* |
| 260 | СА 19-9 |
В наше время активно изучаются причины возникновения раковых заболеваний, и это дает возможность предотвратить до 40% случаев заболевания. Здоровый образ жизни, включающий физическую активность, правильное питание и отказ от вредных привычек – основа первичной профилактики, а своевременное обследование – надежная защита от развития онкологических заболеваний.
Цель
Провести генетический анализ полиморфизма МАОА и психологическое обследование статистически значимой группы испытуемых.
Описание
Развитие науки и техники естественно-научных областей в так называемую постгеномную эру в значительной степени направлено на развитие технологий индивидуальной медицины. В настоящее время многое сделано в области исследования моногенных наследственных заболеваний. Однако, такие генетические явления как пенетрантность, экспрессивность и кумулятивный характер наследования различных характеристик существенно затрудняют выявление связи между физиологическим или психологическим феноменом и конкретной локализацией, определяющей его последовательности ДНК. Наиболее интересными и сложными на данный момент являются исследования в области генетики поведения. Наследованию подвергаются не только такие параметры, как цвет волос, рост и форма носа. Дети в большинстве случаев воспроизводят поведенческие мотивы своих родителей. Важным вопросом в этой ситуации оказывается проблема разграничения влияния двух факторов – наследственности (генетической) и социальной ситуации развития индивида.
Другими словами, человек ведёт себя определённым образом благодаря генам родителей или по причине того, что они его обучили тем или иным реакциям?
Гипотеза
Полиморфизм МАОА оказывает влияние на формирование индивидуальных личностных особенностей человека и внутри групп людей, имеющих различные полиморфизмы МАОА будут наблюдаться различия в основных чертах личности.
Задачи
1. Сбор и обработка данных психометрических тестов.
2. Сбор биологического материала.
3. Выделение ДНК.
4. Наработка необходимой последовательности методом ПЦР.
5. Анализ продуктов ПЦР.
6. Статистическая обработка результатов.

Проведя анализ доступных ресурсов, была подобрана информация о связи некоторых генов и психологических особенностей человека. Наиболее удобными для анализа в условиях имеющейся в распоряжении конвергентной лаборатории Курчатовского проекта оказались полиморфизмы гена моноаминооксидазы А (МАОА). Определённые аллели этого гена могут обуславливать внезапные вспышки ярости у человека. Важность этого фермента в передаче нервного импульса и функционирования нервной системы натолкнула на мысль о его влиянии на существенно более широкий спектр психологических черт человека.
Далее сравнили длину и количество участков в разных образцах: чем длиннее встречающийся участок, тем больше повторов гена моноаминоксидазы А в геноме. Каждому образцу был присвоен порядковый номер.
Учитывая факт того, что ген МАОА локализуется в X-хромосоме, стоит упомянуть, что женские особи несут два его варианта и могут быть гетерозиготами по данной последовательности ДНК.
После генотипирования образцов, на основе полученных результатов, экспериментальная группа была разбита на подгруппы по полиморфизмам МАОА для последующего исследования. Используя критерий Стьюдента (t-критерий), были сравнены средние значения шкальных оценок исследуемых психологических черт и сопоставлены группы студентов, которые отличаются между собой по полиморфизмам МАОА. У исследуемых характеристик значения распределены от 1 до 5. Проанализировав значимость полученных различий, выяснилось, что действительно существенные различия были получены только на выборке тестируемых мужского пола.
Оснащение и оборудование, использованное в работе
• Оборудование для горизонтального электрофореза
Результаты
1. У испытуемых, имеющих низкоактивный вариант гена МАОА, выше значения по психопатии (психологическая нестабильность). Наряду с этим – ниже показатели по сознательности и авторитарному подчинению.
2. Неожиданными оказались результаты сравнения студентов двух разных специальностей по разным характеристикам. Они показали, например, что студенты МФТИ имеют меньшую зависимость от вознаграждения своей активности.
3. Полученные данные подтверждают выдвинутую гипотезу. Некоторые из личностных характеристик человека связаны с его генотипом и могут передаваться по наследству.
Перспективы использования результатов работы
Результаты, полученные в ходе данного исследования, могут быть применимы при разработке методик лечения и диагностики психических и поведенческих расстройств, а также для составления персонализированного психологического портрета человека, с последующим использованием для разрешения проблем социальной адаптации.
Сотрудничество с вузом при создании работы
Московский физико-технический институт (национальный исследовательский университет) (МФТИ).
Полиморфизм компьютерного вируса - специальный механизм, позволяющий вредоносному коду меняться от заражения к заражению.
Содержание
Полиморфизм вируса заключается в формировании кода вируса "на лету" - уже во время исполнения, при этом сама процедура, формирующая код также может быть непостоянной и видоизменяться при каждом новом заражении. Таким образом, можно говорить, что полиморфные вирусы имеют способность полностью менять себя при каждом новом заражении, образуя многообразие образцов одного и того же вируса.
Полиморфные вирусы
Полиморфный вирус - вирус, предпринимающий специальные меры для затруднения своего обнаружения и анализа. Не имеет сигнатур, т. е., не содержит ни одного постоянного участка кода. В большинстве случаев два образца одного и того же вируса-полиморфика не будут иметь ни одного совпадения. Достигается это за счет шифрования основного тела вируса и существенной модификации от копии к копии модуля-расшифровщика.
Каждый экземпляр полиморфного вируса шифруется своим ключом. Для шифрования кода полиморфного вируса могут использоваться случайные ключи и алгоритмы шифрования.
Для обнаружения полиморфных вирусов, как правило, используются специально разрабатываемые для каждого полиморфного вируса алгоритмы обнаружения.
Уровни полиморфизма
В классификации CARO полиморфные вирусы в зависимости от их сложности разделяют на несколько уровней.
Уровень 1. Вирусы первого уровня полиморфизма используют постоянные значения для разных расшифровщиков. Их можно обнаружить по некоторым постоянным участкам кода расшифровщика. Такие вирусы принято называть "не совсем полиморфными", или олигоморфными (oligomorphic).
Уровень 2. Ко второму уровню полиморфизма относят вирусы, расшифровщик которых имеет постоянной одну или несколько инструкций. Например, он может использовать различные регистры, некоторые альтернативные инструкции в расшифровщике. Такие вирусы также можно распознать по определенной сигнатуре - заданным сочетаниям байт в расшифровщике.
Уровень 3. Вирусы, использующие в расшифровщике команды, не участвующие в расшифровании вирусного кода, или "команды-мусора", относят к третьему уровню полиморфизма. Это такие команды ассемблера, как NOP, MOV AX, AX, STI, CLD, CLI и т.д. Данные вирусы также можно определить с помощью некоторой сигнатуры, если произвести отсеивание всех "мусорных" команд.
Уровень 4. Вирусы четвертого уровня используют в расшифровщике взаимозаменяемые инструкции и "перемешанные" инструкции без изменения алгоритма расшифрования. Например, ассемблерная команда MOV AX,BX имеет взаимозаменяемые инструкции: PUSH BX - POP AX; XCHG AX,BX; MOV CX,BX - MOV AX,CX и т. д. Детектирование данных вирусов возможно с помощью некоторой перебираемой сигнатуры.
Уровень 5. Пятый уровень полиморфизма включает свойства всех перечисленных уровней, а кроме того, расшифровщик может использовать различные алгоритмы расшифрования вирусного кода. Для расшифровки возможно использование основного вирусного кода, расшифровки части самого же декриптора или нескольких расшифровщиков, поочередно расшифровывающих друг друга либо непосредственно вирусный код. Как правило, обнаружение вирусов данного уровня полиморфизма с помощью сигнатуры невозможно. Если для обнаружения такого вируса возможен серьезный анализ кода только самого расшифровщика, то для лечения необходимо произвести частичную или полную расшифровку тела вируса, чтобы извлечь информацию о зараженном файле.
Уровень 6. К нему относятся нешифрованные вирусы - т. е. вирусы, состоящие из программных единиц-частей, которые "перемешиваются" внутри тела вируса. Данные вирусы, как "кубики", тасуют свои подпрограммы (инсталляции, заражения, обработчика прерывания, анализа файла и т. д.). Такие вирусы еще называются пермутирующими (permutating).
История
Первым представителем полиморфных вирусов стал "Chameleon" в начале 1990 года, однако проблема стала серьезней чуть позже – в апреле 1991 года была зарегистрирована эпидемия "Tequila". Идея полиморфных вирусов стала столь популярна, что дошло до создания генераторов полиморфных вирусных кодов – первым стал MtE. Кроме того, генератор позволял получать полиморфный вирус из обычного – путем присоединения к OBJ-файлу вируса файла полиморфного кода с идентичным расширением.
Фактически, с появлением генераторов для создания полиморфного вируса не требовалось знать код оригинального вируса – достаточно было просто "скормить" его генератору, и тот делал всю работу за начинающего хакера. Впоследствии полиморфные вирусы стали крайне популярны, так как для их отлова требуются специальные математические алгоритмы восстановления исходного кода вируса, эмуляция исполняемого вирусом действий и другие сложности.
Генераторы полиморфных вирусов также совершенствовались – в середине девяностых это были MTE 0.90 (Mutation Engine), TPE (Trident Polymorphic Engine), четыре версии NED (Nuke Encryption Device) и DAME (Dark Angel's Multiple Encryptor).
Полиморфные вирусы активно развивались примерно до начала XXI века, однако затем произошел общий крен вирусописательства в сторону червей и троянов. Технология постоянной мутации кода для затруднения обнаружения антивирусными программами временно оказалась невостребованной.
Однако начиная примерно с 2003 года полиморфизм снова начинает привлекать внимание вирусного сообщества. Это было вызвано тем, что антивирусные программы все больше и больше совершенствовались, и уже стало нельзя использовать в качестве инструментов скрытия кода различные программы-паковщики, которые были на тот момент излюбленным детищем вирусописателей.
Читайте также:


