Секвенирование днк при диагностики туберкулеза

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
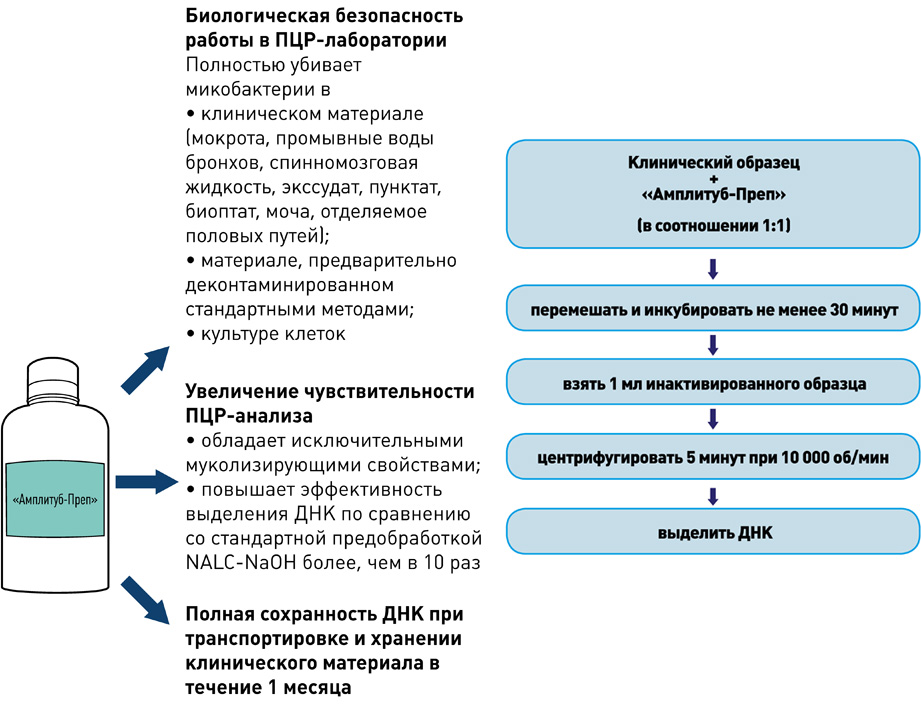
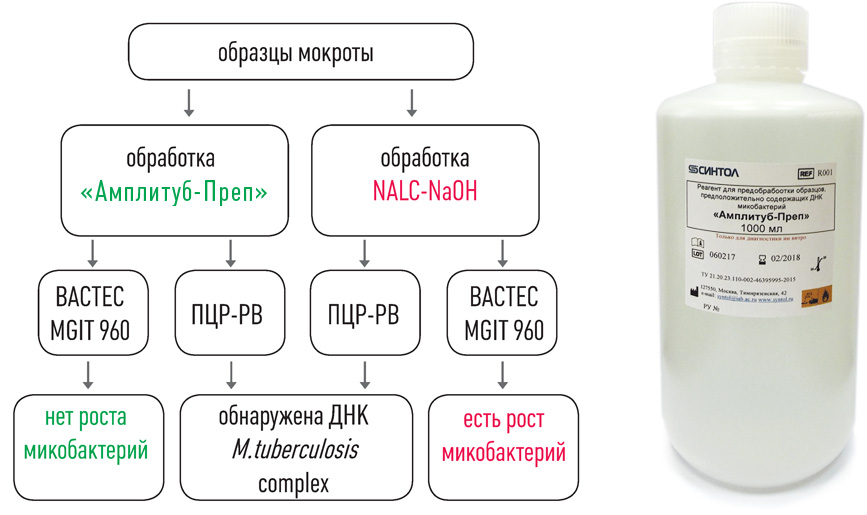
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
Набор реагентов АМПЛИТУБ-РВ — это:
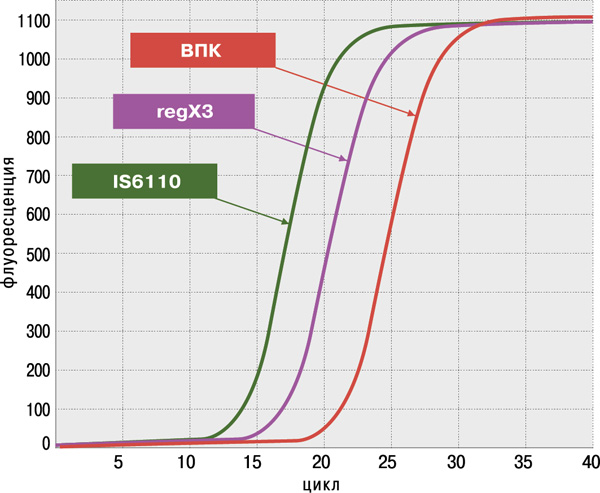
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
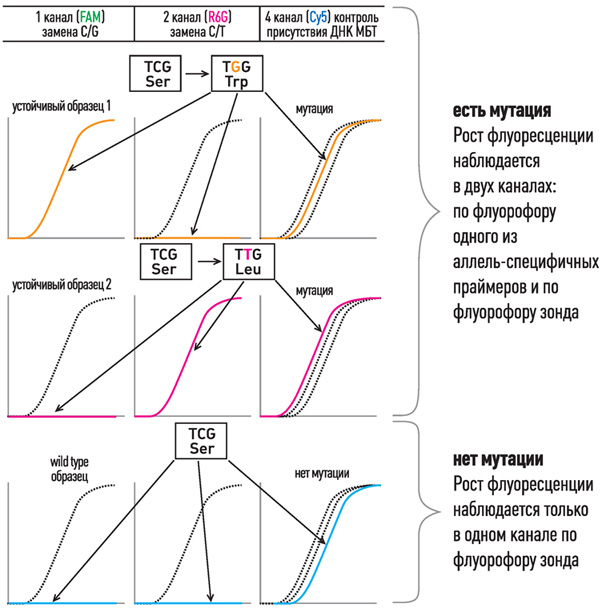
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
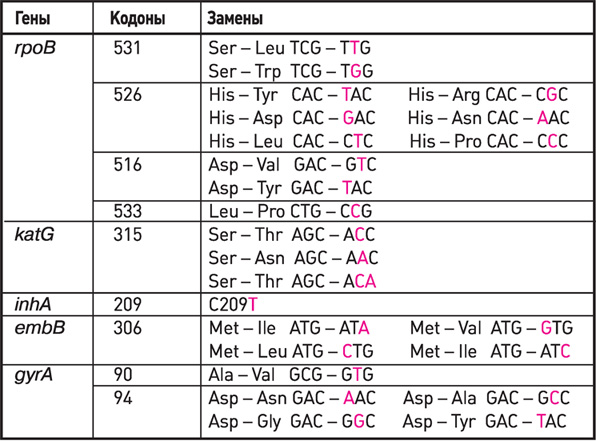
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
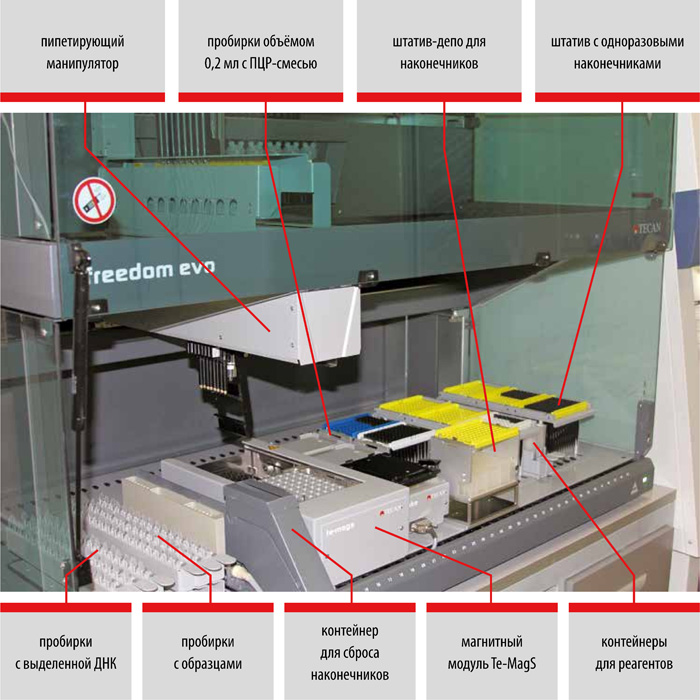
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
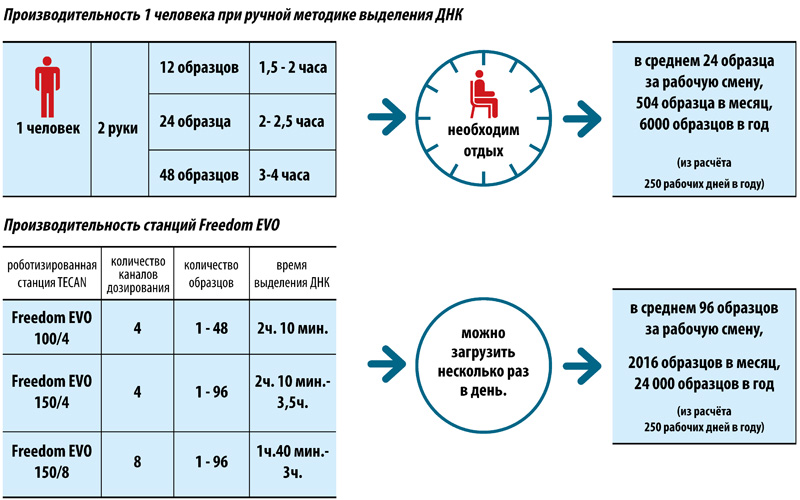

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Полногеномное секвенирование (ПГС) позволяет определять видовую принадлежность микобактерий и устойчивость к антибиотикам. Годичное исследование, проведенное британскими учеными, показало, что эффективность ПГС сравнима с традиционными методами.
Колонии M. tuberculosis. Credit: Wikimedia Commons

Колонии M. tuberculosis. Credit: Wikimedia Commons
В 2015 году по данным ВОЗ было зарегистрировано 10,4 миллиона новых случаев туберкулеза, 1,4 миллиона смертей связаны непосредственно с этим заболеванием. Около 3% новых случаев и 20% ранее выявленных вызваны штаммами, резистентными к одному или нескольким противотуберкулезным препаратам.
При подозрении на мультирезистентность ВОЗ рекомендует линейный анализ образцов (line probe assays, LPA) — это ПЦР и затем гибридизация, позволяющая идентифицировать гены устойчивости.
Молекулярные тесты более точны, чем фенотипические, в том числе биохимические. Однако из-за межвидового сходства некоторых генов, например рибосомных, близкородственные виды бывает трудно распознать. Сейчас вполне реально использовать для рутинной идентификации видов микобактерий (помимо Mycobacterium tuberculosis, существует 176 микобактериальных видов), а также для тестирования на чувствительность к лекарствам полногеномное секвенирование (ПГС).
Группа британских ученых сравнила результаты ПГС и стандартных лабораторных методик по идентификации микобактерий, прогнозированию резистентности к антибиотикам первой линии M. tuberculosis, а также оценила затраченное на анализы время. Исследования проводились в Национальной референсной службе по микобактериям в течение года. с апреля 2015 года по март 2016-го.
Виды определяли генотипированием (тест GenoType CM, затем GenoType Mycobacterium MTBC или GenoType Mycobacterium AS, Hain Lifescience GmbH, Nehran, Germany), устойчивость к антибиотикам — также генотипированием (GenoType MTBDRplus ) либо фенотипически (Becton Dickinson MGIT 960 system).
Из 2039 изолятов, определенных до вида методами LPA, для 74 (3,6%) не удалось определить вид методом секвенирования или ПГС, таким образом, для сравнения остались 1965. Клинически значимые виды были идентифицированы методом LPA и полногеномным секвенированием в 1902 изолятах, причем в 1825 (96,0%) результаты совпали.
По резистентности к препаратам первой линии — изониазиду и рифампину — в общей сложности были получены 2215 результатов LPA в 728 изолятах комплекса M. tuberculosis (группа близкородственных видов микобактерий, способных вызвать туберкулез). Исключая 216 (10,0%) случаев, когда данных не хватило для ПГС, общая согласованность составила 99,3%, чувствительность — 97,6%, специфичность — 99,5%.
Всего было зарегистрировано 2982 фенотипических результата по резистентности для 777 изолятов комплекса M. tuberculosis. Из них 356 (11,9%) не имели параллельных результатов ПГС, а в 154 (5,2%) случаях результат был неопределенным из-за обнаружения новых, ранее не охарактеризованных мутаций. За исключением этих данных, общая согласованность составила 99,2%, чувствительность — 94,2%, а специфичность — 99,4%. Медианное время обработки для обычных лабораторных тестов по сравнению с ПГС было близким — 20 и 21 день соответственно.
Показано, таким образом, что полногеномное секвенирование с большой точностью определяет виды и восприимчивость к лекарственным средствам.
T. Phuong Quan et al. // Evaluation of Whole-Genome Sequencing for Mycobacterial Species Identification and Drug Susceptibility Testing in a Clinical Setting: a Large-Scale Prospective Assessment of Performance against Line Probe Assays and Phenotyping. // J. Clin. Microbiol. February 2018, 56:14 e01480-17; Accepted manuscript posted online 22 November 2017, DOI: 10.1128/JCM.01480-17
Еще о микобактериях и молекулярной диагностике в Journal of Clinical Microbiology (2018, февраль)
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>
Туберкулез — проблема не только социальная.
кандидат биологических наук
Институт общей генетики им. Н.И. Вавилова РАН, Москва
Динамика заболеваемости туберкулезом в России
(вверху — всего населения, в середине — детей) и смертности от него.
По данным ВОЗ, туберкулезом инфицирована одна треть жителей нашей планеты. Ожидается, что к 2010 г. будет около 1 млрд вновь инфицированных, более 200 млн заболевших, а 70 млн умрет от этой болезни. К сожалению, таковы печальная статистика и не менее пессимистический прогноз. Однако не надо забывать, что впечатляющие успехи в научных разработках по молекулярной биологии туберкулеза могут быть реально использованы для точной диагностики и производства более эффективных вакцин и новых лечебных средств.
Особенности строения и функционирования возбудителя туберкулеза
В конце 1998 г. усилиями огромного коллектива молекулярных биологов из Великобритании, США, Франции и Дании полностью расшифрован геном Mycobacterium tuberculosis H37Rv — наиболее изученного лабораторного штамма (Cole S.T., Brosch R., Parkhill J. et al. // Nature. 1998. V.393. №6685. P.537—544). Этот самый медленно растущий на искусственных средах микроорганизм имеет довольно большой геном (4 411 529 пар нуклеотидов), 65.6% которого составляют гуанин и цитозин, что соответствующим образом отражается на аминокислотном составе бактериальных белков, которые в свою очередь определяют специфические особенности заболевания. Из 4000 генов 60 кодируют функциональные компоненты РНК: уникальный рибосомальный РНК оперон, 10Sа РНК, участвующий в деградации белков с нетипичной матричной РНК, РНК компонент фермента РНК-азы Р, а также 45 транспортных РНК (тРНК).
Причиной медленного роста микобактерий на искусственных средах, вероятно, служит необычайно большое расстояние между оперонами rrn и сайтами репликации oriC . Гены, кодирующие тРНК, которые узнают 43 из 61 возможных смысловых кодонов, распределены по всему геному. Интересно, что ни одна из многочисленных тРНК туберкулеза не узнает аденин в первой позиции антикодона, что в конечном итоге влияет на ход трансляции. Помимо большого количества гуанина и цитозина в геноме M. tuberculosis имеется множество вставок, повторяющихся по всему геному: IS 6110 — 16 раз, IS 1081 — 6 раз, а также другие повторы с меньшим числом копий. Устойчивость бактериальных клеток к лизису в культуральной среде определяют две профаговые последовательности. Выяснилось, что бактериальная клетка синтезирует все необходимые для своего обмена компоненты — незаменимые аминокислоты, витамины, ферменты и кофакторы. В ее геноме представлены гены самых разных ферментов: липидного обмена, гликолиза, цикла трикарбоновых кислот и глиоксилатного пути. По сравнению с другими видами бактерий у M. tuberculosis повышена активность ферментов липогенеза. Имеются два гена, которые кодируют гемоглобинподобные белки, играющие роль антиокислительных протекторов или ловушек избытка клеточного кислорода. Эти особенности способствуют быстрой адаптации туберкулезных бацилл к резким изменениям окружающей среды.
Несмотря на полную расшифровку структуры генома палочки Коха, пока не ясен механизм ее патогенности. Понятно только, что в патогенезе играют роль не единичные гены и даже не согласованное действие двух или же нескольких факторов. Ранее было известно, что за вирулентность микобактерий туберкулеза ответственны: ферменты каталаза и пероксидаза, нейтрализующие действие активного кислорода, который продуцируют фагоциты; ген mce , кодирующий макрофаг-колониобразующий фактор и sigma -фактор sig A ( aka rpoV ), мутация которого может привести к ослаблению жизнеспособности бактерий, а кроме того, клеточная стенка бактерии. Сложность ее состава не позволила пока выяснить механизм вирулентности. Анализ секрета микобактерий показал, что помимо протеаз патогенными свойствами могут обладать фосфолипаза С, липаза и эстераза — ферменты, атакующие клеточные и вакуолярные мембраны тканей человека.