Проблемы туберкулеза с млу

В настоящее время одной из основных проблем фтизиатрии является множественная лекарственная устойчивость микобактерий туберкулеза (МЛУ МБТ) к противотуберкулезным препаратам (ПТП) основного ряда. В каждом регионе для организации успешной борьбы с туберкулезом, планирования и проведения мероприятий по сокращению резервуара туберкулезной инфекции необходимо иметь четкое представление о распространенности МЛУ штаммов возбудителя среди больных с бактериовыделением [1, 4, 5, 8, 13–15].
Известно, что наличие у больного туберкулезом легких лекарственной устойчивости МБТ существенно снижает эффективность лечения, приводит к формированию хронических форм, устойчивого бациллярного ядра, повышает показатель смертности [3, 4, 7, 9, 11, 12].
Неблагоприятные социальные и экономические условия жизни отдельных групп населения, а также обусловленная этими условиями социальная дезадаптация пациентов, нарушения и прерывания режима химиотерапии, отрывы от лечения и наблюдения создают благоприятные условия для формирования, размножения и распространения лекарственно-устойчивых штаммов МБТ. При наличии исходной первичной множественной устойчивости МБТ наблюдается высокая вероятность хронизации туберкулезного процесса. Накопление неэффективно пролеченных больных с МЛУ МБТ способствует дальнейшему распространению возбудителя туберкулеза среди населения, инфицированию и новым случаям заболевания [1, 5, 6, 10].
Для мониторинга лечения больных с МЛУ МБТ рекомендованные временные рамки анализа исходов химиотерапии должны отражать продолжительность соответствующих режимов, поэтому когортный анализ рекомендуют проводить через 24 мес.
Цель исследования: оценить результаты лечения и диспансерного наблюдения впервые выявленных в 2006–2010 гг. больных туберкулезом легких с МЛУ МБТ.
Материал и методы исследования
Результаты исследования и их обсуждение
За последние годы в г. Якутске наблюдается заметное повышение частоты первичной множественной лекарственной резистетности среди впервые выявленных больных туберкулезом легких с бактериовыделением: от 17,6 % за 2008 г. до 28,3 % за 2010 г., т.е. в 1,6 раза. За период исследования в годовых когортах впервые выявленных больных с МЛУ МБТ наблюдалось всего 147 чел.: в 2006 г. – 16 больных, в 2007 г. – 34, в 2008 г. – 29, в 2009 г. – 26 и в 2010 г. – 42 чел., что свидетельствует о сохраняющейся тенденции к возрастанию лекарственно-устойчивого туберкулеза легких. В исследование включены взрослые больные туберкулезом легких, все ВИЧ-отрицательные.
При изучении возрастно-половой характеристики больных установлено, что среди впервые выявленных преобладают мужчины – 53 (69,4 %) чел. В распределении больных по возрасту как среди женщин, так и у мужчин установлено превалирование лиц в возрасте от 20 до 39 лет – 63 (42,8 %) чел., что говорит о том, что большинство заболевших ‒ люди трудоспособного возраста.
При оценке семейного положения выявлено, что состояли в браке или имели гражданскую семью на момент заболевания 39 (26,5 %) чел., разведенные лица составили 14 (9,5 %) чел., все остальные считают себя одинокими – 94 (63,9 %). По этнической характеристике больных с МЛУ МБТ существенной разницы не наблюдается: коренные жители составили – 67 (45,5 %), приезжие – 80 (54,5 %) чел.
При анализе профессионального состава больных с МЛУ МБТ обращало на себя внимание то, что большая часть лиц трудоспособного возраста не имеют постоянного места работы – 50,3 % (74 чел.), рабочие составили 12,3 % (18 чел.), служащие – 18,3 % (27 чел), студенты – 9,5 % (14 чел.), пенсионеры – 2,1 % (3 чел.) и инвалиды по соматическим заболеваниям – 7,5 % (11 чел.). У 1/4 больных в анамнезе отмечено пребывание в учреждениях пенитенциарной системы.
Новые случаи туберкулеза легких выявлялись как при обращении больных в лечебно-профилактические учреждения с изменениями в самочувствии – 44,3 % (65 чел.), так и при прохождении профилактического осмотра – 41,8 % (62 чел.), кроме того, при привлечении противотуберкулезным диспансером лиц, состоящих в контакте с туберкулезным больным, выявлено 13,9 % (20 чел.).
В клинической характеристике впервые выявленного туберкулеза легких с МЛУ преобладает инфильтративная форма – 89 (60,5 %) чел., диссеминированная составила 30 (20,4 %), очаговая – 20 (13,6 %), регистрировано по три случая казеозной пневмонии (2,0 %) и фиброзно-кавернозного туберкулеза легких (2,0 %) и два случая туберкуломы (1,5 %).
У всех больных туберкулезный процесс выявлен в фазе распада, у 40 (41,6 %) деструкции имелись в обоих легких, у 36 (37,5 %) больных они имели множественный характер, т.е. более двух полостей распада, в 20 (20,8 %) случаях имелись крупные полости, т.е. более 4 см в диаметре.
Характеристика резистентности возбудителя туберкулеза к антибактериальным препаратам приведена в табл. 1.
Характеристика лекарственной устойчивости у впервые выявленных больных туберкулезом легких с МЛУ МБТ

Пациент получает лечение МЛУ ТБ в клинике MSF Инсейн в Янгоне, Мьянма (Yasmin Rabiyan/ MSF)
Туберкулез – это самое смертоносное инфекционное заболевание в мире: по оценкам, в 2016 году он унес жизни 1,7 млн человек. Но кроме этого, мы утрачиваем позиции в борьбе с устойчивыми формами туберкулеза.
В то время как обычный туберкулез поддается излечению, лекарственно-устойчивый туберкулез зачастую приводит к смерти больного.
Следующие вопросы и ответы помогут лучше понять сложную задачу, которая стоит перед нами:
Лечение обычной формы туберкулеза длится шесть месяцев, в течение которых пациент принимает четыре разных антибиотика.
Но такое лечение все чаще и чаще оказывается напрасным, потому что используемые препараты неэффективны против устойчивых форм туберкулеза.
В зависимости от уровня лекарственной устойчивости, различают три типа туберкулеза:
- Лекарственно-устойчивый туберкулез (ЛУ ТБ)
- Туберкулез с множественной лекарственной устойчивостью (МЛУ ТБ)
- Туберкулез с широкой лекарственной устойчивостью (ШЛУ ТБ)
Проект endTB ориентирован на лечение МЛУ ТБ и ШЛУ ТБ. Перейдите по ссылке, чтобы узнать больше о проекте.
Масштабы проблемы только увеличиваются. По оценкам ВОЗ, каждый год появляется полмиллиона новых случаев МЛУ ТБ, причем один больной МЛУ ТБ может заразить в течение года от 10 до 15 человек.
Да. Когда человек с легочным туберкулезом разговаривает, чихает и – особенно – кашляет, он распространяет бактерии воздушно-капельным путем. Если здоровый человек вдохнет эти бактерии, он может заразиться. Заражение особенно часто происходит при длительном и близком контакте с больным туберкулезом.
Если больной получает эффективное лечение, риск распространения болезни значительно снижается.
Симптомы МЛУ ТБ в целом схожи с симптомами обычного туберкулеза: потеря веса, лихорадка, ночная потливость и чувство слабости. Если туберкулез поражает легкие, – а это случается в большинстве случаев и представляет собой фактически единственную заразную форму туберкулеза, – часто появляется боль в груди и кашель с кровью.
Довольно часто туберкулез диагностируется точно так же, как и сто лет назад: образец мокроты больного помещают под микроскоп и изучают на наличие бактерий туберкулеза. Проведение самого надежного теста этого типа занимает два месяца.
В большинстве стран проведение такого теста усложняется из-за отсутствия лабораторий, оборудованных для диагностики туберкулеза, и поэтому образцы приходится отправлять заграницу. Из-за этого заболевание часто не диагностируется.
В последние годы появились экспресс-тесты, в том числе перспективная технология под названием Xpert MTB/RIF, которая способна обнаружить бактерии туберкулеза менее, чем за два часа. Эта технология также может выявить устойчивость туберкулеза к рифампицину, одному из основных противотуберкулезных препаратов. Иными словами, она помогает в диагностике лекарственно-устойчивого туберкулеза (ЛУ ТБ).
К сожалению, система Xpert MTB/RIF пока непригодна для использования на местах, в пункте оказания помощи, так как для ее работы требуется постоянное подключение к электросети и вентиляция воздуха. Тем не менее, она значительно упростила диагностику туберкулеза с устойчивостью к рифампицину в окружных медицинских учреждениях.
Разработка следующего поколения системы Xpert или других молекулярных экспресс-тестов должна способствовать дальнейшей децентрализации диагностики и выявлению устойчивости к другим противотуберкулезным препаратам.

Общинный медработник Вероника Киспе и техник полевой медицинской службы Есела Родригез консультируют пациента Диего* в медицинском центре Пунчаука, Карабайльо, Перу.
* Имя пациента изменено
(Фото William Castro Rodríguez / Partners In Health)
Устойчивость к антибиотикам может возникнуть в следующих случаях:
- При проведении несоответствующего лечения, как, например, прием некачественных препаратов, нерегулярный прием препаратов или прием препаратов в меньших дозировках, неправильных комбинациях или через большие промежутки времени;
- При заражении бактериями туберкулеза, которые уже обладают лекарственной устойчивостью.
Очень часто никак: мир пока не готов к борьбе с МЛУ ТБ.
Из 600 000 пациентов, которым в 2016 году было необходимо лечение МЛУ ТБ, лишь 129 689 или 22% получили соответствующее лечение.
Для этих людей тяжелое бремя МЛУ ТБ не ограничивается симптомами болезни.
Из-за того, что МЛУ ТБ устойчив к большинству эффективных противотуберкулезных препаратов, у пациентов почти нет вариантов лечения.
- может длиться до двух лет;
- включает восемь месяцев инъекций и прием до 14 600 таблеток;
- часто вызывает изнуряющие побочные эффекты, например, нарушения работы желудочно-кишечного тракта, острый психоз, хроническую глухоту и многие другие.
Очень часто пациенты бросают лечение до его завершения.
Более того, само лечение оказывается эффективным только у 54% пациентов.
Это означает, что только 11.9% из всех предполагаемых больных МЛУ ТБ могут рассчитывать на излечение от болезни.
Зачастую МЛУ ТБ приводит к смерти больного из-за высокой токсичности и низкой эффективности препаратов, а также запущенности заболевания на момент начала адекватного лечения (если оно вообще начинается).
Возбудителями МЛУ ТБ являются бактерии, устойчивые к двум основным препаратам стандартного режима лечения – изониазиду и рифампицину. Лечение часто длится 18‑24 месяцев, в течение которых пациент принимает не менее пяти различных препаратов.
Что касается ШЛУ ТБ, то он, по подсчетам, встречается в 6.2% всех случаев МЛУ ТБ, однако в некоторых странах доля ШЛУ ТБ может достигать 25–30% (например, в Беларуси, где работает endTB). Бактерии ШЛУ ТБ обладают устойчивостью к двум основным препаратам стандартного режима лечения и двум основным препаратам режима лечения МЛУ ТБ.
Довольно часто лечение ШЛУ ТБ длится 24 месяца, в течение которых больной принимает не менее пяти препаратов, многие из которых очень токсичны и не имеют доказанной эффективности. Среди таких пациентов процент излечившихся еще ниже: только 30%, согласно ВОЗ.
Судя по всему, бремя МЛУ ТБ и ШЛУ ТБ распространяется по всему миру. И, несмотря на то, что во всем мире пациенты с МЛУ ТБ составляют лишь 4.6% от общего числа больных туберкулезом, из-за широкого распространения туберкулеза мы каждый год видим не менее полумиллиона новых случаев МЛУ ТБ.
В Африке и Азии процент больных МЛУ ТБ низкий. Однако в Африке, из-за эпидемии ВИЧ, миллионы людей становятся исключительно уязвимыми для первичного и повторного заражения туберкулезом и МЛУ ТБ.
В странах Восточной Европы и бывшего Советского Союза отмечено низкое абсолютное число больных туберкулезом, однако процент лекарственно-устойчивого туберкулеза крайне высок.
Первый пациент принимает самую первую дозу бедаквилина, Алматы, Казахстан.
(Фото Yekaterina Sahabutdinova / Partners In Health)
В 90-е гг. XX века эксперты по туберкулезу провели оценку распространения лекарственно-устойчивого туберкулеза. Вплоть до начала XXI века это заболевание не считалось проблемой мирового масштаба. А это значит, что готовые препараты для его лечения отсутствовали.
Не проводилось ни одного исследования, не совершалось научных открытий, не создавалось новых режимов лечения почти 50 лет.
Препараты, используемые для лечения лекарственно-устойчивого туберкулеза – это старые токсичные лекарства, которые ранее часто применялись для лечения других заболеваний. В разных регионах мира используются разные режимы лечения. По нашим оценкам, для лечения МЛУ ТБ или ШЛУ ТБ применяется более 20 различных лекарственных средств.
Все режимы лечения объединяет только одно: они попросту неэффективны и недостаточно просты в применении, чтобы сдержать распространение болезни.
Режим лечения – это комбинация препаратов, назначаемая пациенту для лечения заболевания. Из-за того, что научных исследований по туберкулезу мало, а препараты по-разному действуют на разных людей, мы не знаем, какая комбинация препаратов лучше всего подойдет определенному пациенту.
Задача проекта endTB состоит в восполнении этого недостатка доказательной базы.
Это первые противотуберкулезные препараты, разработанные за последние 50 лет. Они дают большие надежды в лечении лекарственно-устойчивых форм туберкулеза.
Будем надеяться, что открытие этих препаратов приведет к улучшению результатов лечения, и на данный момент исследования указывают на их эффективность. В некоторых развитых странах бедаквилин и деламанид уже одобрены и имеются в продаже.
Одна из целей проекта endTB состоит в расширении применения этих препаратов. На сегодняшний день только 5% пациентов могут рассчитывать на лечение бедаквилином и деламанидом, и, как правило, это жители богатых стран.
Другая важная цель проекта endTB состоит в повышении эффективности режимов лечения. Производитель лекарственного препарата стремится вывести на рынок свой продукт. Однако на рынке, прежде всего, не хватает данных о применении препаратов в различных комбинациях.
У нас нет данных по оптимальному использованию этих препаратов, и поэтому мы не знаем, как велика в них потребность и как много пациентов во всем мире получат пользу от их приема. Другими словами, сбор данных о новых и улучшенных режимах лечения окажет влияние на потребности рынка и поможет повысить доступность бедаквилина и деламанида для пациентов.
Лекарственно устойчивые штаммы туберкулёза возникают естественным путём в ходе спонтанного мутагенеза как ответная реакция на введение антибиотиков. Они, как правило, обладают слабым фитнесом, т.е. они медленнее растут, слабее размножаются, у них нет других преимуществ, за исключением устойчивости к антибиотикам. И, соответственно, первоначальная стратегия при столкновении с лекарственно устойчивыми штаммами заключалась в том, чтобы, во-первых, антибиотики, направленные на лечение туберкулёза, были изъяты из широкой сети обращения и использовались только в специализированных учреждениях и, во-вторых, курс лечения проводился особым образом: сначала больного лечили антибиотиками, потом делали перерыв, за это время оставшиеся лекарственно чувствительные штаммы начинали доминировать, соответственно вытесняя лекарственно устойчивые варианты, затем опять проводили химиотерапию, достигали хороших результатов, что снова приводило к появлению лекарственно устойчивых штаммов, снова делали перерыв и так до полного излечения. Но потом оказалось, и обнаружили это, прежде всего в Африке, что такие проблемы как СПИД, который поражает иммунную систему, приводят к значительному росту числа лекарственно устойчивых штаммов. Причём если раньше эти штаммы были в основном в лечебных учреждениях, то теперь они стали обнаруживаться во всей популяции. И наиболее распространённая на сегодняшний день теория, для которой находится всё больше и больше подтверждений, заключается в том, что для того, чтобы лекарственно устойчивые штаммы вырвались в популяцию, они должны пройти несколько циклов размножения в организме со слабой иммунной системой, а именно такими объектами являются, прежде всего, больные СПИДом. Далее обнаружилось, что в странах, где происходят колоссальные социальные пертурбации, где всё рушится, возникает большая прослойка бедных, социально дезориентированных людей, у которых доходы ниже прожиточного реального минимума и иммунная система ослаблена, и такие люди тоже становятся тем резервуаром, в котором лекарственно устойчивые штаммы могут адаптироваться и приобрести такие преимущества, которые позволяют им конкурировать с лекарственно чувствительными штаммами. Таким образом с появлением и распространением СПИДа в мире, а также с началом таких крупных социальных потрясений, как в бывших странах СНГ, появились две большие зоны, включающие Африку, Азию, страны СНГ, где лекарственно устойчивые штаммы стали стремительно распространяться.
И тогда первыми забеспокоились международные организации, потому что эпидемия любого заболевания, в том числе и туберкулёза, в одной стране, является проблемой многих. В данном случае это было связано и усугублялось миграцией, поскольку открылись все ворота, люди стали эмигрировать из бывшего Советского Союза, и в Западной Европе вдруг стали обнаруживать те генотипы туберкулёза, которые раньше там не регистрировались.
Несмотря на то, что со дня открытия туберкулёза прошло уже больше ста лет, микобактерия хорошо изучена, известен и расшифрован её геном, но, тем не менее, мы пока не имеем надёжных средств вакцинации от туберкулёза. Спектр имеющихся лекарственных препаратов из-за проблемы лекарственной устойчивости приходится постоянно расширять и модифицировать, и ещё одна большая проблема – это проблема ранней диагностики туберкулёза.
Кох, открыватель туберкулёза, получивший за это Нобелевскую премию, был уверен, что можно быстро справиться с этой инфекцией. Но оказалось, что вакцина Коха защиты не даёт. Тогда появилась другая вакцина, БЦЖ, но она защищает только детей, а после 14 лет – что её вводи, что ни вводи – защиты нет. Кроме того, эффективность использования этой вакцины значительно меняется в зависимости от географического региона. В некоторых странах она обеспечивает высокую защиту детей – до 80%, а в других – 0%. К этому могли привести очень многие факторы. БЦЖ отличается от диких штаммов туберкулёза, у неё отсутствует фрагмент генома, и соответственно, несколько десятков генов у БЦЖ нет. В каждой стране штаммы для производства вакцины свои, единого мирового стандарта нет. По утверждениям специалистов-фтизиатров, наблюдается неуклонный рост осложнений при вакцинации БЦЖ. В чём причины? Они могут быть разнообразными. Может быть, сам ребёнок и его состояние, потому что в последнее время возросло число патологий среди новорождённых. Может быть, вакцинный штамм. Вакцинные штаммы строго контролируют по всем стандартным микробиологическим параметрам, но эти параметры не позволяют учитывать генотипические варианты. Так, во Франции на сегодняшний день идентифицировано не менее четырех штаммов БЦЖ, которые используют для вакцинации, в России – около двадцати. Поскольку при производстве штамм контролируется не на генетическом уровне, то не исключено, что на генетическом уровне могут происходить изменения и некоторые из них могут привести к не очень хорошим свойствам, которые, в свою очередь, и приводят к осложнениям. Возможно. Этого никто не проверял. Мы готовы принять участие в таких исследованиях, и мы могли бы найти те нуклеотидные замены, которые не должны присутствовать в исходном штамме, и создать устройство, с помощью которого можно было бы контролировать штаммы в ходе производства. Это позволяло бы проводить более глубокий независимый внутренний производственный контроль. Это в любом случае необходимо делать и, безусловно, это будет сделано, потому что любые живые вакцины требуют такого контроля. Всё в этом мире меняется, хотим мы или нет, это естественный, неизбежный процесс, возникают мутации, приобретаются какие-то селективные преимущества, иногда эти селективные преимущества срабатывают в организме, и это может привести к осложнениям. Такие работы – составление генетических портретов вакцинных штаммов - необходимы для практического здравоохранения и весьма интересны с научной точки зрения.
Следующая проблема – диагностика. Для детей это – реакция Манту, для взрослых – флюорография или томография. В ходе наших исследований и в ходе общения с коллегами, мы поняли, что реакция Манту имеет весьма условное диагностическое значение. Во-первых, реакция Манту не однозначна и существенно зависит от иммунного статуса человека. Во-вторых, она не всегда обладает высокой специфичностью и чувствительностью и не может отличить иммунитет, полученный при вакцинации БЦЖ, от дикой бактерии. Ведь реакция Манту – это суммарные белки от БЦЖ, и если вы вакцинированы БЦЖ, то они пересекаются с белками, полученными при прививке, появляется папула, на основании чего возникает подозрение, и надо проводить исследования дальше, тщательно проверять, что же происходит в организме. Чувствительность реакции Манту очень высока, а специфичность очень низкая, по оценкам некоторых специалистов она составляет всего 8-20%. Если же ещё накладывается коассоциированная инфекция – ВИЧ, или гепатит, или респираторные заболевания, то это вносит ещё большую путаницу. Поэтому в случае положительной реакции Манту необходимо провести подтверждающие диагностические анализы с помощью более совершенных методов. Если же говорить о флюорографии или результатах томографических исследований, то они выдают уже патологию. Т.е. это, безусловно, очень нужная, но уже не ранняя диагностика.
В России Т-клеточные технологии пока не внедрены. А в мире эти технологии уже внедрены в Германии и США, в специализированных крупных центрах, что надо делать и нам. Там не только есть центры, но действует система иммунологического мониторинга и система мониторинга генотипов микобактерии туберкулёза. Это позволяет реально оценивать эффективность всех противотуберкулёзных мероприятий, позволяет изучать процессы, которые реально происходят с микобактерией туберкулёза, вовремя выявлять эпидемические очаги, а не работать, как это делали раньше, по территориям в целом.
Туберкулез легких с множественной лекарственной устойчивостью возбудителя у больных сахарным диабетом
Изучение особенностей клинических проявлений и эффективности лечения туберкулеза легких с множественной лекарственной устойчивостью (МЛУ) возбудителя (Mycobacterium tuberculosis) у больных с разными типами сахарного диабета (СД). Материалы и методы. Обследованы 66 пациентов с туберкулезом легких в сочетании с СД типа 1 (СД 1) и 48 пациентов с туберкулезом легких и сопутствующим СД типа 2 (СД 2). Установлено, что у больных СД 1 туберкулез с МЛУ возбудителя чаще наблюдался у мужчин в возрасте до 40 лет в виде инфильтративного туберкулеза легких с наличием распада в легочной ткани размером до 2 см в диаметре, бактериовыделением и резко выраженной интоксикацией. У больных СД 2 туберкулез с МЛУ чаще наблюдался у мужчин в возрасте старше 40 лет в виде фиброзно-кавернозного туберкулеза с наличием распада в легочной ткани размером более 2 см в диаметре, бактериовыделением и умеренно выраженной интоксикацией. Эффективность комплексного лечения по прекращению бактер ювыделения в сравниваемых группах достоверно не различалась и составила 71,2 и 64,7% соответственно. Однако по закрытию каверн в легком лечение было более эффективным у больных СД 1, что, вероятно, обусловлено особенностями туберкулезного процесса у данной категории больных. Ключевые слова: туберкулез легких, множественная лекарственная устойчивость, сахарный диабет. Повышение эффективности лечения больных туберкулезом легких с сопутствующим сахарным диабетом (СД) является актуальной проблемой современной фтизиатрии. Объективными предпосылками этого являются как увеличение числа больных туберкулезом легких с множественной лекарственной устойчивостью (МЛУ) возбудителя (Mycobacterium tuberculosis - МБТ), так и неуклонный рост распространенности СД. По данным Всемирной организации здравоохранения, в 2017 г. в мире были зарегистрированы 600 тыс. больных с МЛУ МБТ (490 тыс. больных с устойчивостью к изониа шду и рифампицину и 110 тыс. пациентов с устойчивостью МБТ к рифампицину). В Российской Федерации в 2016 г. зарегистрированы 37 925 больных туберкулезом с МЛУ МБТ. Сложность эпидемической ситуации по туберкулезу обусловлена также значительным ростом числа больных с сопутствующим СД. По темпам распространения СД опережает все неинфекционные заболевания. По данным Международной диабетической федерации, в 2016 г. в мире насчитывалось 425 млн больных СД. В настоящее время каждый 11-й человек на Земле болен СД. РФ по числу больных СД занимает 5-е место в мире. По данным Госрегистра, в РФ в 2016 г. были зарегистрированы 4,38 млн больных СД. СД является фактором риска развития туберкулеза. У больных СД туберкулез выявляется в 3-14 раз чаще, чем у остального населения. Особенно подвержены заболеванию туберкулезом лица с тяжелым декомпенсированным диабетом и с его осложнениями. Известно, что у больных СД наблюдаются различные осложнения: микроангиопатия (диабетическая нефропатия, диабетическая ретинопатия), макроангиопатия (ишемическая болезнь сердца, цереброваскулярная болезнь, хронические облитерирующие заболевания периферических артерий), диабетическая нейропатия, диабетическая нейроостеоартропатия (артропатия Шарко), синдром диабетической стопы, которые ухудшают переносимость противотуберкулезных препаратов, что затрудняет лечение туберкулеза у этой категории больных. Ситуация усугубляется еще и тем, что в условиях повсеместного распространения МЛУ МБТ у больных СД чаще диагностируют первичный туберкулез с МЛУ возбудителя. Данная объективная реальность объясняет актуальность проблемы туберкулеза легких с МЛУ возбудителя у больных СД. Цель исследования - изучение особенностей клинических проявлений и эффективности лечения туберкулеза легких с МЛУ возбудителя у пациентов с разными типами СД. Были обследованы 114 больных туберкулезом легких с МЛУ МБТ и сопутствующим СД. Среди обследованных пациентов преобладали мужчины - 72 (63,2%) человека, женщин было 42 (36,8%). Возраст больных варьировал от 18 до 65 лет. Туберкулез был выявлен впервые у 20 (17,6%) пациентов. После первого неэффективного курса лечения в стационар поступили 43 (37,7%), после двух и более курсов - 40 (35,1%) человек. Рецидив туберкулеза был диагностирован у 11 (9,6%) пациентов. При распределении по формам заболевания наибольшую группу составили больные инфильтративным туберкулезом легких - 45 (39,5%) человек. Фиброзно-кавернозный туберкулез был диагностирован у 38 (33,3%), туберкулема - у 26 (22,8%), диссеминированный туберкулез легких - у 3 (2,6%) и казеозная пневмония - у 2 (1,7%) пациентов. Деструктивные изменения в легких были выявлены у всех больных (100%). Каверны размером до 2 см наблюдали у 43 (37,7%) больных, 2-4 см - у 61 (53,5%), более 4 см - у 10 (8,8%) пациентов. Туберкулезная интоксикация у 11 (9,6%) больных была выражена слабо, у 70 (61,4%) - умеренно и у 33 (28,9%) - резко. МБТ в мокроте были обнаружены у всех больных (100%). В условиях стационара всем пациентам проводили детальное обследование с помощью клинико-рентгенологических и лабораторных методов. Применяли как обязательные, так и факультативные методы исследования. Нарушение углеводного обмена определяли по содержанию глюкозы крови, которое проводили еженедельно (при необходимости чаще), по гликемическому и глюкозурическому профилям. При поступлении также исследовали уровень гликированного гемоглобина. Всем больным, находившимся под нашим наблюдением, было проведено комплексное лечение. Применяли индивидуальные режимы химиотерапии с учетом спектра лекарственной устойчивости МБТ и переносимости противотуберкулезных препаратов. После получения последующих данных о лекарственной устойчивости МБТ проводили коррекцию режима химиотерапии. Кроме того, всем больным независимо от типа СД на стационарном этапе проводили инсулинотерапию. Помимо этого назначали различные виды патогенетической терапии (физиотерапия, витаминотерапия, гепатопротекторы, плазмаферез, ангиопротекторная терапия, лечение, направленное на улучшение нервнопроводимости).

Устойчивость возбудителя туберкулеза к препаратам, используемым для лечения, и особенно множественная лекарственная устойчивость (МЛУ), во многих странах стала серьезной проблемой общественного здравоохранения, препятствующей эффективной борьбе с туберкулезом [3; 4].
По оценкам Всемирной организации здравоохранения в 2012г около 3,7% впервые выявленных больных туберкулезом выделяли штаммы микобактерий с множественной лекарственной устойчивостью. Среди ранее получавших лечение больных уровни МЛУ гораздо более высокие – около 20%. В 2011 г. среди всех случаев заболевания туберкулезом было от 220 000 до 400 000 случаев заболевания туберкулезом с МЛУ. Около 60% этих случаев приходилось на страны БРИКС (Бразилию, Российскую Федерацию, Индию, Китай и Южно-Африканскую Республику) [9].
На территории Сибири и Дальнего Востока наблюдался самый высокий уровень регистрируемого числа случаев туберкулеза с множественной лекарственной устойчивостью среди впервые выявленных больных [6; 8].
Уровень первичной лекарственной устойчивости характеризует часть микобактериальной популяции, циркулирующей на территории, и этот показатель чрезвычайно важен для оценки степени напряженности эпидемической ситуации [2; 7].
Лекарственная устойчивость имеет не только клиническое значение, связанное с увеличением продолжительности лечения дорогостоящими препаратами, вызывающими серьезные побочные реакции, но и крайне важное эпидемиологическое значение. Доказано, что эпидемические очаги туберкулеза, сформированные бактериовыделителями устойчивых к противотуберкулезным препаратам микобактерий, представляют собой территории особого риска заболевания контактных лиц. Недостаточная эффективность химиопрофилактики в очагах туберкулеза с МЛУ способствует формированию очаговости с высоким уровнем заболеваемости контактных лиц [5].
В системе эпидемиологического надзора за туберкулезной инфекцией изучение характеристик циркулирующих штаммов микобактерий туберкулеза (МБТ) позволяет адекватно воздействовать на составляющие эпидемического процесса [1].
Цель исследования: качественная характеристика циркулирующих на территории Омской области штаммов M. tuberculosis, а также краткосрочное прогнозирование заболеваемости населения туберкулезом с множественной лекарственной устойчивостью.
Материалы и методы
Оценка статистической значимости различий результатов исследования в сравниваемых группах была проведена с помощью критерия Пирсона χ2 (хи-квадрат). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимался равным 0,05. Статистический анализ осуществлялся с использованием возможностей МS Excel, STATISTICA 7.0.
Результаты и обсуждение
На территории Омской области за исследуемый период наблюдалось некоторое улучшение ряда эпидемиологических показателей, характеризующих эпидемический процесс туберкулезной инфекции, что выражалось в наметившейся тенденции к снижению заболеваемости, распространенности и смертности населения от туберкулеза.
Вместе с тем сохранялся значительный уровень заболеваемости населения туберкулезом органов дыхания с бактериовыделением - 44,0 на 100 тысяч населения (95% ДИ 41,0÷46,9). Распространенность туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ) возросла с 20,7 (95% ДИ 18,7÷22,6) до 40,4 на 100 тысяч населения (95% ДИ 37,6÷43,2). Хотя за указанный период смертность населения от туберкулеза снизилась (с 25,8 до 11,4 на 100 тысяч населения, T сн.=-3,47%), в структуре смертности ежегодно увеличивался удельный вес умерших, страдавших туберкулезом с МЛУ – с 10,7% (N= 468; n=50; ДИ 2,2÷19,2) в 2004г до 51,5% в 2013г.(N=227; n=117; ДИ 42,4÷60,5) (p=0,000).
Динамика заболеваемости туберкулезом органов дыхания с множественной лекарственной устойчивостью имела умеренную тенденцию к росту (Тпр. = 2,7%). Заболеваемость МЛУ-ТБ возросла практически в 2 раза с 3,5 (95% ДИ 2,7÷4,3) до 7,6 на 100 тысяч населения (95% ДИ 6,3÷8,8), причем рост заболеваемости МЛУ-ТБ происходил на фоне умеренной тенденции (Тсн.=-1,43%) к снижению общей заболеваемости населения туберкулезом (рисунок).
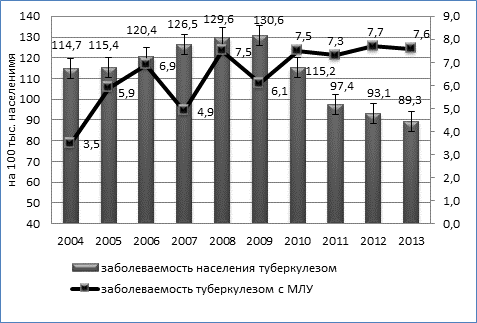
Динамика заболеваемости туберкулезом населения Омской области и заболеваемости туберкулезом с множественной лекарственной устойчивостью возбудителя (на 100 тыс. населения), 2004-2013гг.
К концу наблюдаемого периода доля больных с первичной МЛУ среди обследованных больных составляла 22,0% (N=685; n=151; ДИ 15,4÷28,6), доля приобретенной в процессе лечения множественной лекарственной устойчивости в контингенте больных - бактериовыделителей – 49,6% (N=326; n=162; ДИ 41,9÷57,3).
Нами изучена качественная характеристика бактериовыделения в контингенте впервые выявленных больных туберкулезом органов дыхания. Как показали результаты исследования, в основной группе лекарственная устойчивость к одному и более противотуберкулезных препаратов была обнаружена у 52,5% (N=122; n=64; ДИ 40,3÷64,7) впервые выявленных больных туберкулезом. В структуре лекарственной устойчивости монорезистентными (устойчивыми к одному из ПТП) были 9,4% выделенных штаммов, множественная лекарственная устойчивость определена в 59,4% случаев, полирезистентыми (устойчивыми к комбинации различных ПТП, кроме одновременной к изониазиду и рифампицину) были 31,2% штаммов (таблица).
Структура первичной лекарственной устойчивости штаммов М. tuberculosis, выделенных у впервые выявленных больных туберкулезом органов дыхания
Читайте также:


