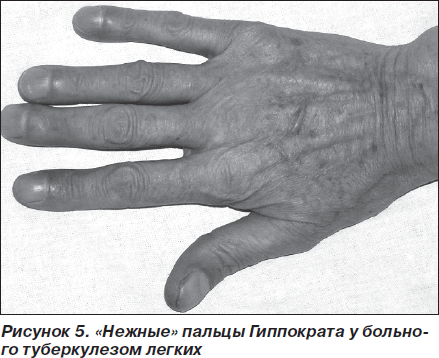
Пальцы барабанные палочки при туберкулезе
Пальцы Гиппократа: клиническое значение
Потейко П.И., Харьковская медицинская академия последипломного образования, кафедра фтизиатрии и пульмонологии
В настоящее время ПГ считают основным проявлением гипертрофической остеоартропатии (ГОА, синдром Мари — Бамбергера) — множественный оссифицирующий периостоз.
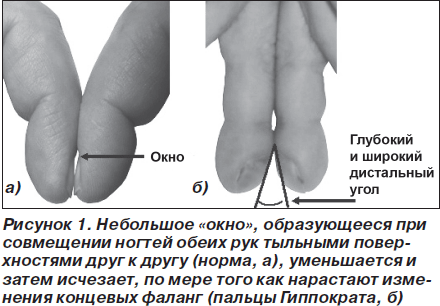
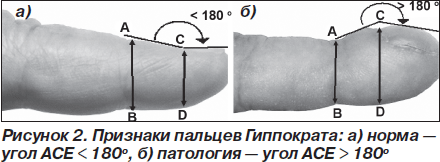
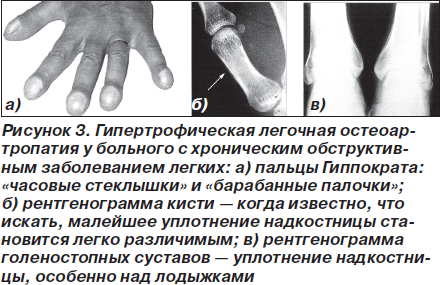
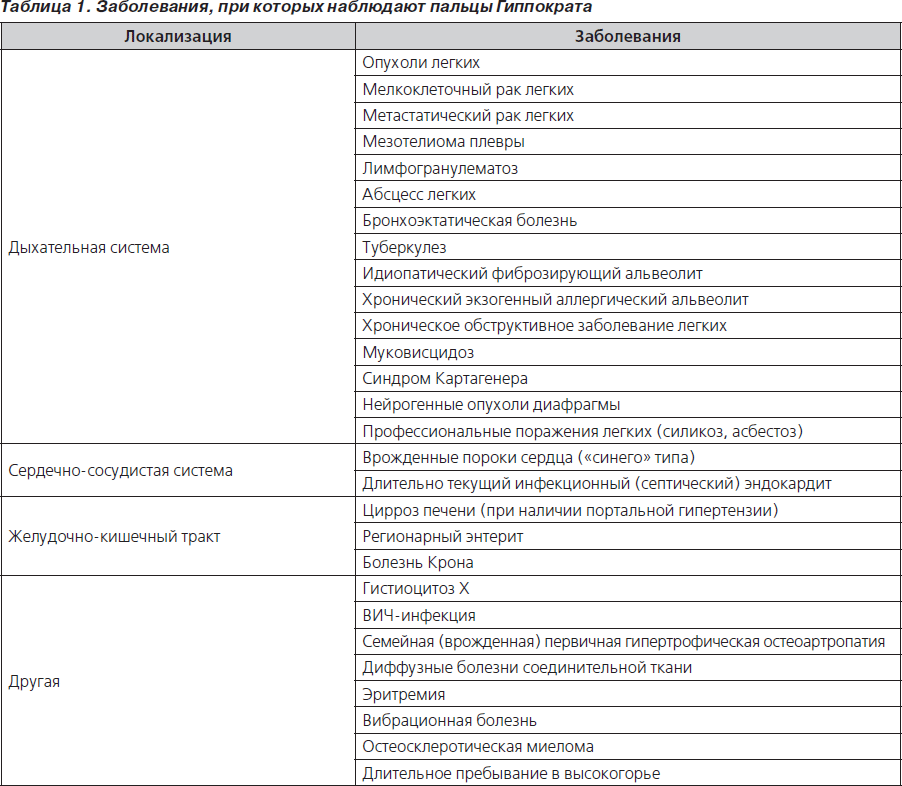

При диффузных болезнях соединительной ткани с вовлечением легочной паренхимы ПГ всегда отражают тяжесть ДН и являются крайне неблагоприятным прогностическим фактором [4, 20, 30].
По мере прогрессирования поражения легких ПГ появляются не менее чем у 50 % больных экзогенным аллергическим альвеолитом [27]. Следует подчеркнуть ведущее значение стойкого снижения парциального давления кислорода в крови и тканевой гипоксии в развитии ГОА у пациентов, страдающих хроническими заболеваниями легких. Так, у детей с муковисцидозом величины парциального давления кислорода в артериальной крови и объема форсированного выдоха за 1-ю секунду оказались наименьшими в группе с наиболее выраженными изменениями дистальных фаланг пальцев и ногтей [6].
Имеются единичные сообщения о появлении ПГ при саркоидозе костей (J. Yancey и соавт., 1972) [3, 34]. Мы наблюдали более тысячи больных с саркоидозом внутригрудных лимфатических узлов и легких, в том числе с кожными проявлениями, и ни в одном случае не выявили формирования ПГ. Поэтому наличие/отсутствие ПГ мы рассматриваем как дифференциально-диагностический критерий при саркоидозе и другой патологии органов грудной клетки (фиброзирующие альвеолиты, опухоли, туберкулез).
Связь развития ПГ с гипоксемией подтверждает и неоднократно описанная возможность исчезновения этого признака после трансплантации легких. У детей с муковисцидозом характерные изменения пальцев рук регрессировали в течение первых 3 мес. после трансплантации легкого [6, 26].
Появление ПГ у больного с интерстициальным заболеванием легких, особенно с длительным стажем заболевания и при отсутствии клинических признаков активности поражения легких, требует настойчивого поиска злокачественной опухоли в легочной ткани. Показано, что при раке легкого, развившемся на фоне ИФА, частота ГОА достигает 95 %, в то время как при поражении легочного интерстиция без признаков неопластической трансформации ее обнаруживают более редко — у 63 % больных [1, 11].
ГОА — одно из самых частых паранеопластических проявлений рака легких, распространенность ее у этой категории пациентов может превышать 30 %. Показана зависимость частоты выявления ПГ от морфологической формы рака легких: достигая 35 % при немелкоклеточном варианте, при мелкоклеточном этот показатель составляет лишь 5 % [7, 17].
Развитие ГОА при раке легких связывают с гиперпродукцией гормона роста и простагландина Е2 (PGE-2) опухолевыми клетками. Парциальное давление кислорода в периферической крови при этом может оставаться нормальным [9, 30, 35]. Установлено, что в крови больных раком легкого с симптомом ПГ уровень трансформирующего фактора роста β (TGF-β) и PGE-2 достоверно превышает таковой у больных без изменений дистальных фаланг пальцев рук. Таким образом, TGF-β и PGE-2 можно считать относительными индукторами формирования ПГ, относительно специфичными для рака легких; по-видимому, этот медиатор не участвует в развитии обсуждаемого клинического феномена при других хронических легочных заболеваниях с ДН.
ПГ могут быть паранеопластическим проявлением опухолей, локализующихся и вне области легких, и даже могут предшествовать первым клиническим проявлениям злокачественных опухолей [29, 33]. Описано их формирование при злокачественной опухоли тимуса, раке пищевода, толстой кишки, гастриноме, характеризовавшейся клинически типичным синдромом Золлингера — Эллисона, саркоме легочной артерии.
Неоднократно продемонстрирована возможность формирования ПГ при злокачественных опухолях молочной железы, мезотелиоме плевры, не сопровождавшейся развитием ДН [11, 29, 33].
ПГ выявляют при лимфопролиферативных заболеваниях и лейкозах, в том числе остром миелобластном, при котором они были отмечены на руках и ногах. После химиотерапии, купировавшей первую атаку лейкоза, признаки ГОА исчезли, но появились вновь через 21 мес. при рецидиве опухоли [9]. В одном из наблюдений констатировано регрессирование типичных изменений дистальных фаланг пальцев рук при успешной химио- и лучевой терапии лимфогранулематоза [33].
R. Khouzam и соавт. (2005) описали ишемический инсульт эмболического происхождения, развившийся спустя 6 недель после родов у 18-летней больной. Наличие характерных изменений пальцев рук и гипоксии, потребовавшей респираторной поддержки, обусловило поиск аномалии строения сердца: при трансторакальной и чреспищеводной ЭхоКГ было обнаружено, что нижняя полая вена открывалась в полость левого предсердия [23].
С возрастающей частотой (не менее 5 %) ПГ регистрируют у ВИЧ-инфицированных [10]. В основе их формирования могут лежать разнообразные формы ВИЧ-ассоциированных легочных заболеваний, но этот клинический феномен наблюдается у ВИЧ-инфицированных с интактными легкими. Установлено, что наличие характерных изменений дистальных фаланг пальцев рук при ВИЧ-инфекции ассоциировано с меньшим количеством CD4-положительных лимфоцитов в периферической крови, кроме того, у таких больных чаще регистрируют интерстициальную лимфоцитарную пневмонию. У ВИЧ-инфицированных детей появление ПГ — вероятное указание на легочный туберкулез, который возможен даже при отсутствии Mycobacterium tuberculosis в образцах мокроты.
Известна так называемая первичная, не связанная с заболеваниями внутренних органов форма ГОА, нередко имеющая семейный характер (синдром Турена — Соланта — Голе) [32]. Ее диагностируют только при исключении большинства причин, способных обусловить появление ПГ. Больные с первичной формой ГОА нередко предъявляют жалобы на боли в области измененных фаланг, повышенную потливость. R. Seggewiss и соавт. (2003) наблюдали первичную ГОА с вовлечением пальцев только нижних конечностей. Вместе с тем, констатируя наличие ПГ у членов одной семьи, необходимо учитывать возможность наличия у них наследуемых врожденных пороков сердца (например, незаращения боталлова протока) [25]. Формирование характерных изменений пальцев рук может продолжаться в течение примерно 20 лет.
Пальцы Гиппократа: клиническое значение
Появление пальцев Гиппократа нередко опережает более специфичные симптомы, в связи с чем правильная интерпретация данного клинического признака, дополненная результатами лабораторных методов исследования, позволяет своевременно установить достоверный диагноз.
Пальцы Гиппократа, дифференциальная диагностика, гипоксемия.
В настоящее время ПГ считают основным проявлением гипертрофической остеоартропатии (ГОА, синдром Мари — Бамбергера) — множественный оссифицирующий периостоз.
2010/47/1.png)
2010/48/1.png)
2010/48/2.png)
2010/49/1.png)
2010/48/3.png)
2010/48/4.png)
При диффузных болезнях соединительной ткани с вовлечением легочной паренхимы ПГ всегда отражают тяжесть ДН и являются крайне неблагоприятным прогностическим фактором [4, 20, 30].
По мере прогрессирования поражения легких ПГ появляются не менее чем у 50 % больных экзогенным аллергическим альвеолитом [27]. Следует подчеркнуть ведущее значение стойкого снижения парциального давления кислорода в крови и тканевой гипоксии в развитии ГОА у пациентов, страдающих хроническими заболеваниями легких. Так, у детей с муковисцидозом величины парциального давления кислорода в артериальной крови и объема форсированного выдоха за 1-ю секунду оказались наименьшими в группе с наиболее выраженными изменениями дистальных фаланг пальцев и ногтей [6].
Имеются единичные сообщения о появлении ПГ при саркоидозе костей (J. Yancey и соавт., 1972) [3, 34]. Мы наблюдали более тысячи больных с саркоидозом внутригрудных лимфатических узлов и легких, в том числе с кожными проявлениями, и ни в одном случае не выявили формирования ПГ. Поэтому наличие/отсутствие ПГ мы рассматриваем как дифференциально-диагностический критерий при саркоидозе и другой патологии органов грудной клетки (фиброзирующие альвеолиты, опухоли, туберкулез).
Связь развития ПГ с гипоксемией подтверждает и неоднократно описанная возможность исчезновения этого признака после трансплантации легких. У детей с муковисцидозом характерные изменения пальцев рук регрессировали в течение первых 3 мес. после трансплантации легкого [6, 26].
Появление ПГ у больного с интерстициальным заболеванием легких, особенно с длительным стажем заболевания и при отсутствии клинических признаков активности поражения легких, требует настойчивого поиска злокачественной опухоли в легочной ткани. Показано, что при раке легкого, развившемся на фоне ИФА, частота ГОА достигает 95 %, в то время как при поражении легочного интерстиция без признаков неопластической трансформации ее обнаруживают более редко — у 63 % больных [1, 11].
ГОА — одно из самых частых паранеопластических проявлений рака легких, распространенность ее у этой категории пациентов может превышать 30 %. Показана зависимость частоты выявления ПГ от морфологической формы рака легких: достигая 35 % при немелкоклеточном варианте, при мелкоклеточном этот показатель составляет лишь 5 % [7, 17].
Развитие ГОА при раке легких связывают с гиперпродукцией гормона роста и простагландина Е2 (PGE-2) опухолевыми клетками. Парциальное давление кислорода в периферической крови при этом может оставаться нормальным [9, 30, 35]. Установлено, что в крови больных раком легкого с симптомом ПГ уровень трансформирующего фактора роста β (TGF-β) и PGE-2 достоверно превышает таковой у больных без изменений дистальных фаланг пальцев рук. Таким образом, TGF-β и PGE-2 можно считать относительными индукторами формирования ПГ, относительно специфичными для рака легких; по-видимому, этот медиатор не участвует в развитии обсуждаемого клинического феномена при других хронических легочных заболеваниях с ДН.
ПГ могут быть паранеопластическим проявлением опухолей, локализующихся и вне области легких, и даже могут предшествовать первым клиническим проявлениям злокачественных опухолей [29, 33]. Описано их формирование при злокачественной опухоли тимуса, раке пищевода, толстой кишки, гастриноме, характеризовавшейся клинически типичным синдромом Золлингера — Эллисона, саркоме легочной артерии.
Неоднократно продемонстрирована возможность формирования ПГ при злокачественных опухолях молочной железы, мезотелиоме плевры, не сопровождавшейся развитием ДН [11, 29, 33].
ПГ выявляют при лимфопролиферативных заболеваниях и лейкозах, в том числе остром миелобластном, при котором они были отмечены на руках и ногах. После химиотерапии, купировавшей первую атаку лейкоза, признаки ГОА исчезли, но появились вновь через 21 мес. при рецидиве опухоли [9]. В одном из наблюдений констатировано регрессирование типичных изменений дистальных фаланг пальцев рук при успешной химио- и лучевой терапии лимфогранулематоза [33].
R. Khouzam и соавт. (2005) описали ишемический инсульт эмболического происхождения, развившийся спустя 6 недель после родов у 18-летней больной. Наличие характерных изменений пальцев рук и гипоксии, потребовавшей респираторной поддержки, обусловило поиск аномалии строения сердца: при трансторакальной и чреспищеводной ЭхоКГ было обнаружено, что нижняя полая вена открывалась в полость левого предсердия [23].
С возрастающей частотой (не менее 5 %) ПГ регистрируют у ВИЧ-инфицированных [10]. В основе их формирования могут лежать разнообразные формы ВИЧ-ассоциированных легочных заболеваний, но этот клинический феномен наблюдается у ВИЧ-инфицированных с интактными легкими. Установлено, что наличие характерных изменений дистальных фаланг пальцев рук при ВИЧ-инфекции ассоциировано с меньшим количеством CD4-положительных лимфоцитов в периферической крови, кроме того, у таких больных чаще регистрируют интерстициальную лимфоцитарную пневмонию. У ВИЧ-инфицированных детей появление ПГ — вероятное указание на легочный туберкулез, который возможен даже при отсутствии Mycobacterium tuberculosis в образцах мокроты.
Известна так называемая первичная, не связанная с заболеваниями внутренних органов форма ГОА, нередко имеющая семейный характер (синдром Турена — Соланта — Голе) [32]. Ее диагностируют только при исключении большинства причин, способных обусловить появление ПГ. Больные с первичной формой ГОА нередко предъявляют жалобы на боли в области измененных фаланг, повышенную потливость. R. Seggewiss и соавт. (2003) наблюдали первичную ГОА с вовлечением пальцев только нижних конечностей. Вместе с тем, констатируя наличие ПГ у членов одной семьи, необходимо учитывать возможность наличия у них наследуемых врожденных пороков сердца (например, незаращения боталлова протока) [25]. Формирование характерных изменений пальцев рук может продолжаться в течение примерно 20 лет.

Видели ли Вы когда-нибудь такие необычные пальцы? Выглядит это, как утолщение кончиков пальцев и округление ногтей. При этом на ощупь кажется, что ноготь плохо держится и немного "плывет". Это - пальцы-барабанные палочки или, как их ещё называют, "часовые стекла". В английской литературе чаще всего встречается термин "clubbing". Историческое их название - "пальцы Гиппократа". Вы, наверняка, могли видеть такие у пожилых мужчин, но иногда они встречаются и у лиц молодого возраста. Бытует мнение, что их развитие связано с тяжёлым физическим трудом, однако, данное предположение является мифом.
Основная причина возникновения такого феномена - гипоксия тканей. Но по сей день не понятно, зачем природа придумала такой странный ответ на гипоксию - какую функцию он несет. Кроме того, не совсем ясно, почему не при всех заболеваниях, связанных с гипоксией, развивается подобное состояние.

Распространенным заблуждением является предположение о том, что для развития данного симптома требуются годы. На самом деле, пальцы-барабанные палочки могут сформироваться всего за пару недель. К сожалению, обратного развития в данном случае практически нет (даже после излечения основного заболевания).
Вот список наиболее часто встречающихся причин возникновения этих загадочных пальцев:
Пороки сердца. Но не мелкие аномалии развития, такие как открытое овальное окно, а настоящие серьезные пороки, в основном "синего типа".
Инфекционный эндокардит - воспаление внутренней оболочки сердца, часто сопровождающийся формированием приобретенных пороков сердца.
Заболевания легких. Чаще всего это хронический бронхит курильщика или другой вариант ХОБЛ (хронической обструктивной болезни лёгких). Но, если появились пальцы, то это говорит о том, что уже давно пора начать лечение, в том числе ингаляторную терапию и т.п. Сюда же относятся все виды онкологии легких, интерстициальные заболевания, в том числе альвеолиты.
Патология желудочного-кишечного тракта: целиакия, болезнь Крона, язвенный колит.
Цирроз.
Гипертиреоз.
Гипертрофическая остеоартропатия.
И ещё немалый список редких причин.
По многим заболеваниям возникает закономерный вопрос: а где тут гипоксия? Вероятно, большинство из них ассоциировано с системным воспалением и явлениями гипоксии тканей, вторичными к метаболическим нарушениям.
Главное!
Пальцы-барабанные палочки, за редким исключением, практически никогда не бывают самостоятельной единицей и всегда указывают на серьезные заболевания. Поэтому обнаружение данного симптома требует хорошей диагностики и выявления настоящей причины!
И напоследок небольшой случай из личной практики.
Уже будучи кардиологом, на одном из семейных застолий, я отметила наличие пальцев в виде барабанных палочек у одного своего родственника. Было известно, что у него в детстве имела место операция на сердце. Тогда я уточнила у его мамы, что в детстве мальчику был поставлен диагноз "дефект межжелудочковой перегородки" и в возрасте около трёх лет его прооперировали. Дефект межжелудочковой перегородки - это врождённый порок "синего" цвета, который должен быть закрыт в короткие сроки.
В голове все сошлось! Невысокий рост, низкая мышечная масса, синие губы, пальцы - барабанные палочки. Значит, дефект закрыт поздно и осталась лёгочная гипертензия или, ещё хуже, дефект ушит не полностью.
Кстати, после операции эхокардиография не выполнялась ни разу. Да и на учёте кардиолога мальчик почему-то не стоял.
В полной уверенности, что на эхокардиографии будет что-то плохое, я отправила его на исследование… И ничего! Нет резидуального дефекта, нет остаточных явлений, порок хорошо закрыт и сердце выглядит отлично!
Однако в ходе дальнейшего обследования была выявлена другая патология - тяжелая ХОБЛ на фоне длительного стажа курения.
Этот пример, с одной стороны, подтверждает связь описанного симптома с гипоксией и ХОБЛ, а, с другой стороны, иллюстрирует, что порой бывает так, что самая очевидная причина не всегда является истинной.
В апреле этого года в варшавском костеле Святого Креста глубокой ночью была вскрыта ниша в одной из колонн. Эксперты-медики смогли увидеть хранящееся в храме сердце великого композитора Польши Фредерика Шопена. Исследователи надеялись, что это событие поможет поставить точку в многолетней дискуссии о причинах болезни и смерти Шопена. Но этого так и не произошло.

Фредерик Шопен умер 17 октября 1849 года в два часа ночи в парижской квартире на Вандомской площади в возрасте 39 лет. Смерть засвидетельствовал врач Жан Крувелье, он же производил посмертное вскрытие. Композитор был похоронен на кладбище Пер-Лашез, а сердце, по его завещанию, было отправлено в Варшаву.
Точный диагноз Шопена стал поводом для многочисленных статей в медицинских журналах, которые продолжают появляться и в XXI веке. Считалось, что причиной его смерти был туберкулез, но за этим названием на самом деле могут скрываться некоторые другие расстройства, которые в то время еще не умели различать.
Протокол вскрытия, сделанный Крувелье, был утрачен. В свидетельстве о смерти в качестве причины указан туберкулез легких и гортани. Однако в одном из писем Войцеха Гржималы, польского политика и банкира, парижского друга Шопена упоминается, что при вскрытии не было обнаружено признаков туберкулеза в легких и что болезнь Шопена неизвестна современной медицине.
Шопен с детства был болезненным ребенком. Он был болезненно худ: в возрасте 28 лет при росте 170 см весил всего 45 килограммов. Его желудок с трудом переносил жирную пищу, особенно свинину. Она вызывала сильные боли, диарею и потерю веса. Улучшить свое состояние он смог при помощи особой диеты, куда входили в частности мед и овсяные отруби. Также он всю жизнь страдал от приступов кашля и обильной мокроты, особенно по утрам.
В 1826 году он проболел полгода, страдая от увеличения шейных лимфатических узлов и головной боли. В 1830 году отек носа из-за хронического насморка вынудил Шопена отменить концерты в Вене. В 1831 году, когда Шопену был 21 год, был отмечен первый случай кровохарканья, возобновлявшегося и в последующие годы. Тяжелые ларингит и бронхит в течение двух месяцев 1835 года привели к тому, что в Варшаве возникли слухи о смерти Шопена: от него перестали приходить письма.

Внимание исследователей привлекают ближайшие родственники Шопена. Родители были вполне здоровы. Отец перенес лишь несколько респираторных инфекций и дожил до 74 лет. У матери не было хронических заболеваний и она скончалась в возрасте 87 лет. Крепким здоровьем отличалась и сестра Шопена Изабелла (дожила до 70 лет). А вот сестры Людвика и Эмилия были болезненны, подобно брату. Людвика страдала от постоянных инфекций дыхательных путей и умерла в возрасте 47 лет. У Эмилии с самого детства отмечались кашель и одышка, в одиннадцать лет у нее начались кровотечения в верхних отделах желудочно-кишечного тракта, а в 15 лет она умерла.
Официальным диагнозом Шопена при жизни, как уже говорилось, был туберкулез. Лечение, которое назначали его врачи, точно соответствует предписаниям медицины того времени в случае туберкулеза (включая кровопускания, которые истощали и без того невеликие силы больного). Однако современные медики выражают сомнения в этом диагнозе.
Муковисцидоз вызывается мутацией гена CFTR в седьмой хромосоме. Есть много типов мутации этого гена, поэтому формы муковисцидоза могут отличаться у разных больных. Возможно, у Шопена была сравнительно легкая разновидность заболевания, позволившая ему дожить до сравнительно большого (для человека с муковисцидозом) возраста. В какой-то момент болезнь могла усугубиться после заражения туберкулезом.
Альфа 1-антитрипсин (А1АТ) – это белок, который производится в печени и выделяется ею в кровь. У этого белка важная функция, он заботится о том, чтобы средство, которое организм использует для защиты, не вредило бы ему самому. При воспалительных процессах нейтрофилы (одна из разновидностей лейкоцитов) выделяют фермент эластазу. Эластаза разлагает белки, помогая бороться с воспалением. Но если активность эластазы ничем не ограничить, она вредит тканям организма, особенно легким. За инактивацию эластазы и отвечает А1АТ. В случае генетической мутации выработка А1АТ снижается или же производится неработающая его разновидность.

Проявления дефицита А1АТ.
Опять-таки разные типы мутаций могут вести к проявлениям дефицита А1АТ различной тяжести. Из-за повреждений легких у больных появляются хрипы, хронический кашель или бронхит, тяжелая одышка после физических нагрузок. Обычно диагностируется эмфизема легких или хроническая обструктивная болезнь легких. Также возможен цирроз печени, из-за скапливающегося в ней дефектного белка А1АТ. Кровотечения у сестры Эмилии эта гипотеза объясняет варикозным расширением вен пищевода – вторичным проявлением цирроза печени.
Критики гипотезы указывают, что у Шопена не отмечалось достаточно характерной для дефицита А1АТ желтухи, а также отмечают, что эта все прочие симптомы с таким же успехом можно объяснить муковисцидозом.
Кроме этих двух основных гипотез врачи успели выдвинуть немало других. Шотландские исследователи Адам Кубба и Меделин Янг в статье 1998 года в журнале Chest перечисляют еще семь: стеноз митрального клапана, синдром Чарга-Стросса, аллергический бронхопульмональный аспергиллез, гипогаммаглобулинемия, идиопатический гемосидероз легких, абсцесс легкого, врожденная легочная артериовенозная мальформация.
По крайней мере два основных диагноза легко проверить. И муковисцидоз, и дефицит А1АТ имеют генетическую природу, следовательно анализ ДНК их легко выявит. К тому же и материал для такого анализа есть – сердце Шопена в Варшаве. Но неоднократные обращения ученых за разрешением такого исследования встречают неизменный отказ польского правительства, неодобрение католической церкви и негативную реакцию ныне живущей родственницы композитора – прапраправнучки его сестры.
Помимо мнения, что изучение ДНК одной из святынь Польши будет кощунством и оскорбительным для поляков деянием, причиной отказа может служить и опасение. Возможно, в храме хранится сердце вовсе не великого композитора. Дело в том, что во время Варшавского восстания немцы взорвали костел Святого Креста. Колонна, куда было замуровано сердце Шопена, была разрушена. Но сосуд с сердцем спасли, вытащив его перед взрывом. Он попал в коллекцию обергруппенфюрера СС Эриха фон дем Бах-Зелевского, который руководил подавлением восстания. Лишь после войны сердце вернули в отстроенный храм.
Поскольку нет гарантий, что сердце Шопена не подменили за это время, анализ ДНК кажется многим нежелательным. Однако профессор судебной медицины Тадеуш Добош, который участвовал в осмотре сердца в этом году, считает сомнения в его подлинности беспочвенными. По его словам, вид сердца, тип консерванта и использованного шовного материала однозначно указывают на середину XIX века, следовательно, сердце подлинное.
Итак, сосуд с сердцем Шопена не вскрывали, и он даже не покидал стен храма. Что же нового дал визуальный осмотр? Немного, но кое-что исследователи все-таки заметили. На сердце Шопена есть образования, которые могут быть туберкулезными бугорками. Следовательно, первоначальный диагноз еще не следует признавать неверным.
После осмотра эксперты подтвердили хорошую сохранность сердца, поэтому оно вновь было помещено в нишу колонны и замуровано. Извлечь его для следующего осмотра планируют в 2064 году.
Но ученым не следует полвека ждать следующей возможности уточнить диагноз. Образец ДНК Шопена вполне можно поискать в других местах. В музеях хранится немало его личных вещей, на которых могут остаться волосы или следы крови. Вполне возможно, кто-то из поклонников великого композитора сохранил, как это часто делали в XIX веке, прядь его волос в медальоне. При современных технологиях даже малого количества материала будет достаточно для проведения исследования.






































Главное меню
Главное меню
Даже поверхностный осмотр позволяет опытному диагносту заподозрить заболевание с характерными стигмами. Напротив, есть болезни, которые внешне ничем себя не проявляют, или маскируются под другие.
Эпидемическая ситуация по туберкулезу во многих регионах Российской Федерации (в первую очередь - Дальневосточный и Сибирский федеральные округа) остается неблагоприятной, структура внелегочных форм заболевания -нестабильной 6. Урогенитальный туберкулез (УГТ) нередко выявляют в инкурабельной стадии по причине низкой настороженности, недостаточности знаний врачей по фтизиоурологии, в связи с нетипичным течением заболевания [4,7-8]. Выявление поло-возрастных и антропометрических особенностей больных УГТ позволило бы врачу повысить уровень настороженности в отношении этого заболевания.
Цель исследования - определить половые и антропометрические характеристики больных УГТ на примере пациентов с туберкулезом предстательной железы.
МАТЕРИАЛЫ И МЕТОДЫ
РЕЗУЛЬТАТЫ
Поскольку УГТ объединяет заболевание органов мочевой и мужской половой системы логично было бы ожидать преобладание в структуре лиц мужского пола, однако проведенный анализ свидетельствует об обратном (рис. 1).

Рис. 1. Половые пропорции больных урологическим туберкулезом в Сибири и на Дальнем Востоке в динамике
За восемь лет только трижды число заболевших мужчин равнялось или даже незначительно превышало число заболевших женщин, в остальные годы уверенно лидировали больные женского пола.
Средний ИМТ определенный у больных туберкулезом предстательной железы составил 28 кг/м2; при этом избыточную массу тела имели 53,8% пациентов. У 35,0% больных туберкулезом предстательной железы было выявлено нарушение углеводного обмена, каждый четвертый имел гиперхолестеринемию. Метаболический синдром как совокупность абдоминального ожирения, нарушения углеводного и липидного обмена и артериальной гипертензии был диагностирован у 41,6% больных туберкулезом предстательной железы - и ни в одном случае среди больных туберкулезом органов дыхания.
Внешний вид больного туберкулезом предстательной железы представлен на рисунке 2.

Рис. 2. Внешний вид больного туберкулезом предстательной железы
Безусловно, представлено фото не самого типичного пациента, однако именно его внешний вид долгое время не позволял лечащему врачу даже допустить мысль о туберкулезе, настолько сильны стереотипы этого заболевания.
Таблица. Индекс массы тела больных туберкулезом органов дыхания
| Показатели ИМТ (М±о) | пол | чел. | % | Всего |
|---|---|---|---|---|
| Нормальное питание (22,14±1,67) | Ж | 14 | 26,4 | 40,7 |
| М | 29 | 54,9 | ||
| Повышенное питание (26,75±0,87) | Ж | 4 | 7,8 | 8,6 |
| М | 5 | 9,5 | ||
| Пониженное питание (19,31±0,37) | Ж | 5 | 9,6 | 21 |
| М | 17 | 32,4 | ||
| Гипотрофия I ст. (18,24±0,63) | Ж | 4 | 7,5 | 16,3 |
| М | 13 | 25,1 | ||
| Гипотрофия II ст. (16,48±0,38) | Ж | 7 | 13,6 | 13,4 |
| М | 7 | 13,2 | ||
| ВСЕГО | 105 | 100 | ||
ОБСУЖДЕНИЕ
ВЫВОДЫ
1. В структуре урогенитального туберкулеза преобладают женщины, несмотря на то, что урологический туберкулез по определению охватывает заболевание мочевой и мужской половой системы.
2. Современный урогенитальный туберкулез не имеет никаких внешних проявлений, позволяющих заподозрить это заболевание.
2. В половине случаев больной туберкулезом предстательной железы имеет избыточный вес, нарушение углеводного и липидного обмена.
3. У 41,6% больных туберкулезом предстательной железы диагностируют метаболический синдром.
ЛИТЕРАТУРА
1. Кульчавеня Е.В., Брижатюк Е.В., Хомяков В.Т. Туберкулез экстраторакальных локализаций в Сибири и на Дальнем Востоке. Туберкулез и болезни легких 2005;6:23-25.
2. Кульчавеня Е.В., Брижатюк Е.В., Ковешникова Е.Ю., Свешникова Н.Н. Новые тенденции в эпидемической ситуации по туберкулезу экстраторакальных локализаций в Сибири и на Дальнем Востоке. Туберкулез и болезни легких 2009;10:27-31.
3. Kulchavenya E. Best practice in the diagnosis and management of Urogenital Tuberculosis. Ther Adv Urol. 2013 Jun;5(3):143-51. doi: 10.1177/1756287213476128.
4. Kholtobin D., Kulchavenya E. Kidney tuberculosis in last century and now -is it the same disease? ERS annual Congress, Amsterdam 2011. - 496s - P2695.
5. Мордык А.В., Яковлева А.А., Николаева И.Н., Леонтьев В.В. Актуальность проблемы внелегочного туберкулеза в современных эпидемиологических условиях. Тихоокеанский медицинский журнал 2015; 3(61):19-21.
6. Kulchavenya E., Zhukova I., Kholtobin D. Spectrum of Urogenital Tuberculosis. JInfect Chemother 2013;19(5):880-883.
7. Жукова И.И., Кульчавеня Е.В., Холтобин Д.П., Брижатюк Е.В., Хомяков
В.Т. Туберкулез мочеполовой системы сегодня. Урология 2013;1:13-16.
8. Кульчавеня Е.В., Шадеркин И.А., Краснов В.А., Шевченко С.Ю., Баран-чукова А.А., Шадеркина В.А. К вопросу о причинах поздней выявляемости больных урогенитальным туберкулезом. Экспериментальная и клиническая урология 2015;2:108-113.
9. Охтяркина В.В., Новоселов П.Н. Медико-социальная характеристика больных туберкулезом в сочетанной ВИЧ-инфекцией. Проблемы социальной гигиены, здравоохранения и истории медицины 2012;5:9-12.
10. Мордык А.В., Удалова Т.Ю., Пузырева Л.В., Леденева Т.Н., Ситникова
С.В. Сравнение личностных особенностей с впервые выявленным ин-фильтративным туберкулезом легких и сочетанной инфекцией ВИЧ/туберкулез. Бюллетень сибирской медицины 2015;14(1):60-65.
11. Мордык А.В., Удалова Т.Ю., Ситникова С.В., Пузырева Л.В. Личность пациента туберкулез / ВИЧ. Дальневосточный медицинский журнал 2016;1:50-53.
12. Большакова И.А., Корецкая Н.М. Туберкулез органов дыхания и его выявление у студентов медицинского ВУЗа. Туберкулез и болезни легких 2011;88(4):59-63.
13. Корецкая Н.М., Наркевич А.Н. Впервые выявленный туберкулез легких среди организованного и неорганизованного населения. Уральский медицинский журнал 2012;9 (101):37-41.
14. Корецкая Н.М., Потехин П.Г. Санитарная грамотность по туберкулезу у лиц, имеющих заболевания группы повышенного риска. Инфекционные болезни 2015;13(1): 166-167.
15. Осадчий А.В., Кульчавеня Е.В., Рейхруд Т.А., Нарышкина С.Л., Кожевникова Е.В., Хомяков В.Т. Социально-демографическая характеристика больных туберкулезом легких и внелегочных локализаций. Туберкулез и болезни легких 2015;2:46-48.
16. Кульчавеня Е.В., Осадчий А.В., Рейхруд Т.А., Нарышкина С.Л., Рей-хруд М.В., Хомяков В.Т. Различия в социально-демографической характеристике больных туберкулезом легких и внелегочных локализаций. Туберкулез и болезни легких 2015;5:102-103.
17. Кульчавеня Е.В., Алексеева Т.А., Шевченко С.Ю. Особенности половозрастной характеристики больных туберкулезом легких и мочеполовой системы. Туберкулез и болезни легких 2015;5:104-106.
Читайте также:


