Морфологическая картина туберкулеза легких
Проблема ВИЧ-инфекции более 25 лет остается актуальной для мирового сообщества, масштабы распространения иммунодефицита человека приобрели глобальный характер и стали реальной угрозой для социально-экономического развития большинства стран мира. Всемирная организация здравоохранения указывает, что в мире более 34 млн человек страдают этой инфекцией и уже более 2,5 млн умерло от ВИЧ-ассоциированных заболеваний [7]. В России в настоящее время эпидемическая ситуация по ВИЧ-инфекции остается напряженной – продолжается распространение данной инфекции среди населения России: 463 случая на 100 тыс. населения; получается, что один из 216 жителей является носителем вируса иммунодефицита [5]. На начало января 2016 г. в Алтайском крае зарегистрировано 22 349 случаев ВИЧ-инфекции. Проживает на территории края – 17 480 чел., пораженность на 100 тыс. населения – 728,7, что на 17% ниже, чем в Сибирском федеральном округе (828,4 на 100 тыс. населения). По уровню пораженности ВИЧ-инфекцией, из 12 территорий СФО, Алтайский край занимает 4-е рейтинговое место [1].
При этом растет и количество смертей от ВИЧ-инфекции и ассоциированных с ней заболеваний [9]. ВИЧ-инфекция на стадии вторичных заболеваний 4 (А, Б, В) резко увеличивает риск развития туберкулезного процесса. Активный туберкулез может развиться на любой из стадий ВИЧ-инфекции и имеет множество клинико-рентгенологических, морфологических особенностей, которые зависят от выраженности иммунодефицита. Значительная распространенность ВИЧ-инфекции в сочетании с туберкулезом, частота развития и тяжесть осложнений при двойной инфекции определили ее как социально значимое заболевание, приводящее к инвалидизации, снижению качества жизни и высокой смертности, что требует мультифакторного анализа и подхода в контексте этой проблемы. Остаются мало изученными причины смерти и особенности морфологических изменений в органах при туберкулезе на фоне ВИЧ-инфекции с учетом медико-социальных параметров [7].
Одной из основной причиной смерти ВИЧ-инфицированных лиц остается туберкулез, осложняющий течение ВИЧ-инфекции [7; 9], диагностика которого при таком сочетании до сих пор остается затрудненной [2; 6]. ВИЧ-инфекция на стадии вторичных заболеваний в IV стадию (А, Б, В) значительно увеличивает количество форм активного туберкулеза у таких пациентов. По данным российских и зарубежных авторов, доля больных туберкулезом среди ВИЧ-инфицированных достигает 75% [7; 10].
Следует отметить, что наряду с количественными изменениями в структуре аутопсий умерших от туберкулеза произошли и качественные изменения. Стали преобладать генерализованные формы заболевания с нетипичной микроскопической картиной и преимущественно альтеративным характером воспаления в туберкулезных очагах, отсутствием эпителиоидных и гигантских клеток, сомнительными, а зачастую отрицательными результатами окрашивания по Циль-Нильсену при выявлении кислотоустойчивых бактерий на срезах. Появление и доминирование данных атипичных форм туберкулеза связывают с увеличением числа больных с иммунодефицитными состояниями на фоне наркомании и ВИЧ-инфекции, которые сопровождаются резким снижением уровня СD4+-лимфоцитов, играющих важную роль в механизме противотуберкулезной защиты [8].
Все это позволяет нам вынести туберкулез, ассоциированный с ВИЧ-инфекцией, в группу довольно значимых социальных заболеваний, которые, несмотря на довольно обширное освещение в научных трудах как в отечественной, так и в зарубежной литературе, требуют более комплексного анализа и подхода для правильного понимания истинных причин смертности в данной группе пациентов.
Цель исследования – изучить особенности морфологической картины ВИЧ-ассоциированного туберкулеза у пациентов, не получающих противовирусную терапию, с определением основных причин смерти у данной категории лиц.
Материалы и методы исследования. Было изучено 20 случаев протоколов вскрытия ВИЧ-инфицированных с клиникой туберкулеза, по той или иной причине не получающих противовирусную терапию (в большинстве случае отказ самих больных), и 20 больных с туберкулезом без ВИЧ-инфекции. Критериями включения в исследование были: ВИЧ-инфекция с положительным иммуноблотом и подтвержденный туберкулез методами морфологического и гистологического исследования. В I группу вошли больные ВИЧ-ассоциированные с туберкулезом, среди которых мужчины составили 12 (60%) человек, а женщины 8 (40%) человек. Средний возраст среди мужчин – 32±5 лет, среди женщин 36±4 года. Все умершие были жители города. Среди них 15 (0,75%) умерших последние несколько месяцев не употребляли наркотики, оставшиеся утверждали, что не принимали наркотики в течение 1-2 лет. В группу II вошли больные с туберкулезом без ВИЧ-инфекции (ограниченные формы). Средний возраст в этой группе составил 51±6 лет, мужчин было 11 (55%) человек, женщин – 9 (45%).
При анализе клинико-морфологических особенностей в исследовании учитывали возраст, пол умерших и количество клеток CD4+/мкл. При этом все умершие имели IV Б – IV В и V стадию ВИЧ-инфекции, согласно классификации, утвержденной Приказом МЗ СР РФ № 166 от 17 марта 2006 года, с количеством клеток CD4+ 100-200/мкл и менее 100 клеток/мкл. У всех умерших в анамнезе имелся факт употребления инъекционных наркотических средств.
При изучении микроскопической картины стеклопрепаратов, окрашенных гематоксилином и эозином и методом по Циль-Нильсену, для морфометрического анализа применяли программу UTHSCSA Image Tool 3.0 (разработанную в University of the Texas Health Science Center of San Antonio, Tеxas, USA, 2007 и свободно доступную в Интернете). С каждого случая делали по 10 снимков. Определяли площадь казеозного некроза в туберкулезных очагах, а также толщину лимфоцитарно-макрофагального вала клеток.
Результаты исследования и их обсуждение.
В I группе встречался генерализованный туберкулез с поражением головного мозга, лимфатических узлов, легких, почек, селезенки, печени, а также диссеминированные и милиарные формы туберкулеза, казеозная пневмония 1 (5%). В патологический процесс при туберкулезе были вовлечены следующие органы: двусторонние поражения легких – 20 (100%), печень – 9 (45%), селезенка – 12 (60%), мозг – 7 (35%), позвоночник – 2 (10%), миокард – 7 (35%). Генерализованные формы туберкулеза сопровождались выраженной интоксикацией, что нашло отражение в увеличении печени и селезенки. Масса печени была зафиксирована в пределах средних цифр – 3200±140 г, желтого цвета с поверхности с субкапсулярными бугорками серо-белого цвета по 2 мм. На разрезе гладкая, имеет сальный блеск, при микроскопировании отмечена диффузная крупнокапельная жировая дистрофия гепатоцитов. Масса селезенки достигала 720 г, среднее значение составило – 520±50 г, дрябловатой консистенции, капсула слабой напряженности. Субкапсулярно и на разрезе определяются мелкие очаги (бугорки) белесого цвета по 1-2 мм, в 5 (10%) случаях отмечено их слияние до 1 см. При гистологическом исследовании отмечена атрофия лимфоидных фолликулов, гемосидероз, утолщение и склероз синусов.
Во II группе у 11 (55%) человек были выявлены милиарные и диссеминированные формы туберкулеза, у 9 (45%) человек процесс был локализован только в легких с одной стороны, не затрагивая другие органы. Селезенка в процесс не вовлекалась, а печень в 12 (60%) случаях была увеличена – 2500±85 г. Морфологическая картина туберкулеза во II группе была классической, с типичными формами течения туберкулезной инфекции. В туберкулезных очагах выявлены типичное продуктивное воспаление и типичные клеточные реакции. Площадь казеозного некроза в определяемых туберкулезных очагах составила 210,4±12,2 мкм2, толщина вала клеточной популяции на периферии казеозного некроза составила 67,1±11,2 мкм, среди клеток определялись в большом количестве эпителиоидные клетки и классические клетки Пирогова-Лангханса.
В морфологической картине I группы преобладали распространенные формы туберкулеза легких, миллиарные и диссеминированные формы, с поражением других внутренних органов. Отмечены обширные очаги казеозного некроза, не отграниченные коллагеном, размером до 1 см, со снижением количества эпителиодных клеток и клеток Пирогова-Лангханса, экссудативными компонентом, диссеминацией процесса и генерализованными формами. Площадь казеозного некроза широко варьировала от 257 до 410 мкм2, средняя площадь составила – 350±36,7 мкм2, вал клеток был меньше и составил 32-49 мкм в среднем – 41,5±5,3 мкм. Во многих очагах (легкие, печень, селезенка) преобладали экссудативные реакции с лейкоцитарной инфильтрацией в центре казеозного некроза, что свойственно ВИЧ-ассоциированному туберкулезу при многих других исследованиях [8]. Гигантские клетки были единичные, мелких размеров и с наименьшим количеством ядер в клетке, их малым диаметром. Эпителиоидные клетки были также единичными, в очагах выявлено большое количество микобактерий туберкулеза, что совпадает с данными ряда других исследователей [9]. Корреляционной анализ выявил взаимосвязь между клетками СD4+ и толщиной клеточного вала в туберкулезных очагах в группе I – r=0,58, р=0,0000. Корреляция CD4+ клеток с площадью некроза казеозного – r=-0,7, р=0,0000 (рисунок). На течение заболевания неблагоприятное влияние оказывает нерегулярное лечение, а порой и полный отказ от противовирусной терапии, а при сочетании с туберкулезом прием до 5 препаратов приводит к более тяжелому токсическому повреждению печени, что неблагоприятно сказывается на течении ВИЧ-ассоциированного туберкулеза [3].
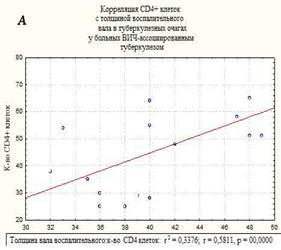
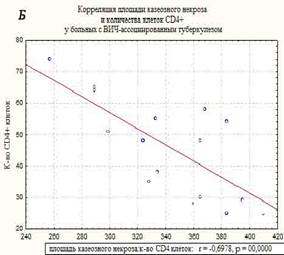
Корреляционные взаимосвязи CD4+-клеток и толщины воспалительного вала в очагах казеозного некроза (А), и с площадью казеозного некроза (Б) у больных ВИЧ-ассоциированным туберкулезом
В терминальной стадии также отмечены диссеминированные и генерализованные формы туберкулеза. Встречаются очаги различных размеров, от милиарных до 1 см. Поражения легких носят двусторонний характер, плевра тусклая, иногда с фибрином, спайки между листками междолевой плевры, висцеральной и костальной плевры. Микроскопически отмечена многочисленность фокусов казеозного некроза с поражением мелких бронхов и бронхиол.
По мере прогрессирования иммунодефицита на стадиях IVБ-В преобладают альтеративно-экссудативные изменения над продуктивными. В терминальной стадии - только альтерация с экссудацией, нередко с экссудацией по типу гнойного воспаления в центре некротических очагов.
Теоретическое обоснование содержания лимфоцитов и их участия в дифференцировке клеток в туберкулезных очагах и выраженность продуктивных реакций, возможно, связано с тотальной иммунной анергией и дисбалансом между Th1 и Th2 лимфоцитами, которые не способны активировать клетки моноцитарного ряда в очаге воспаления и обеспечить нужную продуктивную тканевую реакцию с формированием гранулем и фиброза. Все эти клеточные реакции рассматриваются как проявление гиперчувствительности немедленного типа с потерей биологического смысла реакции гиперчувствительности замедленного типа, что связано с иммунносупрессией и лимфогенной диссеминацией микобактерий туберкулеза по типу туберкулезного сепсиса Ландузи [4].
В большинстве наших наблюдений диагностика ВИЧ-инфекции была только посмертной со скудным анамнезом болезни и жизни, что не позволяло в полной и должной мере оценить и выявить основные и непосредственные причины смерти с большой долей вероятности. Эти трудности свойственны многим другим специалистам, занимающимся проблемой ВИЧ-инфекции, ассоциированной с туберкулезом. Причины смерти в I группе – это, как правило, туберкулез генерализованный или диссеминированный с его интоксикационными проявлениями в виде глубоких дистрофических изменений во внутренних органах, отеком легких. В некоторых случаях доминировали признаки сердечной и легочно-сердечной недостаточности, отека мозга (при менингоэнцефалите). Непосредственная причина смерти у ВИЧ-инфицированных с туберкулезом в стадии IV Б-В и V – это генерализованные и диссеминированные формы туберкулеза, основная причина смерти – ВИЧ-инфекция, подвергающаяся кодированию по МКБ-10. При определении основной и непосредственной причины смерти при стадии менее IVА – это, как правило, туберкулез, кодируемый по МКБ-10. У всех умерших этой группы было диагностировано второе конкурирующее заболевание – гепатит C, а у 9 (45%) была диагностирована двусторонняя бактериальная полисегментарная пневмония.
Заключение. ВИЧ-ассоциированный туберкулез характеризуется атипичной морфологической картиной с преобладанием альтеративно-экссудативных тканевых реакций над продуктивными, склонностью к генерализации и диссеминации туберкулезного процесса с преобладанием его среди мужчин трудоспособного возраста. На данный процесс оказывают влияние отсутствие, отказ или нерегулярный прием противовирусных препаратов, а также наличие конкурирующего заболевания в виде гепатита С. Снижение содержания количества СD4+ клеток находит свое отражение в полном отсутствии и снижении степени выраженности продуктивных тканевых реакций.

Одним из самых известных и распространенных путей передачи ВИЧ-инфекции является инъекционное употребление психотропных веществ [1]. ВИЧ поражает дезадаптивные группы лиц и по мере прогрессии приводит к вторичному иммунодефициту [1, 2]. Развитию иммунодефицита способствует и сам факт воздействия наркотических средств на макроорганизм: иммунные нарушения с инверсией иммунорегуляторного индекса СD 4+/СD 8+ наблюдаются в 98 % случаев наркоманий без ВИЧ-инфекции [5].
В свою очередь почти 100 % инфицированность микобактериями туберкулеза, которые находятся в дремлющем, персистирующем состоянии в макроорганизме у взрослого населения, на фоне иммунодефицита при ВИЧ-инфекции, является фактором, способствующим возникновению активных форм туберкулёза в данной когорте [3, 7]. Клинические варианты течения туберкулёза при ВИЧ-инфекции широко освещены в современной мировой научной литературе, а патоморфологические особенности имеют множество вариантов и представляют очевидный интерес как для морфологов, так и для клиницистов [10, 12].
Патоморфологические варианты туберкулеза при ВИЧ-инфекции у лиц с различными медико-социальными параметрами, особенности течения коинфекционного процесса остаются малоизученными, что является серьезной проблемой при патологоанатомической диагностике, а также в судебно-медицинской практике.
Цель исследования – охарактеризовать патоморфологические изменения в лёгких и медико-социальные параметры при туберкулёзе на фоне ВИЧ-инфекции на аутопсийном материале умерших лиц с инъекционной наркоманией.
Материалы и методы исследования
В изучаемом материале (n = 262) информацию о наличии при жизни инъекционной наркомании имели 18 % умерших (n = 47) от коинфекции ВИЧ/туберкулез, которые составили основную группу исследования (группа № 1), из них у 16 % умерших (n = 7) выявлен прием парентерального наркотика за несколько дней до смерти (по данным записей медицинской документации и наличия характерных следов в проекции периферических сосудов, обнаруженных нами во время секции), что явилось включением их в группу сравнения (группа № 2).
Результаты исследования и их обсуждение
Группа № 1 стадия ВИЧ-инфекции по данным амбулаторных карт IVВ–V характеризовалась сниженным количеством CD4+ лимфоцитов, медиана составила 68,8 клеток/мкл, медиана количества CD8+ лимфоцитов – 581,6 клеток/мкл, медиана иммунорегуляторного индекса – 0,12. Клинико-морфологические формы были представлены генерализованными формами туберкулёза с множественными локализациями в 66 % (n = 31), диссеминированным туберкулёзом легких – в 13 % (n = 6), фиброзно-кавернозным – в 13 % (n = 6), казеозной пневмонией – в 4 % (n = 2), инфильтративным туберкулёзом – в 4 % (n = 2). Т-лимфоциты СD4+, СD8+ выполняют главную роль в иммунопатогенезе туберкулёза, т.к. распознают внутриклеточный антиген, контролируют процессы миграции макрофагов, нейтрофилов, Т и В лимфоцитов. Под влиянием секреции субпопуляций Т-лимфоцитов СD4+ CD27+, СD4+ CD27 – цитокинов, таких как γ-интерферон, участвуют в патологических реакциях, вызывающих деструкцию легочной ткани. Переход от субпопуляции СD4+ CD27+ к СD4+ CD27 происходит в легких. Макрофаги, в свою очередь, трансформируются в гигантские клетки Пирогова – Лангханса, локализуя процесс с формированием гранулёмы. Кроме того, СD4+, СD8+ лимфоциты посредством секреции ФНО-α оказывают цитотоксическое действие на МБТ, находящихся внутри макрофагов [4, 11].
Выше представленные макро- и микроскопические изменения характеризуют смешанный характер диссеминации микобактерий туберкулёза с преобладанием гематогенного типа, что обуславливает двусторонний характер поражения при вторичных прогрессирующих туберкулёзных процессах, что сопровождается микст- инфекцией в легких при ВИЧ-инфекции у данной категории больных [6]. Кроме того, выявленная неспецифическая парагранулематозная реакция с наличием кониофагов с инородными включениями может свидетельствовать о прижизненном инъекционном употреблении наркотиков [8].
В группе сравнения (группа № 2) ВИЧ/туберкулез с инъекционной наркоманией стадия ВИЧ-инфекции по данным медицинской документации IVВ–V характеризовалась резким снижением иммунологических показателей количества CD4+ лимфоцитов, медиана составила 18,2 клеток/мкл, медиана количества CD8+ лимфоцитов – 264,4 клеток/мкл, медиана иммунорегуляторного индекса – 0,062. Группа сравнения была представлена клинико-морфологическими генерализованными формами туберкулёза с множественными локализациями. В паренхиме легких обнаруживались множественные участки казеозных некрозов, а также неспецифические некрозы по типу инфарктов легкого на фоне признаков отека легких. В микроскопической картине преобладали казеоз с резким обеднением клеток лимфоидного вала без формирования грануляционной ткани в сочетании с диффузным альвеолярным повреждением. В просветах альвеол преобладал смешанный серозно-геморрагический экссудат, в котором обнаруживались нейтрофильные лейкоциты, нити фибрина и значительное количество альвеолярных макрофагов и слущенных эпителиоцитов. В альвеолцитах отмечалось отсутствие ядер, межальвеолярные перегородки были увеличены за счет отека и диапедезных кровоизлияний. В мелких бронхах и бронхиолах выявлялись параспецифические изменения в виде бронхиолита и панбронхита. Кроме того, обнаруживались выраженные сосудистые поражения в виде васкулитов с формированием периваскулярных неспецифических фибриноидных некрозов и тромбозов. Изменения в легких в данной группе наблюдения, по-видимому, связаны с развитием синдрома острого повреждения легких (СОПЛ), или респираторного дистресс-синдрома взрослых (РДВС, ARDS), патогенез которого, возможно, обусловлен дисбалансом цитокинов при ВИЧ-инфекции в сочетании с туберкулезом при иммунодефиците [11], которые повышают проницаемость микрососудов, в том числе аэрогематического барьера, что приводит к геморрагическому альвеолярному отеку, васкулитам с некрозами, повреждению эндотелиальной выстилки. Кроме того, поврежденный эндотелий выделяет вазоактивные медиаторы, в том числе соединения азота и кислорода, что способствует усилению повреждающих эффектов. При СОПЛ рассматривается роль активации комплемента, а именно его фракции С5a, которая вызывает системную активацию нейтрофильных лейкоцитов совместно с тромбоцитами, что приводит к секвестрации в микроциркуляторном русле легких с их повреждением [14]. Наряду с вышеперечисленными механизмами, важная роль в развитии респираторного дистресс-синдрома взрослых отводится альвеолоцитам II типа, которые являются, во-первых, камбиальными клетками для альвеолоцитов I типа и участвуют в их восстановлении, во-вторых, участвуют в активном удалении экссудата из альвеол и, в-третьих, участвуют в синтезе сурфактанта, повреждение которого приводит к усилению альвеолярного отека, что способствует усилению блока воздух-кровь с развитием артериальной гипоксемии. Кроме того, протеины сурфактанта не только участвуют в биомеханике дыхания, но и, по мнению некоторых исследователей, фракции SP-A; SP-D, повышают функциональную активность макрофагов, увеличивая способность экспрессии антигена и его захвата, тем самым обеспечивая неспецифическую защиту против МБТ [4]. Стоит отметить, что по данным медицинской документации в нашем исследовании у 58 % (n = 27) пациентов с инъекционной наркозависимостью наблюдалась ВИЧ-ассоциированная липодистрофия, а в группе сравнения – в 86 % случаев (n = 6) с клиническими проявлениями в виде общей гипотрофии и/или накопления и потери жира в различных участках тела. ВИЧ-ассоциированная липодистрофия может сопровождаться поражением легких, её патогенез гипотетически связан с различными факторами: побочным действием АРВТ, а именно с приемом ингибиторов протеаз и других комбинированных препаратов, а также в результате эндотоксикоза, вызванного психотропными веществами [15], что в нашем исследовании морфологически проявлялось диффузным альвеолярным повреждением на фоне туберкулёзных изменений.
Вышеописанный многокомпонентный механизм развития СОПЛ, наблюдаемый в группе сравнения у лиц с инъекционной наркоманией (группа № 2), по-видимому, приводил к местному иммунодефициту со снижением функционального состояния альвеолярно-макрофагального звена воспаления, а системная иммунная депрессия, вызванная ВИЧ в сочетании с наркоманией, привела к резкому снижению количественного и качественного состояния иммунокомпетентных клеток СD 4 + , СD 8 + с инверсией иммунорегуляторного индекса, что явилось благоприятным фактором для размножения МБТ и прогрессии туберкулёза.
Заключение
Рецензенты:
Снигур Г.Л., д.м.н., доцент, заведующий кафедрой биологии, Волгоградский государственный медицинский университет, г. Волгоград;
Поройский С.В., д.м.н., заведующий лабораторией моделирования патологии, Волгоградский медицинский научный центр, г. Волгоград.

Дата публикации: 06.08.2016 2016-08-06
Статья просмотрена: 321 раз
Актуальной проблемой современной медицины является развитие и течение туберкулезной инфекции лёгких у больных, инфицированных вирусом иммунодефицита человека (ВИЧ, Human immunodeficiency virus – HIV). По данным ВОЗ на 2014 – 2015 год микобактериями туберкулеза инфицировано 33% населения планеты. В тоже время ежегодно в мире регистрируют до 8 млн. новых случаев туберкулеза и до 2 млн. смертей от него. Наибольший риск заражения туберкулезом у ВИЧ - инфицированных. У этих больных заболеваемость туберкулезной инфекцией в 200 раз выше, чем в других группах населения [1,2]. В настоящее время туберкулез занимает первое место в структуре оппортунистических инфекций у ВИЧ-инфицированных.
Целью работы явилось изучение морфологических особенностей туберкулеза легких у ВИЧ-инфицированных больных.
Анализировался аутопсийный материал с различными типами тканевой реакции в легких при туберкулезной инфекции в зависимости от давности заболеваний, степени иммунодепрессии, гендерной принадлежности и возраста респондентов.
Были изучены протоколы вскрытия и гистологические препараты аутопсийного материала 39 умерших больных с сочетанием ВИЧ-инфекции и туберкулеза легких за 2015 год РФ РОПАБ. В работе использовались следующие гистологические окраски: гематоксилин-эозином, по Цилю-Нильсену (для обнаружения M. Tuberculosis в некротических очагах), окраска пикрофуксином по ван-Гизону. Микроскопия осуществлялась с помощью микроскопа Leica с увеличением 10*10, 10*20, 10*40, 10*90. Возраст умерших больных и распределение по полу представлены в графике 1.


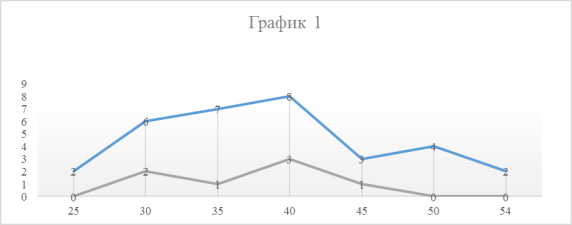
Как видно из графика возраст умерших больных чаще приходился на четвертое десятилетие (69%) случаев. Имело место превалирование мужчин - 32 больных (82%) над женщинами - 7 больных (18%).
Согласно современной классификации стадийности ВИЧ-инфекции по В.И. Покровскому (2001 год) развитие туберкулезной инфекции больного с ВИЧ соответствует 4 стадии HIV (стадия вторичных заболеваний) [3]. Она характеризуется гибелью CD4-клеток и истощению их популяции, что приводит к развитию вторичных (оппортунистических), инфекционных или онкологических заболеваний на фоне иммунодефицита. В зависимости от тяжести вторичных заболеваний выделяют стадии 4А, 4Б, 4В.
Стадия 4Б у ВИЧ-инфекционных умерших встретилась в 16 (41%) случаев. Для нее характерен уровень иммуносупрессии 200 – 350 кл. в 1 мкл. В наших наблюдениях иммунограмма выполнена в 10 (62,5%) случаях, в 7 (70%) из которых количество РНК-копий вируса в сыворотки крови составило от 25 до 300 тыс. В легких при макроскопических исследованиях в 5 (31,25%) наблюдениях встретился милиарный или мелкоочаговый двусторонний диссеминированный туберкулез легких. В 10 (62,5%) случаях имела место крупноочаговая диссеминация, в 1 случае (6,25%) – казеозная пневмония. Морфологически в данной группе респондентов микроскопическая картина изменений в легких имела следующие особенности: была отмечена утрата черт специфичности морфологической картины воспаления и отсутствовали признаки волнообразного течения процесса, характерного для туберкулеза. Помимо очагов казеозного некроза наблюдались очаги специфического гнойно-некротического характера воспаления, обычно располагающиеся периваскулярно. Это объяснялось явлениями неспецифического деструктивного васкулита, который часто сопровождался тромбированием сосудов. Внутригрудные лимфатические узлы были увеличены и гиперплазированы, гистологически в них отмечена картина гнойного воспаления. Очаги казеозного некроза с формированием гигантоклеточных бугорков в них были отмечены лишь в 2 (12,5%) случаях из 16. При окраске по Циль-Нильсену Mycobacterium tuberculosis отмечалась лишь в фокусах казеозного некроза. В тех участках легкого, где имело место гнойно-некротическое воспаление она отсутствовала.
У 21 (53,8%) умершего больного стадийность ВИЧ-инфекции была определена как 4В. В 15 (71,4%) случаях была выполнена иммунограмма, в которой уровень CD4-клеток составил менее 200 кл. в 1 мкл. У этих же 15 больных количество РНК-копий вируса в 1 мл сыворотки крови составило от нескольких сотен тысяч до 3 млн. Морфологические изменения легких характеризовались диффузным поражением всей легочной ткани. Превалировали поражения нижних долей с диссеминацией процесса не только в лёгких, но и с поражением внутригрудных лимфатических узлов. При морфологическом исследовании регистрировалась ареактивная картина. Имело место развитие очагов казеозного некроза от миллиарных до нескольких сантиметров с тенденцией к распаду и формированием острых каверн. Перифокальная воспалительная реакция была представлена слабо и в основе характеризовалась скудной лимфоэпителиоидной инфильтрацией без гигантских клеток Пирогова-Ланганса в спавшейся легочной ткани. При окраске по Циль-Нильсену в казеозных массах отмечается большое количество палочковидных форм Mycobacterium tuberculosis. Явлений некроза даже при длительном течение заболевания (до нескольких месяцев) при окраске по ван-Гизону не наблюдалось [5].
Исходя из анализа полученных данных, мы отметили следующие морфологические особенности сочетания туберкулеза легких с ВИЧ-инфекцией:
- Стадия 4А характеризовалась выраженной реакцией специфического продуктивного воспаления с эпителиоидно-гигантоклеточной и лимфоидной реакцией по периферии гранулём. Имелись признаки волнообразного течения заболевания в виде наличия довольно хорошо отграниченных за счет пневмофиброза фокусов казеозного некроза. При нарастании иммуносупрессии изменения в легких характеризовались в основном как развитием специфического воспаления, так и формированием очагов гнойно-некротического характера. В этих случаях имелась картина гнойно-некротического васкулита сосудов легкого с их тромбированием и последующим развитием некротических изменений в легком. Макроскопически поражение легких имело более распространенный характер с поражением уже всех легочных долей.
- Стадия 4Б как и терминальная стадия СПИДа характеризовалась отсутствием или слабовыраженной ответной воспалительной реакцией на появление в легких очагов казеозного некроза. Помимо резко выраженной иммуносупрессии в эту стадию наблюдалось резкое увеличение в сыворотке крови РНК-копий вируса от нескольких сотен до нескольких млн. Поражение лимфоузлов в эту стадию имело черты специфического туберкулезного воспаления также без формирования типичных туберкулезных гранулём.
Проведен ретроспективный анализ операционного материала 13 больных деструктивным туберкулезом легких, получавших в предоперационном периоде не менее 3 мес. перибронхиальную лимфотропную терапию (ПБЛТ) или ингаляции с противотуберкулезными препаратами по поводу воспалительных изменений в бронхах. Всем больным выполнена резекция легкого на уровне главного или долевого бронха. При патоморфологическом исследовании на фоне ингаляционного лечения противотуберкулезными препаратами наблюдали выраженную дистрофию реснитчатого эпителия слизистой оболочки бронхов и значительное утолщение базальной мембраны. В группе, получавшей ПБЛТ, подобные изменения были минимальны или не встречались вовсе (p
врач торакальный хирург
630040, г. Новосибирск, ул. Охотская, д. 81а.
Тел.: 8 (383) 203-76-93
доктор медицинских наук, директор
Тел./факс: 8 (383) 203-78-25.
630040, г. Новосибирск, ул. Охотская, д. 81а.
Тел.: 8 (383) 203-76-93
доктор медицинских наук, заведующий туберкулезным легочно-хирургическим отделением
630040, г. Новосибирск, ул. Охотская, д. 81а.
Тел.: 8 (383) 203-76-93
доктор медицинских наук, врач торакальный хирург
630040, г. Новосибирск, ул. Охотская, д. 81а.
Тел.: 8 (383) 203-76-93
врач торакальный хирург
630040, г. Новосибирск, ул. Охотская, д. 81а.
Тел.: 8 (383) 203-76-93
доктор медицинских наук, профессор кафедры фтизиопульмонологии, патологоанатом.
630091, г. Новосибирск, Красный проспект, д. 52
Тел.: 8 (383) 343-65-12
1. Абрикосов А. И. Частная патологическая анатомия. – М.: Медгиз, 1947. ‒ Т. 3. – 568 с.
2. Авдиенко К. А., Краснов Д. В., Грищенко Н. Г., Петренко Т. И. Перибронхиальная лимфотропная терапия в предоперационной подготовке больных туберкулезом органов дыхания // Туб. и болезни легких. – 2016. – № 10. – С. 44-47.
3. Национальные клинические рекомендации по применению хирургических методов в лечении туберкулеза легких. Национальная ассоциация фтизиатров. Ассоциация торакальных хирургов России. 2013.
4. Непомнящих Г. И. Прижизненная морфология крупных бронхов человека при хронических воспалительных заболеваниях легких. Методические разработки к патологогистологическому и ультраструктурному исследованию бронхиальных биопсий. ‒ Новосибирск, 1977. – 68 с.
5. Плетнев Г. В., Краснов Д. В. Перибронхиальная лимфотропная терапия в комплексном лечении больных с прогрессирующим туберкулезом легких // Пробл. туб. – 2003. – № 12. – С. 3-5.
6. Попов В. А. Перибронхиальное введение лекарственной смеси на пролонгирующей основе в комплексном лечении деструктивного туберкулеза легких с множественной лекарственной устойчивостью // Фтизиатрия и пульмонология. – 2011. – № 2. – С. 135.
7. Процюк Р. Г., Ерохин В. В., Филиппенко Л. Н. Влияние ультразвуковых ингаляций потивотуберкулезных препаратов на воздушно-кровяной барьер легкого // Пробл. туберкулеза. – 1985. – № 4. – С. 48-51.
8. Серов О. А., Колпакова Т. А., Краснов В. А. Воспалительные изменения в бронхах у больных туберкулезом легких в предоперационном периоде // Туб. и болезни легких. – 2013. – № 11. – С. 32-35.
9. Серов О. А. Комплексный подход в оценке характера поражения бронхиального дерева у больных туберкулезом легких с разной длительностью заболевания: Автореф. дис. … канд. мед. наук. – Новосибирск, 2013.
10. Струков А. И. Форма легочного туберкулеза в морфологическом освещении. – М.: Медгиз, 1948. – 160 с.
11. Фтизиатрия. Национальные клинические рекомендации / под ред. П. К. Яблонского. – М.: ГЭОТАР-Медиа, 2015. – 240 с.
12. Шестерина М. В. Изменения бронхов при туберкулезе легких: монография. М.: Медицина, 1976. – 168 с.
- Обратные ссылки не определены.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


