Методы дифференциации микобактерий туберкулеза

Автореферат диссертации по ветеринарии на тему Индикация и дифференциация микобактерий туберкулеза методом молекулярной гибридизации
КАЗАНСКИЙ ОЩЕНА ЛЕНИНА ВЕТЕРИНАРНЫЙ ИНСТИТУТ имени Н.Э.БАУМАНА
На правах рукописи
ШИЛОВА ВАЛЕНТИНА ИВАНОВНА
ИЩИКАЦЙЯ И ДИФФЕРЕНЦИАЦИЯ МЖОБАКТЕРИЙ ТУБЕРКУЛЕЗА МЕТОДОМ МОЛЕКУЛЯРНОЙ ГИБРИДИЗАЦИИ
16.00.06 - ветеринарная микробиология, вирусология, эпизоотология, микология и иммунология
диссертации на соискание ученой степени кандидата ветеринарных наук
Работа выполнена на кафедре биохимии Казанского ордена Ленина ветеринарного института имени Н.Э.Баумана и в лаборатории биохимии Всероссийского научно-исследовательского ветеринарного института
Научные руководители - заслуженный деятель науки Республики
Татарстан, Лауреат Государственной премии СССР, доктор ветеринарных наук, профессор ХАЗШОВ Н.З., старший научный сотрудник, кандидат биологических наук АЛИМОВ A.M.
Официальные оппоненты: доктор ветеринарных наук, профессор
кандидат ветеринарных наук, доцент СИБГАТУЛЛИН P.C.
Ведущая организация - Московская'ветеринарная академия
Из микобактериальных культур после соответствующей обработки и очистки полезны чистые препараты дезоксирибонуклеиновой кислоты.
Для лизирования клеточной стенки минобактерий били использованы ферменты лизоцим, проназа. Обработка микобактерий 12 %-ной трихлоруксусной кислотой дала возможность получить препараты ДНК в течение одного часа. Депротеишзацию проводили хлороформ :изоаииловым спиртом. Полученные препараты ДНК очищали РНК-зой в концентрации 50 мкг/мл. По этой методике.выделяли ДНК из следующих микобактерий М. bovis штаммы 8, 14, ЕЦК, м. tuberculosis , М. phlei , Ы. intracellulars., 11. fortuitum, И. eorofulaeeum , U. kaasasü . Апробированная методика хотя и оказалась быстрой и эффективной для ввделения ДНК вышеуказанных минобактерий, но все попытки получить ДК из u. avium оказались безуспешными. В связи с этим использование ультразвука для разрушения клеточной стенки И. avium после соответствующей экстракции позволило осадить ДНК этой культуры.
Для определения размера генома требуются высокоочищенные препараты ДНК. Чистоту и концентрацию препаратов ДНК контролировали визуально, используя электрофорез ДНК, окрашенных бромистым гидием, в агарозном геле и по спектрам поглощения в области 190-300 нм, которые регистрировали на спектрофотометре "Ferkin-Eimer " /Швеция/. Оптическая плотность препаратов
ДНК на спектрограмма при длине волны 260 ни позволила рассчитать концентрацию ДНК в растворе для количественного внесения ДНК в лунки при электрофорезе.
Определение состава ДНК проводили по методике Марлура и Доти /1962/. Содержание гуанина и цитозина устанавливали по температуре плавления ДНК. Для этого, поднимая температуру от 60 до 100 °С, провели запись оптического-поглощения раствора ДНК на спектрограмме при длине волны 260 нм и определили температуру плавления ДНК. Используя температуру плавления ДНК, рассчитали процентное содержание суммы гуанина /Г/ и цитозина /Ц/ по форлуле:
Г + Ц - процентное содержание суммы гуанина и цитозина,
Тпл - температура плавления.
Для дот-блот гибридизации исследуемые чистые, нативные препараты ДНК в количестве 3 мил в виде точек были нанесены в квадраты /1,5x1,5 см/, начерченные ка капроновых мембргшгых фильтрах /размер пор 0,2 ши'/, выпускаемые эксперимен- альной лабораторией "Хийу Калур" /Эстония/.
Денатурацию двухцепочечной ДНК проводили с использованием щелочного раствора. "Отниг" одноцепочечной ДНК, адсорбированной на мембране, осуществляли при тешературе 80 °С з течение 2-х часов.
Для приготовления ДНК-зонда обработанную ультра- -уном /при 22 кГц/ в течение 8 минут ДНК н. bovio депротеинизировали равным объемом хлороформшзоавдловым спиртом /24:1/. Экстрагированную 'ДКК растворяли в кипяченной бадистиллироБаьюй воде.
Мечение ДНК-зовда II. bovin -роводили дезоксиаденозик о -/ об- - трифосфатом методом кик-трансляции. Дня получения меченого ДНК-зонда ы. bovis к вкушенной метке /АТФ и ТШ/ добавили дезоксинуклеотвдтри$осфаты /ГШ и ЦЗФ/ и осуществили реакцию полимеризации с использованием ДНК-полимеразы I. Сггесь инкубировали при температуре 37 °С в течение часа. Обычно за это время ДНК метится до требуемой удельной активности. Ник-транслированнуга ДНК отделяли от невключившкхся dinp на .солон-
ке с сефздэксом с - 50. Концентрация метки составляла 345-378«Ю3 имп./минЛясг ДК.
Предгибридкзацгёо проводили при температуре 42 °С в течение 3 часов, используя 50 si-нкй форкш.тид и ДИК носитель из сперши лосося, которую предварительно денатурировали кипячением в течение 5 икнут. Предгкбридизационную смесь вносили из расчета 0,5 ыл смеси на I см^ мембраны.
Гибридизацию проводили при температуре 42 °С в течение 1618 часов. ГибрвдизгциЪннуа смесь, состоящую из меченого ДНК-зовда м. bovis и предгкбридизационной смеси, вносили из расчета 50 ккл смеси на I см мембраны.
Отмнвку фильтра делали в буфере, содержащем 20XSSO и 10 îS-ньй SDS . Высушенную мембрану помещали в кассету с рентгеновской пленкой к ставили в холодильник при температуре -20 °С на 16-20 часов.
Была определена чувствительность метода дот-гибридизации ДЩ-зонда ы. bovis. Дня этого в пробирках по стандарту мутности делали разведение микробных клеток М. bovis. На квадраты /1,5x1,5 см/, начерченные на капроновых фильтрах, наносили различное количество микробных клеток. После высушивания на воздссе фильтр смачивали 10 Si-нык SDS , лизоциыом в концентрации 26 мг/ыл к проназой в концентрации 500 ыкг/мл и инкубировали в термостате в течение 30 минут. Денатурацию проводили 0,5.1 щелочным раствором. Нейтрализовали 0,Si. трис-Ш1, pH -6,0 при комнатной температуре. "Отжиг" адсорбированных одно-цепочечных ДК проводили в вакууме.
Для выполнения геномной "дактилоскопии" требуется расщепление Д1К генома специфическими ферментами - рестриктазами. Путец сравнительного изучения рестрикции ДНК ыикобактериГ: разными ферментами установлено, что рестриктазы Eco 91 I, Eco 64 I, Eco 47 I дают фрагменты, годные для идентификации мико-бактерий.
Гидролиз ДНК ферментами проводили в ультратермостате при температуре 37 °С в течение 3 часов. Результаты рестрикции проверяли ча электрофорезе.
Злектрофоретическое фракционирование ДК осуществляли в горизонтальном блоке I 5^-ного агарозного геля при напряжении
поля 0,8 В/си в течение 16-20 часов. Для визуализации .фрагментов ДК их окрашивали этидиум бромидом. В качестве маркера брали фрагменты ДНК фага Л>.
Фрагменты ДМ, разделенные с помощью гель-электрофореза в агароэном геле, сначала денатурировали в растворе, содержащем 1,51! иась и 0,3.1 гГаШ в течение часа, а затем нейтрализовали, поместив гель в буфер, содержащий 0,5.1 трис-НС1, рН - 8,0 и 1,Ш КаСЬ в течение часа.
Блотгинг проводили при комнатной температуре в буфере, содержащем ЮХ ббс , по Саузерну. Перенос фрагментов ДгК из геля на фильтры происходил в течение 18-20 часов. Спорость переноса ДЩ зависит от размера фраплентов ДК1С и пористости геля. Перенос мелких фрагментов ДКК /I кВ/ из 0,8-1,0 '/-ной г гарозц заканчивается через 1-2 часа, а перенос фрагментов, превышающих 15 кВ, продолжается 15 часов и больше.
Фильтр, пропитанный 6Х ббс в течение 5 миЯут, высушивали при комнатной температуре, а затем под вакуумом при тешерату-ре 80 °С в течение 2 часов.
Предгибридизациы проводили при температуре 65 °С в течение 3-4 часов. Предгибридизацноняая смесь состояла из 20Х .-.БС , 10 ?*-ной Б г® , 5 ОХ Денхардта. Гибридизацию делали с высокоме-ченным /удельная активность Ю7 ими./мин на I мкг ДЕ/ од-ноцепочечныы зондом на основе ДНК фага М'З юр II при темяера-туре 65 °С в течение 16-18 часов /Тазза!^ й. ег аХ , 193?/. "Отетг" .ДНК фага М13 с праймером проводили при температуре 65 °С в тс гение 10-15 минут.
Для введения метки в ДНК фага Ы13 использовали фрагаект Кленова /2 ед. акт./, смесь немеченых трифосфатов, ЮХ буфер ник-трансляции. Па сцинциляционном счетчике измеряв процент включения метки. Чистоту отмывки фильтров проверял;? на счетчике. Затем мембрану высушивали и помещали в кассету с рентгек-пленкой. Ее ставили в холодильник лри ?е:«1пературз -70 °С на 12-16 часов, затем пленку проявляли и делал:! снимки.
Данные, подученные в опытах, подвергали статистической обработке на программируемых микрокалькуляторах "Электро'шка МК-56" /1укшаитов Р.Х., Нигматуллин Н.Х., 1984/.
Биохимическая характеристика препаратов ДНК микобактерий. Исследованше нами спектральные характеристики чистоты и количественного содержания препаратов ДНК микобактерий в области 190-300 мл, а тагсге отношение Дзбс/%30 и ^260^280' Указыва" юще„ на коэффициент чистоты от полисахаридов и белков соответственно, указаны в таблице I.
I. Спектральная характеристика препаратов ",ЩК микобактерий
¡Концентрация в! Коэффициент чистоты от; Микобак^ерии .'растворе ДНК, ¡полисахаридов! белков
___! миг/мкд ! ДябО^ЗЗО ! Д260/Д280
11. bovis 2,80 1,83 1,80
М. bovis штамм БЦЙ 2,80 1,92 1,86
М. avium • 3,00 1,81 1,80
Ы. phlei 3,20 1,81 1,87
11. intracellulare 2,65 1,82 1,89
Ii. fortuitum 2,77 1,81 1,31
11. о его fulaceum 3,20 1,81 1,92
ДЖ фага Я 2,80 2,00 1,83
Как видно из таблицы I, отношение величины оптической плотности при длине волны 260 им к величине оптической плотности при длине волны 230 нм, а также отношение величины оптической плотности, измеренной при длине волны 260 нм, к величине оптической плотности, полученной при длине волны 280 im, колебались в пределах 1,8-2,0, что указывает на чистоту препаратов ДНК микобактерий от полисахаридов и белков.
Результаты исследований температуры плавления ДНК микобактерий представлены в таблице 2.
Согласно полученным данным /табл. 2/ препараты ДНК мико-бактери: мокно разделить на три группы.
В первую группу входят препараты ДНК и. bovis , м. bovis штамм БЦД. Средняя температура плавления ДНК этих микобактерий
2. Сравнительная характеристика ДНК микобактерий
Температура °С .'Средняя тем- .'Мол.
Микобактерии .'начала пла-!конца пла-!пература пла-!гуаншм-_!влегом ДНК !вления .ДНК.' вления ДМ !цитозин
II. bovis 83,5+0,65 99,5+0,29 91,5+0,41 54,1
М.Ъоvis штамм ЕВД 84,8+0,85 99,¿0,48 92,(¿0,35 55,3
М. avium 72,¿0,85 97,6+0,47 85,(¿0,20 38,3
И. phlei 76,3+0,48 94,¿0,48 85,5+0,41 39,5
Н. intraoellulare 77,3+0,43 95,^0,75 86,5+0,20 41,9
II. fortuitum 80,5+0,65 98,5+0,96 89,5+0,35 49,1 ■
II. scrofulaceum 79,8+1,11 99,5+0,29 89,6*0,43 49,3
ДНК фага Л 75,8+1,11 99,2^0,48 87,5+0,54 44,4
была в пределах 91,5-92 °С, а процентное содержание гуанша и цитозина равно 54,1-55,3 мол.
Во вторую группу входят препараты ДНК ц. avium, и. phlei, 11. intraoellulare • Средняя тешература плавления соответственно составила 85,0, 85,5, 86,5 °С, а содержание гуан|ша и цитозина соответственно равно 38,3, 39,5 и 41,9 мол. 'Л.
Оказались близки ме:кду собой показатели ДНК Li. fortuitum. и и. scrofulaceum, которые вошли в третью группу. Средняя температура плавления составила 89,5, 83,6 °С, а сумма гуанина и цитозина равна 49,1, 49,3 мол. Я соответственно.
.ДНК-ДНК гибридизация. Для туцшации и идентификации мико-бактерий туберкулеза нами был создан ДНК-зонд из патогенного шташа и. bovis , который метили дезоксиаденозин 5 - /сб -^Р/ трифосфатон методом ннк-трансляции.
На рисунках I, 2 видны радиоавтографические пятна гибридизации ДНК-зонда Н. bovis С ДЖ II. bovis , Н. tuberculoais, н. bovis штамм БЦЖ.
Гибридизация не произошла с ДНК ц. intraoellulare, ц. phlei, И. scrofulaceum, и, fortuitum и гетерологическнми бактериями Brucella штамм 544, листерии, Brucella canin , культуры клеток, т.е. в этом случае результат был отрицательный.
Рис. I. Дифференциация патогенных от атипичных и сапрофитных форм микобактерий А: 1-м. bovie > 2 -Ы. bovis штамм 14, 3-й. intracellulare , 4 -II. scroíulaceuia ; В: I - м. bovis штамы БЦЖ, 2 - И. tuberculosis ,3-11. phlei , 4 -
Рис. 2. Результаты точечной гибридизации ДНК ы. bovis,
меченой /АТ , который обеспечивает индикацию микобактерий ы. tuberculosis, M. bovis штаммы 8, 14 и Б1Щ, а также дифференцирует патогенные микобактерии от условно-патогенных. Чувствительность ДНК-зовда .в реакции ДНК-ДНК гибридизации составляет 50-100 микробных клеток на точку.
4. Согласно нуклеотидноыу составу ДНК микобактерий туберкулеза можно разделить на три группы. Процентное содержание гуанина и цитозика в ДНК К. bovis и H. bovis штамм БЦЯ составило 54,1-55,3 МОЛ. M. aviua , 11, phlei , Ii. iivtracellulare 38,3-41,9 мол. M. fortuitum, M. scrofulaeeum - 49,1-49,3
1. Выявле!ше гипервариабельных участков ДАС микобактерий туберкулеза при помопдо зонда ДНК бактериофага !ЯЗ_позволяет дифференцировать патогенше, атипичнне и сапрофитные формы ми-кобактернй. Геномная "дактилоскопия" рекомендуется для идентификации бактериальных штаммов, систематики микроорганизмов и для решения ряда .других теоретических и практических задач микробиологии и эпидемиологии.
2. Методы вццеления ДИ^ из микобактерий туберкулеза, усовершенствованные нами /рацпредложение У 318-91 от 3 апреля 1991 г. и II? 17 от 19 июня 1991 г./, позволяют с меньшими затратами выделять хромосомальную ДНК и рекомендуется к использованию в научных исследованиях и в учебном процессе.
СПИСОК опубликованных работ по теме диссертации:
1. Якупов Т.Р., Шилова В.И. И$А - в прижизненной диагностике туберкулеза крупного рогатого скота И Тезисы докладов межвузовской научно-практ:1ческой конференции молодых ученых и специалистов, посвященной 60-летию Ставропольского ордена Трудового Красного Знамени сельскохозяйственного института. -Ставрополь, 1991. -С. 133-134.
2. Фаизов Т.Х., Шилова В.И., Алимов A.M., Хазипов Н.З. Разработка экспресс-метода выделения ДНК из микобактерий туберкулеза // Достижения Казанской ветеринарной школы - в практику зхивотноводства: Тезисы докладов. -Казань, 1991. -С. 12.
3. Шилова В.И., Фаизов Т.Х., Алимов A.M., Хазипов Н.З., Вали-ев Li.В. Метод ДНК-ДНК гибридизацга! для дифференциации мико-бантерий /,' Актуальные вопросы ветеринарш! и. зоотехнии: Тезисы докладов. -Казань, 1992. -С. 55.
4. Фал зов Т.Х., Алимов A.M., Хазипов Н.З., Шилова В.И. Использование молекулярной гибридизации для идентификации возбудителей зоонозов // Экологические проблемы животноводства и
совершенствование,подготовки ветеринарных врачей: Материалы Всероссийской научной конференции. -Челябинск, 1992. -С. 68. б. Алимов A.M., 5аизов Т.Х., Шилова В.И. Идентификация возбудителен отдельных зооантропонозов методом молекулярной гибридизации // Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии: Материалы научной конференции ВШШВВиМ. -Покров, 1Э92. -Ч. 2. -С. 218. 6. Шилова В.И., ¿аизов Т.Х., Алимов A.M., Хазипов Н.Э., Вали-ев П.В. Индикация и дифференциация микобактерий методом Д-К-ДНК гибридизации // Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии: Материалы научной конференции ВНИИВВиМ. -Покров, 19Э2. -Ч. 2. -С. 216.
Заказ 12. Подписано г печать 17.02.93. Формат 60 к в*1/« Бумега писчая. Печать . . егная. I п.л. Тирах 100 экз.
УчеС10к 0Фсетной печати КВИ. К8зань-420074. Ветинститут.
Туберкулез - хроническая инфекция с длительным периодом выделения возбудителя, многообразием клинических проявлений, поражением различных органов и систем - представляет непростую задачу для лабораторной диагностики. Молекулярно-биологические методы (ПЦР) используются для выявления, видовой дифференциации и определении лекарственной устойчивости микобактерий туберкулезного комплекса.
Ввиду биологических особенностей возбудителя и иммунного ответа человека диагностика туберкулеза не может ограничиваться каким-либо одним методом и должна проводиться комплексно.
Возбудители туберкулеза могут быть обнаружены в различных биоматериалах, природа которых определяет выбор наборов реагентов для экстракции ДНК. Ключевой принцип выбора биоматериала для диагностики туберкулеза методом ПЦР: необходимо выбирать биоматериал, соответствующий клинической форме туберкулезной инфекции.
Например, для диагностики туберкулеза мочеполовой системы нужно исследовать мочу или менструальную кровь, рекомендуется также исследовать биоптаты из подозрительного очага. Для диагностики туберкулеза легких используется мокрота, бронхо-альвеолярный лаваж.
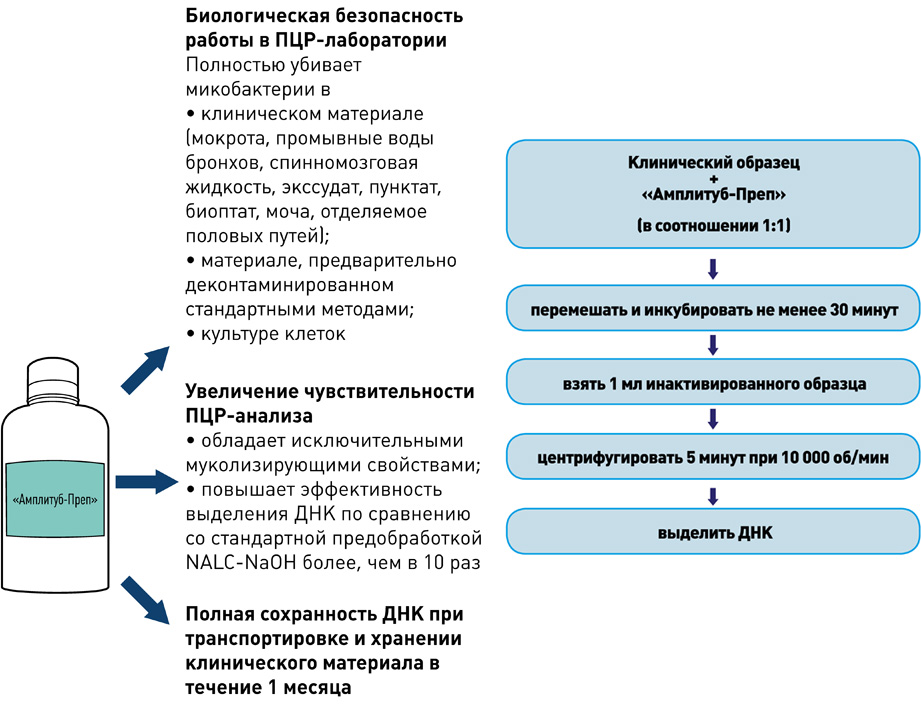
Реагенты и оборудование для предобработки биоматериалов и экстракции ДНК
| Наборы реагентов для экстракции ДНК из мокроты, бронхо-альвеолярного лаважа, мочи, синовиальной жидкости и смывов с объектов окружающей среды | АмплиПрайм ДНК-сорб-В и АмплиПрайм РИБО-преп |
| Реагент для разжижения мокроты и синовиальной жидкости | Муколизин |
| Набор для экстракции ДНК, используемый при исследовании биоптатов (легкие, лимфатические узлы, почки, печень, мозг, селезенка) | ДНК-сорб-С |
| Оборудование для гомогенизации биоптатов | TissueLyser LT или TissueLyser II |
| Парафиновые блоки нарезают на микротоме или вырезают фрагмент ткани одноразовым скальпелем, а затем проводят экстракцию ДНК, например, с помощью набора реагентов QIAamp DNA FFPE Tissue Kit (50) | QIAamp DNA FFPE Tissue Kit (50) |
Наборы реагентов для ПЦР-диагностики туберкулеза
Применение молекулярно-биологических методов (в частности, выявление ДНК методом ПЦР) в диагностике туберкулеза регламентировано Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009).
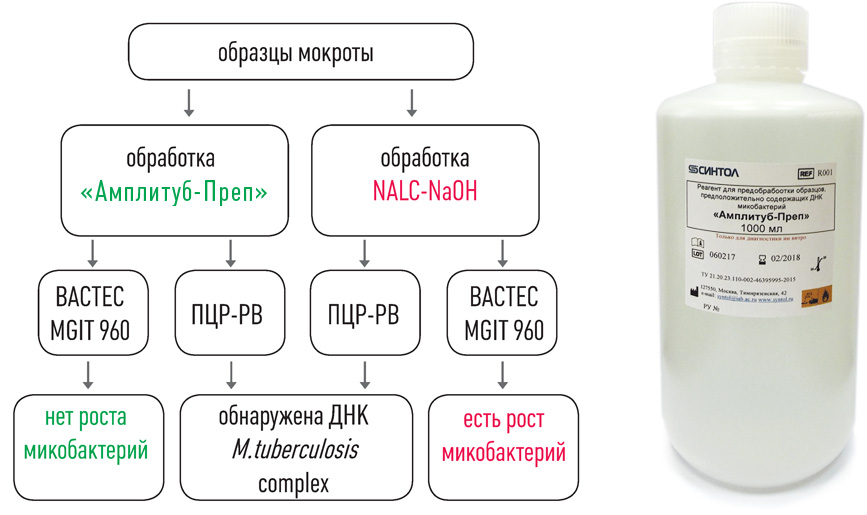
Выявление микобактерий туберкулезного комплекса
Набор реагентов АмплиСенс® МТС-FL предназначен для обнаружения ДНК микобактерий туберкулеза – Mycobacterium tuberculosis complex (MTC), включающий в себя виды микобактерий разной степени вирулентности, вызывающих туберкулез у человека (M.tuberculosis, M.bovis, M.africanum, M.microti, M.canetti, М.pinipedii).
Микобактерии туберкулеза выявляются без видовой дифференциации; микобактерии, не относящиеся к MTC (например, M.avium и M.paratuberculosis) - не выявляются. Данный набор реагентов используется в топической диагностике туберкулеза и позволяет быстро (за несколько часов) с высокой чувствительностью и специфичностью (близким к 100%) определять наличие микобактерий туберкулеза в образце биоматериала.
Благодаря высокой скорости и информативности в диагностике туберкулеза, методы амплификации нуклеиновых кислот (в том числе ПЦР) в 2010 году были предложены CDC США для подтверждения диагноза туберкулеза наряду с культуральным методом.
Видовая дифференциация микобактерий туберкулеза методом ПЦР
Не менее важно дифференцирование до вида внутри группы MTC. Это связано с необходимостью определения источника заболевания, определения тактики противотуберкулезной терапии, а также для подтверждения случаев поствакцинальных осложнений.
С этой задачей позволяет справиться набор реагентов АмплиСенс® МТС-diff-FL, предназначенный для дифференцирования видов микобактерий туберкулеза внутри MTC: человеческого (M.tuberculosis), бычьего (M.bovis) и вакцинного штамма (M.bovis BCG) – в клиническом материале и культурах микроорганизмов.
Актуальность видовой дифференциации определяется, например, тем, что разные виды микобактерий отличаются профилем лекарственной устойчивости. Например, M.bovis и её вакцинный штамм M.bovis BCG отличаются природной резистентностью к одному из основных противотуберкулезных препаратов - пиразинамиду. Поэтому при туберкулезе, вызванной M.bovis, и БЦЖите пиразинамид не назначается.
Приказом Минздрава РФ от 21.03.2003 № 109 "О совершенствовании противотуберкулезных мероприятий в Российской Федерации" (ред. от 29.10.2009) регламентировано применение наборов реагентов, дифференцирующих M.bovis от ее вакцинного штамма M.bovis BCG, для диагностики БЦЖита.
Определение лекарственной устойчивости туберкулеза
Распространение штаммов туберкулеза с лекарственной устойчивостью, в том числе с множественной лекарственной устойчивостью (МЛУ, или MDR) составляет одну из серьезнейших проблем современного здравоохранения. Определение лекарственной устойчивости туберкулеза с помощью молекулярно-биологических методов всё шире применяется ввиду высокой скорости получения результатов (1-2 дня), что становится возможным благодаря использованию не только первичной культуры, но и непосредственно клинического материала.
Важно понимать, что наборы реагентов, основанные на разных молекулярно-биологических методах, характеризуются разными показателями диагностической чувствительности и специфичности.
| Наименование набора реагентов | АмплиСенс® MTC-Rif-Seq | АмплиСенс® MTC-PZA-Seq |
| Исследуемый ген | rpo B | pnc A |
| Препараты, к которым определяется устойчивость | рифампицин | пиразинамид |
| Кол-во выявляемых мутаций | более 200 | более 500 |
Наборы включают реагенты для амплификации фрагментов ДНК микобактерий туберкулеза, очистки продуктов амплификации (сорбентным методом), определения концентрации очищенного продукта амплификации и праймеры для секвенирования. Наборы для экстракции ДНК (АмплиПрайм РИБО-преп или ДНК-сорб-С ) и реагенты для проведения реакции секвенирования приобретаются отдельно.

Нормативные документы, публикации, информационные материалы >>

В 2004 году по инициативе д.м.н., профессора Михаила Александровича Владимирского, заведующего сектором молекулярной диагностики туберкулёза НИИ Фтизиопульмонологии Первого МГМУ им. И.М.Сеченова, мы начали разработки в области ПЦР-диагностики туберкулёза.
Выделение ДНК: использование оригинальных реагентов и магнитных частиц обеспечивает получение максимального количества чистой ДНК и позволяет автоматизировать процесс выделения ДНК.
ПЦР в реальном времени: одновременная детекция нескольких различных участков генома комплекса микобактерий туберкулёза (МБТ) увеличивает информативность и достоверность анализа.
I этап – Пробоподготовка, инактивация
II этап – Выделение ДНК
набор реагентов для выделения ДНК (на магнитных частицах)
набор реагентов для выделения ДНК микобактерий из клинических образцов и культур клеток на автоматизированных станциях TECAN

- Снижение риска контаминации во время выделения ДНК практически до нуля.
- Значительное уменьшение трудоёмкости процесса выделения ДНК.
- Стандартизированное выделение ДНК из клинических образцов.
- Экономическая выгода: низкий расход пластика и реактивов.
набор реагентов для ускоренной пробоподготовки и выделения ДНК микобактерий из образцов мокроты
III этап – ПЦР в реальном времени
Обнаружение и количественное определение комплекса МБТ
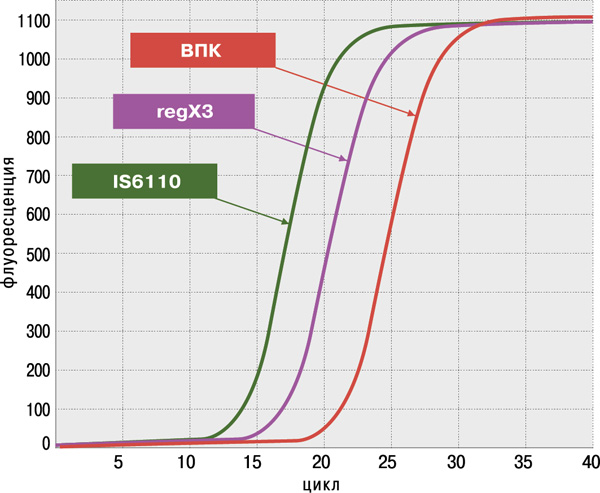
Набор реагентов АМПЛИТУБ-РВ — это:
- высокая достоверность анализа благодаря одновременному обнаружению двух специфичных генов M.tuberculosis complex: IS6110 и regX3;
- оценка пригодности образца ДНК для определения антибиотикоустойчивости;
- высокая чувствительность (не более 100 КОЕ/мл мокроты или 1–10 копий фрагментов ДНК в реакции) и 100%‑ая специфичность, подтверждённые на панели QCMD (Quality Control for Molecular Diagnostics) Mtb EQA (UK).
Определение антибиотикоустойчивости МБТ к препаратам I и II ряда
Наборы реагентов АМПЛИТУБ-МЛУ-РВ, АМПЛИТУБ-FQ-РВ — это:
- диагностика форм туберкулеза с лекарственной устойчивостью, в том числе множественной лекарственной устойчивостью (МЛУ) и широкой лекарственной устойчивостью (ШЛУ);
- быстрая детекция мутаций M.tuberculosis, ассоциирующихся с устойчивостью к антибиотикам первого и второго ряда (рифампицину, изониазиду, этамбутолу, фторхинолонам);
- достоверность результатов, ежегодно подтверждаемая при проведении Федеральной службой внешней оценки качества (ФСВОК) Росздравнадзора испытаний шифрованных тест-культур и образцов.
Наборы АМПЛИТУБ-МЛУ-РВ и АМПЛИТУБ-FQ-РВ основаны на использовании оригинальной мультиконкурентной аллель-специфичной методики ПЦР в реальном времени, позволяющей выявлять мутации в генах микобактерий туберкулеза, ответственных за устойчивость к конкретным антибиотикам.

Принцип мультиконкурентной аллель-специфичной методики ПЦР в реальном времени
- В формате одной пробирки используются 5’-флуоресцентно-меченые аллель-специфичные праймеры с общим комплементарным им 3’-меченым олигонуклеотидом-гасителем и контрольный флуоресцентный зонд, комплементарный участку ДНК без мутаций.
- При отсутствии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается только по флуорофору зонда.
- При наличии мутаций в ДНК нарастание флуоресценции в ходе ПЦР-РВ наблюдается как по флуорофору зонда, так и по флуорофору 5’-флуоресцентно-меченого аллель-специфичного праймера. Данный метод позволяет определить не только точку мутации, но и процент устойчивого мутантного штамма МБТ на фоне дикого.
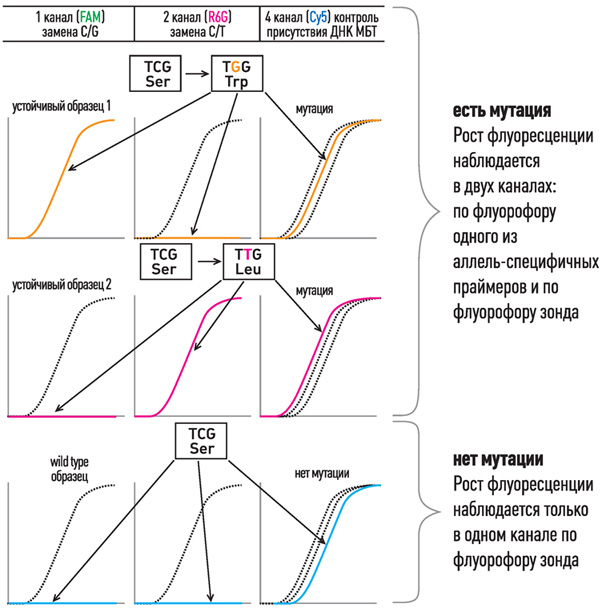
Интерпретация результатов выявления мутаций на примере
531 кодона rpoB гена M.tuberculosis
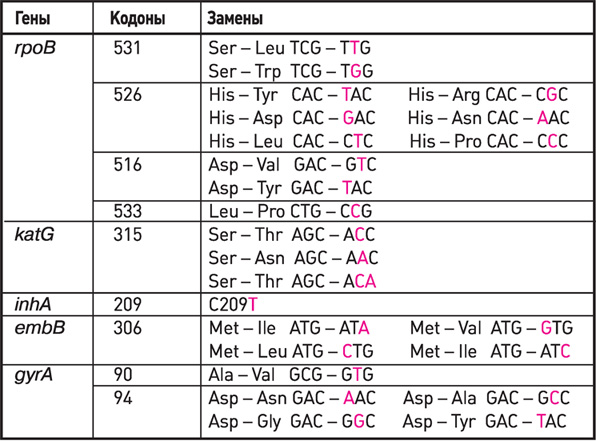
Гены, кодоны, замены, используемые в наборах реагентов
АМПЛИТУБ-МЛУ-РВ при определении антибиотикоустойчивости
Использование автоматизированных станций Freedom EVO (TECAN, Швейцария) для молекулярно-генетической диагностики туберкулёза
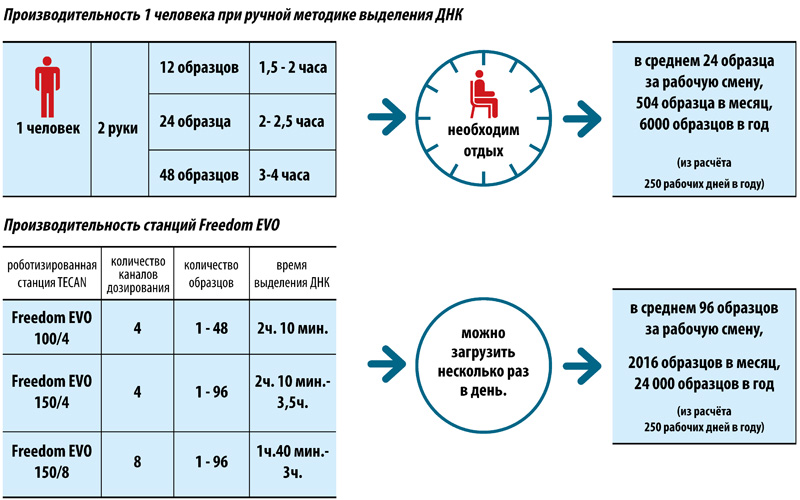

Трудозатраты — 1 час
Продолжительность выделения ДНК — не более 2 часов
Подготовка к амплификации и ПЦР-РВ — 1,5 часа
ИТОГО: результаты анализа будут готовы через 3,5 часа
Оператор затратит 1 час своего рабочего времени.
Данная диссертационная работа должна поступить в библиотеки в ближайшее время
Уведомить о поступлении
480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация, - 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Шилова, Валентина Ивановна. Индикация и дифференциация микобактерий туберкулеза методом молекулярной гибридизации : автореферат дис. . кандидата ветеринарных наук : 16.00.03.- Казань, 1993.- 19 с.: ил.
Введение к работе
Актуальность теш. Обеспечение населения страны качественными продуктами животноводства является важной народнохозяйственной задачей. Определенные трудности для ее решения создает заболевание крупного рогатого скота туберкулезом.
пеки сходства ДНК, рестрикционного анализа да, электрофорети-ческих характеристик белков свидетельствуют о перспективности и больао-t информативности этих методов. Однако исследования в этом аспекте еще только развертываются и представляют большой научный и практический интерес, ибо они открывают новые возможности в идентификации и дифференциации возбудителей инфекционных болезней.
Цель к задачи исследование. Целью нашей работы была индикация и дифференциация микобактерий туберкулеза методом молекулярной гибридизации. Для разрешения.ее были намечены следующие задачи:
получить очищенные препараты хромосомалыюй ДНК разных видов микобактерий;
провести сравнительную характеристику гиперхромного эффекта Д*К бактериальных клеток;
получить ДНК-зонд из м. Ъо-via и определить пригодность его для дифференциации микобактерий;
изучить ДКК генома разных микобактерий методом геномной "дактилоскопии".
Научная новизна. Разработан способ дифференциации различных видов бактерий, основанный на расщеплении ДНК рестриктаза-ми, разгонке гель-электрофорезом в горизонтальном блоке с последующим переносом фрагментов ДНК на нитроцеллюлозные мембраны и определении гипервариабельных; участков ДНК при помощи зонда из ДНК фага ИІЗ, отличающейся тем, что применение рестрикта-зы Есо 91 I дает возможность получить генетический паспорт, специфичный для каждого вида микобактерий, что позволяет дифференцировать патогенные микобактерий от атипичных.
Усовершенствована методика выделения ДНК, которая позволяет получить препараты ДНК из кислото- щелочеустоЯчивых микобактерий с наименьшими затратами времени, реактивов' и бактериальных культур. Разработан метод выделения ДНК из М. avium , используя для разрушения клеточной стенки ультразвуковой дезинтегратор при частоте 22 кГц в течение 30-60 секунд.
Созван тотальный ДШ-зонд из ы. Ъопв , с помощью которого удается дифференцировать-патогенные микобактерий в патологическом материале.
Практическое значение. Усовершенствованы методы выделения ДНІ-С из микобактерий.
'.'етод ДНК-ДНК гибридизации позволяет провести индикацию патогенных форм и дифференциацию атипичных и патогенные микобактерий.
Метод геномной "дактилоскопии" появоляет идентифицировать все виды микобактерий туберкулез).
Апробация работа. Основные положения работы доло.т.ены и обсуждены на республиканской научно-производственной конференции Казанского ветеринарного института /I9QI-I992 гг./, мсгвузов-ской научно-практической конференции молодых ученых и специалистов, посвященной 60-летию Ставропольского сельс ^хозяйственного института /1991/, Всероссийской научной ко :ференции в городе Троицк /1992/ и научной конференции ВНИИВНа;,'' в городе Покров /1992/.
Публикации. По материалам диссертации опубликовано б научных работ.
Внедрение. Результаты работы используются в практике лабораторных исследований Всероссийского научно-исследовательского ветеринарного института и Казанского ветеринарного кь.титута.
Получено положительное решение по заявке на изобретение К? 4942381/13 047174 "Способ дифференциации различных видов микобактерий туберкулеза". Казанским ветеринарна. институтом к Всероссийским научно-исследовательским ветеринарным институтом оформлены рационализаторские предложения под ;? 318-91 от 3 апреля 1991 г. и 13 17 от 19 июня 1991 г. соответствен j.
На защиту выносятся. Способ дифференциации микобактерий туберкулеза, основанный на выявлении гипервариабельных последовательностей геномов, методом молекулярной гибридизации; индикация и идентификация ДНК мк обактерий методом дот-блот гибридизации.
Структура и объем диссертации. Работа изложена на 152 страницах машинописного текста и состоит из введения, обзора литературы, собственных исследований, обсуждения результатов исследования, выводов, иллюстрирована 2 таблицами к 50 рисунками. Список использованной литературы включает 26а иг ^очникоз, в том числе 127 иностранных работ.
Читайте также:


