Линезолид при туберкулезе отзывы
Материал опубликован 04 апреля 2015 в 15:00.
Обновлён 08 апреля 2015 в 15:09.

В своей статье руководитель Фонда "Здоровье" Эдуард Гаврилов указывает на то, что препарат офлоксацин якобы дешевле и так же эффективен, как предлагаемые для применения бедаквилин и линезолид.
Но, видимо, перед критикой сами рекомендации Э. Гаврилов прочесть не потрудился. Дело в том, что в методических рекомендациях по совершествованию диагностики и лечения туберкулеза применение бедаквилина ограничено и полностью соотвествует рекомендациям Всемирной организации здравоохранения, препарат не входит в состав режимов лекарственно чувствительного и полирезистентного туберкулеза, а также стандартного режима МЛУ ТБ. Бедаквилин включен лишь в алгоритмы составления индивидуализированных режимов химиотерапии в особых ситуациях при наличии данных о лекарственной устойчивости возбудителя к препаратам первого и второго ряда. Ограничения широкого применения бедаквилина связаны с опасностью развития лекарственной устойчивости возбудителя к препарату при включении его в неэффективный режим. Именно эти принципы применения бедаквилина отражены в руководстве ВОЗ 2014 года. Включение бедаквилина в режимы лечения больных туберкулезом основано на данных международных многоцентровых клинических исследований, соответствующих стандартам GCP.
В 2013 году применение бедаквилина как нового противотуберкулезного препарата с доказанной эффективность и безопасностью было рекомендовано ВОЗ.
Продвигая препарат офлоксацин, Э. Гаврилов, видимо, не знает, что офлоксацин относится к фторхинолонам второго поколения, имеющего худшие фармакокинетические и фармакодинамические свойства, чем доступные сегодня фторхинолоны третьего и четвертого поколений левофлоксацин, спарфлоксацин, левофлоксацин. Так, например, левофлоксацин рекомендован руководством ВОЗ (2011) как наиболее предпочтительный фторхинолон в лечении туберкулеза с множественной лекарственной устойчивостью, а моксифлоксацин рекомендован ВОЗ для лечения туберкулеза с широкой лекарственной устойчивостью, начиная с 2006 года. Оба этих препарата являются обязательными компонентами режимов химиотерапии и рекомендуются ВОЗ к применению на протяжении всего курса лечения.
В перечень препаратов дополнительно по просьбам клиницистов был включен спарфлоксацин – фторхинолон третьего поколения, доказавший свою эффективность и безопасность при туберкулезе, показан к применению при туберкулезе согласно инструкции, входит в перечень ЖНВЛП и может применяться как альтернатива левофлоксацину в отдельных клинических ситуациях (например, при непереносимости левофлоксацина).
Странно также то, что Э. Гаврилов указывает на бедаквилин как на иностранный препарат. Вместе с тем обладателем лицензии на производство препарата бедаквилин в России и странах СНГ в 2013 году стала отечественная компания ОАО "Фармстандарт-УфаВита".
В данный момент ОАО "Фармстандарт-УфаВита", являясь владельцем регистрационного удостоверения, локализовало производство препарата на своем предприятии в Уфе, осуществляет контроль качества бедаквилина и фармаконадзор. Не соответствует действительности также информация о том, что препарат линезолид производит будто бы только компания TEVA Pharmaceutical Works Private, Ltd. Co (Израиль). Любой может проверить ложность этого утверждения, зайдя на сайт Государственного реестра лекарственных средств.
Туберкулез – это очень серьезная проблема отечественного здравоохранения. К большой радости врачей и пациентов, сегодня смертность от этой болезни в России снижается. Одна из причин этого – эффективная фармакотерапия, основанная на доказательных принципах. Поэтому нельзя относиться к обсуждению вопросов лечения этого заболевания поверхностно и безответственно.
Ирина Васильева - главный внештатный фтизиатр Минздрава России, профессор, доктор медицинских наук, известный эксперт международного уровня, член группы STAG-TB, участвует в предоставлении рекомендаций стратегического и технического характера Генеральному директору ВОЗ по вопросам противотуберкулезной помощи и контроля за туберкулезом в мире.
Ориентирован на лечение туберкулеза легких с широкой или множественной лекарственной устойчивостью.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило претоманид (pretomanid) — новейший препарат, предназначенный для лечения взрослых пациентов с туберкулезом легких, характеризующимся высокой невосприимчивостью к терапии. Претоманид показан для применения в составе комбинированной схемы, включающей бедаквилин (bedaquiline) и линезолид (linezolid), при туберкулезе с широкой лекарственной устойчивостью (XDR-TB) либо же сопровождающемся лекарственной непереносимостью или отсутствием ответа на существующую терапию туберкулезе со множественной лекарственной устойчивостью (MDR-TB).
Претоманид не используется в случае:
- лекарственно чувствительного туберкулеза;
- латентной инфекции Mycobacterium tuberculosis;
- внелегочной инфекции M. tuberculosis;
- туберкулез со множественной лекарственной устойчивостью, не сопровождающийся лекарственной непереносимостью или отсутствием ответа на стандартную терапию.
Первичная резистентность туберкулеза к лечению случается при инфицировании устойчивым штаммом M. tuberculosis, тогда как вторичная (приобретенная) может развиться в ходе терапии при изначально чувствительной M. tuberculosis, когда лечение осуществляется неправильно, пациент не следует предписаниям по приему препаратов или использует низкокачественные таковые. Лекарственно устойчивый туберкулез является серьезной проблемой для многих развивающихся стран, так как требует куда более продолжительной, зачастую весьма токсичной терапии и назначения дорогостоящих медикаментов. Под MDR-TB понимают резистентность к двум самым эффективным препаратам первой линии: рифампицину и изониазиду. Под XDR-TB подразумевают резистентность к не менее чем четырем из шести классов препаратов второй линии: помимо рифампицина и изониазида заболевание не отвечает на фторхинолоны, такие как левофлоксацин и моксифлоксацин, и на какой-либо инъекционный препарат — амикацин, капреомицин или канамицин.
В 2017 году туберкулезом заболели приблизительно 10 млн человек, из которых скончались 1,6 млн. В 558 тыс. случаев фиксировалась форма болезни, резистентная к рифампицину, причем 82% пациентов из этого числа получили диагноз MDR-TB. Бремя туберкулеза со множественной лекарственной устойчивостью легло главным образом на три страны — Индию, Китай и Россию, которые совокупно охватили почти половину всех случаев такового. Где-то 8,5% диагнозов MDR-TB пришлось на XDR-TB. Кроме того, 1,7 млрд человек на планете, или 23% мировой популяции, заражены туберкулезом, который находится в латентном состоянии, но может активизироваться в течение жизни.
Проверка безопасности и эффективности претоманида носила ограниченный характер и была осуществлена в опорных клинических испытаниях Nix-TB (NCT02333799) фазы III (нерандомизированных, открытых, многоцентровых), охвативших пациентов (n=109) в возрасте 14 лет и старше с туберкулезом легких, характеризующимся вышеуказанными особенностями невосприимчивости к стандартному лечению. Участники получали сочетание претоманида с бедаквилином и линезолидом (схема BPaL) на протяжении 6 месяцев с последующим 24-месячным наблюдением.
Среди критериев включения в исследования:
- XDR-TB: резистентность к изониазиду, рифамицинам, фторхинолону и какому-либо инъекционному препарату;
- MDR-TB: отсутствие ответа на лучшую из доступных противотуберкулезных схем в течение минимум шести месяцев либо невозможность продолжать прием препаратов второй линии ввиду непереносимости таких лекарственных средств, как пара-аминосалициловая кислота, этионамид, аминогликозиды или фторхинолоны.
По итогам успех лечения был засвидетельствован для 89% пациентов (n=95/107); данная частота излечения существенно превзошла 34- и 55-процентную историческую, описанную в литературе для XDR-TB и MDR-TB соответственно.
Для остальных 11% больных (n=12/107) терапия оказалась безуспешной. Провал лечения был определен как случай бактериологической неудачи: повторное инфицирование (конверсия культуры в положительный статус с другим штаммом M. tuberculosis), бактериологический рецидив (конверсия культуры в положительный статус с таким же штаммом M. tuberculosis) или клинический провал (в течение периода до 6 месяцев после завершения терапии).
Y-mAbs Therapeutics надеется на таргетирование против GD2.
Epizyme предложила таземетостат — первый в своем классе ингибитор EZH2.
Профиль безопасности схемы BPaL характеризуется следующими самыми частыми (у ≥ 20% пациентов) побочными реакциями: периферическая нейропатия (81%), акне (39%), анемия (37%), тошнота (37%), рвота (34%), мышечно-скелетная боль (29%), головная боль (28%), рост трансаминаз (28%), диспепсия (24%), снижение аппетита (22%), сыпь (21%), зуд (20%).
Пероральный антимикобактериальный претоманид (pretomanid, PA-824), ставший третьим противотуберкулезным лекарственным средством, одобренным FDA за минувшие четыре десятка лет, относится к классу нитроимидазооксазинов. Претоманид, будучи пролекарством, располагает очень сложным механизмом действия. Он уничтожает равно как активно реплицирующуюся M. tuberculosis путем ингибирования биосинтеза миколовой кислоты (блокадой окисления гидроксимиколата до кетомиколата), тем самым препятствуя созданию клеточной стенки, так и гипоксическую, нереплицирующуюся M. tuberculosis, выступая своего рода респираторным ядом за счет высвобождения реактивных форм азота.
Появление претоманида действительно снимает многие вопросы, ведь нынешняя терапия туберкулеза с высокой лекарственной устойчивостью предполагает прием до восьми антибиотиков на протяжении минимум 18 месяцев, включая какой-либо инъекционный, и выдержать такое под силу далеко не каждому пациенту.
В целом перед TB Alliance стоит серьезная задача, предполагающая прорыв в лечении туберкулеза. Необходимо создать качественно новую схему, универсально подходящую для всех больных. Подход должен характеризоваться максимально коротким курсом лечения, быть простым в применении и доступным каждому по цене. Для реализации подобной универсальной схемы, гарантированно излечивающей все формы туберкулеза, следует разработать мультилекарственный комплекс из совершенно новых противотуберкулезных препаратов. Изменение существующей парадигмы ведения туберкулеза поможет справиться с его пандемией, спасет миллионы жизни, сэкономит миллиарды долларов.
Суть дела заключается в том, что вышеназванный приказ рекомендует введение в режимы химиотерапии туберкулеза бедаквилина и, в то же время, обходит молчанием отечественный препарат перхлозон. Это вызывает недовольство со стороны группы специалистов, которые видят в этом ущемление отечественного производителя и больных туберкулезом. На их взгляд, тема приобретает особую актуальность в свете курса страны на импортозамещение и отстаивание независимости.
Нужно сказать, что эти препараты не относятся к числу основных, и рассматриваются как дополнение к существующим режимам лечения лекарственно-устойчивых форм туберкулеза.
Но, вернемся к медицинским аспектам проблемы. Представления об эффективности и безопасности лекарств лишь в исключительных случаях (крайне высокая (близко к 100%) или крайне низкая эффективность и/или безопасность) могут базироваться на упрощенных исследованиях: когортных, сериях случаев, открытых сравнительных испытаниях. Во всех остальных случаях нужны рандомизированные контролируемые испытания (РКИ).
Можно понять лоббистов российской фарминдустрии: они за хорошие деньги обеспечивают прибыли нанимателей. Из-за отсутствия надежных данных об эффективности и безопасности серьезно рассматривать перхлозон на предмет включения в национальные КР нельзя. Тот факт, что он разрешен к применению или вошел в ПЖНВЛС, не является аргументом для специалиста. Причины таких разрешений и включений могут быть вполне анекдотические.
С бедаквилином другая история. Из представленных публично и доступных всем результатов двойных слепых РКИ известно, что препарат ускоряет конверсию мокроты по сравнению с плацебо (бедаквилин или плацебо добавлялись к наилучшему индивидуально выбранному режиму химиотерапии МЛУ ТБ). На 120 сутки прекращение бактериовыделения получено на бедаквилине 58% против 32% на плацебо. Как и множество других препаратов, бедаквилин обладает токсичностью, но в условиях, когда он добавлялся к основной химиотерапии, частота нежелательных эффектов была такой же, как у плацебо. К сожалению, испытание, опубликованное в 2014 г (DiaconAHetal), на которое мы ссылаемся, невелико по размеру и страдает множеством характерных для РКИ во фтизиатрии проблем – выпадения пациентов, отклонений от режима и т.д. Тем не менее, как упоминалось выше, FDA и European Medicines Agency, а затем и агентства других стран разрешили препарат, несмотря на необходимость его дальнейшего испытания.
В заключение мы возвращаемся к проблеме ЛУ и ее профилактике. На наш взгляд, абсолютно важным является построение такой политики в области туберкулеза, которая бы ориентировалась не на лечение сформировавшихся ЛУ форм (что само по себе важно), а на их предотвращение. Каждый медицинский работник должен отдавать себе отчет в том, что, в конечном итоге, ЛУ – это рукотворное явление. Вина за нее в значительной степени лежит на нас, врачах. Для успешной борьбы с этим явлением необходимо понимать причины и пути формирования ЛУ. Как известно, их две: неправильное лечение (особенно на первом этапе) и экзогенная реинфекция. По поводу первого добавим лишь, что необходимо пересмотреть I режим химиотерапии в сторону его максимального усиления за счет использования всего набора препаратов 1-го ряда и увеличения сроков лечения. Основания для такого пересмотра серьезны, суммированы в проведенных в последние годы систематических обзорах исследований на эту тему. По поводу экзогенной реинфекции: нужно, наконец, признать, что основной поток ЛУ мы формируем сами, подвергая больных туберкулезом массовой госпитализации и длительному содержанию в стенах туберкулезных больниц. Мало того, что при этом наносится часто непоправимый социальный урон людям, вынужденным покинуть свои семьи, потерять работу и нести дополнительные расходы. Но, что самое плохое с эпидемиологической точки зрения, мы подвергаем их заражению ЛУ штаммами микобактерий в условиях длительного и тесного контакта. Сколько таких случаев: в туберкулезную больницу приходит больной с сохраненной чувствительностью, а уходит оттуда с другим штаммом и ЛУ микобактерий туберкулеза! Давно назрела необходимость изменений: переход к полному амбулаторному лечению больных по месту жительства. Множество других стран показали на своем примере, что такой путь возможен, обоснован с позиций эпидемиологии и экономики, отвечает социальным потребностям больных и снижает распространение ЛУ.
Василий Власов, профессор Высшей школы Экономики, президент Общества специалистов доказательной медицины
Александр Пасечников, советник по туберкулезу в международных проектах
Туберкулез остается и в XXI веке опасной болезнью. Его возбудитель - палочка Коха - быстро вырабатывает резистентность. Но появился препарат для лечения особо сложных случаев.

Каждый год почти 9 миллионов человек по всему миру заболевают туберкулезом, почти полтора миллиона умирают от него. Одна из самых серьезных проблем здесь состоит в том, что возбудитель туберкулеза быстро вырабатывает резистентность, то есть устойчивость организма к воздействию медикаментов. Поэтому так важно, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, или FDA) одобрило новый препарат PA-824 (претоманид) для использования в лечении туберкулеза с широкой лекарственной устойчивостью в комбинации с двумя другими противотуберкулезными медикаментами – бедаквилином и линезолидом. Это третий противотуберкулёзный препарат, одобренный FDA за более чем 40 лет.
В чем сложность лечения туберкулеза?
"Лечить туберкулез с помощью одного препарата невозможно", - объясняет Себастьян Дитрих (Sebastian Dietrich) из организации"Врачи без границ" (Ärzte ohne Grenzen). "Когда в терапии используется только один медикамент, бактерии быстро становятся резистентны к лечению". В самом начале пациенту может стать лучше, однако вероятность развития устойчивости бактерий и их дальнейшего размножения в организме велика. Поэтому наиболее эффективно использовать сразу нескольких препаратов, чаще всего от трех до пяти, что значительно снижает риски.
Как немецкие врачи относятся к прививкам
Вакцинация детей - одна из самых болезненных тем в Германии. Какие проблемы волнуют сейчас немецких врачей? Мы решили разобраться. (05.04.2019)
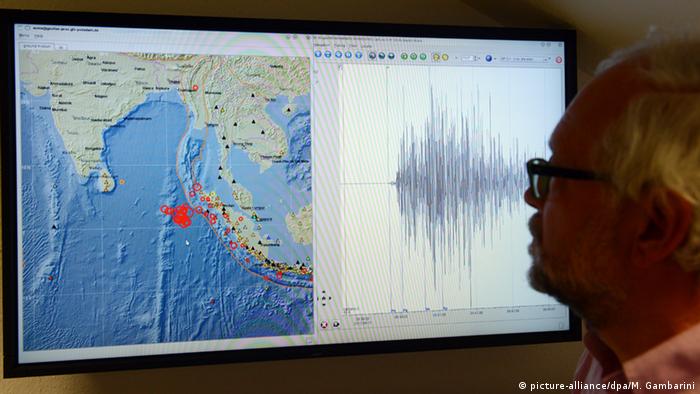
День борьбы с туберкулезом: в РФ распространены самые опасные формы
В регионах РФ часто встречается сочетание трудно излечимого туберкулеза с ВИЧ на фоне наркозависимости. Из-за перерывов в лечении туберкулез вырабатывает устойчивость к лекарствам. (24.03.2016)
Почему в России растет смертность от ВИЧ-инфекции
Минздрав РФ насчитал почти 86 000 новых ВИЧ-инфицированных за 2018 год. Академик Вадим Покровский объяснил DW, почему эпидемию не удается остановить и при чем тут духовность и пропаганда. (03.08.2019)
Как Германия помогает Таджикистану бороться с туберкулезом
Семь тысяч случаев заболевания туберкулезом были зафиксированы в Таджикистане в минувшем году. Причиной тому врачи называют социально-экономическое положение граждан. Бороться с туберкулезом Таджикистану помогает ФРГ. (24.03.2011)
В Восточной Европе число ВИЧ-инфицированных выросло почти на треть
По данным ООН, в восточноевропейских странах смертность от ВИЧ с 2010 года выросла на 5%. При этом в мире резко увеличилось число инфицированных, получающих терапию. (16.07.2019)
Распознать и диагностировать туберкулез не так сложно. Но существует другая проблема: определить, резистентны ли микобактерии к тому или иному препарату, и соответственно - какое лечение окажется эффективным в каждом отдельном случае.
Туберкулез в России и Германии
Туберкулез - это инфекционная болезнь. Она широко распространена в бедных странах. Около 85 процентов новых случаев заболевания приходится на Африку, Южную Азию и западную часть Тихого океана. Однако количество заражений туберкулезом также высоко в таких странах как Грузия, Казахстан и Беларусь. Там также встречаются резистентные виды туберкулеза, очень трудно поддающиеся лечению. Почти половине всех пациентов медикаменты не помогают, то есть они остаются носителями инфекции и заражают других людей.
Согласно докладу Всемирной организации здравоохранения о глобальной борьбе с туберкулезом за 2018 год, в списке стран с самыми высокими показателями туберкулеза Россия находится на 20 месте и при этом входит в первую тройку лидеров по числу больных лекарственно-устойчивым туберкулезом. После развала СССР заболеваемость туберкулезом стала резко расти и в 2000 году достигла пика - 90,7 на 100 тысяч населения. Однако в последние десять лет ситуация улучшается: в прошлом году заболеваемость активным туберкулезом опустилась до 42 случаев на 100 тысяч человек.
И все равно это очень много. Для сравнения: в 2017 году, согласно данным Федерального статистического ведомства, в Германии насчитывалось 6,7 больных на 100 тысяч населения. "В сравнении с другими странами это число не так высоко, - говорит Гласмахер о ситуации в Германии, - однако любая цифра слишком велика, если речь идет о туберкулезе". Среди взрослых немцев чаще всего туберкулезом болеют люди в возрасте 80 лет и старше. Возможно, они заразились еще после Второй мировой войны. Антисанитария и скопление большого числа людей в маленьких помещениях - идеальные условия для распространения инфекции.
Как рассказывает Сюзанне Гласмахер (Susanne Glasmacher) из института Роберта Коха в Берлине, в группе риска в Германии - и дети, родственники которых живут в странах с наибольшим распространением туберкулеза. Хотя чаще всего для передачи инфекции необходим тесный и постоянный контакт, нельзя исключить вероятность заражения даже при более поверхностном взаимодействии.

1-е место: ученые-экономисты
Как выяснилось, в Германии самой полезной для здоровья является профессия ученого-экономиста. Ее представители болеют реже всех остальных. Всего лишь 7,6 дня в год отсутствуют они по болезни на рабочем месте. По данным головного объединения больничных касс Германии, наиболее часто ученые-экономисты страдают нервно-психическими заболеваниями, снижением остроты зрения, остеохондрозом.

2-е место: программисты
Специалисты по разработке программного обеспечения пропускают работу по болезни в среднем 7,8 дня в год. Специфика их работы такова, что им приходится трудиться за компьютером, да еще при искусственном освещении. Поэтому неудивительно, что многие представители этой профессии испытывают проблемы со зрением. Сидячая работа оборачивается кроме того болями в спине и предплечьях, а также простатитом.

3-е место: научно-техническая деятельность
8 дней в году отсутствуют на работе по бюллетеню инженеры и специалисты в области технических наук. Наиболее часто заболевшие жалуются на проблемы со зрением, психические расстройства, бессонницу.

4-е место: PR-специалисты
Синдром эмоционального выгорания, простудные заболевания, депрессии, - по таким причинам чаще всего берут больничный специалисты по связям с общественностью. Впрочем, проблемы со здоровьем они испытывают нечасто. В среднем они пропускают по болезни всего 8,2 рабочего дня в год.
5-е место: географы, геологи и метеорологи
Представители этих сфер деятельности наиболее часто страдают варикозным расширением вен, артритом, заболеванием голосовых связок, дерматитом, заболеваниями опорно-двигательного аппарата. Однако на больничный садятся редко. Среднестатистический географ, геолог или метеоролог не выходит на работу по болезни 8,5 дня в год.

6-е место: преподаватели и научные сотрудники вузов
Тот, кто преподает и занимается научно-исследовательской деятельностью в вузе, пользуется большим уважением в Германии. Впрочем, такая работа не только престижна, но и полезна для здоровья. Всего 8,6 рабочих дня в год пропускают по болезни представители этой профессии. Наиболее частые причины - нервные срывы, сердечнососудистые заболевания, головные боли.

7-е место: математики и статистики
В среднем, 8,8 рабочего дня в год отсутствует на работе по бюллетеню среднестатистический представитель этой сферы деятельности. Из-за того, что специалисты по математике и статистике вынуждены много сидеть, им нередко приходится жаловаться на боли в спине, нарушения работы опорно-двигательного аппарата, варикозное заболевание.

8-е место: врачи-терапевты и стоматологи
По последним данным, в Германии среднестатистический врач-стоматолог или терапевт не выходит на работу по болезни 10,4 дня в год. Основные причины - простудные и инфекционные заболевания, нервные срывы, остеохондроз, боли в спине, поражения соединительной ткани.

9-е место: ветеринары
Согласно последним статистическим данным, 11,3 дня в год отсутствует на работе по бюллетеню среднестатистический представитель этой сферы деятельности. Вообще ветеринар - значительно более рискованная профессия, нежели врач, лечащий людей. Около 40 процентов ветеринаров по меньшей мере один раз за свою практику лечились от инфекций, полученных на работе. Чаще всего им передается стригущий лишай.

10-е место: менеджеры высшего звена
Это наиболее вредная из самых безвредных сфер деятельности. Один ее представитель пропускает по болезни в среднем 11,9 рабочего дня. Стремление быстро двигаться вверх по карьерной лестнице не проходит бесследно. Стресс и постоянные риски нередко приводят к гипертонии, ишемической болезни сердца, хронической усталости, язвенной болезни и гастриту.
Русское название
Латинское название вещества Линезолид
Химическое название
Брутто-формула
Фармакологическая группа вещества Линезолид
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Линезолид
Антибиотик класса оксазолидинонов.
Фармакология
Связывается с бактериальными рибосомами, предотвращает образование функционального инициирующего комплекса 70S — важного компонента процесса трансляции при синтезе белка.
В отношении большинства (≥90%) штаммов следующих микроорганизмов in vitro установлены минимальные подавляющие концентрации линезолида, однако эффективность и безопасность клинического применения в терапии инфекций, вызванных этими возбудителями, не установлена в адекватных и хорошо контролируемых исследованиях: аэробные и факультативные грамположительные микроорганизмы — Enterococcus faecalis (включая ванкомицинорезистентные штаммы), Enterococcus faecium (ванкомициночувствительные штаммы), Staphylococcus epidermidis (включая метициллинорезистентные штаммы), Staphylococcus haemolyticus, Streptococcus viridans, некоторые аэробные и факультативные грамотрицательные микроорганизмы — Pasteurella multocida.
Резистентны к линезолиду: Haemophilus influenzae, Moraxella catarrhalis, Neisseria spp., Enterobacteriaceae spp., Pseudomonas spp. Постантибиотический эффект in vitro (РАЕ) для Staphylococcus aureus составляет около 2 ч. На экспериментальных моделях у животных РАЕ in vivo составляет 3,6–3,9 ч для Staphylococcus aureus и Streptococcus pneumoniae, соответственно.
Резистентность микроорганизмов по отношению к линезолиду развивается медленно путем многостадийной мутации 23S рибосомальной РНК и происходит с частотой менее 1·10 −9 — 1·10 −11 .
Линезолид является обратимым неселективным ингибитором МАО .
При приеме внутрь быстро и интенсивно всасывается из ЖКТ , биодоступность около 100%. При приеме жирной пищи Тmax пролонгируется от 1,5 ч до 2,2 ч и Cmax снижается примерно на 17%. Тем не менее, общая экспозиция линезолида, определяемая как AUC0–∞, не изменяется; линезолид можно принимать без учета времени приема пищи. В плазме связывается с белками на 31%. Уровень в плазме превышает МПК90 для чувствительных микроорганизмов в течение всего интервала между введениями. Хорошо проникает в ткани, Vss составляет 40–50 л. Постоянная концентрация в крови устанавливается на 2–3 сутки применения. При однократном приеме внутрь 400 или 600 мг в виде таблеток, покрытых оболочкой, Сmax достигается через 1,52 и 1,28 ч (стандартное отклонение (SD) — 1,01 и 0,66) и составляет 8,1 и 12,7 мкг/мл (SD — 1,83 и 3,96), AUC — 55,1 и 91,4 мкг х ч/мл (SD — 25 и 39,3), T1/2 — 5,2 и 4,26 ч (SD — 1,5 и 1,65), Cl — 146 и 127 мл/мин (SD — 67 и 48) соответственно. При двукратном приеме внутрь 400 или 600 мг в виде таблеток, покрытых оболочкой, Сmax достигается через 1,12 и 1,03 ч (SD — 0,47 и 0,62) и составляет 11 и 21,2 мкг/мл (SD — 4,37 и 5,78), Cmin 3,08 и 6,15 мкг/мл (SD — 2,25 и 2,94), AUC — 73,4 и 138 мкг х ч/мл (SD — 33,5 и 42,1), T1/2 — 4,69 и 5,4 ч (SD — 1,7 и 2,06), Cl — 110 и 80 мл/мин (SD — 49 и 29) соответственно. При однократном приеме внутрь 600 мг в виде суспензии Сmax достигается через 0,97 ч (SD — 0,88) и составляет 11 мкг/мл (SD — 2,76), AUC — 80,8 мкг х ч/мл (SD — 35,1), T1/2 — 4,6 ч (SD — 1,71), Cl — 141 мл/мин (SD — 45). Метаболизируется до двух практически неактивных производных карбоновой кислоты с незамкнутым кольцом: гидроксиэтилглицина, образуется в результате неферментного процесса и является основным метаболитом и аминоэтоксиуксусной кислоты. Экскретируется почками в виде гидроксиэтилглицина (40%), неизмененного препарата (30–35%) и аминоэтоксиуксусной кислоты (10%). С фекалиями выводится 6% гидроксиэтилглицина и 3% аминоэтоксиуксусной кислоты.
У детей клиренс больше и уменьшается с увеличением возраста. У пациентов старше 65 лет фармакокинетика значительно не меняется. У женщин Vd меньше, клиренс снижен примерно на 20%.
Фармакокинетика линезолида не изменяется при нарушении функции почек легкой, средней и тяжелой степени, однако при почечной недостаточности два основных метаболита линезолида могут кумулировать и степень кумуляции увеличивается с выраженностью почечной дисфункции. Примерно 30% дозы выводится в течение 3 ч при диализе.
Не установлено изменений фармакокинетических параметров при нарушении функции печени легкой (Child Pugh Class A) и средней (Child Pugh Class B) степени выраженности. Фармакокинетика линезолида у пациентов с тяжелой степенью печеночной недостаточности (Child Pugh Class C) не изучалась.
Применение вещества Линезолид
Лечение инфекций, вызванных чувствительными грамположительными микроорганизмами.
Инфекции, вызванные резистентными к ванкомицину штаммами Enterococcus faecium, в т.ч. сопровождающиеся бактериемией.
Госпитальная пневмония, вызванная Staphylococcus aureus (метициллиночувствительные и метициллинорезистентные штаммы) или Streptococcus pneumoniae (включая полирезистентные штаммы — MDRSP*).
Внебольничная пневмония, вызванная Streptococcus pneumoniae (включая полирезистентные штаммы — MDRSP*), в т.ч. случаи, сопровождающиеся бактериемией, или Staphylococcus aureus (только метициллиночувствительные штаммы).
Осложненные инфекции кожи и мягких тканей, включая инфекции при синдроме диабетической стопы, не сопровождающиеся остеомиелитом, вызванные Staphylococcus aureus (метициллиночувствительные и метициллинорезистентные штаммы), Streptococcus pyogenes или Streptococcus agalactiae.
Неосложненные инфекции кожи и мягких тканей, вызванные Staphylococcus aureus (только метициллиночувствительные штаммы) или Streptococcus pyogenes.
* — штаммы с множественной резистентностью к антибиотикам (Multi-drug resistant Streptococcus pneumoniae — MDRSP), включая штаммы, ранее известные как PRSR (Penicillin-resistant S. pneumoniae), и штаммы, резистентные к двум или более из следующих антибиотиков: пенициллин (при МПК ≥2 мкг/мл), цефалоспорины II поколения (например цефуроксим), макролиды, тетрациклины и триметоприм/сульфаметоксазол.
Противопоказания
Гиперчувствительность; одновременный прием ЛС , ингибирующих МАО А или МАО В, а также период 2 нед после прекращения их приема; при отсутствии мониторинга АД не следует применять при неконтролируемой артериальной гипертензии, феохромоцитоме, тиреотоксикозе, а также одновременно с такими ЛС как эпинефрин, норэпинефрин, допамин, добутамин (возможно повышение АД); при отсутствии тщательного наблюдения за пациентами с возможным развитием серотонинового синдрома не следует применять при карциноидном синдроме, а также одновременно с ингибиторами обратного захвата серотонина, трициклическими антидепрессантами, агонистами 5-НТ1-рецепторов (триптанами), буспироном.
Ограничения к применению
Почечная недостаточность (клиническая значимость кумуляции двух метаболитов линезолида у пациентов с тяжелой почечной недостаточностью не изучена), печеночная недостаточность (имеются ограниченные клинические данные), беременность, период грудного вскармливания.
Применение при беременности и кормлении грудью
При беременности возможно, если ожидаемый эффект терапии превышает потенциальный риск для плода.
Категория действия на плод по FDA — C.
Неизвестно, выделяется ли линезолид с грудным молоком у человека. Линезолид и его метаболиты экскретируются в грудное молоко лактирующих крыс, концентрации в молоке сходны с таковыми в плазме крови самок. Следует соблюдать осторожность при применении линезолида в период грудного вскармливания.
Побочные действия вещества Линезолид
Наиболее частыми побочными эффектами, отмеченными при проведении клинических испытаний линезолида, были диарея, головная боль, тошнота.
Со стороны нервной системы и органов чувств: 1–10% — головная боль, головокружение, инсомния, извращение вкуса, изменение окрашивания языка.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): 1–10% — тромбоцитопения.
Со стороны органов ЖКТ : 1–10% — диарея, тошнота, рвота, запор; 0,1–1% — кандидоз слизистой оболочки полости рта, отклонения показателей функции печени, в т.ч. повышение активности АЛТ , АСТ , ЩФ , уровня билирубина.
Со стороны кожных покровов: 1–10% — сыпь.
Прочие: 1–10% — лихорадка, вагинальный кандидоз, грибковая инфекция; 0,1–1% — изменение лабораторных показателей, в т.ч. повышение концентрации триглицеридов в крови, повышение концентрации пролактина, повышение активности лактатдегидрогеназы, липазы, амилазы, уровня креатинина.
Подростки (12–17 лет)
Со стороны нервной системы и органов чувств: 1–10% — головная боль, вертиго.
Со стороны респираторной системы: 1–10% — инфекции верхних дыхательных путей, фарингит, кашель.
Со стороны органов ЖКТ : 1–10% — диарея, тошнота, рвота, боль в животе (генерализованная и локальная), жидкий стул.
Со стороны кожных покровов: 1–10% — сыпь; 0,1–1% — зуд.
Прочие: 1–10% — лихорадка, травма; 0,1–1% — изменение лабораторных показателей, в т.ч. эозинофилия, повышение концентрации триглицеридов в крови, повышение активности АЛТ , липазы, уровня креатинина.
Со стороны нервной системы и органов чувств: периферическая нейропатия, нейропатия зрительного нерва (иногда приводящая к потере зрения), серотониновый синдром, судороги.
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): миелосупрессия ( в т.ч. анемия, лейкопения, панцитопения, тромбоцитопения).
Со стороны органов ЖКТ : изменение окраски эмали зубов и языка.
Аллергические реакции: анафилаксия, ангионевротический отек, буллезное поражение кожи, подобное синдрому Стивенса-Джонсона.
Взаимодействие
Линезолид не является индуктором изоферментов цитохрома Р450 у крыс. Кроме того, не выявлено клинически значимого ингибирующего эффекта линезолида у человека на изоформы CYP1А 2, CYP2С 9, CYP2С 19, CYP2D6 , CYP2E1 и CYP3A4 . Основываясь на этих данных, не ожидается влияние линезолида на фармакокинетику других ЛС , метаболизирующихся с участием этих ферментов. Одновременное применение линезолида и варфарина (субстрат CYP2C9 ) не изменяло существенным образом фармакокинетические характеристики (S)-варфарина. Варфарин и фенитоин (субстрат CYP2C9 ) могут применяться совместно с линезолидом без изменения режима дозирования.
При одновременном применении линезолида с азтреонамом или гентамицином изменений фармакокинетики этих ЛС не отмечалось.
В исследовании у здоровых добровольцев (n=16) показано, что при пероральном приеме линезолида по 600 мг дважды в день в течение 2,5 дней с/без рифампицина (сильный индуктор цитохрома Р450) по 600 мг один раз в день в течение 8 дней, в случае сочетанного приема этих ЛС Cmax линезолида снижалась на 21%, AUC — на 32%. Механизм этого взаимодействия до конца не изучен и может быть связан с индукцией печеночных ферментов; клиническое значение этого взаимодействия неизвестно. Другие сильные индукторы печеночных ферментов (например, карбамазепин, фенитоин, фенобарбитал) могут вызывать такое же или меньшее снижение экспозиции линезолида.
Поскольку линезолид является обратимым неселективным ингибитором МАО , потенциально возможно его взаимодействие с адренергическими и серотонинергическими средствами.
Адренергические средства. Значительное вазопрессорное действие наблюдалось у здоровых взрослых, получавших линезолид и тирамин в дозах более 100 мг. В связи с этим пациентам, получающим линезолид, необходимо избегать употребления большого количества пищевых продуктов или напитков с высоким содержанием тирамина.
У пациентов, получающих линезолид, может возникнуть обратимое повышение АД в ответ на действие симпатомиметиков, вазопрессоров или дофаминергических средств.
Так, в исследовании у здоровых людей с нормальным АД было показано, что псевдоэфедрин и фенилпропаноламин вызывают обратимое повышение АД . Было показано, что среднее максимальное увеличение сАД по сравнению с исходным составило 32 мм рт.ст. (диапазон: 20–52 мм рт.ст. ) и 38 мм рт.ст. (диапазон: 18–79 мм рт.ст. ) при одновременном применении линезолида с псевдоэфедрином или фенилпропаноламином, соответственно.
Подобных исследований у больных артериальной гипертензией проведено не было.
Начальные дозы таких адренергических средств как допамин или эпинефрин должны быть уменьшены, в дальнейшем необходимо осуществлять подбор дозы титрованием, до достижения желаемого ответа.
Серотонинергические средства. Совместное применение линезолида и серотонинергических ЛС не было ассоциировано с развитием серотонинового синдрома в клинических исследованиях Фазы 1, 2 и 3. Имеются спонтанные сообщения о развитии серотонинового синдрома, связанного с сочетанным применением линезолида и серотонинергических ЛС , включая СИОЗС . За пациентами, находящимися на лечении линезолидом и одновременно получающими серотонинергические ЛС , следует вести тщательное наблюдение.
Фармацевтическая несовместимость. При назначении линезолида в форме раствора для инфузий одновременно с другими ЛС каждый препарат следует вводить отдельно.
Раствор для инфузий фармацевтически несовместим с растворами амфотерицина В, хлорпромазина, диазепама, фенитоина, эритромицина, ко-тримоксазола.
Раствор для инфузий химически несовместим с цефтриаксоном натрия.
Линезолид в форме раствора для инфузий совместим со следующими растворами: 5% раствор декстрозы, 0,9% раствор натрия хлорида, раствор Рингер лактат для инъекций.
Взаимодействие с трициклическими антидепрессантами
Имеются сообщения о развитии потенциально опасного для жизни серотонинового синдрома при одновременном применении трициклических антидепрессантов из группы дибензазепина (таких как кломипрамин, имипрамин) и линезолида. В связи с этим пациентам, которые находятся на лечении линезолидом, противопоказан прием кломипрамина или имипрамина.
Источник информации
fda.gov
Передозировка
Лечение: симптоматическая терапия; мероприятия, направленные на поддержание клубочковой фильтрации, гемодиализ.
Читайте также:


