Что такое полирезистентность микобактерий туберкулеза

Микобактериями туберкулеза в ходе эволюционного развития были выработаны механизмы защиты от факторов внешней среды, такие как толстая клеточная стенка, богатые метаболические возможности, которые способны обезвреживать многие клеточные токсины и вещества (альдегиды, перекиси), повреждающие клеточную стенку, также можно упомянуть способность к трансформации(переход в L-форму, образование доминантных клеток) [8].
Выделяют несколько классификаций лекарственной устойчивости микобактерии туберкулеза:
I. По чувствительности к противотуберкулезным препаратам [6, 8]
Истинная генетическая устойчивость – это видовой признак микроорганизмов, который связан с отсутствием точки приложения антибиотика с МБТ, ее недоступностью из-за плохой проницаемости клеточной стенки или разрушения ферментами.
МБТ обладают истинной генетической устойчивостью ко многим неспецифическим антимикробным препаратам, относящимся к семействам пенициллинов, β-лактамов, макролидов, карбапенемов, цефалоспоринов, тетрациклинов. Однако чувствительны к аминогликозидам (стрептомицин, канамицин, амикацин), полипептидам (капреомицин), рифампицинам (рифампицин, рифабутин) и фторхинолонам (ципрофлоксацин, ломефлоксацин, офлоксацин, левофлоксацин, моксифлоксацин, спарфлоксацин) [5].
Приобретенная лекарственная устойчивость МБТ проявляется в возможности размножаться при воздействии на них противотуберкулезных препаратов по средствам развития точечных мутаций [7] в хромосомах и формировании новых генов, контролирующих синтез новых белков-ферментов, разрушающих или инактивирующие конкретные противотуберкулезные препараты. Приобретенную лекарственную устойчивость подразделяют на первичную и вторичную. Первичная ЛУ определяется у больных, заразившихся лекарственно-устойчивыми МБТ. Эти пациенты ранее не принимали противотуберкулезные препараты [6]. Вторичная ЛУ развивается в процессе самого лечения больного туберкулезом. Устойчивость МБТ развивается через 3-6 месяцев с начала лечения [6].
II. По спонтанности возникновения мутаций (спонтанные и индуцированные)
В большой и активно размножающейся микобактериальной популяции всегда имеется небольшое количество лекарственно-устойчивых спонтанных мутантов в соотношениях:
1 клетка-мутант на 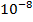
устойчивых к рифампицину;
1 клетка-мутант на 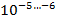
устойчивых к изониазиду, этамбутолу, стрептомицину, канамицину, фторхинолонам;
1 клетка-мутант на 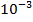
устойчивых к пиразинамиду, этионамиду, капреомицину и циклосерину.
С учётом того что в каверне величина микобактериальной популяции составляет 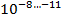
, там имеются мутанты ко всем противотуберкулезным препаратам; в очагах и осумкованных казеозных фокусах эта величина составляет 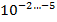
. Спонтанные мутации устойчивы только к одному препарату (спонтанная или эндогенная ЛУ) [6].
При экзогенной (индуцированной) ЛУ происходит естественный отбор в пользу мутантов с естественной ЛУ к противотуберкулезным препаратам. В дальнейшем это приводит к изменению в геноме, что приводит к увеличению бактериальной популяции с лекарственно-устойчивыми микобактериями. Этому способствует проведение неадекватной химиотерапии, при этом пациенту назначается неправильный режим, несбалансированное сочетание и дозы противотуберкулезных лекарственных средств [6].
По эпидемиологической классификации ВОЗ (2008) МБТ могут быть:
- монорезистентными (МР) – к одному противотуберкулезному препарату;
- полирезистентными (ПР) – к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина;
- множественно лекарственно-устойчивыми (МЛУ) – как минимум к сочетанию изониазида и рифампицина. Такие больные обладают высокой эпидемиологической опасностью вследствие высокой вирулентности и контагиозности, длительного периода бактериовыделения. К группам повышенного риска относятся ВИЧ-инфицированные больные и ранее неправильно лечившиеся пациенты с туберкулезом [4]. При анализе заболеваемости туберкулёзом среди ВИЧ-инфицированных г. Краснокамска была выявлена МЛУ у 60% больных с впервые выявленным туберкулезом [1].
- широко лекарственно-устойчивыми (ШЛУ) – как минимум к сочетанию изониазида, рифампицина, фторхинолонов и инъекционных препаратов (канамицина, амикацина, капреомицина). Так как ШЛУ проявляет ЛУ к препаратам I ряда, а противотуберкулезные препараты II ряда не обладают выраженным антибактериальным действием, то можно утверждать, что такие штаммы опасны для жизни пациентов [4].
Генетические основы резистентности ко многим антибиотикам изучены недостаточно хорошо. По имеющимся данным в приобретении лекарственно-устойчивого фенотипа МБТ плазмиды и траспозоны особой роли не играют. Причиной возникновения лекарственно-устойчивых штаммов являются точечные мутации [7] и небольшие инсерции/делеции в геноме микроорганизма [2, 3].
Выделяют следующие механизмы лекарственной устойчивости микобактерий туберкулёза [8]: инактивация антибиотика ферментами, (например, β-лактамазами); изменение мишени (в результате мутации соответствующего участка генома происходит модификация белковой структуры); избыточное образование мишени, которое приводит к нарушению соотношения агент-мишень, в результате чего высвобождаются белки, необходимые для жизнедеятельности бактерии; выведение лекарственного вещества из бактериальной клетки (эффлюкс) по средствам включения стрессорных механизмов защиты; уменьшение проницаемости клеточной стенки, вследствие чего антибиотик не может проникнуть внутрь бактерии; появление дополнительного (обходного) пути обмена веществ.
Помимо прямого воздействия на метаболизм микробных клеток многие антибактериальные препараты (бензилпенициллин. стрептомицин, рифампицин) и другие неблагоприятные факторы (биоциды иммунной системы) приводят к появлению изменённых форм микобактерий (протопласты, L-формы), а также переводят клетки в дормантное состояние: интенсивность обмена клетки снижается и бактерия становится невосприимчивой к действию антибиотика [8].
Выделяют основные противотуберкулезные препараты I ряда: рифампицин, изониазид, этамбутол, стрептомицин, пиразинамид. Препараты II ряда являются резервными и используются для лечения полирезистентного туберкулеза, к ним относятся: этионамид, циклосерин, канамицин, виомицин, амикацин и др. [3, 5]
Механизм рифампицина основан на взаимодействии с β-субъединицей РНК-полимеразы (ген rpoB), в результате чего происходит ингибирование инициации транскрипции. МБТ устойчивы к рифампицину благодаря мутации в фрагменте β-субъединицы (27 кодонов – 507-533) этого фермента (более 95%штаммов). При мутации в кодонах 526 (36%) и 531 (43%) [3, 10] обнаруживают высокий уровень резистентности к антибиотику, в то время как, в кодонах 511, 516, 518 и 522 – низкий. У 4%штаммов механизм резистентности неизвестен, так как они не несут мутаций в данном гене [3, 6].
Изониазид является пролекарством. Молекула препарата активируется внутри микробной клетки под действием фермента каталазы-пероксидазы (ген katG). Мутации в гене katG (в положении 315) приводят к снижению активности фермента примерно на 50%. Также ферменты, участвующие в метаболизме миколевой кислоты (основной компонент клеточной стенки МБТ), являются мишенями для активированного изониазида: ацетилированный белок-носитель (ген acpM), синтетаза (ген kasA) и редуктаза (ген inhA) белка-носителя. Мутации, возникшие в этих генах, вызывают устойчивость, связанную с гиперпродукцией мишеней. Уровень устойчивости при этом ниже, чем при мутации в гене katG [3, 10].
О механизмах действия пиразинамида известно мало. Он также является пролекарством. Пиразинамид по средствам пассивной диффузии проникает в бактериальную клетку, где под действием фермента пиразинамидазы переходит в активную форму – пиразиноевую кислоту (ген pncA), которая блокирует ферменты биосинтеза жирных кислот. 72% изолятов, устойчивых к пиразинамиду, имеют мутации в гене pncA. У пиразинамидустойчивых МБТ выявляют также отсутствие АТФ-зависимого транспорта этого препарата в клетку [3, 6].
Стрептомицин приводит к ингибированию синтеза белка, связываясь с 16S рРНК (rrs). Мутации, ассоциированные с устойчивостью к стрептомицину, идентифицированы в генах, кодирующих 16S РНК (rrs) и белок малой рибосомной субъединицы 12S (rpsL). Есть данные о мутации, которая ведет к повышению устойчивости МБТ к стрептомицину – эти штаммы плохо растут, пока в их питательную среду не добавить данный антибиотик (стрептомицинзависимые штаммы) [6].
Этамбутол осуществляет свое влияние через белок embB (арабинозилотрансфераза), принимающий участие в синтезе структурных элементов клеточной стенки МБТ. Устойчивость к этому препарату появляется вследствие точечной мутации в 306-м кодоне [10].
Этионамид (протионамид) также способствует появлению мутаций в гене inhA, поэтому резистентность к этионамиду иногда возникает вместе с резистентностью к изониазиду, так как эти препараты имеют общего предшественника – никотинамид. Этионамид является пролекарством и для его активирования необходим фермент, который в настоящее время еще не установлен [3, 6].
Канамицин (амикацин) вызывает мутации в 16S рРНК (1400 позиция) – замена аденина на гуанин [6].
Фторхинолоны вызывают мутации в генах gyrA и gyrB ДНК-гиразы. Вследствие этого нарушается процесс репликации ДНК [9].
Представленная информация призвана способствовать формированию целенаправленной деятельности для контроля лекарственной устойчивости в интересах совершенствования лечебно-профилактических мероприятий у больных туберкулезом.
Клинический ординатор 1-ого года обучения
Абасов Тарлан Мамед Рагим оглы
Лекарственная резистентность МБТ……………………………………. 3
Механизм и динамика формирования лекарственной устойчивости… 4
Методы диагностики лекарственной устойчивости…………………… 8
Профилактика развития лекарственной устойчивости……………….. 22
Лекарственная резистентность МБТ.
Появление множественной лекарственной устойчивости микобактерий туберкулеза стало серьезной угрозой эффективности противотуберкулезных программ во многих странах мира. В Российской Федерации распространение микобактерий, устойчивых к основным противотуберкулезным препаратам, является одной из главных проблем фтизиатрической службы. В 2007 г в Российской Федерации у 13% больных с вновь выявленным туберкулезом до лечения была диагностирована множественная лекарственная устойчивость микобактерий. Приобретенная множественная лекарственная устойчивость в ряде регионов страны достигает 50-60% среди повторных случаев лечения туберкулеза. Излечение больных туберкулезом является главным компонентом национальной противотуберкулезной программы. Больной, который излечивается от туберкулеза, обрывает цепочку передачи инфекции. В тех случаях, когда пациенты не получают необходимого лечения и продолжают выделять микобактерий туберкулеза, происходит распространение инфекции в обществе в течение нескольких лет. У большинства больных туберкулезом можно достигнуть излечения, несмотря на наличие лекарственной устойчивости микобактерий туберкулеза (МБТ), сопутствующих заболеваний и развития побочных эффектов от приема лекарственных средств. Своевременно диагностированные больные с МБТ, чувствительными к основным противотуберкулезным препаратам, получают лечение в течение не менее 6 месяцев и практически всегда излечиваются от туберкулеза. Наиболее сложная ситуация возникает, когда у МБТ определяется устойчивость к основным противотуберкулезным препаратам. Больные с множественной лекарственной устойчивостью (МЛУ) микобактерий туберкулеза - те, у которых диагностирована устойчивость МБТ к действию изониазида и рифампицина одновременно, с наличием или без наличия устойчивости к любым другим противотуберкулезным препаратам. Организация диагностики и лечения больных с множественной лекарственной устойчивостью МБТ требует значительных финансовых затрат в лабораторной диагностике, организации специализированного отделения для лечения данной категории больных, покупке противотуберкулезных препаратов второго ряда и лекарственных средств, для купирования побочных эффектов. Больные туберкулезом, выделяющие лекарственно-устойчивые штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих лекарственно-резистентными возбудителями. Чем больше число больных, выделяющих лекарственно-устойчивые МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной лекарственной устойчивостью. По определению экспертов ВОЗ, лекарственно-устойчивый туберкулез – это случай туберкулеза легких с выделением МБТ, устойчивых к одному и более противотуберкулезным препаратам. В последние годы в связи с ухудшением эпидемической ситуации существенно увеличилось число больных, выделяющих МБТ, устойчивые к основным противотуберкулезным препаратам. По данным ЦНИИ туберкулеза РАМН в 2008г. у 50% впервые выявленных и ранее не леченных противотуберкулезными препаратами больных в мокроте определялись лекарственно-устойчивые МБТ, из них у 27,7% имелась устойчивость к 2 основным противотуберкулезным препаратам – изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота выявления лекарственно-устойчивых МБТ возрастает до 95,5%. Феномен лекарственной устойчивости МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является лекарственная устойчивость. В активно размножающейся бактериальной популяции всегда имеется некоторое количество лекарственно-устойчивых мутантов, которые практического значения не имеют, но по мере сокращения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством лекарственно-чувствительных и устойчивых МБТ. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. В клинической практике необходимо исследовать лекарственную чувствительность МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких.
Механизм и динамика формирования лекарственной устойчивости .
Развитие лекарственной устойчивости у МБТ является результатом случайных генетических мутаций. В любой достаточно большой популяции МБТ существуют возникшие естественным путем микобактерии-мутанты. Подвижного фактора устойчивости, подобного плазмидам грамотрицательных палочек, в данном случае нет. Мутации не связаны между собой и происходят с низкой, но предсказуемой частотой в пределах 1-2 делений на 106- 108 МБТ. В Таблице 1 показаны коэффициенты и распространенность мутаций, обусловливающих устойчивость к четырем противотуберкулезным препаратам первого ряда.
Таблица 1. Коэффициенты и распространенность мутаций
Центральный научно-исследовательский институт туберкулеза, Москва, Россия
Отсутствие ускоренной диагностики туберкулеза с устойчивостью возбудителя к изониазиду с сохраненной чувствительностью к рифампицину (ИР-ТБ) может быть причиной низкой эффективности терапии и приводить к амплификации лекарственной резистентности, в том числе к формированию множественной лекарственной устойчивости. Целью работы было определить частоту встречаемости ИР-ТБ в современной популяции, охарактеризовать фенотипическую чувствительность и генетические детерминанты устойчивости к изониазиду представителей этой группы M. tuberculosis на репрезентативном материале. Анализировали результаты определения лекарственной чувствительности, полученные при исследовании молекулярно- генетическими и/или культуральными методами изолятов M. tuberculosis / ДНК M. tuberculosis, выделенных от больных туберкулезом легких из клинических отделений Центрального научно-исследовательского институа туберкулеза за период 2011–2018 гг. Частота ИР-ТБ составила 12% от всех выявленных случаев туберкулеза. M. tuberculosis с ИР были как монорезистентными к изониазиду (45%), так и полирезистентными (устойчивыми к 2–6 противотуберкулезным препаратам), а устойчивость к изониазиду была обусловлена мутациями в гене katG, приводящими к высокому уровню резистентности. На основании анализа литературных данных и собственных наблюдений подчеркивается важность разработки и внедрения новых простых молекулярных тестов для определения устойчивости одновременно к рифампицину и изониазиду.
Ключевые слова: однонуклеотидный полиморфизм , туберкулез , Mycobacterium tuberculosis , изониазид-резистентность , лекарственная чувствительность , молекулярная диагностика
Вклад авторов в работу: А. Эргешев, Л. Н. Черноусова — разработка дизайна исследования; Е. Е. Ларионова, И. Ю. Андриевская — получение данных для анализа; Т. Г. Смирнова — анализ полученных данных; С. Н. Андреевская — написание текста рукописи, обзор публикаций по теме статьи; все авторы участвовали в обсуждении результатов.
Для корреспонденции: Софья Николаевна Андреевская
Яузская аллея, д. 2, г. Москва, 107564; ur.liam@aifosdna
МАТЕРИАЛЫ И МЕТОДЫ
Выявление M. tuberculosis проводили на жидкой среде Middlebrook 7H9 в системе BACTEC MGIT 960 (BD; USA) согласно стандартному протоколу изготовителя [9]. Фенотипическую лекарственную чувствительность определяли модифицированным методом пропорций в системе BACTEC MGIT 960 (BD; США) к восьми противотуберкулезным препаратам в критических концентрациях: изониазид (H, 0,1 мкг/мл), рифампицин (R, 1,0 мкг/мл), этамбутол (E, 5,0 мкг/мл), пиразинамид (Z, 100,0 мкг/мл), этионамид (Eto, 5,0 мкг/мл), амикацин (Am, 1,0 мкг/мл), капреомицин (Cm 2,5 мкг/мл) и левофлоксацин (Lfx 1,0 мкг/мл) согласно стандартным процедурам [9, 10].
Статистическая обработка результатов
При оценке результатов исследования использовали описательную статистику: количество наблюдений, частота, доля (в %), 95%-й доверительный интервал (95% ДИ). Весь анализ проводили с использованием MS Excel (Microsoft; США).
Были проведены культуральные и молекулярно-генетические исследования диагностического материала от 4056 больных туберкулезом легких. В 71 случае ни ДНК M. tuberculosis, ни культура M. tuberculosis не были выделены; эти случаи были исключены из исследования. Из оставшихся 3985 образцов диагностического материала были выделены ДНК и/или культуры M. tuberculosis и определена фенотипическая/ генотипическая чувствительность к ПТП. При получении результатов для клинических изолятов M. tuberculosis и культуральным, и молекулярно-генетическим методом (МГМ), в случае их несовпадения, приоритет отдавался данным, полученным культурально (табл. 1). Так, 38 штаммов, для которых при исследовании культуральным методом была определена устойчивость одновременно к изониазиду и рифампицину, но не были определены мутации в rpoB, обусловливающем устойчивость к рифампицину, были отнесены к категории МЛУ, так как использованные нами тесты для молекулярно-генетического определения ЛУ фиксируют только ограниченное число мутаций, поэтому генетические детерминанты устойчивости к рифампицину в этих случаях могли быть не выявлены. И наоборот, 29 штаммов с выявленными мутациями в rpoB, которые не имели фенотипического проявления в виде формирования устойчивости к рифампицину, были отнесены к категории ИР.
Среди устойчивых штаммов доминировали штаммы с МЛУ (см. табл. 1), однако штаммы с устойчивостью к изониазиду при сохраненной чувствительности к рифампицину также были достаточно широко представлены (502/3985; 12,60%).
Исследование динамики выявления M. tuberculosis с ИР за период 2011–2018 гг. показало, что в 2011–2012 и 2017–2018 гг. частота выявления ИР-ТБ среди всех исследованных за год случаев туберкулеза составила около 14%. В 2013–2016 гг. частота выявления этой формы ТБ была ниже (на уровне 10–11%). Линейный тренд показателя с достаточной степенью надежности описать не удалось (табл. 2).
Так как культуральные методы диагностики туберкулеза обладают меньшей чувствительностью, чем молекулярно-генетические, часть образцов не дали рост культуры M. tuberculosis на питательных средах. Поэтому фенотипическая чувствительность к ПТП была определена только для 260 изолятов M. tuberculosis с ИР (табл. 3).
При классификации по характеру лекарственной резистентности изолятов M. tuberculosis с ИР опирались на следующие определения [1]: монорезистентность — устойчивость микобактерий туберкулеза только к одному из ПТП; полирезистентность — устойчивость микобактерий туберкулеза к двум и более противотуберкулезным препаратам, но не к сочетанию изониазида и рифампицина.
Изоляты с моноустойчивостью к изониазиду выделяли в 117/260 (45%) случаев. Остальные 143 (55%) образца относились к полирезистентным и были устойчивы к 2–6 препаратам. Среди полирезистентных изолятов приблизительно в равных долях обнаружены M. tuberculosis с устойчивостью к изониазиду в комбинации только с ПТП 1-го ряда (42/143; 29,37%) и в комбинации только с ПТП 2-го ряда (38/143; 26,57%), причем во втором случае почти всегда регистрировали устойчивость к этионамиду (31/38; 81,58%). Наибольшее число полирезистентных изолятов было устойчиво одновременно к препаратам 1-го и 2-го рядов (63/143; 44,06%). Из них устойчивость одновременно к изониазиду, этамбутолу и этионамиду (HEEto), в том числе в сочетании с другими ПТП 2-го ряда, была выявлена в 20/63 (31,75%) случаев; устойчивость к изониазиду, пиразинамиду и этионамиду (HZEto), в том числе в сочетании с другими ПТП 2-го ряда, встречалась реже — в 9/63 (14,29%) случаев; и устойчивость к HEZEto — в 15/63 (23,81%) случаев. У 19/63 (30,16%) изолятов в спектрах резистентности были представлены другие сочетания препаратов (12 спектров резистентности, включающих от 3 до 5 ПТП).
Данные о мутациях в генах, ассоциированных с устойчивостью к изониазиду, были получены для 451 изолята M. tuberculosis с ИР (табл. 4). Чаще всего выявляли единичные однонуклеотидные полиморфизмы (ОНП) в одном из генов, ассоциированных с устойчивостью к изониазиду, — в 386/451 (85,59%) случаев; реже ОНП обнаруживали в двух генах, ассоциированных с устойчивостью к изониазиду, — в 65/451 (14,41%) случаев. Доминировали мутации в 315-м кодоне katG — 413/451 (91,57%), причем только в этом гене — в 348/413 (84,26%) случаев, реже в сочетании с ОНП в inhA — в 62/413 (15,01%) случаев, в единичных образцах — в сочетании с ОНП в ahpC.
Достаточно часто (94/451; 20,84%) регистрировали замену inhA15_C->T, которая в виде единичной мутации встречалась в 33/94 (35,11%) образцов, в остальных случаях эта мутация была сочетанной с ОНП в 315 кодоне katG.
Для 209 изолятов M. tuberculosis с ИР, устойчивость которых к изониазиду была подтверждена фенотипически, получили подобное распределение мутантных вариантов: 152/209 (72,73%) имели единичную мутацию katG315_ Ser->Thr(1); 32/209 (15,31%) — сочетанные мутации katG315_Ser->Thr(1) + inhA15_C->T; 17/209 (8,13%) — единичную inhA15_C->T. Оставшиеся 8 (3,83%) изолятов с подтвержденной фенотипической ИР несли мутации в других регионах генов, ассоциированных с устойчивостью к изониазиду (единичные в ahpC10_C->T, katG315_Ser->Asn; сочетанные katG315_Ser->Gly + inhA15_C->T, katG315_Ser->Thr(1) + inhA8_T->G; katG315_Ser->Thr(1) + ahpC10_C->T).
Таким образом, среди M. tuberculosis с ИР доминирующей мутацией была единичная мутация katG315_Ser->Thr(1), которая соответствует нуклеотидной замене AGC->ACC (333/451; 73,84%), далее по убыванию выявлены сочетанные мутации katG315_Ser->Thr(1) + inhA15_C->T (60/451; 13,30%) и единичная мутация inhA15_C->T (33/451; 7,32%). В целом, на долю этих трех мутантных вариантов приходилось 426/451 (94,46%) M. tuberculosis с ИР.
В систематическом обзоре, посвященном связи первичной резистентности к изониазиду с приобретением резистентности к другим ПТП [12], было сделано заключение, что приобретенная устойчивость к любому ПТП (не только переход в МЛУ) у моноустойчивых к изониазиду штаммов возникает в 5,1 раз чаще по сравнению с лекарственно-чувствительными штаммами. Показанная в нашем исследовании высокая частота встречаемости полирезистентных штаммов (55% от всех ИР), устойчивых кроме изониазида дополнительно к 1–5 ПТП, подтверждает возможность амплификации лекарственной устойчивости у M. tuberculosis с ИР.
Так как стандартный курс химиотерапии по I режиму, часто назначаемый эмпирически при новых случаях туберкулеза, включает в себя ПТП 1-го ряда — этамбутол и пиразинамид, логично было ожидать выявление высокой доли устойчивости M. tuberculosis с ИР именно к этим препаратам. Действительно, устойчивость к этамбутолу была выявлена почти у половины полирезистентных M. tuberculosis (70/143, 48,95%; 95% ДИ: 40,89–57,06%) и чуть реже регистрировали устойчивость к пиразинамиду (57/143, 39,86%; 95% ДИ: 32,20–48,05%).
Однако еще чаще у полирезистентных M. tuberculosis определяли устойчивость к препарату 2-го ряда этионамиду (80/143, 55,94%; 95% ДИ: 47,76–63,82%). Полученный результат можно объяснить тем, что этионамид является структурным аналогом изониазида и также угнетает синтез миколовых кислот, нарушая построение клеточной стенки микобактерий, поэтому эти два препарата могут иметь общие мишени и генетические детерминанты устойчивости [5, 13].
В целом, терапия ИР форм ТБ препаратами 1-го ряда по стандартной схеме приводит к неоптимальным результатам терапии (неэффективное лечение, рецидивы, приобретенная МЛУ). Кроме того, стандартизованное эмпирическое лечение ИР-ТБ может в значительной степени способствовать развитию эпидемии ТБ с МЛУ, особенно в тех регионах, где часто встречается ИР-ТБ [7]. В то же время своевременная коррекция терапии при получении данных о наличии устойчивости к изониазиду и применение модифицированных схем гарантировали успех лечения и не приводили к рецидивам [14–16].
В связи с этим следует упомянуть два клинических исследования, задачей которых было установить зависимость от мутаций в геноме возбудителя эффективности терапии высокими дозами изониазида ИР формы ТБ [17, 18]. Известно, что мутации в katG (доминировали в нашем исследовании) приводят к высокому уровню резистентности к изониазиду, а мутации только в inhA — к низкому уровню резистентности [5]. По итогам клинических исследований, терапия изониазидом была эффективна в том случае, если у возбудителя выявляли мутации на уровне inhA, а неблагоприятные исходы лечения были при мутациях на уровне katG [17, 18].
Все вышесказанное свидетельствует о том, что необходима отработка эффективных схем терапии ИР-ТБ [8, 19]. Кроме того, важно уделять внимание ускоренной диагностике ЛУ к изониазиду. Быструю специфичную и чувствительную диагностику ЛУ M. tuberculosis могут обеспечить только молекулярно-генетические методы (1–2 дня по сравнению с несколькими неделями культуральной диагностики), которые также дают возможность получить информацию о мутации и об уровне резистентности к изониазиду возбудителя [1]. Это делает МГМ наиболее востребованными в диагностике туберкулеза и определении лекарственной устойчивости возбудителя. Применяемые в крупных диагностических центрах фтизиатрического профиля тесты, основанные на аллель-специфичной ПЦР, биочипах или ДНК-стрипах, позволяют провести диагностику в кратчайшие сроки, но предъявляют высокие требования к квалификации персонала и инфраструктуре лабораторий.
В настоящее время единственным молекулярным тестом, который можно применять в лабораториях всех уровней, является Xpert MTB/RIF на платформе GeneXpert [20]. Но так как диагностика сегодня сосредоточена на выявлении МЛУ, маркером которой служит устойчивость к рифампицину, этот тест диагностирует только генотипическую устойчивость к рифампицину. Следовательно, устойчивость только к изониазиду без устойчивости к рифампицину (12% в нашем случае) не будет определена с использованием этого метода диагностики, а при невозможности применения дополнительных диагностических тестов никогда не будет установлена и, следовательно, из-за неадекватной химиотерапии может способствовать появлению новых случаев МЛУ. Поэтому актуальна разработка простого молекулярно-генетического теста, который может быть внедрен повсеместно и по удобству использования будет подобен Xpert MTB/RIF.
Туберкулез с ИР возбудителя можно рассматривать как потенциального предшественника туберкулеза с МЛУ. Поэтому важно контролировать распространение первичной устойчивости к изониазиду и предотвращать амплификацию устойчивости. Анализ частоты встречаемости устойчивости к изониазиду с сохраненной чувствительностью к рифампицину у M. tuberculosis, выделенных от больных туберкулезом легких, показал достаточно высокий уровень встречаемости ИР-TБ (более 12% от всех проанализированных случаев) — как правило с мутациями, приводящими к высокому уровню резистентности к изониазиду. Полученные данные подчеркивают важность ускоренного определения молекулярно-генетическими методами лекарственной чувствительности M. tuberculosis одновременно к рифампицину и изониазиду в лабораториях всех уровней. Для обеспечения этой возможности необходима разработка новых простых тестов в формате point-of-care, не предъявляющих высоких требований к инфраструктуре лаборатории.

Устойчивость возбудителя туберкулеза к препаратам, используемым для лечения, и особенно множественная лекарственная устойчивость (МЛУ), во многих странах стала серьезной проблемой общественного здравоохранения, препятствующей эффективной борьбе с туберкулезом [3; 4].
По оценкам Всемирной организации здравоохранения в 2012г около 3,7% впервые выявленных больных туберкулезом выделяли штаммы микобактерий с множественной лекарственной устойчивостью. Среди ранее получавших лечение больных уровни МЛУ гораздо более высокие – около 20%. В 2011 г. среди всех случаев заболевания туберкулезом было от 220 000 до 400 000 случаев заболевания туберкулезом с МЛУ. Около 60% этих случаев приходилось на страны БРИКС (Бразилию, Российскую Федерацию, Индию, Китай и Южно-Африканскую Республику) [9].
На территории Сибири и Дальнего Востока наблюдался самый высокий уровень регистрируемого числа случаев туберкулеза с множественной лекарственной устойчивостью среди впервые выявленных больных [6; 8].
Уровень первичной лекарственной устойчивости характеризует часть микобактериальной популяции, циркулирующей на территории, и этот показатель чрезвычайно важен для оценки степени напряженности эпидемической ситуации [2; 7].
Лекарственная устойчивость имеет не только клиническое значение, связанное с увеличением продолжительности лечения дорогостоящими препаратами, вызывающими серьезные побочные реакции, но и крайне важное эпидемиологическое значение. Доказано, что эпидемические очаги туберкулеза, сформированные бактериовыделителями устойчивых к противотуберкулезным препаратам микобактерий, представляют собой территории особого риска заболевания контактных лиц. Недостаточная эффективность химиопрофилактики в очагах туберкулеза с МЛУ способствует формированию очаговости с высоким уровнем заболеваемости контактных лиц [5].
В системе эпидемиологического надзора за туберкулезной инфекцией изучение характеристик циркулирующих штаммов микобактерий туберкулеза (МБТ) позволяет адекватно воздействовать на составляющие эпидемического процесса [1].
Цель исследования: качественная характеристика циркулирующих на территории Омской области штаммов M. tuberculosis, а также краткосрочное прогнозирование заболеваемости населения туберкулезом с множественной лекарственной устойчивостью.
Материалы и методы
Оценка статистической значимости различий результатов исследования в сравниваемых группах была проведена с помощью критерия Пирсона χ2 (хи-квадрат). Критический уровень значимости (p) при проверке статистических гипотез в данном исследовании принимался равным 0,05. Статистический анализ осуществлялся с использованием возможностей МS Excel, STATISTICA 7.0.
Результаты и обсуждение
На территории Омской области за исследуемый период наблюдалось некоторое улучшение ряда эпидемиологических показателей, характеризующих эпидемический процесс туберкулезной инфекции, что выражалось в наметившейся тенденции к снижению заболеваемости, распространенности и смертности населения от туберкулеза.
Вместе с тем сохранялся значительный уровень заболеваемости населения туберкулезом органов дыхания с бактериовыделением - 44,0 на 100 тысяч населения (95% ДИ 41,0÷46,9). Распространенность туберкулеза с множественной лекарственной устойчивостью (МЛУ-ТБ) возросла с 20,7 (95% ДИ 18,7÷22,6) до 40,4 на 100 тысяч населения (95% ДИ 37,6÷43,2). Хотя за указанный период смертность населения от туберкулеза снизилась (с 25,8 до 11,4 на 100 тысяч населения, T сн.=-3,47%), в структуре смертности ежегодно увеличивался удельный вес умерших, страдавших туберкулезом с МЛУ – с 10,7% (N= 468; n=50; ДИ 2,2÷19,2) в 2004г до 51,5% в 2013г.(N=227; n=117; ДИ 42,4÷60,5) (p=0,000).
Динамика заболеваемости туберкулезом органов дыхания с множественной лекарственной устойчивостью имела умеренную тенденцию к росту (Тпр. = 2,7%). Заболеваемость МЛУ-ТБ возросла практически в 2 раза с 3,5 (95% ДИ 2,7÷4,3) до 7,6 на 100 тысяч населения (95% ДИ 6,3÷8,8), причем рост заболеваемости МЛУ-ТБ происходил на фоне умеренной тенденции (Тсн.=-1,43%) к снижению общей заболеваемости населения туберкулезом (рисунок).
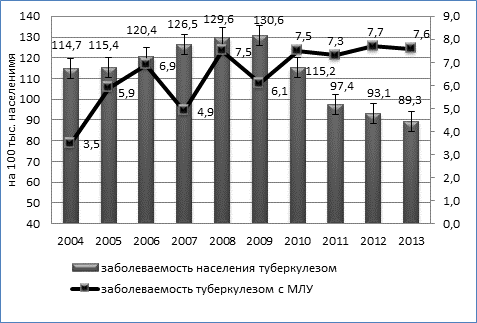
Динамика заболеваемости туберкулезом населения Омской области и заболеваемости туберкулезом с множественной лекарственной устойчивостью возбудителя (на 100 тыс. населения), 2004-2013гг.
К концу наблюдаемого периода доля больных с первичной МЛУ среди обследованных больных составляла 22,0% (N=685; n=151; ДИ 15,4÷28,6), доля приобретенной в процессе лечения множественной лекарственной устойчивости в контингенте больных - бактериовыделителей – 49,6% (N=326; n=162; ДИ 41,9÷57,3).
Нами изучена качественная характеристика бактериовыделения в контингенте впервые выявленных больных туберкулезом органов дыхания. Как показали результаты исследования, в основной группе лекарственная устойчивость к одному и более противотуберкулезных препаратов была обнаружена у 52,5% (N=122; n=64; ДИ 40,3÷64,7) впервые выявленных больных туберкулезом. В структуре лекарственной устойчивости монорезистентными (устойчивыми к одному из ПТП) были 9,4% выделенных штаммов, множественная лекарственная устойчивость определена в 59,4% случаев, полирезистентыми (устойчивыми к комбинации различных ПТП, кроме одновременной к изониазиду и рифампицину) были 31,2% штаммов (таблица).
Структура первичной лекарственной устойчивости штаммов М. tuberculosis, выделенных у впервые выявленных больных туберкулезом органов дыхания
Читайте также:


