Токсокароз как личинка выглядит
Токсокароз — паразитарное заболевание, вызываемое миграцией личинок аскарид животных семейства псовых (T. canis ). Характеризуется длительным рецидивирующим течением и полиорганными поражениями иммунологической природы. Возбудителями токсокароза могут бы
- Биология возбудителя
Половозрелые формы T. canis — крупные раздельнополые черви длиной 4 — 18 см локализуются в желудке и тонком кишечнике животных (собак). Интенсивность инвазии у собак может быть очень высокой, особенно у молодых животных. Средняя продолжительность жизни половозрелых особей составляет 4 месяца, максимальная — 6 месяцев. Самка паразита за сутки откладывает более 200 тыс. яиц. В 1 г фекалий может содержаться 10 000—15 000 яиц, так что в почву попадают миллионы яиц, обусловливая тем самым высокий риск заражения токсокарозом.
 |
Яйца токсокар округлой формы, крупнее яиц аскариды (65—75 мкм). Наружная оболочка яйца толстая, плотная, мелкобугристая. Внутри яйца располагается темный бластомер.
Цикл развития возбудителя следующий. Выделившиеся яйца токсокар попадают в почву, где, в зависимости от влажности и температуры почвы, созревают за 5—36 суток, становясь инвазионными. Инвазионность яиц сохраняется в почве длительное время, в компосте — несколько лет.
Жизненный цикл токсокары сложный. Выделяют основной цикл и два варианта вспомогательных. Основной цикл происходит по схеме: окончательный хозяин (псовые) — почва — окончательный хозяин (псовые). Передача инвазии осуществляется геооральным путем. Вспомогательный цикл (вариант 1) идет трансплацентарно, в этом случае паразит в личиночной стадии переходит от беременной самки к плоду, в организме которого совершает полную миграцию, достигая в кишечнике щенка половозрелой стадии. Инвазированный щенок становится функционально полноценным окончательным хозяином, источником инвазии.
Вспомогательный цикл (вариант 2) осуществляется по цепи: окончательный хозяин (псовые) — почва — паратенический хозяин. Паратеническим (резервуарным) хозяином могут быть грызуны, свиньи, овцы, птицы, земляные черви. Человек также выступает в роли паратенического хозяина, но не включается в цикл передачи инвазии, являясь для паразита биологическим тупиком. Дальнейшее развитие возбудителя происходит при условии, что паратенический хозяин будет съеден собакой или другим окончательным хозяином. Механизм передачи инвазии при этом варианте — геооральный — ксенотрофный.
В зависимости от возраста хозяина реализуются разные пути миграции личинок токсокар. У молодых животных (щенков до 5 недель) почти все личинки совершают полную миграцию с достижением половозрелых форм в кишечнике и выделением яиц во внешнюю среду. В организме взрослых животных большая часть личинок мигрирует в соматические ткани, где сохраняет жизнеспособность несколько лет. В период беременности и лактации у беременных сук возобновляется миграция личинок. Мигрирующие личинки через плаценту попадают в организм плода. Личинки остаются в печени пренатально инвазированных щенков до рождения, а после рождения личинки из печени мигрируют в легкие, трахею, глотку, пищевод и попадают в желудочно-кишечный тракт, где через 3—4 недели достигают половозрелой стадии и начинают выделять во внешнюю среду яйца. Кормящие суки могут передавать щенкам инвазию также через молоко.
У человека цикл развития возбудителя, его миграция осуществляется следующим образом. Из яиц токсокар, попавших в рот, затем в желудок и тонкий кишечник выходят личинки, которые через слизистую оболочку проникают в кровеносные сосуды и через систему воротной вены мигрируют в печень, где часть из них оседает, инцистируется или окружается воспалительными инфильтратами, образуя гранулемы. Часть личинок по системе печеночных вен проходит фильтр печени, попадает в правое сердце и через легочную артерию — в капиллярную сеть легких. В легких часть личинок также задерживается, а часть, пройдя фильтр легких, по большому кругу кровообращения заносится в различные органы, оседая в них. Личинки токсокар могут локализоваться в различных органах и тканях — почках, мышцах, щитовидной железе, головном мозге и др. В тканях личинки сохраняют жизнеспособность многие годы и периодически, под влиянием различных факторов, возобновляют миграцию, обусловливая рецидивы заболевания.
- Географическое распространение и эпидемиология
Токсокароз — широко распространенная инвазия, она регистрируется во многих странах. Показатели пораженности плотоядных являются высокими во всех странах мира. Средняя пораженность собак кишечным токсокарозом, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах у части животных достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз. Распространенность инвазии в различных регионах точно неизвестна, поскольку токсокароз не подлежит обязательной регистрации. Совершенно очевидно, что токсокароз имеет широкую геграфию распространения, и число больных значительно выше официально регистрируемых.
| Токсокароз широко распространен и регистрируется во многих странах. Средняя пораженность кишечным токсокарозом собак, обследованных на различных континентах, составляет свыше 15%, но в некоторых регионах достигает 93%. По данным сероэпидемиологических исследований, от 2 до 14% обследованных практически здоровых лиц в различных очагах токсокароза имеют положительные иммунологические реакции на токсокароз |
Основным источником инвазии для человека являются собаки, особенно щенки. Заражение происходит при непосредственном контакте с инвазированным животным, шерсть которого загрязнена инвазионными яйцами, или при попадании в рот земли, в которой были яйца токсокар. Особенно подвержены заражению дети во время игры в песке или с собакой. Наибольший риск заражения у детей, страдающих геофагией. Взрослые заражаются при бытовом контакте с инвазированными животными или в процессе профессиональной деятельности (ветеринары, собаководы, работники коммунальной службы, шоферы, землекопы и др.). У человека возможно заражение также при поедании сырого или плохо обработанного термически мяса паратенических хозяев. Описаны случаи заражения токсокарозом при употреблении в пищу печени ягненка. Не исключается возможность трансплацентарной и трансмаммарной передачи инвазии и у человека.
- Патогенез и патологическая анатомия
Патогенез токсокароза сложный и определяется комплексом механизмов в системе паразит — хозяин. В период миграции личинки травмируют кровеносные сосуды и ткани, вызывая геморрагии, некроз, воспалительные изменения. Ведущая роль принадлежит иммунологическим реакциям организма в ответ на инвазию. Экскреторно-секреторные антигены личинок оказывают сенсибилизирующее действие с развитием реакций немедленного и замедленного типов. При разрушении личинок в организм человека попадают соматические антигены личинок. Аллергические реакции проявляются отеками, кожной эритемой, увеличением резистентности дыхательных путей к вдыхаемому воздуху, что клинически выражается развитием приступов удушья. В аллергических реакциях принимают участие тучные клетки, базофилы, нейтрофилы, но основную роль играют эозинофилы. Пролиферация эозинофилов регулируется Т-лимфоцитами при участии медиаторов воспалительных реакций, выделяемых сенсибилизированными лимфоцитами, нейтрофилами, базофилами. Образующиеся иммунные комплексы привлекают в очаг поражения эозинофилы. Вокруг личинок токсокар кумулируются сенсибилизированные Т-лимфоциты, привлекаются макрофаги и другие клетки — формируется паразитарная гранулома.
Патоморфологическим субстратом токсокароза является выраженное в различной степени гранулематозное поражение тканей. При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими. При токсокарозе находят многочисленные гранулемы в печени, легких, поджелудочной железе, миокарде, лимфатических узлах, головном мозге и других органах.
- Клиническая картина токсокароза
Наиболее характерным лабораторным показателем является повышенное содержание эозинофилов в периферической крови. Относительный уровень эозинофилии может колебаться в широких пределах, достигая в ряде случаев 70 — 80% и более. Повышается содержание лейкоцитов (от 20х109 до 30х109 на 1 л). При исследовании пунктата костного мозга выявляется гиперплазия зрелых эозинофилов. У детей нередко отмечается умеренная анемия. Некоторые исследователи отмечают прямую корреляцию между тяжестью клинических проявлений инвазии и уровнем эозинофилии и гиперлейкоцитоза периферической крови. Характерным лабораторным признаком является также ускорение СОЭ, гипергаммаглобулинемия. В случаях поражения печени наблюдается повышение билирубина, гиперферментемия.
В хронической стадии болезни острые клинические и лабораторные признаки затухают. Наиболее стабильным лабораторным показателем остается гиперэозинофилия периферической крови.
Выделяют субклиническое, легкое, среднетяжелое и тяжелое течение токсокароза. Возможна так называемая бессимптомная эозинофилия крови, когда явные клинические проявления инвазии отсутствуют, но наряду с гиперэозинофилией выявляются антитела к антигенам T.canis.
Одной из наиболее серьезных проблем, связанных с токсокарозом, является его взаимосвязь с бронхиальной астмой. При сероэпидемиологических исследованиях установлено, что у больных бронхиальной астмой нередко обнаруживаются антитела к антигенам T.canis классов Ig G и Ig E. В зависимости от остроты паразитарного процесса, его длительности и длительности клинических проявлений бронхиальной астмы преобладает тот или другой класс иммуноглобулинов. Имеются клинические наблюдения, свидетельствующие об улучшении течения бронхиальной астмы или выздоровлении после ликвидации токсокарозной инвазии.
Паразитологический диагноз устанавливается редко и только по наличию в тканях характерных гранулем и личинок и их идентификации при исследовании биопсийного и секционного материала. Это возможно при пункционной биопсии печени, легких, оперативном вмешательстве. Обычно диагноз токсокароза устанавливается на основании данных эпидемиологического анамнеза, клинической симптоматики и гематологических проявлений. Используют также иммунологические реакции, позволяющие выявлять антитела к антигенам токсокар. Обычно применяют ИФА с секреторно-экскреторным антигеном личинок токсокар второго возраста. В настоящее время в России выпускается коммерческий диагностикум. Диагностическим титром считают титр антител 1:400 и выше (в ИФА). Титр антител 1:400 свидетельствует об инвазированности, но не болезни. Титр антител 1:800 и выше свидетельствует о заболевании токсокарозом. Практика показывает, что прямая корреляция между уровнем антител и тяжестью клинических проявлений токсокароза существует не всегда. Не всегда имеется и корреляция между уровнем антител и гиперэозинофилии крови.
При постановке диагноза и определении показаний к специфической терапии следует учитывать, что токсокароз протекает циклически с рецидивами и ремиссиями, в связи с чем возможны значительные колебания клинических, гематологических и иммунологических показателей у одного и того же больного.
М. И. Алексеева и соавт. (1984) разработали алгоритм диагностики токсокароза, основанный на оценках в баллах значимости клинических симптомов и сопоставлении клинико-эпидемиологических и лабораторных показателей. Этот метод может быть перспективен при проведении массовых обследований населения.
Дифференциальный диагноз проводят с миграционной стадией других гельминтозов (аскаридоз, описторхоз), стронгилоидозом, эозинофильной гранулемой, лимфогранулематозом, эозинофильным васкулитом, метастазирующей аденомой поджелудочной железы, гипернефромой и другими заболеваниями, сопровождающимися повышенным содержанием эозинофилов в периферической крови. Следует иметь в виду, что у больных с системными лимфопролиферативными заболеваниями и серьезными нарушениями в системе иммунитета иммунологические реакции могут быть ложно положительными. В этих случаях необходим тщательный анализ клинической картины заболевания.
| При интенсивной инвазии развиваются тяжелые гранулематозные поражения многих органов и систем, которые при повторных заражениях могут стать хроническими |
Глазной токсокароз. Патогенез этой формы токсокароза до конца не ясен. Существует гипотеза об избирательном поражении глаз у лиц с инвазией низкой интенсивности, при которой не развивается достаточно выраженная иммунная реакция организма из-за слабого антигенного воздействия небольшого числа поступивших в организм личинок токсокар.
Эта форма токсокароза чаще наблюдается у детей и подростков, хотя описаны случаи заболевания и у взрослых.
Для токсокароза характерно одностороннее поражение глаз. Патологический процесс развивается в сетчатке, поражается хрусталик, иногда параорбитальная клетчатка. В тканях глаза формируется воспалительная реакция гранулематозного характера. Патологический процесс часто принимают за ретинобластому, проводят энуклеацию глаза. При морфологическом исследовании обнаруживают эозинофильные гранулемы, иногда — личинки токсокар.
Клинически поражение глаз протекает как хронический эндофтальмит, хориоретинит, иридоциклит, кератит, папиллит. Глазной токсокароз — одна из частых причин потери зрения.
Диагностика глазного токсокароза сложна. Количество эозинофилов обычно нормальное или незначительно повышено. Специфические антитела не выявляются или выявляются в низких титрах.
- Лечение токсокароза
Разработано недостаточно. Применяют противонематодозные препараты — тиабендазол (минтезол), мебендазол (вермокс), медамин, диэтилкарбамазин. Эти препараты эффективны в отношении мигрирующих личинок и недостаточно эффективны в отношении тканевых форм, находящихся в гранулемах внутренних органов.
Минтезол (тиабендазол) назначают в дозах 25—50 мг/кг массы тела в сутки в три приема в течение 5—10 дней. Побочные явления возникают часто и проявляются тошнотой, головной болью, болями в животе, чувством отвращения к препарату (в настоящее время препарат в аптечную сеть России не поступает).
Вермокс (мебендазол) назначают по 200 —300 мг в сутки в течение 1—4 недель. Побочные реакции обычно не наблюдаются.
 |
Медамин применяют в дозе 10 мг/кг массы тела в сутки повторными циклами по 10 — 14 дней.
Диэтилкарбамазин назначают в дозах 2 — 6 мг/кг массы тела в сутки в течение 2 — 4 недель. (В настоящее время препарат в России не производится, не закупается за рубежом. — Прим. ред.)
Альбендазол назначают в дозе 10 мг/кг массы тела в сутки в два приема (утро — вечер) в течение 7 — 14 дней. В процессе лечения необходим контроль анализа крови (возможность развития агранулоцитоза) и уровня аминотрансфераз (гепатотоксическое действие препарата). Небольшое повышение уровня аминотрансфераз не является показанием к отмене препарата. В случае нарастающей гиперферментемии и угрозы развития токсического гепатита требуется отмена препарата.
Критерии эффективности лечения: улучшение общего состояния, постепенная регрессия клинических симптомов, снижение уровня эозинофилии и титров специфических антител. Следует отметить, что клинический эффект лечения опережает положительную динамику гематологических и иммунологических изменений. При рецидивах клинической симптоматики, стойкой эозинофилии и положительных иммунологических реакциях проводят повторные курсы лечения.
Прогноз для жизни благоприятный, однако при массивной инвазии и тяжелых полиорганных поражениях, особенно у лиц с нарушениями иммунитета, возможен летальный исход.
Включает соблюдение личной гигиены, обучение детей санитарным навыкам.
Важным профилактическим мероприятием является своевременное обследование и дегельминтизация собак. Наиболее эффективно преимагинальное лечение щенков в возрасте 4 — 5 недель, а также беременных сук. Для лечения собак используют противонематодозные препараты. Необходимо ограничение численности безнадзорных собак, оборудование специальных площадок для выгула собак.
Следует улучшить санитарно-просветительскую работу среди населения, давать информацию о возможных источниках инвазии и путях ее передачи. Особого внимания требуют лица, по роду деятельности имеющие контакты с источниками инвазии (ветеринарные работники, собаководы, землекопы и другие).
Дата публикации: 08 января 2019 .
Врач лабораторной диагностики
Централизованной иммуно-токсикологической
лаборатории Семкова З.А.
Токсокароз – гельминтное заболевание, вызываемое несвойственным человеку паразитом – токсокарой, очень схожей с аскаридой человеческой – нематодой семейства Anisaridae рода Toxocara. Диаметр ее личинки составляет 0,02 мм.
Toxocara Canis – гельминт, поражающий представителей семейства псовых (собак, волков, лисиц, песцов).
По данным отдельных авторов, в России количество детей, зараженных токсокарозом, составляет 40-50%, в США Центром по борьбе с болезнями ежегодно регистрируется 700-1000 случаев токсокароза.
Источником инвазии для людей являются собаки, выделяющие яйца токсокар с фекалиями, а также загрязненная яйцами шерсть животного. В США 20% взрослых собак и 95% щенков заражено этими гельминтами, а яйца токсокар обнаруживаются в 10-30% проб почв и дворов.
Инвазированные токсокарозом люди не являются источником заражения, так как человек для токсокары несвойственный хозяин, и возбудители в организме человека не достигают половозрелого состояния.
Для людей основными предпосылками передачи возбудителя токсокароза является загрязненность почвы яйцами токсокар и контакт с ней.
Клинические проявления токсокароза. Это гельминтоз из группы нематодозов, характеризующийся лихорадкой, бронхитом, пневмонией, гепатоспленомегалией и эозинофилией (в крови). Личиночный токсокароз регистрируется во многих странах мира.
У человека различают личиночный (висцеральный, глазной) и имагинальный (кишечный) токсокароз.
Люди заражаются токсокарозом при проглатывании яиц токсокар с пищей и водой, загрязненными испражнениями животных, а также при контакте с инвазированными животными. Вышедшие из яиц личинки мигрируют из кишечника через стенку кишки и по кровеносным сосудам попадают в различные органы и ткани, где инкапсулируются и, сохранив длительное время биологическую активность, вызывают личиночную форму заболевания. Личинки токсокар кошек после миграции вновь попадают в кишечник в половозрелой стадии развития (имаго) и вызывают имагинальную форму заболевания.
Чаще болеют дети 1-4 лет. Заболевание протекает с ярко выраженными аллергическими симптомами: зудящими высыпаниями, лихорадкой, гепатоспленомегалией, бронхопневмонией с приступами мучительного кашля и удушья, одутловатостью лица, образованием в различных органах специфических гранулём, содержащих личинки токсокар. Возможны токсокарозный офтальмит с поражением заднего сегмента глаза (хориоретинит), кератит. При глазном токсокарозе возможны необратимые повреждения глаз, вплоть до потери зрения.
Длительность болезни от нескольких месяцев до нескольких лет. Имагинальный токсокароз встречается редко. Клинически проявляется тошнотой, болями в животе, обильной саливацией, понижением аппетита, головокружением.
Диагноз токсокароза основывается на клинической картине, данных эпидемиологического анамнеза и результатах лабораторных исследований. Проводят серологические реакции с токсокарозным антигеном. В крови стойкая длительная эозинофилия (до 70-90%) и СОЭ до 50 мм/ч, гиперглобулинемия. Диагноз имагинального токсокароза ставят при обнаружении яиц токсокар в испражнениях.
Лечение заболевания проводят тиабендазолом в суточной дозе 25-50 мг/кг в течение 5-7 дней или мебендазолом в дозе 3-5 мг/кг в течение 5-7 дней. Применяют десенсибилизирующие средства.
Прогноз чаще благоприятный. Для лечения имагинального токсокароза используют пирантел и левамизол. Лечение глазной формы токсокароза альбендазол 15 мг/кг в сутки 20 дней.
Профилактика личиночного и имагинального токсокароза включает общесанитарные мероприятия по охране от загрязнения окружающей среды фекалиями собак и кошек, дегельминтизация их, создание в городах социальных мест для выгула собак и кошек, соблюдение правил личной гигиены, мытье рук после контакта с животными!
БУДЬТЕ ЗДОРОВЫ! БЕРЕГИТЕ СЕБЯ И СВОИХ БЛИЗКИХ!
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ наверх
1 . Этиологический фактор: нематоды из рода Toxocara , которые являются случайными паразитами человека, мигрирующие на протяжении многих лет в личиночной форме в тканях и внутренних органах (печени, миокарде, легких, скелетных мышцах, глазных яблоках и ЦНС), никогда не достигая половой зрелости. Взрослая форма нематоды развивается соответственно в организме домашней собаки ( Тохосаrа canis ) или кошки ( Тохосаrа cati ). Яйца паразита, выделяемые с калом животных, попадают в почву, где наступает их дальнейшее биологическое развитие.
2. Резервуар и пути заражения: домашние и дикие собаки и кошки; инфицирование человека происходит через случайное употребление инвазивных яиц Тохосаrа spp . с землей, загрязненной фекалиями животных (напр. песочницы, скверы и городские парки, приусадебные участки и районные игровые площадки для детей), через немытые руки или загрязненные землей сырые овощи и фрукты.
3. Эпидемиология: встречается во всем мире. Факторы риска заражения : геофагия, разведение собак или кошек, нерегулярные дегельминтизации домашних животных (особенно молодых, 4. Инкубационный и заразный период: от 2 нед. до нескольких месяцев или лет. Больной не является заразным для контактирующих с ним людей.
КЛИНИЧЕСКАЯ КАРТИНА И ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ наверх
1. Системная форма: проявляется полносимптомным синдромом висцеральной мигрирующей личинки: лихорадка, увеличение печени и селезенки, эозинофилия, гипергаммаглобулинемия и поражение дыхательной системы; также может возникнуть неполный синдром висцеральной мигрирующей личинки с наличием нескольких, указанных выше симптомов. Полносимптомные случаи с тяжелым течением редки и в основном касаются детей в возрасте 2–5 лет с геофагией. Миграция личиночных форм паразита сопровождается болями в животе, потерей аппетита, потерей массы тела, кашлем, приступами одышки, кратковременной кожной сыпью (крапивница или экзема), воспалением лимфатических узлов, мышечными и суставными болями, реже миокардитом или менингитом.
2. Локализованная форма: токсокароз органа зрения и токсокароз ЦНС (нейротоксокароз, очень редкая форма) являются следствием инвазии небольшого количества личинок, обычно даже одной личинки в пределах органа зрения или головного мозга. При глазном токсокарозе наблюдается одностороннее ослабление остроты зрения, лейкокория (белый зрачковый рефлекс), косоглазие, иногда болезненность глазного яблока. При токсокарозе ЦНС преобладают симптомы энцефалита, часто с генерализованными или парциальными судорожными припадками.
3. Скрытый токсокароз: разнообразные и мало характерные симптомы, напр. острый бронхит, пневмония с синдромом Леффлера или без него, бронхиальная астма, хроническая крапивница, аллергическая экзема, генерализованная лимфаденопатия, воспаление мышц или суставов. Может перейти в полносимптомный синдром висцеральной или глазной мигрирующей личинки. Скрытый токсокароз обычно диагностируется только на основании уменьшения или исчезновения неспецифических симптомов после применения противопаразитарного лечения.
4. Бессимптомная форма: чаще всего диагностируется на основании положительных результатов серологических тестов у членов семьи больного. Личинки Тохосаrа spp. со сниженной активностью, оставшиеся в тканях, сохраняют на протяжении всей жизни способность активироваться и снова начать миграцию.
Паразит не развивается до половозрелой формы в организме человека, поэтому никогда не обнаруживают яиц собачьего или кошачьего токсокара в кале. Единственным способом подтверждения инфекции являются косвенные исследования.
Дополнительные методы исследования
1. Идентификация этиологического фактора: серологические исследования:
а) специфические антитела IgG или IgE в сыворотке (ИФА, подтверждающий тест вестерн-блоттинг);
б) определение авидности антител IgG позволяет дифференцировать острую фазу активной инвазии ( 2. Другие:
1) определение общего количества антител IgE в периферической крови — это имеет значение в случае аллергических симптомов, сопровождающих миграцию личиночных форм нематод, особенно при скрытой форме заболевания (напр. при бронхиальной астме и хронической крапивнице);
2) морфология крови и концентрация иммуноглобулинов: при полносимптомных случаях висцеральной формы синдрома мигрирующей личинки увеличение количества и процента эозинофилов и количества лейкоцитов в периферической крови, а также гипергаммаглобулинемия в сыворотке крови; в случае эозинофильного энцефалита и менингита высокая эозинофилия в периферической крови и спинномозговой жидкости;
3) визуализирующие методы обследования:
а) УЗИ или КТ брюшной полости — обнаруживают увеличение печени и многочисленные гранулемы в печени, образующиеся вокруг личиночных форм паразита;
б) КТ или МРТ головного мозга — обнаруживает хорошо отграниченные от окружающих тканей очаговые изменения в белом веществе или коре, часто единичные и частично кальцифицированные;
в) рентгенография грудной клетки — может обнаружить летучие инфильтраты при эозинофильном воспалении легких на аллергическом фоне (сидром Леффлера);
г) УЗИ органа зрения при глазной форме синдрома мигрирующей личинки — обнаруживает гранулемы, расположенные внутри глаза или под сетчаткой; изменения, в основном, односторонние и единичные;
4) офтальмологическое исследование — при глазной форме можно обнаружить серо-белую гранулему в заднем полюсе или на периферии сетчатки, часто с поствоспалительным пролиферативным фиброзным валиком и серповидной элевацией сетчатки вокруг изменения.
Положительный эпидемиологический анамнез (напр. геофагия в анамнезе, наличие не дегельминтизированных щенков в ближайшем окружении, привычка есть немытые фрукты и овощи с приусадебного участка, игра детей в не защищенной песочнице), а также ≥1 из следующих критериев: специфические антитела IgG или IgE в периферической крови, эозинофилия в периферической крови (> 440/мкл или >4 %); характерные клинические симптомы или изменения при визуализирующих исследованиях.
1. Синдром мигрирующей личинки — висцеральная форма: заражение Baylisascaris procyonis , синдром тропический легочной эозинофилии ( Wuchereria bancrofti, Brugia malayi ) личиночная форма аскаридоза, стронгилоидоз, аллергические заболевания (астма, крапивница, атопический дерматит, реакции на лекарства), аутоиммунные заболевания (системная красная волчанка, узелковый полиартериит, полимиозит и дерматомиозит), лимфо- и миелопролиферативные заболевания, идиопатическая эозинофилия.
2. Нейротоксокароз: эозинофильное воспаление мозга, вызванное Gnathostoma spinigerum и Angiostrongylus cantonensis , цистицеркоз ЦНС (нейроцистицеркоз).
3. Синдром мигрирующей личинки — глазная форма: ретинобластома и другие опухоли глазного яблока, глазной токсоплазмоз, туберкулез органа зрения, экссудативный ретинит (болезнь Коатса).
1 . Синдром мигрирующей висцеральной личинки: препаратом выбора является альбендазол п/о 15 мг/кг массы тела/ день (макс. 800 мг/день) в течение 5–10 дней.
2. Глазной токсокароз: альбендазол, а также глюкокортикостероиды системно или местно и оперативное лечение (витрэктомия и лазерная фотокоагуляция).
Регулярный контроль эозинофилии, а также активности аминотрансфераз в периферической крови во время лечения альбендазолом. Лечение должно быть прекращено в случае появления признаков токсического гепатита. Периодическое обследование глазного дна осуществляется в случае повторного ухудшения остроты зрения.
1. Синдром висцеральной мигрирующей личинки: потеря или отсутствие набора массы тела, задержка физического развития, печеночная недостаточность, фиброз легких, эозинофильный миокардит с сердечной недостаточностью.
2. Глазной токсокароз: тракционная отслойка сетчатки, катаракта, атрофия глазного яблока, косоглазие, постоянные дефекты поля зрения, амблиопия, слепота.
3. Нейротоксокароз: изменения личности и поведения, эпилепсия.
Прогноз благоприятный у больных с неполным синдромом висцеральной мигрирующей личинки, а также со скрытой формой инфекции. Серьезный и неопределенный прогноз при глазном токсокарозе и в случае локализации мигрирующих личинок в ЦНС или миокарде.
Регулярная дегельминтизация собак и кошек, особенно молодых, тщательное мытье фруктов и овощей перед употреблением, использование защитных перчаток для работы в саду, удаление фекалий собак и кошек из зон отдыха и городских парков, защита песочниц от загрязнения фекалиями животных.

Дата публикации: 09.12.2018 2018-12-09
Статья просмотрена: 9454 раза
Гельминты-многоклеточные организмы, жизненный цикл которых отличается сложным индивидуальным развитием [2]. Современной науке известно более четырехсот видов червей, являющихся паразитами животных и человека.
Наиболее часто встречающиеся в человеческом организме типы гельминтов, следующие [4]:
1) трематоды (плоские черви);
2) цестоды (ленточные черви);
3) нематоды (круглые черви).
Плоские черви. Этот тип гельминтов включает множество форм, патогенных для человека. Широко распространенные заболевания, такие как описторхоз, фасциолез могут оказаться смертельными.
Ленточные черви. Цестоды- гермафродиты, поэтому ленточные черви чрезвычайно плодовиты. Характерным является и большой размер гельминтов, до десяти метров. Серьезное распространенное заболевание, вызываемое эхинококком, поражает печень, легкие, мозг, кости, но может встречаться в любом органе человека.
Тип круглые черви включает в себя огромное количество видов, более двадцати четырех тысяч. Аскаридоз, энтеробиоз, токсокароз отличаются широким ареалом распространения и являются самыми популярными гельминтозами человека.
Возбудителем токсокароза является токсокара — паразит (гельминт) из группы нематод (рис.1).
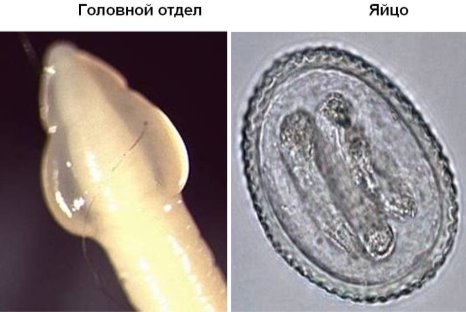
Рис. 1. Головной отдел и яйцо токсокары
Токсокароз, вызываемый данным патогенным микроорганизмом, представляет большой интерес с точки зрения медицины. Изучение этого гельминта важно для диагностирования, лечения и профилактики заболевания, широко распространенного во всем мире. Диагностика болезни непростая, клиническая картина разнообразна и непредсказуема, поэтому с токсокарозом можно обращаться к врачам различной специализации.
Возбудителем токсокароза является нематода семейства Anisakidae рода Toxocara. Основными хозяевами этих паразитов являются кошки и собаки. Поэтому различают два вида данного паразита.
Toxocara canis непосредственно связан с собаками, волками и другими представителями семейства псовых.
Toxocara mistax (Toxocara cati) поражает представителей семейства кошачьих [5].
Современная наука токсокарозом называет заболевание человека, которое вызывают именно Toxocara canis.
Toxocara canis— нематода, самка которой достигает в длину 6–18 см, самец — 4–10 см. Одной из основных отличительных морфологических особенностей паразита являются вздутия кутикулярного происхождения на головном конце, образующие боковые крылья размером 2,3x0,3мм [5].
Яйца токсокар округлой формы. Они крупнее оплодотворенных яиц аскарид — соответственно 65–75 и 50–70 мкм. Защитная наружная оболочка яиц толстая, плотная, мелкобугристая, цвет её — от светло-коричневого до тёмно-коричневого. Внутри незрелого яйца расположен шаровидный бластомер, заполняющий почти всё яйцо. В зрелом яйце содержится живая личинка [3].
Половозрелые нематоды обитают в тонком кишечнике и желудке облигатных хозяев (обычно это собаки, лисицы и т. д.). Взрослые паразиты живут около 4 мес., максимум- 6 мес. Самка тoxocara canis откладывает более 200 тыс. яиц в сутки [3]. Во внешнюю среду выделяются незрелые и неинвазионные яйца. Для дальнейшего развития яиц нужны оптимальные условия окружающей среды (температура и влажность). При изменении данных условий на менее благоприятные, сроки развития меняются. Инвазионное яйцо, способное вызвать заражение, содержит развитую личинку после двух линек. Её жизнеспособность сохраняется во внешней среде длительное время, так как яйца устойчивы к негативному влиянию окружающей среды.
Полный жизненный цикл токсокар, с прохождением всех стадий, обеспечивается только у окончательных хозяев- животных семейства псовых или кошачьих.
Инвазия начинается с заболевания животного. Многообразие путей и возможностей расселения паразита приводит к высоким показателям распространенности токсокароза. Механизм инфицирования животных через резервуарных (паратенических) хозяев включает в себя такие способы:
- Животное может заразится яйцами и личинками гельминта из окружающей среды практически в любом месте — это прямой путь передачи возбудителя.
- Внутриутробный — потомство инфицируется больной матерью через плаценту. Личинки, проникнув в плод, переходят в кишечник, где достигают половозрелой стадии. Этот организм выступает окончательным хозяином паразита.
- Трансмаммарный, когда токсокара передается щенкам при вскармливании молоком взрослой собаки [5].
Последующее развитие инфекции зависит от определенных факторов [4]: возраста и иммунитета животного.
Гельминты в активной личиночной стадии из кишечника проникают в кровеносные сосуды. Миграция личинок вместе с кровью по всему организму часто приводит к поражению органов и тканей. Следовательно, гельминт попадает и в легкие, а затем и в трахею. При кашле часть личинок вместе с мокротой выделяются во внешнюю среду. Другая часть проглатывается со слюной, попадает в кишечник и достигает половой зрелости. Взрослые особи откладывают яйца, которые с выделениями животного выводятся во внешнюю среду. В почве происходит дальнейшее развитие яиц паразитов. Для созревания яиц необходимо от 5 до 35 суток в зависимости от условий окружающей среды. Созревшие яйца токсокары являются заразными для человека и животных [3]. Инвазионность яиц может сохраняться годами.
Необходимо отметить, что человек является тупиком в жизненном цикле токсокар. В организме человека они не могут перейти от стадии личинки до половозрелой особи и продолжить свой род [5].
После проглатывания яиц гельминтов (во многих случаях из-за игнорирования правил гигиены), человек становится новым хозяином паразита. Яйца токсокар через желудок попадают в тонкую кишку, где вылупляются личинки. Через слизистую оболочку стенки кишечника личинка проникает в кровеносную систему и мигрирует по организму, локализуясь в разных органах и тканях. В выбранном органе токсокары активно создают себе условия: вокруг личинки образуется капсула, устойчивая к атаке имунных клеток. В капсуле личинки могут пребывать годами, подвергая организм длительной интоксикации продуктами своей жизненной активности.
Протекание заболевания зависит от органа-мишени токсокары. Если поражены мышцы, человек испытывает мышечные боли, если личинка гельминта осела в головном мозге, болезнь сопровождается головными болями, нарушениями сна, возможны судороги и параличи. Часто поражаются суставы, сердце, глаза.
Симптоматика токсокароза схожа с другими нематодозами в острый период [2]. Это осложняет диагностику данного заболевания. Точно так же, как и подтверждение инвазии токсокарой. Обнаружить гранулемы и личинки можно только с помощью материала, взятого на биопсию. Поэтому для постановки диагноза собирают анамнез, принимают во внимание жалобы пациента. С помощью серологических исследований выявляют антитела и антигены в сыворотке крови больного.
Для выявления антител к токсокаре наиболее часто применяются следующие реакции [2]:
– реакция связывания комплемента (РСК);
– иммуноферментный анализ (ИФА).
Подведя итог, можно сделать заключение, что токсокароз относится к числу распространенных и весьма опасных зоонозных паразитозов, способных поражать человека. Исследования последних лет показали относительно низкий уровень распространенности токсокароза в странах Западной Европы. Наиболее высокий уровень заболеваемости регистрируется в тропических странах (Бали, Вест-Индия). Токсокароз — относительно новая и достаточно сложная проблема современного здравоохранения. Повсеместная распространенность инвазионного заболевания требует серьезного отношения к проблеме. Эффективность борьбы с заболеванием зависит от объединенных усилий медицинской и ветеринарной служб. Не менее важно использование в практике здравоохранения современных методов диагностики, лечения и профилактики этой инвазии.
Читайте также:


