Техника безопасности при работе с гельминтами
Сайт СТУДОПЕДИЯ проводит ОПРОС! Прими участие :) - нам важно ваше мнение.
Пути заражения.
Человек гельминтами животных заражается: 1) через руки, загрязненные при работе на ферме, при уходе за домашними животными, ветеринарном обслуживании животных, сборе и исследовании материала от животных и объектов окружающей среды и т.д.; инвазионное начало с рук заноситься в рот с пищей, водой и даже при курении и т.д.; 2) при активном нападении промежуточных хозяев (кровососущих насекомых), происходит инокуляция личинок гельминтов (например, филярий); 3) при активном нападении в водоеме фуркоцеркарий шистозомат, в наземной среде – личинок стронгилоидид и анкилостомид домашних и диких животных; 4) при употреблении в пищу сырых или недостаточно обработанных термически, или недостаточно по времени просоленных животных и растительных продуктов, которые могут содержать яйца и личинки гельминтов; 5) при питье воды из водоемов, в которые могут поступать стоки ферм и бытовые отходы, и в этой воде которых могут находиться инвазионные элементы гельминтов.
Профилактику соблюдают при взятии материала от животных для копрологической диагностики и дальнейшем лабораторном исследовании материала, аналогичные меры профилактики соблюдают и при исследовании объектов окружающей среды.
Взятие проб фекалий из прямой кишки жвачных, лошадей, свиней или свеже выделенных фекалий, их исследование в ближайшее время (до полутора суток) является не опасным.
Напротив, несвежие фекалии, которые находились какое-то время в помещении или на пастбище при комнатной (положительной) температуре, могут представлять определенную опасность. В этой связи сбор материала и его упаковку необходимо производить в перчатках.
Свежие и полежавшие фекалии домашних и диких плотоядных очень опасны в смысле инвазии персонала личинками (онкосферами) тениид и различными цистицерками. Поэтому пробы берут и упаковывают в резиновых перчатках. Пробы фекалий целесообразно консервировать.
Пробы фекалий на месте взятия упаковывают в полиэтиленовые пакеты или специальные пластмассовые (стеклянные) банки, чтобы в пути не было загрязнения транспорта и окружающих предметов. В лаборатории упаковочный материал тщательно стерилизуют или утилизируют.
Подготовку материала для исследования и микроскопию препаратов проводят на отдельных столах, которые покрыты моющейся пленкой, при этом стол должен находиться рядом с водопроводным краном. Пробы фекалий для исследований готовят в больших кюветах, которые можно легко промыть и дезинвазировать (например, обработать термически).
Пробы фекалий берут специальным пинцетом, избегая контакта с руками.
Особенные меры предосторожности соблюдают при исследовании фекалий от домашних и диких плотоядных в районах неблагополучных по эхинококкозу, альвеококкозу и другим тениидозам, независимо от времени (сезона) взятия проб. Работу обязательно выполняют в резиновых перчатках. Гельминтологическое вскрытие и последующее исследование кишечника этих животных также производят обязательно в перчатках.
В хранившихся пробах от жвачных, свиней и лошадей (особенно молодняка) в теплое время (при температуре 25-30º С) через полтора суток развиваются инвазионные личинки строгилоидид, представляющие опасность для исследователей. Если проводить исследование проб в день взятия материала невозможно, их помещают в холодильник, что задеражать развитие личинок.
При культивировании личинок стронгилят (особенно анкилостоматид) учитывают, что возможно загрязнение рук инвазионным началом и последующее заражение. В этой связи обязательно работают в перчатках, исключая возможность загрязнения столов и помещения.
При исследовании мышц свиней, кабанов, медведей, барсуков и других млекопитающих с целью диагностики личинок трихинелл, соблюдают максимальные меры профилактики. После проведенной диагностической работы столы и инструментарий дезинфицируют спиртом. Аналогичные меры профилактики соблюдают и при исследовании пресноводных рыб и морепродуктов (рыба, крабы, креветки, моллюски и др.) особенно в районах неблагополучных по описторхозу, клонорхозу, псевдамфистомозу, нанофиэтозу, парагонимозу и др. При исследовании материала методом переваривания в искусственном желудочном соке обязательно работают в резиновых перчатках. Для микроскопических исследований материал отбирают специальной пипеткой с резиновым баллончиком.
После окончания работы тщательно промывают столы, лабораторную посуду и инструментарий. В том случае, если исследовали материал от плотоядных, то проводят дополнительную дезинвазию использованной лабораторной посуды, пластикового покрытия столов. Внешние детали микроскопа (поворотные ручки и объективы) протирают спиртом.
После окончания исследований руки моют с мылом под струей воды, особенно тщательно промывают подногтевые пространства, используя специальную щетку.
После исследования отработанный материал от плотоядных (остатки фекалий, смывы с проб, вода после промывания и т.д.) подвергают дезинвазии путем кипячения или утилизируют в специальной канализации.
При сборе и исследовании проб из окружающей среды (почва, ил, осадок сточных вод, навоз и др.) соблюдают аналогичные меры профилактики как и при исследований фекалий.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Биологическую опасность, или риск для здоровья людей и окружающей среды, могут представлять инфицированные организмы или биологический материал, содержащий микроорганизмы или токсины биологического происхождения.
Биологическая безопасность – порядок осуществления лабораторных исследований и специальное оснащение микробиологических лабораторий, которые защищают персонал лабораторий и окружающую среду при работе с потенциально инфекционными микроорганизмами.
Уровень биобезопасности – уровень мер предосторожности, необходимых при работе с потенциально опасными биологическими агентами. Различают 4 уровня биобезопасности (табл. 1). В зарубежных странах более высокий номер уровня биобезопасности означает возрастающий риск при выполнении лабораторных исследований.
Характеристика уровней биобезопасности
Биологические агенты, которые обладают минимальным риском для персонала и окуружающей среды.
Не требуется специального оснащения. Должны быть приспособления для мытья рук, легко обеззараживаемые рабочие поверхности, прочная мебель, окна с противомоскитными сетками, отсутствие автоматической вентиляции, личная защитная одежда (перчатки, халаты), автоматические дозаторы, защита глаз и лица, автоклавы, безопасные центрифуги.
Escherichia coli K12
Lactobacillus acidophilus Micrococcus leuteus
Биологические агенты, обладающие потенциальным риском для персонала и окружающей среды. Часто вызывают серьёзные заболевания, эффективное лечение и профилактика которых доступны.
Оснащение соответствует классу 1. Требуются строгие меры предосторожности при проведении процедур, при которых могут создаваться инфекционный аэрозоль или брызги. Особые меры предосторожности применяют в отношении острых и режущих предметов.
Clostridium difficile Mycobacterium other than tuberculosis
Staphylococcus aureus (MRSA и VRSA)
в. эпидемического паротита
генетически модифицированные организмы
Биологические агенты, которые могут вызывать серьёзные или потенциально летальные заболевания в результате ингаляционного заражения, в отношении которых существуют вакцины и способы лечения.
Боксы безопасности 2 класса
в. венесуэльского лошадиного энцефаломиелита
в. жёлтой лихорадки
в. лихорадки долины Рифт
в. лихорадки Западного Нила
в. лихорадки Пятнистых гор
в. натуральной оспы
Plasmodium falciparum Trypanosoma cruzi
Опасные и экзотические агенты, вызывающие тяжёлые заболевания, в отношении которых не разработаны вакцины и способы лечения.
вирусы геморрагических лихорадок (в. крымской геморрагической лихорадки (вирус Конго), в. Ласса,
в. лихорадки Денге,
в. Марбург, в. Мачупо,
в. Хунин, в. Эбола,
В Республике Беларусь и России по степени опасности для человека и окружающей среды также выделено 4 группы возбудителей инфекционных заболевани, однако, наоборот, более низкий номер группы означает возрастающий риск при выполнении лабораторных исследований.
I группа – возбудители ООИ: чумы, натуральной оспы, геморрагических лихорадок (Ласса, Эбола и др.).
II группа – возбудители высококонтагиозных бактериальных, грибковых и вирусных инфекций: сибирской язвы, бруцеллеза, туляремии, холеры, сыпного тифа, бластомикоза, бешенства, СПИДа, гепатитов В и С и др., ботулотоксины и столбнячный токсин.
III группа – возбудители других инфекций: коклюша, столбняка, ботулизма, туберкулёза, трихомониаза, малярии, лейшманиоза, гриппа, полиомиелита, герпесвирусы и др.
IV группа – условно-патогенные (возбудители газовой гангрены, клебсиеллы, стафилококки, стрептококки, синегнойная палочка, некоторые кандиды и аспергиллы, амебиаза, аденовирусы, ротавирусы, энтеровирусы и др.) и непатогенные микроорганизмы.
Аттенуированные штаммы возбудителей I–II групп относятся к микроорганизмам III группы патогенности, а аттенуированные штаммы III–IV групп – к IV группе патогенности.
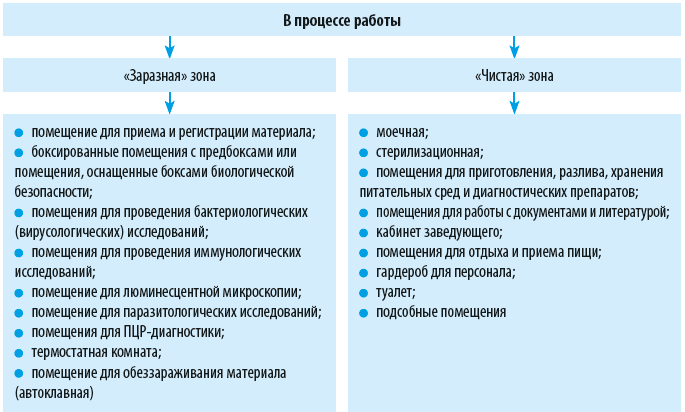
Работа с материалом, содержащим микроорганизмы I–II групп патогенности, требует соблюдения строгих мер безопасности для предупреждения случаев внутрилабораторного заражения, выноса инфекции за пределы лаборатории и предупреждения контаминации окружающей среды, поэтому исследования проводятся в специально оборудованных режимных микробиологических лабораториях специально обученным и вакцинированным персоналом (если существуют вакцины).
В зависимости от выполняемых исследований, микробиологические лаборатории подразделяют на диагностические, производственные и научно-исследовательские. В соответствии с типами микроорганизмов, изучаемых в микробиологических лабораториях, выделяют бактериологические, вирусологические, микологические и протозоологические лаборатории.
В зависимости от уровня безопасности работы с микроорганизмами микробиологические лаборатории подразделяют на четыре группы риска.
I группа – лаборатории особого режима (максимально изолированные) с высоким индивидуальным и общественным риском.
II группа – режимные лаборатории (изолированные) с высоким индивидуальным и низким общественным риском.
III группа – базовые (основные) лаборатории с умеренным индивидуальным и ограниченным общественным риском.
IV группа – базовые (основные) лаборатории с низким индивидуальным и общественным риском.
На практических занятиях студенты работают с микроорганизмами IV группы патогенности. Учебный практикум кафедры микробиологии считается учебной микробиологической лабораторией, где необходимо соблюдать следующие правила:
1. В помещение бактериологической лаборатории нельзя входить без специальной одежды - медицинского халата и шапочки, запрещается приносить в практикум верхнюю одежду. Запрещается посещение студентов, работающих в лаборатории, посторонними лицами. Каждый студент должен работать на закреплённом за ним рабочем месте. Во время работы в лаборатории следует соблюдать тишину, порядок и чистоту.
2. В помещении бактериологической лаборатории категорически запрещается принимать пищу, курить, использовать косметические средства. Ежедневная тщательная уборка помещения производится влажным путём с применением дезинфицирующих жидкостей.
3. В каждой группе назначается постоянный дежурный студент, который осуществляет контроль за поддержанием чистоты и порядка студентами группы на рабочих местах.
4. Всё необходимое для работы на занятии (чашки, пробирки, пипетки, бактериальные петли) студенты берут на специальном столе, туда же ставится выполненная на занятии работа. Пробирки и чашки с инфицированным материалом обязательно подписывают (характер материала, название культуры, дата, № группы, ф. и. о. исследователя). После окончания работы рабочее место должно быть приведено в полный порядок.
5. Перед выполнением работ и после завершения необходимо вымыть руки с мылом. Весь материал, поступающий в лабораторию, должен рассматриваться как инфицированный.
Работа с биоматериалами проводится в резиновых перчатках. Запрещается прикасаться к биоматериалу и микробным культурам руками.
Если контакт с кровью или другими биологическими жидкостями произошел с нарушением целостности кожных покровов (укол, порез), пострадавший должен:
– снять перчатки рабочей поверхностью внутрь;
– выдавить кровь из раны;
– обработать повреждённое место (70% спиртом, или 5% йодом, или 3% раствором перекиси водорода, или другим разрешенным антисептиком);
– руки вымыть под проточной водой с мылом;
– на рану наложить пластырь;
– при необходимости продолжить работу, надев новые перчатки.
При отсасывании жидкого материала необходимо пользоваться резиновыми грушами, при этом пипетки должны быть закрыты ватными тампонами. Пипетирование ртом строго запрещено!
6. Посевы проводят у спиртовки, фламбируя при этом края пробирок, петли, шпатели!
Запрещается держать вблизи работающих спиртовок легковоспламеняющиеся материалы и вещества, оставлять без присмотра работающие спиртовки. Перед зажиганием спиртовки необходимо удостовериться, что её корпус исправен, фитиль выпущен на нужную высоту и распущен, а горловина и держатель фитиля сухие. Фитиль должен плотно входить в направляющую трубку держателя (иначе возможна вспышка паров внутри спиртовки и взрыв). Зажжённую спиртовку нельзя переносить с места на место, нельзя зажигать одну спиртовку от другой. Гасить спиртовку нужно, накрывая пламя фитиля колпачком, если это невозможно – залить водой. Задувать пламя запрещается.
7. При работе с биоматериалами необходимо пользоваться инструментами (петлями, шпателями, пинцетами, иглами). Инструменты, имевшие контакт с инфицированным материалом, фламбируются в пламени спиртовки, или полностью погружаются в емкости с дезраствором.
По окончании работы использованная стеклянная посуда и ватно-марлевые пробки сбрасывается в раздельные биксы. Ежедневно посуда, в которой содержался инфицированный материал, поступает в мойку после предварительной стерилизации автоклавированием.
8. Окрашивание препаратов проводится в специально отведённых местах. Отработанные предметные стёкла помещаются в эксикатор.
9. Микроскоп – точный оптический прибор, требующий строгого соблюдения правил работы с ним:
– поднимают конденсор до уровня предметного столика;
– регулируют яркость встроенного осветителя или освещают поле зрения при помощи зеркала (при малой освещенность используют вогнутое зеркало, при достаточной – плоское);
– на предметное стекло с окрашенным препаратом наносят каплю иммерсионного масла, в которую под контролем глаза осторожно погружают объектив;
– поднимая тубус, смотрят в окуляр и вначале макро-, а потом микровинтом устанавливают чёткое изображение объекта;
– по окончании работы поднимают тубус, снимают препарат, марлевой салфеткой удаляют иммерсионное масло с фронтальной линзы объектива;
– микроскоп ставят в шкаф.
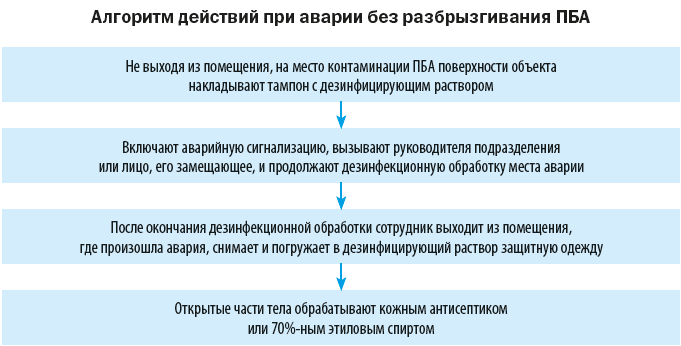
9. При аварии с посудой, содержащей инфицированный материал, или проливании жидкого инфицированного материала надо сообщить преподавателю. Немедленно проводится дезинфекция контаминированных поверхностей и предметов:
– осколки стекла помещают в бикс,
– на место аварии наносят дезраствор, время экспозиции 5–10 мин,
– затем дезраствор вытирают влагопоглощающей тканью.
Проводят антисептическую обработку контаминированных частей тела – мытьё с мылом.
10. При работе с электрооборудованием и электроприборами запрещается проверять наличие напряжения пальцами, переносить включённые приборы, находящиеся под напряжением, пользоваться неисправным элекрооборудованием и электропроводкой. При нарушении правил работы с электрооборудованием и электроприборами возможно поражение людей электрическим током и возникновение пожара.
11. В начале каждого семестра преподаватель проводит инструктаж по технике безопасности при работе с микробными культурами, биоматериалами, спиртовками и электроприборами. Инструктаж фиксируется в журнале личной подписью студента и заверяется подписью преподавателя.
ВНИМАНИЕ! С целью профилактики внутрибольничных инфекций запрещается посещение занятий на клинических базах в халате, в котором студент работал в микробиологической лаборатории!
Методические указания устанавливают методику проведения микробиологического количественного анализа концентрации клеток штамма Penicillium canescens PlPh33 - продуцента пектинлиазы и фитазы в воздухе рабочей зоны в диапазоне концентраций от 50 до 50 000 клеток в 1 м3 воздуха.
| Обозначение: | МУК 4.2.2234-07 |
| Название рус.: | Микробиологическое измерение концентрации клеток плесневого гриба Penicillium canescens PlPh33 - продуцента пектинлиазы и фитазы в воздухе рабочей зоны |
| Статус: | действует |
| Дата актуализации текста: | 05.05.2017 |
| Дата добавления в базу: | 01.09.2013 |
| Дата введения в действие: | 01.10.2007 |
| Утвержден: | 06.08.2007 Главный государственный санитарный врач Российской Федерации |
| Опубликован: | Роспотребнадзор (2010 г. ) |
| Ссылки для скачивания: |