Строение фага кишечной палочки
Действительно, полвека назад антибиотики победно распространились по миру. Тогда казалось, что уже не нужны никакие другие средства, в том числе и бактериофаги, раз существуют надежные антибиотики. Вот как написано об этом в Большой советской энциклопедии, вышедшей в семидесятые годы прошлого века: "Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось". Сегодня в разных изданиях можно прочесть обратное: антибиотики, спасшие миллионы и миллионы человеческих жизней, теряют свою силу. Болезни все более упорно им сопротивляются: каждое новое поколение микробов накапливает устойчивость к этого рода лекарствам, вырабатывая своеобразный иммунитет.
Не случайно в недавнем обращении Всемирной организации здравоохранения говорится, что прогресс в медицине будет сведен на нет, если не удастся найти лекарства, способные справиться с самыми устойчивыми носителями болезней.
Науке известно примерно четыре тысячи антибиотиков, но лишь 60 из них широко применяются как лекарства. Три десятилетия назад, когда казалось, что с их помощью болезнетворные бактерии окончательно побеждены, дальнейший поиск природных антибиотиков шел уже не столь интенсивно. Правда, сегодня антибиотики создают и синтетическим путем - примером может служить синтезированный в последние годы "Линезолид", показавший себя с лучшей стороны при подавлении устойчивых бактерий. В частности, он уничтожает некоторые разновидности стафилококков - возбудителей воспалительно-гнойных заболеваний, против которых природные антибиотики бессильны.
И тем не менее надежных лекарственных средств для борьбы с такими видами микробов, как энтерококки и стафилококки, так и не найдено. По данным врачебной статистики, от этих возбудителей серьезных инфекционных заболеваний и в наши дни погибает немало людей: только в США ежегодно от них умирают 14 000 человек.
ВРАГ ТВОЕГО ВРАГА.
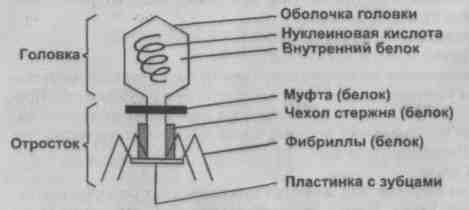
Помните пословицу: "Враг твоего врага - твой друг"? Если врагами человека считать болезнетворные микробы, то, оказывается, у каждого из видов бактерий есть свой враг - фаг (его еще называют вирусом бактерий, поскольку он на них паразитирует). Он атакует бактерию, прикрепляется к ней, прокалывает ее оболочку и впускает внутрь свой генетический материал - действует, как всем знакомый шприц. Однако изучение под микроскопом строения одной из разновидностей фага, известного в медицине как Т2 кишечной палочки, показало, насколько природная конструкция превосходит шприц, созданный инженерами. Первое. Шприц вводится в тело с помощью длинной иглы. Фаг самостоятельно прикрепляется к бактерии множеством нитей и острыми зубцами, находящимися на его конце. Там же, на конце, расположена так называемая базальная пластинка, обеспечивающая плотное примыкание фага к бактерии S. Второе. У фага нет поршня, как у шприца, с помощью которого выдавливалось бы его содержимое в тело бактерии. Это делают белковые нити, подобные мышечным волокнам: сокращаясь, как пружинки, они заставляют молекулы ДНК покидать тело фага. Все это устройство укладывается в миллионные доли миллиметра.
Форма фагов очень разнообразна - округлые, палочковидные, нитеподобные. Типичный фаг напоминает головастика. Но всех их объединяет суть воздействия на бактерию: ДНК фага, оказавшись в бактериальной клетке, подавляет ее ДНК. Происходит разрушение организма микроба, и из этих обломков фаг строит по плану, заложенному в его ДНК, свое потомство. Цикл размножения фагов внутри бактерии длится 30-40 минут. Таким образом умерший микроорганизм превращается в фабрику, производящую фаги, и на месте возбудителя болезни возникает сотня защитников заболевшего организма. Их присутствие в крови человека совершенно безвредно.
Микробиология познакомилась с фагами в конце XIX века. В 1898 году русский ученый Н. Ф. Гамалея открыл вещества, вызывающие разрушение бактерий, - бактериолизины. Он и его сотрудники ставили опыты с носителями "сибирской язвы". Несомненно, Н. Ф. Гамалея имел дело с лизисом - распадом бактерий при действии на них веществ, содержащихся в цитоплазме бактериофага. Но у ученого тогда не было технического оснащения для детального раскрытия этого явления.
Во времена Первой мировой войны канадскому исследователю Ф. Д'Эрелле и англичанину Ф. Туорту впервые удалось увидеть под микроскопом бактериофаги. Но детально изучать этих обитателей невидимого мира тогдашними методами было практически невозможно. Однако главную их особенность - "пожирать", а вернее - разрушать бактерии, ученые заметили. Именно поэтому в публикации об открытии Д'Эрелле дал им название "бактериофаги" - пожиратели бактерий. К тому же времени относятся и первые попытки применить их в медицине.
Применение фагов в качестве лекарств врачи встретили с большим интересом. В тридцатых годах прошлого века американский концерн "Эли Лилли" основал даже клинику, где начали лечить фагами. Пропагандисты нового метода сулили исцеление от всех болезней. Однако действительность оставляла желать лучшего: научные основы такой терапии были еще так скудны, что новое средство применяли практически вслепую. Считалось, что все фаги одинаковы и побеждают любую бактерию. Одним и тем же бактериофагом начинали лечить разные заболевания, а болезнь все не уходила - так метод был серьезно скомпрометирован. Мнение о малой эффективности фагов задержалось в кругах медиков на многие годы, живет оно еще и сегодня.
КАВКАЗСКАЯ НИТЬ ИССЛЕДОВАНИЯ
В годы Первой мировой войны врачом на Трапезундский фронт (северо-восток Турции) попал грузинский биолог Г. Элиава. До него дошла информация об открытии Ф. Д'Эрелле, и он увлекся возможностями бактериофага как мощного оружия медицины. Г. Элиава и Ф. Д'Эрелле встречались после войны и вместе отстаивали взгляд на бактериофаг как на живое существо. Им противостояли сторонники неживой, кристаллический природы этих обитателей микромира - к неживым они относили и все вирусы. Этот спор ученых имел принципиальное, мировоззренческое значение. В нем решался вопрос: где наука должна провести границу между живой и неживой материей?
В 1923 году Г. Элиава основал в Тбилиси Институт для изучения бактериофагов, благодаря которому нить исследования этих микроорганизмов, оборвавшаяся в западных лабораториях, здесь, на Кавказе, протянулась до наших дней. Усилиями энтузиастов, работающих в институте и сегодня, многое прояснилось в биологии фагов. Теперь новейшими исследованиями подтверждено, что фаги, уничтожающие бактерии, ближе к живому миру, нежели к неживому. Установлено, что разновидность фагов в микромире огромна и каждый из них способен умерщвлять только определенные виды бактерий. Для большинства микробов найдены "свои" бактериофаги, в том числе и для возбудителей болезней, сопротивляющихся антибиотикам.
По сравнению с антибиотиками у фагов есть к тому же и определенные преимущества. Известно, что применение антибиотиков часто вызывает нежелательные побочные воздействия на организм человека, - иногда такие серьезные, как аллергия. Или другое осложнение: попадая в кишечник больного, антибиотики зачастую губят там всю микрофлору, вредную и полезную, тем самым открывая дорогу вредоносным микробам (недаром в последнее время такое распространение получил дисбактериоз). Фаги же убивают только определенные виды бактерий, не затрагивая жизнь нужной человеку микрофлоры.
Второе достоинство фагов. Их действия в организме точно укладываются в тот срок, который необходим для уничтожения вторгшейся в него инфекции. С антибиотиками сложнее: врач должен сам определять курс приема лекарства, что не всегда просто. А фаги делают это автоматически. Они размножаются в организме больного за счет материала, взятого из тела бактерии (см. схему), которая ими атакована. Если в крови растет число возбудителей болезни, то и растет число фагов. Когда же такие бактерии уничтожены, воспроизводство фагов прекращается само по себе.
С исследованиями, вот уже 70 лет ведущимися в тбилисском Институте имени Элиавы, сегодня знакомы и ученые на Западе. Американский микробиолог К. Мерилл в 1996 году ставил опыты на мышах, которым в лабораторных условиях вводилась смертельная доза салмонеллы - распространенного и опасного вида бактерий. С помощью фагов животные были спасены. Ученый и сегодня продолжает работать с фагами. В берлинском Институте имени Р. Коха в последние годы стали исследовать влияние фагов на ход излечения некоторых заболеваний внутренних органов человека. Руководитель этого направления Б. Аппель уверен, что именно фаги дадут "новую опору для лечения инфекционных болезней".
Результаты, накопленные за десятилетия усилиями 250 преданных делу специалистов, дают грузинским микробиологам возможность продолжать работу, несмотря на сложности нынешнего существования института: государство прекратило финансирование, оборудование частью изношено, частью уже бездействует, штат сотрудников сократился в несколько раз.
И тем не менее разработана композиция из пяти разновидностей штаммов фагов. Это "пожиратели" тех бактерий, которые, как правило, поселяются на обожженной коже. В отделениях больниц, где исцеляют ожоги, больше всего опасаются заражения обожженных мест стафилококками, что ведет к сепсису крови, который почти не поддается лечению. Теперь в Грузии создано лекарство "пирофаг" - надежный помощник именно в таких случаях. Оно составлено из смеси различных фагов. Гнойные раны, обработанные фаговым препаратом, излечиваются в течение 5-10 дней. Антибиотики, если и побеждают такие инфекции, то только в месячный срок.
В холодильниках института хранится целый арсенал фагов - 3000 штаммов, способных встать на защиту здоровья человека. Раньше, до раздела СССР, институт был Всесоюзным центром фаготерапии. Из больниц, клиник всей страны сюда присылали образцы бактерий, с которыми было сложно справиться, либо вовсе незнакомых врачам микробов. В институте подбирали для неизвестной инфекции фаг, способный подавить ее. Если в институтском собрании фагов такой вид не находился, начинался поиск его в природе. И теперь ученые продолжают изыскивать фаги для разных случаев. (Один из сотрудников с гордостью сказал: "Мы вылечили английского посла!") Продажа лекарств - главный доход, позволяющий институту работать дальше. Здесь не страшатся будущего и верят в то, что их усилия успешно послужат медицине.
В заключение - о появившейся недавно публикации исследователей из Рокфеллеровского университета в Нью-Йорке об успехах терапии с помощью фагов. Ученые нашли новый путь к уничтожению болезнетворных микробов. Главную роль в этом играет один из биологических катализаторов - лизин, получаемый из фагов. Лизин способен разрушать стенки клеток стафилококков, убивая тем не поддающуюся до сих пор стойкую бактерию. (К сожалению, американские ученые не вспомнили о работах русского ученого Н. Ф. Гамалеи, еще в конце XIX века открывшего свойство лизина разрушать бактерии, да и о многолетних работах тбилисского института.)
Как уже говорилось, бактериофаги проникают внутрь бациллы и из "деталей" погибшей бактерии строят новые фаги. Этому молодому поколению фагов лизин также нужен, чтобы разрушить оболочку бактерии и выйти из нее.
Новое, что отмечает работу ученых из Нью-Йорка, - они освободились от самого бактериофага, а действуют на носителя инфекции лишь лизином. Достаточно одной миллиардной части грамма этого вещества, чтобы в течение пяти секунд уничтожить культуру стафилококков. Мыши, которым ввели в кровь эти бактерии, через два часа после инъекции лизина были свободны от них. Исследователи надеются, что биокатализаторы помогут справиться даже с такими болезнями, как чума и туберкулез.
А совсем недавно журнале "Sсience" опубликовал статью об успешной работе биологов из Техаса под руководством доктора Инг-Нанг Вонга. Его словами и завершим статью: "Бактериофаги - поистине золотая жила для создания белковых антибиотиков".
Вопрос о том, что является носителем наследственных признаков – белки или ДНК – решался Многие биологи считали, что химическое строение ДНК слишком просто для хранения большого количества наследственных признаков, белки же, более сложно устроенные, казались более подходящим для этих целей материалом. Доказательства того, что генетическим материалом живых организмов является ДНК, были получены при изучении бактериофагов (или сокращенно фагов) – вирусов, поражающих бактериальные клетки.
В 1952 г. Альфред Херши и Марта Чейз провели блестящий эксперимент, доказав, что наследственным материалом бактериофага T2 является ни что иное, как ДНК.
Бактериофаг T2 – один из наиболее изученных фагов кишечной палочки (). Его ДНК заключена в белковую оболочку, образующую головку вирусной частицы. В состав белков вирусной оболочки входят две аминокислоты (метионин и цистеин), содержащие серу, которая отсутствует в ДНК. А вот 99 % всего фосфора бактериофага T2 заключено именно в молекуле ДНК.
Херши и Чейз размножали фага T2 на бактериях , которые культивировались на питательной среде, содержащей радиоактивные изотопы 35 S и 32 P. Таким образом, белковая оболочка фага метилась изотопом 35 S, а ДНК фага – изотопом 32 P. Это позволило проследить пути белка и ДНК при инфицировании клеток .
Херши и Чейз готовили суспензию фаговых частиц, а затем смешивали ее с культурой живых бактерий в полужидком агаре, содержащем сульфат кальция (CaSO4) с изотопом 35 S и диводородфосфат калия (KH2PO4) с изотопом 32 P. Полученная смесь выливалась в чашку Петри с твердой питательной средой, на которой она застывала. После инкубации бактерии размножались, образуя в чашке Петри сплошной слой клеток (т. н. газон), хорошо заметный невооруженным глазом. В местах, куда попали частицы фага, образовались небольшие проплешины, или бляшки. Их количество соответствовало количеству фаговых частиц, изначально попавших в бактериальную культуру.
После этого, Херши и Чейз заражали фагами, помеченными изотопами 35 S и 32 P, свежую бактериальную культуру, содержащуюся на агаре без радиоактивных меток. Годом раньше Андерсон исследовал процесс заражения клетки фагами под электронным микроскопом, и показал, что фаги прикрепляются к клетке, и если помешать фагам прикрепиться, заражения не будет. Херши и Чейз предположили, что белковая оболочка фага остается вне клетки, а внутрь клетки проникает ДНК.
 |
 |