Клонорхоз и описторхоз в чем разница
Описторхоз и клонорхоз – это термины, которые используют в медицине, чтобы обозначить состояния людей, зараженных определенной разновидностью паразитов.
Возбудителями инфекций могут быть три типа паразитов:
- Clonorchis sinensis (клонорхис синенсис, двуустка китайская). Этот паразит вызывает клонорхоз. Он распространен в восточных регионах России, Китае, Южной Корее, Тайване и в некоторых регионах Вьетнама.
- Opisthorchis viverrini (описторхис виверини, беличья двуустка). Этот паразит вызывает описторхоз. Он распространен в Тайланде и Лаосе.
- Opisthorchis felineus (описторхис фелинеус, кошачья двуустка, сибирский сосальщик). Этот паразит вызывает описторхоз. Он распространен в России, в странах постсоветского пространства, странах восточной и западной Европы.
По некоторым оценкам, в Сибири, на Дальнем Востоке и в Китае описторхозом заражено более 35 миллионов людей. В тех местах, где люди живут возле рек и часто употребляют в пищу сырую или недостаточно приготовленную рыбу, описторхозом заражено до 75% всего населения.
Заразиться этими паразитами можно при употреблении сырой, полусырой, или недоготовленной рыбы, которая заражена микроскопическими 
личинками (цистами) этих паразитов.
Чаще всего люди заражаются от рыб из семейства карповых: карп, карась, вобла, лещ, линь, язь, чехонь, елец, плотва, пескарь, гольян, жерех, чебак и др.
Многие думают, что безопасно есть сырую морскую рыбу, однако, это не так. Да, в ней не будет описторхов, но могут быть другие паразиты. Подумайте несколько раз перед тем, как попробовать подозрительно приготовленную или полусырую рыбу, какой вкусной она бы не казалась.
Отличить зараженную рыбу от незараженной практически невозможно, ведь кисты этим паразитов нельзя заметить невооруженным глазом. Так что не стоит надеяться на то, что сможете визуально отличить здоровую рыбу.
В отличие от некоторых других видов глистов (например, остриц) описторхоз и клонорхоз не передается от человека к человеку.
Домашние животные могут заразиться этими паразитами, но человеку их не передадут, так как личинки должны пройти несколько стадий развития в организме у водяных рыб и улиток.
Данные заболевания часто протекают бессимптомно или со слабовыраженными симптомами, на которые люди редко обращают внимание. Из-за этого медицинскую помощь они получают достаточно поздно, уже после возникновения осложнений.
Однако, есть признаки, на которые стоит обратить внимание. Через 2-4 недели после заражения паразитами, у человека может подняться температура, появятся боли в животе, слабость, боли в суставах, понос, тошнота, отеки на лице, увеличатся лимфатические узлы, появится зудящая сыпь на коже. В медицине похожие случаи болезни называют острым периодом описторхоза. Похожие симптомы могут наблюдаться также при заражении лямблиями и шистосомозом.
Проблема в том, что эти признаки часто списывают на проявление пищевого отравления или других заболеваний.
Данные заболевания опасны своими осложнениями, такими как:
- нефункционирующий желчный пузырь,
- холецистит,
- холангит,
- абсцесс печени,
- камни желчного пузыря.
Помните, что при малейшем подозрении или признаке заражения паразитами, нужно обязательно обратиться к врачу, чтобы сдать анализы и пройти лечение. Это поможет избежать осложнений и улучшит ваше самочувствие.
Для того чтобы выявить описторхоз врач может назначить вам анализ кала на яйца паразитов и анализ крови на антитела к этим паразитам.
В настоящий момент применяют медикаментозную терапию, которую назначает врач-терапевт, гастроэнтеролог, или инфекционист.
К сожалению, после лечения можно вновь заразиться паразитами, ведь наш организм не вырабатывает иммунитет против них, поэтому всегда помните о мерах профилактики.
- Не ешьте сырую или полусырую рыбу. Особенно опасны копченая, подкопченная, слабосоленая и маринованная рыба домашнего приготовления.
- Перед употреблением в пищу хорошо готовьте или замораживайте рыбу. Но замораживать надо тщательно: -35 C или ниже в течение 15 часов; -40 C или ниже в течение 2 часов.
Для того чтобы уничтожить кисты описторхоза, клонорхоза и других паразитов, пресноводную или морскую рыбу нужно прогреть (внутри кусков) до температуры не менее 63 C.
Дорогие читатели! Поздравляем вас с Новым годом! Желаем отличного настроения и самочувствия, творческих успехов, счастья и удачи. Будьте внимательны к своему здоровью!
Основные факты
- По меньшей мере, 56 миллионов человек в мире страдают от одной или более трематодных инфекций пищевого происхождения.
- Люди приобретают инфекцию в результате потребления сырой рыбы, ракообразных или овощей, содержащих личинки паразита.
- Трематодные инфекции пищевого происхождения наиболее распространены в Восточной Азии и Южной Америке.
- Трематодные инфекции пищевого происхождения приводят к тяжелым заболеваниям печени и легких.
- Для профилактики и лечения трематодных инфекций пищевого происхождения существуют безопасные и эффективные лекарства
- Предотвращение и обращение с пищевыми трематодами требует межсекторального сотрудничества в области взаимодействия человека и животных и экосистем.
Люди приобретают инфекцию в результате потребления сырой или плохо приготовленной пищи: рыбы, ракообразных и овощей, содержащих мельчайшие личинки паразита (см. таблицу 1).
Передача инфекции
Трематодные инфекции пищевого происхождения являются зоонозами, то есть в природе они передаются от позвоночных животных людям и наоборот. Однако прямая передача инфекции невозможна, так как соответствующие паразиты, являющиеся возбудителями инфекции, становятся инфекционными только после завершения сложного жизненного цикла, который обычно включает стадии развития в промежуточном хозяине, не являющемся человеком. Первым промежуточным хозяином во всех случаях является пресноводная улитка, а второй хозяин бывает разным — в случае клонорхоза и описторхоза это пресноводные рыбы, а в случае парагонимоза — ракообразные. Конечным хозяином всегда являются млекопитающие.
Люди приобретают инфекцию при потреблении в пищу второго промежуточного хозяина, инфицированного личинками паразита. В случае фасциолеза люди приобретают инфекцию при поглощении личинок вместе с водными растениями, к которым они прикреплены (для подробной информации см. таблицу 1).
| Болезнь | Возбудитель инфекции | Приобретается при потреблении | Естественные конечные хозяева инфекции |
| Клонорхоз | Clonorchis sinensis | Рыбы | Собаки и другие хищники, потребляющие в пищу рыбу |
| Описторхоз | Opisthorchis viverrini | Рыбы | Кошки и другие хищники, потребляющие в пищу рыбу |
| Фасциолез | Fasciola hepatica, F. gigantica | Водных растений | Овцы, крупный рогатый скот и другие травоядные |
| Парагонимоз | Paragonimus spp. | Ракообразных (крабов и раков) | Кошки, собаки и другие хищники, потребляющие в пищу ракообразных |
Эпидемиология
В 2005 г. более 56 миллионов человек в мире имели трематодную инфекцию пищевого происхождения, и более 7 000 человек умерли от нее.
Случаи трематодных инфекций пищевого происхождения зарегистрированы более чем в 70 странах мира; однако наиболее пораженными районами являются Восточная Азия и Южная Америка. В этих регионах трематодные инфекции пищевого происхождения представляют значительную проблему в области общественного здравоохранения.
Внутри стран передача инфекции часто ограничивается определенными районами и отражает поведенческие и экологические модели, такие как пищевые привычки людей, методы производства и приготовления пищи, а также распределение промежуточных хозяев. Информации об эпидемиологическом статусе трематодных инфекций пищевого происхождения в Африке крайне мало.
Экономическое воздействие трематодных инфекций пищевого происхождения значительно и связано, в основном, с тем, что расширяющееся производство аквакультур несет убытки в связи с ограничениями экспорта и снижением потребительского спроса.
Симптомы
Бремя для общественного здравоохранения, обусловленное трематодными инфекциями пищевого происхождения, в большей степени связано заболеваемостью, чем со смертностью.
Инфекции на ранних стадиях и в легкой форме часто остаются незамеченными, так как протекают бессимптомно или с незначительными симптомами. И, наоборот, при большом скоплении червей часто ощущается общее недомогание и могут быть сильные боли, особенно в области живота, и это случается чаще всего в случае фасциолеза.
Хронические инфекции неизменно связаны с тяжелым заболеванием. Симптомы, в основном, затрагивают конкретные органы в зависимости от конечной локализации взрослых червей в организме.
Клонорхоз и описторхоз: взрослые черви паразитируют в мелких желчных проток печени, вызывая воспаление и фиброз сопредельных тканей и, в конечном итоге, холангиокарциному, тяжелую и смертельную форму рака желчных протоков. C. Sinensis и O. viverrini, но не O. felineus, классифицируются как канцерогены.
Фасциолез: Взрослые черви паразитируют в более крупных желчных протоках и в желчном пузыре, где они вызывают воспаление, фиброз, непроходимость, колики и желтуху. Часто также развиваются фиброз печени и анемия.
Парагонимоз: Конечная локализация червей – ткани легких. Они вызывают симптомы, которые могут быть приняты за симптомы туберкулеза: хронический кашель с кровавой мокротой, боль в груди, диспноэ (одышку) и лихорадку. Возможна миграция червей. Наиболее тяжелой является локализация червей в головном мозге.
Профилактика и борьба
Борьба с трематодными инфекциями пищевого происхождения направлена на снижение риска инфицирования и на контроль вызванной инфекцией заболеваемости.
Для снижения риска инфицирования и, в то же время, для контроля заболеваемости рекомендуются принятие ветеринарных мер и соблюдение практических методик для обеспечения безопасности пищевых продуктов. ВОЗ рекомендует проводить превентивную химиотерапию и улучшать доступ к лечению с использованием безопасных и эффективных антигельминтных средств (препаратов, изгоняющих червей).
Лечение может быть предложено в рамках превентивной химиотерапии или ведения отдельных случаев заболевания. Превентивная химиотерапия включает подход, ориентированный на все население, при котором каждый человек в данном районе получает лекарства независимо от его инфекционного статуса. Этот подход применяется в районах с высоким уровнем заболеваемости.
Ведение отдельных случаев заболевания включает лечение людей с подтвержденной или предполагаемой инфекцией (см. таблицу 2). Этот подход применяется в районах, где наблюдается меньшая концентрация случаев заболевания, а также существуют медицинские учреждения, способные этим заниматься.
| Болезнь | Рекомендуемые лекарства и дозы | Рекомендуемая стратегия |
| Клонорхоз и описторхоз | Ведение отдельных случаев | |
| Празиквантел: 25 мг/кг три раза в день в течение 2-3 последовательных дней | Лечение всех подтвержденных случаев В эндемических зонах: лечение всех предполагаемых случаев | |
| Превентивная химиотерапия | ||
| Празиквантел: – 40 мг/кг однократно | В районах, где распространенность инфекции ≥ 20%, проводить лечение всех жителей каждые 12 месяцев В районах, где распространенность инфекции | |
| Фасциолез | Ведение отдельных случаев | |
| Триклабендазол: 10 мг/кг однократно (в случае неэффективности лечения доза может быть увеличена до 20 мг/кг) | Проводить лечение во всех подтвержденных случаях заболевания - В эндемичных районах: проводить диагностику во всех предполагаемых случаях заболевания | |
| Превентивная химиотерапия | ||
| Триклабендазол: 10 мг/кг однократно | В отдельных местностях, селениях или сообществах, где имеются кластеры случаев заболевания фасциолезом: проводить лечение всех детей школьного возраста (5-14 лет) или всех жителей каждые 12 месяцев | |
| Ведение отдельных случаев | ||
| Парагонимоз | Триклабендазол: - 2 х 10 мг/кг в течение одного дня или | Проводить лечение во всех подтвержденных случаях заболевания - В эндемичных районах: проводить лечение во всех предполагаемых случаях заболевания Превентивная химиотерапия: |
| Превентивная химиотерапия | ||
| Триклабендазол: 20 мг/кг однократно | В отдельных местностях, селениях или сообществах, где имеются кластеры случаев заболевания парагонимозом: проводить лечение всех жителей каждые 12 месяцев | |
Деятельность ВОЗ ВОЗ
Работа ВОЗ в отношении трематодных инфекций пищевого происхождения является составной частью интегрированного подхода к борьбе с забытыми тропическими болезнями и включает:
- разработку стратегических указаний и рекомендаций;
- поддержку в картографировании эндемичных стран;
- поддержку в проведении пилотных мероприятий и программ по борьбе с инфекцией в эндемичных странах;
- поддержку в проведении мониторинга и оценки осуществляемой деятельности;
- составление документации о бремени трематодных инфекций пищевого происхождения и о воздействии проводимых мероприятий.
ВОЗ работает над включением трематодных инфекций пищевого происхождения в свою основную стратегию превентивной химиотерапии и над обеспечением полного предотвращения их наихудших последствий (раковых заболеваний желчных протоков и других).
По сообщениям, в 2012 году лечение трематодных инфекций пищевого происхождения получили 608 285 человек, живущих в эндемичных странах. В 2013 году из-за задержек в осуществлении и смещения сроков проведения крупномасштабных мероприятий по лечению этот показатель снизился до 287 590 человек.
Дата последнего пересмотра: 10.12.2013
Объем: 11 страниц За одну страницу принят объем текста приблизительно равный объему одной книжной страницы.
Эта статья написана в соответствии с нашим видением относительно роли, которую объективная информация может играть в принятии личных медицинских решений. Узнайте больше о процессе написания статей и об авторах.
В тексте статьи не содержится скрытая реклама. Смотрите Раскрытие финансовой информации.
(Новая функция) Укажите, насколько вы довольны тем, что нашли эту статью и/или оставьте ваш отзыв.
В организме рыб личинки двуусток мигрируют в мышцы и под чешую, где они покрываются защитной оболочкой, образуя микроскопические цисты.
Следующая стадия развития двуусток начинается, когда рыбу, зараженную личинками описторхоза, съедает человек, дикие или домашние животные (включая собак и кошек).
У них в организме эти личинки мигрируют в желчевыводящие пути в печени, где они превращаются во взрослых червей и начинают откладывать яйца. Яйца выделяются наружу с калом зараженных людей или животных и могут начать новый цикл развития после того как их снова проглотят улитки.
Откуда берутся описторхоз и клонорхоз? Как человек может заразиться ими? В какой рыбе есть эти паразиты?
Как мы уже говорили выше, взрослый человек или ребенок может заразиться описторхозом или клонорхозом, если съест недостаточно приготовленную или сырую рыбу, зараженную микроскопическими личинками (цистами) этих паразитов.
В желудке человека личинки сбрасывают защитную оболочку и мигрируют в тонкий кишечник. Из тонкого кишечника они проникают в желчевыводящие пути и поднимаются по ним в печень, в желчный пузырь или в поджелудочную железу, где они превращаются во взрослых червей. Взрослые черви могут сохраняться в организме человека в течение последующих нескольких десятков лет (до 30 лет).
Каждый взрослый червь ежедневно откладывает от 2000 до 4000 яиц. Яйца выводятся с током желчи в кишечник человека и, далее, с калом, наружу.
Основным источником заражения описторхозом и клонорхозом для человека являются рыбы из семейства карповых: обычный карп, карась, вобла, лещ, линь, язь, чехонь, елец, плотва, пескарь, гольян, жерех, чебак и др.
Многие люди спрашивают можно ли заразиться описторхозом и от другой пресноводной рыбы, например, от хищной рыбы (судака, окуня, щуки, налима) от осетровых и лососевых рыб?
Мы можем ответить на этот вопрос следующим образом: описторхоз может содержаться в любой пресноводной рыбе, которая водится в зонах, где есть улитки, зараженные этим паразитом и где регистрируются случаи заражения описторхозом.
Даже если бы пресноводные хищные рыбы и не могли бы быть носителями описторхоза, их мясо в любом случае нельзя бы было употреблять в сыром виде, так как кроме описторхоза они могут содержать некоторые другие виды паразитов, например, дифилоботриоз.
Морская рыба не может быть заражена описторхозом, но может быть заражена другими паразитами.
Таким образом, потенциально опасной в сыром виде следует считать любую рыбу.
Рыба, зараженная описторхозом или клонорхозом, может выглядеть совершенно нормальной. Кисты этих паразитов имеют очень маленькие размеры и их невозможно рассмотреть невооруженным глазом.
В отличие от некоторых других видов глистов (например, остриц) описторхоз не передается от человека к человеку.
Выше мы уже говорили, что описторхозом могут заразиться и домашние животные, включая кошек и собак. Это действительно так, однако, человек не может заразиться этими паразитами непосредственно от этих домашних животных. Для того чтобы личинки описторхоза стали заразными для человека они должны пройти несколько этапов развития в организме водяных улиток и рыб, как это описано выше.
Взрослые черви, вызывающие клонорхоз имеют удлиненную форму (напоминающую ивовый лист) и небольшие размеры: от 8 до 15 мм в длину, 1,5 – 4 мм в ширину и 1 мм в толщину.
Взрослые черви, вызывающие описторхоз имеют похожую форму и немного меньшие размеры.
Чем опасны описторхоз и клонорхоз? Какие последствия и осложнения они могут вызвать?
Как мы уже говорили выше, паразиты вызывающие описторхоз и клонорхоз мигрируют в печень человека, в желчевыводящие пути, в желчный пузырь и в поджелудочную железу и могут оставаться в этой области в течение многих лет.
В ходе научных исследований было установлено, что из-за продолжительного пребывания в них паразитов, желчевыводящие пути воспаляются, разрушаются, сужаются и в них образуются камни. Это может сильно нарушить работу печени и поджелудочной железы.
У некоторых людей вокруг взрослых двуусток в печени образуются нарывы (абсцессы). Без адекватного лечения такие нарывы могут привести к гибели заболевшего человека.
Одним из самых серьезных последствий описторхоза и клонорхоза может быть рак печени или желчевыводящих путей.
В ходе некоторых эпидемиологических исследований было установлено, что эти две (достаточно редкие) формы рака гораздо чаще развиваются у людей зараженных двуустками.
| Если вы предполагаете, что вы можете быть заражены описторхозом или клонорхозом – обязательно обратитесь к врачу, чтобы сдать анализы и пройти лечение. Это поможет вам избежать осложнений, которые эта инфекция может спровоцировать у вас в будущем. |
Какими симптомами и признаками могут проявляться описторхоз и клонорхоз?
Основная проблема описторхоза и клонорхоза заключается в том, что у большинства людей, зараженных этими паразитами нет никаких выраженных симптомов болезни или есть только симптомы, которые большинство людей не привыкло связывать с заражением глистами. По этой причине многие люди зараженные описторхозом и клонорхозом не знают, что заражены и никогда не обращаются к врачу по этому поводу.
Через 2-4 недели после заражения описторхозом у человека может подняться температура и могут появиться боли в животе, слабость, боли в суставах, понос, тошнота, отеки на лице, увеличение лимфатических узлов, появление зудящей сыпи на коже. В медицине похожие случаи болезни называют острым периодом описторхоза. Похожие симптомы могут наблюдаться также при заражении лямблиями и шистосомозом.
К сожалению, как мы уже говорили выше, многие люди, у которых появляются такие симптомы, не знают, что они могут быть связаны с глистами и списывают их на обычную простуду или пищевое отравление.
Клонорхоз проявляется похожими симптомами.
Какой врач лечит описторхоз и клонорхоз?
Если вы думаете, что вы или ваш ребенок можете быть заражены описторхозом или клонорхозом, обязательно обратитесь к врачу инфекционисту. Лучше всего обратиться к врачу, который специализируется в области лечения глистных инфекций.
Долгое время возбудитель описторхоза – широко распространенного паразитического заболевания, вызванного потреблением инфицированной рыбы, изучался главным образом медиками и паразитологами. Однако современные молекулярно-генетические методы в сочетании с биоинформационными подходами позволяют получить принципиально новые данные о биологии и структурно-функциональной организации генома этого паразита, в том числе определить молекулярные основы его патогенной и канцерогенной активности. Это открывает широкие перспективы для разработки новых методов профилактики и лечения описторхоза
Описторхоз – это тяжелое паразитическое заболевание, с очаговым характером распространения, которое вызывается печеночными сосальщиками. Эти паразитические трематоды (иначе – плоские черви) принадлежат к семейству Opishtorchiidae. Интерес к описторхозу не случаен – он продиктован высокой социальной значимостью этого заболевания для нашей страны, особенно для Западной Сибири.
Здесь, в Обь-Иртышском речном бассейне, еще в 1929 г. был обнаружен крупнейший природный очаг описторхоза. И за прошедшие десятилетия эпидемиологическая ситуация ничуть не улучшилась: по данным Роспотребнадзора, в 2010 г. в нижнем течении Иртыша и среднем течении Оби было заражено до 90—95 % сельского населения, в том числе дети дошкольного возраста. Показатели заболеваемости в разных населенных пунктах этого очага превышают общероссийские в 3—28 раз (О санитарно-эпидемиологической обстановке…, 2008 г.).
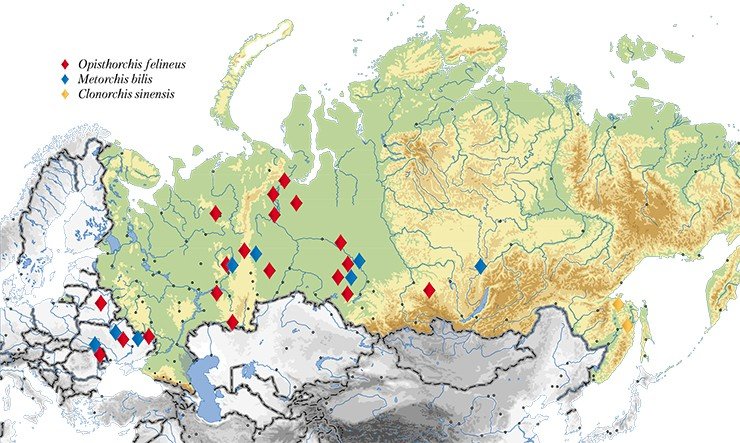
Учитывая широкую географию распространения паразита, для специалистов представляет несомненный интерес выяснить, существуют ли генетические различия, характеризующие популяции из разобщенных зон его ареала. Эти, с первого взгляда, сугубо теоретические исследования имеют и выраженный прикладной аспект. Поскольку именно генетические отличия между паразитами могут обусловливать такие значимые медицинские характеристики, как разнообразие клинических проявлений заболевания, разную вероятность формирования лекарственной устойчивости у паразита, а также его различную иммуногенность (способность вызывать наработку специфических антител). Все эти сведения будут полезны для прогнозирования течения заболевания и формирования иммунного ответа у зараженного человека, а также для разработки диагностических средств и создания вакцин.
Именно такое комплексное исследование проблемы описторхоза и его возбудителей проводится с 2005 г. в Институте цитологии и генетики СО РАН (Новосибирск). Работа по анализу популяционно-генетической структуры гельминтов началась с формирования уникальной коллекции описторхов из разных географических зон – Западной Сибири, европейской части России и Северного Казахстана. На сегодня в ней представлено около 300 образцов Opisthorchis felineus – основного возбудителя описторхоза в нашей стране, и около 300 других видов описторхид, включая эпидемиологически значимые.
Метод как основа
Для оценки генетического разнообразия гельминтов из разных мест обитания был использован метод сравнительного анализа геномных маркеров, в качестве которых выступают фрагменты ДНК. Этот метод, широко использующийся в современной молекулярной биологии, позволяет достаточно надежно судить о степени родства как отдельных индивидов, так и их групп. Поэтому его используют для определения близкородственных видов и реконструкции их эволюционной истории.
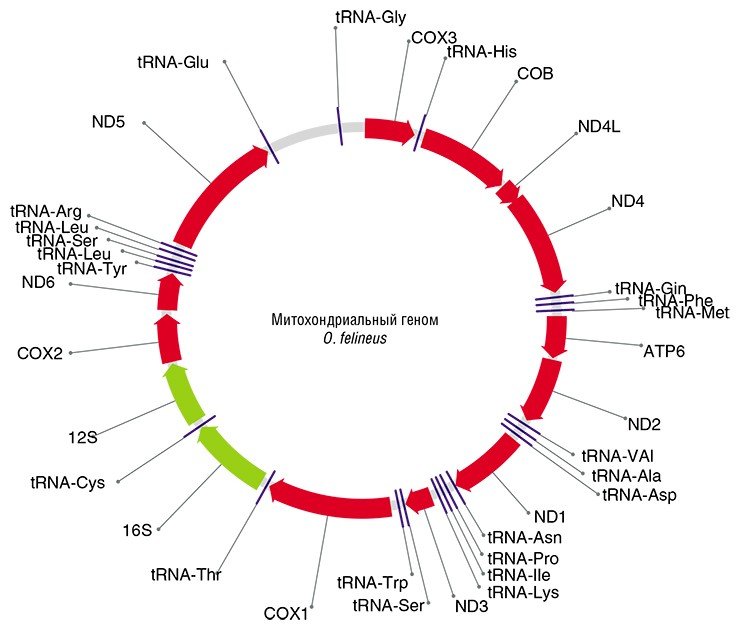
10 –8 —10 –12 на клетку за поколение. Поэтому в качестве геномных маркеров выбирают участки генома с высокой скоростью накопления мутаций, а это характерно для тех из них, которые по тем или иным причинам не попадают под действие отбора, т. е. селективно нейтральны.
Этому требованию отвечают не кодирующие белок последовательности ядерной ДНК, а также собственная ДНК клеточных органелл – митохондрий. Последняя наследуется строго по материнской линии с цитоплазмой яйцеклетки и не участвует в рекомбинационном процессе (обмене участками хромосом при клеточном делении). Скорость накопления нейтральных мутаций в митохондриальных генах в 5—10 раз выше, чем в генах ядерной ДНК.

Принято считать, что число накопленных однонуклеотидных замен в селективно нейтральных участках ДНК линейно зависит от времени. Следовательно, произведя подсчеты этих замен, можно получить приблизительную датировку эволюционных событий.
В результате было найдено восемь подходящих генетических маркеров, из них три (два митохондриальных и один ядерный) были выбраны для генотипирования коллекционных образцов описторхид. Нужно добавить, что хотя в последнее десятилетие аналогичные маркеры использовались при исследованиях популяционной структуры и филогеографии других паразитических трематод в Европе, Восточной и Юго-Восточной Азии, Африке, и Америке, исследования такого рода в отношении O. felineus ранее не проводились.
Последующая эволюционная история O. felineus, по-видимому, была весьма драматичной. Дело в том, что ранее было высказано предположение о существовании трех подвидов описторха – сибирского, казахского и восточно-европейского, обитающих соответственно в Обь-Иртышском и Енисейском, Нура-Сарысукском, Волжском, Донском и Уральском речных бассейнах (Беэр, 2005). Поэтому ожидалось, что коллекционные образцы из столь разнесенных в пространстве популяций продемонстрируют заметные генетические различия, поскольку экологически условия обитания также значительно разнятся. Но вопреки предположениям исследованные выборки описторхов характеризовались крайне низким генетическим разнообразием, в отличие от других уже изученных видов трематод (Брусенцов и др., неопубликованные данные).
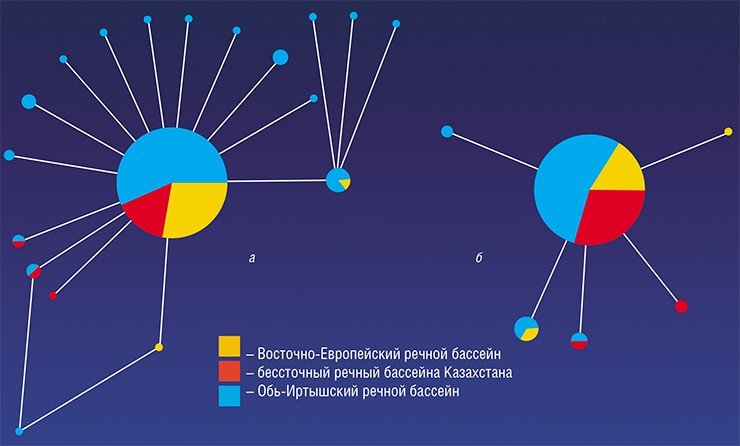
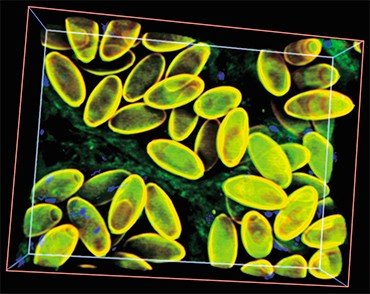
С наступлением потепления и формированием новых речных бассейнов последовало восстановление численности предковой популяции. Согласно расчетам, 21—25 тыс. лет назад в истории вида начался (и продолжается до сих пор) период демографического взрыва, которому, вероятно, в немалой степени способствовал факультативно гермафродитный способ размножения описторха.
К сожалению, проведенное исследование не дает возможности точно указать локализацию предковой популяции и проследить пути расселения паразита. Но, учитывая сложный жизненный цикл O. felineus, представляется очевидным, что направление и скорость его экспансии определялись миграционными способностями его хозяев. Тот факт, что описторхоз сегодня распространен только в некоторых географических зонах, во многом обусловлен средовыми предпочтениями его первого промежуточного хозяина – пресноводных моллюсков битиний, которые в морской воде погибают. Однако одним из окончательных хозяев описторха является человек, для которого географические изолирующие барьеры практически отсутствуют.
В одной пробирке
С помощью метода генетических маркеров удалось решить и актуальную медицинскую задачу точной видовой идентификации описторхид. Дело в том, что, наряду с описторхом, в России, а также в Казахстане и странах Восточной Европы встречается еще один эпидемиологически значимый вид – меторх (Мetorchis bilis). А на Дальнем Востоке – еще и клонорх (C. sinensis), о котором упоминалось выше, обычный для стран Юго-Восточной Азии.
Все эти трематоды вызывают заболевания с очень сходной клинической картиной, поэтому на основе одних лишь симптомов врач не может поставить точный диагноз. Под микроскопом же яйца этих гельминтов практически неразличимы между собой, так что результат микроскопического анализа фекалий или содержимого двенадцатиперстной кишки, взятого при дуоденальном зондировании, во многом зависит от квалификации лаборанта. Ситуацию усугубляет возможность одновременного заражения разными видами описторхид.
Сегодня наиболее точной является ДНК-диагностика трематодозов. За рубежом такие эффективные тест-системы начали интенсивно разрабатываться еще в 1990-е гг. Российские ученые начали подобную работу позже, но в последние годы и у нас, в частности в ИЦиГ СО РАН, активно идет процесс создания ПЦР-дигностикумов, с помощью которых можно выявлять в лабораторном материале генетические фрагменты, строго специфичные для определенного вида возбудителя. Поскольку метод позволяет использовать одновременно генетические маркеры на разных гельминтов, для точной диагностики паразитических агентов достаточно одного анализа.
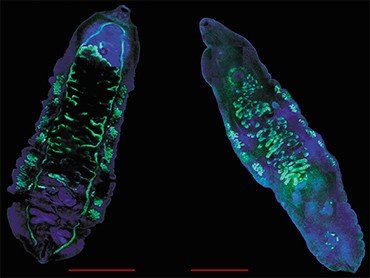
Установление вида паразита может иметь большое значение. Например, оно позволяет определить источник и место заражения. Но самое главное – возбудители описторхоза – меторхоза и клонорхоза различаются по ряду биологических характеристик, что может влиять на течение и прогноз заболевания, возникновение осложнений и степень чувствительности паразитов к лекарственным препаратам.
Так, недавно в эксперименте на золотистых хомячках было показано, что два вида описторхид – наш O. felineus и O. viverrini, встречающийся в странах Юго-Восточной Азии, различаются по агрессивности воздействия на организм хозяина (Lvova et al., 2012). Кстати сказать, в той же Юго-Восточной Азии помимо высокопатогенной O. viverrini широко распространена еще одна похожая трематода – Haplorchis taichui, заражение которой не вызывает тяжелого заболевания (Lovis et al., 2009). Этот пример показывает, насколько важна дифференциальная диагностика трематодозов для назначения адекватного лечения.
Кроме того, даже при низкой степени зараженности хроническая инвазия описторхидами может приводить к серьезным последствиям для здоровья. Однако, как правило, врачи бессильны обнаружить яйца описторхид в лабораторном материале таких пациентов с помощью обычной световой микроскопии, и диагноз зачастую ставится только посмертно (Müller et al., 2007). ПЦР-диагностика же является в этом случае гораздо более чувствительным методом.
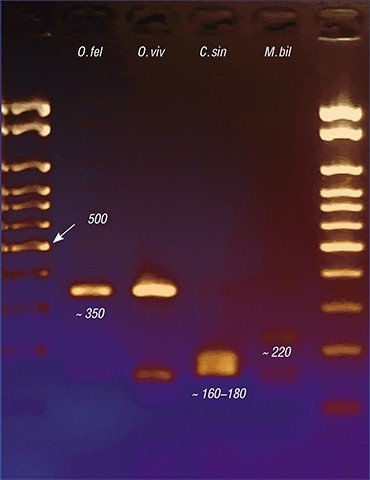
Итак, несмотря на свою драматическую эволюционную историю, паразитическая трематода O. felineus не только выжила, но, даже потеряв часть своего генофонда, сегодня является весьма процветающим видом с высокими адаптационными способностями, в том числе высокой инвазионностью – способностью внедряться в организм хозяина.
Разработанные новосибирскими учеными наборы для ПЦР-диагностики описторхоза прошли стадию лабораторных испытаний, сейчас завершается их тестирование на клиническом материале. С их помощью уже удалось успешно выявить у группы пациентов случаи смешанных трематодных инвазий (Brusentsov et al., 2010), что, несомненно, говорит о необходимости их включения в арсенал методов лабораторной диагностики описторхоза. Ведется разработка производственной технологии выпуска диагностикумов.
Повысить точность ИФА можно путем клонирования генов, кодирующих специфичные для описторха антигены. В ИЦиГ СО РАН уже получены такие генно-инженерные белки-антигены О.felineus, пригодные для создания диагностикумов нового поколения. Их можно использовать для детекции даже незначительного количества специфических антипаразитарных антител в сыворотке крови. Однако в медицинскую практику такие ИФА-диагностикумы поступят еще не скоро.
Внедрение новых диагностических технологий, несомненно, повлияет на качество лечения и продолжительность реабилитации пациентов. Этому есть много примеров, наиболее яркие из которых связаны с диагностикой бактериальных инфекций, перешедшей из чашек Петри в пробирки для ПЦР. Новые технологии не отменят традиционные, но позволят намного повысить чувствительность и точность анализов, особенно в сложных клинических случаях.
Юрлова Н. И. Обская болезнь описторхоз // Наука из первых рук. 2008. №2 (20). С. 12—21.
Пальцев А. И. Системному заболеванию – системный подход // Наука из первых рук. 2008. №2 (20). C. 22—27.
Колчанов Н. А., Мордвинов В. А. Паразитоз от А до Т // Наука из первых рук. 2008. №2 (20). C. 28—41.
Беэр С. А. Биология возбудителя описторхоза. КМК, 2005. 336 с.
Брусенцов И. И., Катохин А. В., Сахаровская З. В. и др. ДНК-диагностика микст-инвазий Opisthorchis felineus и Metorchis bilis с помощью метода ПЦР // Медицинская паразитология и паразитарные болезни. 2010. № 2. С.10—13.
Читайте также:


