Кишечная палочка это анаэроб
Информация
Добавить в ЗАКЛАДКИ| Поделиться: |
кишечная палочкаФаги кишечных палочек как более устойчивые, чем БГК.П, к ряду физико-химических воздействий рассматриваются как показатели энтеровирусного загрязнения водоемов. Наличие фагов кишечных палочек более 1000 БОЕ в 1 л свидетельствует о возможном присутствии в воде источников водоснабжения кишечных вирусов.[ . ] Наличие кишечных палочек само по себе безвредно, но оно ■свидетельствует о загрязнении воды хозяйственно-фекальными стоками и поэтому дает основание предполагать возможность заражения воды болезнетворными бактериями. Объем воды см3), в котором содержится одна кишечная палочка, называемая титром кишечной палочки (коли-титр). Титр кишечной палочки в питьевой воде должен быть не менее 300.[ . ] Преимущество кишечной палочки как показателя фекального загрязнения состоит в полном соответствии основным требованиям, предъявляемым к санитарно-показательному микроорганизму. Кишечная палочка постоянно обитает в кишечнике человека и теплокровных животных, в больших количествах выделяется в окружающую среду; ее выживаемость и устойчивость близка, но несколько превышает таковую патогенных кишечных бактерий. Как правило, кишечные палочки не размножаются до значительных количеств в воде в экспериментальных и натурных условиях. Описаны отдельные случаи размножения кишечных палочек в воде при благоприятной температуре и наличии большого количества легкоусвояемых органических веществ, при изменении естественного биоценоза водоема (в стерильной или обеззараженной воде), в присутствии некоторых химических веществ (например, алкилсульфата). Однако аналогичные условия способствуют более длительному выживанию и увеличению численности патогенных бактерий, в частности, сальмонелл (Е. А. Можаев и др., 1972). При этом кишечная палочка ведет себя так же, как и патогенные энтеробактерии, и сохраняет санитарно-показательное значение.[ . ] Примечание: (+) рост кишечной палочки на среде Эндо, кислоте и газообразование во второй бродильной пробе, (—) отсутствие роста на среде Эндо и отсутствие газообразования во второй бродильной пробе.[ . ] Согласно ГОСТ 2874-73 под кишечной палочкой следует понимать все разновидности граммотрицательных палочек, сбраживающих лактозу с образованием газа при 37°С в течение 27—48 ч или глюкозу при 37°С в течение 27 ч, и негативных по хромоксидазному тесту.[ . ] Наличие в исследуемой воде кишечной палочки и ее разновидностей определяется методом мембранных фильтров - или методом ¿родильных проб, предусмотренных ГОСТом 5216-50-55.[ . ]
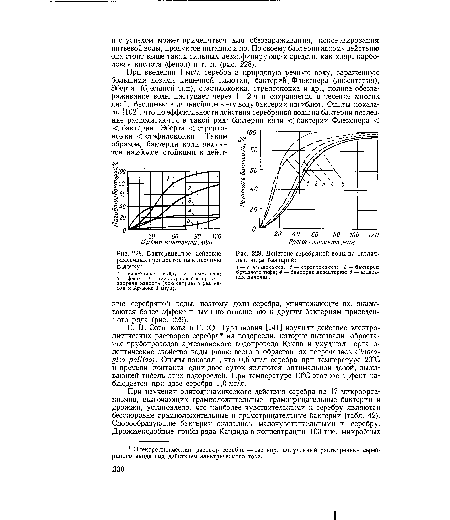
В случае более крупных бактерий кишечной палочки сильный эффект стерилизации достигается уже при относительно малых дозах ”0,3 кГр (рис. 3 [7]).[ . ] Коли-индекс показывает количество кишечных палочек (коли) в 1 мл воды. Коли-титр - это наименьшее количество воды, в котором обнаруживается хотя бы одна кишечная палочка. Многолетний опыт показал, что вода безопасна в эпидемическом отношении, если ее коли-индекс не выше 3.[ . ] Мнение бактериологов в отношении преимущества кишечных палочек нашло отражение в официальных нормативных документах, в последних изданиях которых нормируется именно этот показатель. Кишечные палочки являются основным критерием при оценке качества питьевой воды, воды источников водоснабжения, пресной и морской воды плавательных бассейнов, воды в районах морского водопользования, при определении эффективности очистки и обеззараживания сточных вод.[ . ] Изучение соотношения Е. coli и цитратположительных кишечных палочек в водоемах в летний период показало, что Е. coli очень быстро отмирала в сточных водах и при сбросе их в водоем составляла только 30% от числа лактозоположительных штаммов. В реках и особенно в вог дохранилищах Е. coli была редкой находкой. Обнаружение в этих же пробах воды сальмонелл и кишечных вирусов показало, что оценка качества воды водоемов тодько по Е. coli недостаточно надежна как с эпидемиологической точки зрения, так и в отношении фекального загрязнения. Более надежным тестом является учет всей группы кишечных палочек (Т. 3. Артемова и др., 1972).[ . ]
Одной из наиболее изученных бактерий рода Bacterium является кишечная палочка Bacterium coli (в ряде определителей описывается под другим названием — Escherichia coli). Эта палочка всегда содержится в кишечнике людей и животных. Поэтому обнаружение ее в воде и пищевых продуктах свидетельствует об их загрязнении. Некоторые штаммы (разновидности) Bacterium coli вызывают заболевания у людей.[ . ] Токоферол (витамин Е) при добавлении в элективные среды ускоряет рост кишечных, брюшнотифозных и дизентерийных бактерий. По данным Л. С. Корецкой с со-авт. (1960), время развития кишечной палочки на среде Эндо с витамином Е сокращается на треть.[ . ] Присутствие в воде патогенной микрофлоры оцён Р1 вается по наличию бактерий кишечной палочки (коли-J тест). Коли-тест позволяет определить зпидемиологиче-’ скую опасность воды, поскольку наряду с бактериями Coli в ней могут присутствовать возбудители брюшного тифа, паратифа, холеры и др. Наличие бактерий Coli в воде считается показателем фекальных загрязнений.[ . ] Вопрос доброкачественности питьевой воды решают путем определения количества кишечной палочки в 1 л воды. Кишечная палочка — это микроб, постоянно обитающий в кишечнике человека и животных и, следовательно, безвредный. Однако ее присутствие в воде свидетельствует о наличии в ней выделений людей или животных и о возможности загрязнения воды болезнетворными бактериями. Согласно нормам, в 1 л питьевой воды может содержаться не более трех бактерий группы кишечной палочки (БГКП). Это число называется коли-индексом воды; обратная величина, т! е. количество миллилитров воды, в котором находится одна кишечная палочка, называется коли-титром. Питьевая вода, безупречная в бактериальном отношении, должна иметь коли-титр не менее 333.[ . ] Минимальная токсическая концентрация нитрата уранила (на уран) составляла: для кишечной палочки 1,7—2,2 мг/л, для дафний 13 мг/л, для сине-зеленых водорослей — 22 мг/л и для простейших 28 мг/л 12. Для гольяна средняя смертельная концентрация в мягкой воде при длительности опыта 96 ч составляла: сульфата уранила — 2,8 мг/л, нитрата уранила — 3,1 мг/л, ацетата уранила — 3,7. мг/л; минимальная смертельная концентрация (на металл) составляет 11 мг/л при экспозиции 96 ч [8].[ . ] Особо важным показателем санитарного состояния водоема считают концентрацию в воде кишечной палочки (£. Coli), поскольку ее присутствие говорит о загрязненности воды фекальными стоками.[ . ] Таким образом, для очищенных водопроводных вод требуемое нашим стандартом количество кишечных палочек является вполне надежным показателем освобождения питьевой воды от патогенных микробов, и кишечная палочка, с этой точки зрения, может считаться не только косвенным, но и прямым бактериологическим индикатором на загрязнение питьевой воды.[ . ] Обнаружение яиц паразитических червей (гельминтов) человека и животных во внешней среде наряду с кишечной палочкой является прямым показателем ее фекального загрязнения и может служить критерием эффективности проводимых санитарных мероприятий.[ . ] Засеянные чашки помещают в термостат на 16—24 часа при температуре 37°С. При отсутствии роста колоний кишечной палочки дается окончательный отрицательный (—) ответ, и дальнейшее исследование прекращается.[ . ] Основными показателями загрязнения морской воды являются плавающие вещества, содержание бактерий и кишечной палочки; повышение окисляемости и ВПК сказывается в сравнительно небольшой степени, поэтому необходимость механической очистки и обезвреживания сточных вод в аналогичных условиях .можно считать доказанной.[ . ] Бактериологическое исследование сточных вод состоит в определении общего числа бактерий в 1 мл, числа кишечных палочек в 1 л (показателя фекального загрязнения) и характерной микрофлоры.[ . ] Наиболее признанным и распространенным во всем мире санитарно-показательным микроорганизмом является кишечная палочка, открытая в 1885 г. Escherich. Масе (1888) впервые предложил использовать кишечную палочку в качестве показателя фекального загрязнения воды.[ . ] Дополнительные сведения о происхождении загрязнения можно получить путем определения энтерококков и фагов кишечных палочек как более устойчивых к действию обеззараживающих агентов, нежели БГКП.[ . ] Показателями загрязненности воды служат коли-титр и коли-индекс. Наименьший объем воды в миллилитрах, содержащий одну кишечную палочку, называют коли-титром, количество кишечных палочек в 1 л воды — коли-индексом.[ . ] Кол и-т и т р - наименьшее количество грунта, почвы или воды (выраженное, соответственно, в г или мл), в котором обнаруживается кишечная палочка. Чем больше величина коли-титра данного грунта, тем чище грунт в отношении кишечной палочки (Escherichia coli). Его определяют бродильным методом, заключающимся в посеве определенных объемов исследуемого субстрата в среды накопления, которые выдерживают при 37 °С. В качестве сред накопления используют глюкозопептонную или лактозопептонную среду с индикатором. Затем из сред накопления делают высевы на среду Эндо с последующей идентификацией выросших колоний.[ . ] Присутствие в водопроводной воде болезнетворных бактерий является недопустимым. Показателем бактериального загрязнения могут служить кишечные палочки (бактерии коли), которые сравнительно легко обнаружить при анализе и которые попадают в воду тем «ли иным путем из кишечника животных и людей.[ . ] Вторичная бродильная проба позволяет установить, действительно ли выделенный на фуксин-сульфитной среде микроорганизм относится к группе кишечной палочки или он является непоказательным в санитарном отношении (кишечная палочка холоднокровных).[ . ] Токсичен для водных организмов: токсическая концентрация для водорослей сценедесмус 4 мг/л при 24 °С через 4 сут, для дафний—100 мг/л при 23 °С через 2 сут. На кишечную палочку не оказывает действия концентрация 1000 мг/л [2]. Пескари в хорошо аэрированной воде при 15°С, переносят концентрацию 70 мг/л, но погибают при 100 мг/л.[ . ] Нафтеновые кислоты обладают высокими дезинфицирующими свойствами по отношению к холерным вибрионам, стафилококкам, бактериям сибирской язвы, тифа и к кишечной палочке [18].[ . ] Наряду с нормативами, приведенными в табл. 34, Правила предусматривают, что в местах водозаборов плавательных бассейнов с морской водой количество бактерий группы кишечных палочек и энтерококков не должно превышать 100/л и 50/л соответственно. В местах массового купания дополнительным показателем загрязнения является содержание стафилококков в воде. Сигнальное значение для регламентации нагрузки на пляжи имеет количество стафилококков более 100/л. Коли-ин-декс морской воды на границе I и II поясов зоны санитарной охраны не должен превышать 1 млн.[ . ] Процесс синтеза белка является очень сложным многоступенчатым процессом. Совершается он в специальных органеллах — рибосомах. В клетке содержится большое количество рибосом. Например, у кишечной палочки их около 20 000.[ . ] Нитроанилины очень токсичны для людей и теплокровных животных 7. Минимальная средняя токсическая концентрация для рыб 24 мг/л 16, для дафний — 24 мг/л, для водорослей Сценедесмус — 20 мг/л, для кишечной палочки — более 100 мг/л [1].[ . ] Для рыб летальная концентрация хлорида тория—18 мг/л при экспозиции в 1 сут [1]. Нитрат тория оказывает губительное действие на водоросли Сценедесмус в концентрации 0,4—0,8 мг/л через 4 сут при 24 °С, на кишечную палочку — 0,8 мг/л, на простейших Микрорегма — 25 мг/л 2, на рыб — 18 мг/л 24.[ . ] Вызывает гибель гольяна при 200 мг/л через 26 ч, оказывает токсическое действие на рыб при 65,7 мг/л, водоросли сценедесмус погибают при 240 мг/л через 4 сут при 24 °С, дафнии при 88 мг/л через 2 сут при 23 °С, но кишечная палочка выживает при 1000 мг/л [2].[ . ] В чашку со средой Эндо вносят 1 мл воды из каждого разведения и распределяют равномерно шпаделем по поверхности среды. Посевы инкубируют при 43°С в течение 24 часов. Затем учитывают наличие на поверхности среды Эндо типичных для кишечной палочки колоний, без их подсчета. Наличие или отсутствие роста кишечной палочки отмечают в протоколе анализа соответствующим знаком (+ или —).[ . ] Так как в фекалиях человека термофилы присутствуют в очень незначительных количествах, обильное обнаружение их в почве при большом количестве коли-бактерий свидетельствует о загрязнении почвы навозом, а не фекалиями. Напротив, обилие кишечной палочки при малом числе термофилов — показатель фекального загрязнения.[ . ] В отдельных случаях производился высев проб воды на элективные среды: среду Чапека, сроду Красильникова и суо-ло-агар. Для анализа отбирали 1 и 10 мл воды, а в случае определения бактерий на среде Эндо - 333 мл.[ . ] Основными источниками микробиологического загрязнения являются сточные воды предприятий пищевой и кожевенной промышленности, бытовые и промышленные свалки, кладбища, канализационная сеть и др. Загрязняются почвы, горные породы, поверхностная и подземная гидросфера. Патогенные кишечные палочки обнаруживаются в подземных водах на глубине до 300 м от поверхности земли.[ . ] Согласно другому стандарту обязательным при контроле почвы санитарнозащитной зоны предприятия независимо от его профиля является определение pH почвы и содержания в ней канцерогенных и радиоактивных веществ, а из санитарно-бактериологических показателей - определение бактерий группы кишечной палочки и титра Clostridium perfringers. Ряд загрязняющих почву химических веществ подлежит определению только при наличии известного источника загрязнения - это аммонийный и нитратный азот, хлориды, пестициды, тяжелые металлы в валовых и подвижных формах, нефть и нефтепродукты, летучие фенолы, сернистые соединения, детергенты, мышьяк, цианиды, полихлоридные бифенилы.[ . ] Более надежными являются почвенные методы биологической очистки (на полях орошения и полях фильтрации), которые при условии нормальной нагрузки на поля обеспечивают высокий эффект (до 99,9%) бактериальной очистки. Работами С. Н. Черкинского и Л. Б. Доливо-Добровольского доказано, что патогенные бактерии кишечной группы обнаруживаются в очищенной воде даже тогда, когда кишечная палочка отмирает на 99%. Поэтому после механической и искусственной биологической очистки сточные воды до спуска их в водоем, безусловно, необходимо обеззараживать. В случаях почвенной очистки сточных вод на полях-орошения или полях фильтрации дезинфекция, как правило, не требуется.[ . ] При обнаружении в водопроводной воде бактериального загрязнения выше допустимых норм следует производить повторный отбор проб, в которых качественно устанавливают наличие или отсутствие показателей свежего фекального загрязнения. В качестве таких показателей в настоящее время приняты бактерии группы кишечных палочек (преимущественно E. coli), способных образовывать газ на лактозном бульоне с бриллиантовым зеленым при 44,5°С или с борной кислотой при 43°С (ГОСТ 18963-73).[ . ] Эффективность очистки воды была изучена при ее коагулировании и пропускании через контактный осветитель. Воду с исходной мутностью 4,5 мг/л коагулировали АЬОз в концентрации 6,75 мг/л; при мутности воды 35 мг/л доза коагулянта увеличивалась до 12,6 мг/л. При последующем пропускании воды через контактный осветлитель содержание фага в воде снижалось в среднем на 99,7%, содержание кишечной палочки — на 90% (при дозе 6,75 мг/л) и 99% (при дозах 11,6 и 12,6 мг/л) и содержание вируса — на 99%. В воде, взятой сразу у выхода из контактного осветлителя, содержание кишечной палочки снижалось менее значительно, чем содержание вируса полиомиелита. Таким образом, при данном методе обработки степень очистки воды от вируса и кишечной палочки можно считать одинаковой. Уменьшению содержания в воде микроорганизмов во всех случаях сопутствовало снижение мутности и цветности воды.[ . ] Исследование вирусной суспензии. Ни один из обнаруженных вирусов не может быть использован как имитатор всех типов вирусов [13, 14]. Однако бактериофаг E. coli Т объединяет многие типы вирусов, найденные в бытовых сточных водах, и его довольно легко определить (Т — является двадцатигранным фагом размером приблизительно 500—100 нм). Поэтому с ним и проводили эксперименты. Связь вирусов с кишечной палочкой зависит от типа и концентрации катионов в растворе.[ . ] При биологическом окислении идут окислительно-восстановительные реакции, сопровождающиеся отнятием атомов водорода от одних соединений (доноров) и передачей его другим (акцепторам), или реакции, связанные с переносом электронов от донора к акцептору. Эти процессы осуществляются при участии ферментов, относящихся к классу оксиредуктаз. Процессы дыхания, в которых акцептором водорода или электронов является молекулярный кислород, называются аэробными. Если же акцепторами будут другие неорганические или органические соединения, то такой тип дыхания называется анаэробным. По типу дыхания выделяют две группы микроорганизмов: аэробы (оксибиотические формы), которым для дыхания необходим кислород, и анаэробы (аноксибиотические формы), развивающиеся в отсутствие кислорода. Между ними нет резкого различия. Наряду со строгими (облигатными) аэробами и анаэробами есть микроорганизмы, которые могут жить в присутствии кислорода и без него. Это микроаэрофилы, оптимум содержания кислорода в воздухе для которых составляет 0,5—1%, и факультативные анаэробы. Так, кишечная палочка является факультативным анаэробом.[ . ] Мясо и мясные продукты во время хранения подвергаются порче в результате попадания и развития в них различных сапрофитных микроорганизмов. Видовой состав микроорганизмов весьма разнообразен: гнилостные бактерии, микрококки, молочнокислые, маслянокислые, уксуснокислые, пропионовокислые бактерии, плесневые грибы, дрожжи, актиномицеты. Наряду с сапрофитами в продуктах могут содержаться патогенные и условно-патогенные микроорганизмы — возбудители зооантропонозных болезней, пищевых токсикоинфекций и токсикозов. Гнилостные бактерии. Широко распространены в природе. Они встречаются в почве, воде, воздухе, на пищевых продуктах, а также в кишечнике человека и животных. Гнилостные бактерии вызывают распад белков, что может привести к возникновению различных пороков пищевых продуктов. К гнилостным бактериям относят аэробные спорообразующие и неспорообразующие палочки, спорообразующие анаэробы, факультативно-анаэробные неспорообразующие палочки. Аэробные спорообразующие палочки. Типичные представители — палочки цереус, грибовидная, капустная, картофельная и сенная. Палочка цереус (Вас. cereus) — это грамположительная палочка длиной 8 мкм, шириной 0,9–1,5 мкм, подвижная, образует споры. Отдельные штаммы этого микроорганизма могут формировать капсулу. Палочка может развиваться и при недостатке кислорода воздуха. На поверхности мясопептонного агара (МПА) вырастают крупные колонии с изрезанными краями, некоторые штаммы выделяют розово-коричневый пигмент; на кровяном агаре вокруг колоний наблюдается резко очерченная зона гемолиза. При развитии в мясопептонном бульоне (МПБ) микроб образует нежную пленку, пристеночное кольцо, равномерное помутнение и хлопьевидный осадок на дне пробирки. Все штаммы палочки цереус интенсивно растут при рН 9–9,5, а при рН 4,5–5 прекращают свое развитие. Микроб может развиваться при концентрации поваренной соли в среде 10–15 %, сахара — до 30–60 %. Оптимальная температура развития 30–32°С, максимальная 37–48, минимальная 10°С. Палочка цереус свертывает и пептонизирует молоко, быстро разжижает желатин, способна образовывать ацетилметилкарбинол, утилизировать цитратные соли, ферментировать мальтозу и сахарозу. Некоторые штаммы расщепляют лактозу, галактозу, дульцит, инулин, арабинозу, глицерин. Но ни один штамм не расщепляет маннита. Грибовидная палочка (Вас. mycoides) является разновидностью палочки цереус (иногда располагаются в виде цепочек), имеет длину 1,2–6, ширину 0,8 мкм, подвижна до начала спорообразования (признак характерен для всех гнилостных спорообразующих аэробов), образует споры, капсул не формирует, по Граму красится положительно (некоторые штаммы грамотрицательны). Грибовидная палочка — аэроб, на МПА вырастают корневидные колонии серо-белого цвета, напоминающие мицелий гриба. Некоторые штаммы этого микроба выделяют красный или розовато-коричневый пигмент. Грибовидная палочка в МПБ образует пленку и трудно разбивающийся осадок, бульон при этом остается прозрачным. Она интенсивно растет при рН 7–9,5. В кислой среде жизнедеятельность замедляется. Грибовидная палочка может развиваться при температуре от 10 до 45°С, оптимальная температура развития 30–32°С. Ферментативные свойства грибовидной палочки ярко выражены. Она свертывает и пептонизирует молоко, разжижает желатин, вызывает гемолиз эритроцитов и гидролиз крахмала. Ферментирует углеводы: глюкозу, сахарозу, лактозу, галактозу, дульцит, инулин, арабинозу, расщепляет глицерин, но не расщепляет маннита, не образует индола. Капустная палочка (Вас. megatherium) — это грамположительная палочка длиной 3,5–7 мкм и шириной 1,5–2 мкм. Она располагается одиночно, попарно или цепочками, подвижна, образует споры, капсул не формирует. На МПА вырастают колонии серо-белого цвета, гладкие, блестящие с ровными краями. Капустная палочка вызывает помутнение МПБ с образованием незначительного осадка. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 25–30°С. Палочка быстро разжижает желатин, свертывает и пептонизирует молоко, вызывает гемолиз эритроцитов, гидролиз крахмала. На средах с глюкозой и лактозой микроб дает кислую реакцию. При развитии капустной палочки выделяются сероводород, аммиак, но индола не образуется. Картофельная палочка (Вас. mesentencus) — это грубая грамположительная палочка с закругленными концами, длиной 1,6–6 и шириной 0,5–0,8 мкм, образует споры, капсул не формирует, подвижна. Картофельная палочка на МПА образует сочные, с морщинистой поверхностью слизистые колонии серо-белого цвета с волнистыми краями. Микроб разжижает желатин, свертывает и пептонизирует молоко, вызывает гидролиз крахмала, выделяет при развитии сероводород, индола не образует, не ферментирует глюкозы и лактозы. Сенная палочка (Вас. subtilis) — это грамположительная короткая палочка с закругленными концами длиной 3–5, шириной 0,6 мкм, иногда располагается цепочками, образует споры, капсул не образует, подвижна. На МПА вырастают сухие бугристые колонии серо-белого цвета. При росте в МПБ появляется сухая, морщинистая беловатая пленка; бульон сначала мутнеет, а затем становится прозрачным. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 37°С, но может развиваться и при 5–20°С. Палочка характеризуется высокой протеолитической активностью: разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, выделяет аммиак, иногда сероводород, но не образует индола, вызывает посинение лакмусового молока и гидролиз крахмала, разлагает глицерин, дает кислую реакцию на средах с лактозой, глюкозой, сахарозой. Аэробные неспорообразующие палочки. К этой группе микроорганизмов относятся чудесная, флуоресцирующая, синегнойная палочки. Чудесная палочка (Serratia marcescens) — это грамотрицательная, очень мелкая палочка (1×0,5 мкм), спор и капсул не образует, подвижна. На МПА вырастают мелкие, круглые (имеющие тенденцию к слиянию), ярко-красные, блестящие, сочные колонии. Температура 20–22°С наиболее благоприятна для образования пигмента. При росте в жидких средах палочка также образует красный пигмент, который нерастворим в воде, но растворим в хлороформе, спирте, эфире, бензоле. Палочка развивается при рН 6,5. Оптимальная температура роста 25°С, но может расти и при 20°С. Микроб разжижает желатин послойно, молоко свертывает и пептонизирует; образует аммиак, иногда сероводород и индол, глюкозы и лактозы не ферментирует. Флуоресцирующая палочка (Ps. fluorescens) — это грамотрицательная небольшая тонкая палочка длиной 1–2, шириной 0,6 мкм, спор и капсул не образует, подвижная. Микроб — строгий аэроб, но встречаются штаммы, которые могут развиваться и при недостатке кислорода. При развитии на МПА вырастают сочные, блестящие колонии, имеющие тенденцию к слиянию и образованию зеленовато-желтого пигмента, растворимого в воде. При росте в жидких питательных средах микроб также образует пигмент, иногда на поверхности появляется пленка. Микроб чувствителен к кислой реакции среды, оптимальная температура развития 25°С, но может развиваться и при 5–8°С. Флуоресцирующие бактерии характеризуются высокой ферментативной активностью: разжижают желатин и свернутую кровяную сыворотку, свертывают и пептонизируют молоко; большинство их штаммов способны расщеплять клетчатку и крахмал. При развитии они образуют сероводород и аммиак, не выделяют индола, глюкозы и лактозы не ферментируют. Бактерии вызывают посинение лакмусового молока. Многие штаммы флуоресцирующих бактерий продуцируют ферменты липазу, лецитиназу; дают положительную реакцию на каталазу, цитохромоксидазу, оксидазу. Флуоресцирующие бактерии — сильные аммонификаторы. Синегнойная палочка (Ps. aeruginosa) — это грамотрицательная небольшая палочка длиной 2–3, толщиной 0,6 мкм, спор и капсул не формирует, подвижная. На МПА вырастают расплывчатые, непрозрачные, окрашенные в зеленовато-синий или бирюзово-синий цвет колонии. Цвет колоний обусловлен образованием пигментов (желтого — флуоресцина и голубого — пиоцианина). Микроб вызывает помутнение МПБ и выделяет пигменты, иногда на поверхности среды появляется пленка. Пигменты растворимы в хлороформе. Как и все гнилостные бактерии, синегнойная палочка чувствительна к кислой реакции среды, оптимальная температура ее развития 37°С. Микроб быстро разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, вызывает посинение лакмусового молока, образует аммиак и сероводород, но не выделяет индола. Синегнойная палочка обладает липолитической способностью. Она дает положительные реакции на каталазу, оксидазу, цитохромоксидазу (эти свойства присущи представителям рода псевдомонас). Некоторые штаммы микроорганизма расщепляют крахмал и клетчатку, но не ферментируют лактозы и сахарозы.Спорообразующие анаэробы. К спорообразующим анаэробам относят палочки пугрификус и спорогенес. Палочка путрификус (Cl. putrificus) — это грамположительная палочка длиной 7–9 и шириной 0,4–0,7 мкм, иногда формирует цепочки, образует довольно термоустойчивые споры, превышающие диаметр вегетативной формы, капсул не образует, подвижная. Колонии на МПА имеют вид клубка волос, непрозрачные, вязкие, при росте в МПБ вызывают его помутнение. Протеолитические свойства микроорганизма ярко выражены: разжижает желатин и кровяную сыворотку, свертывает и пептонизирует молоко. Палочка путрификус образует сероводород, аммиак, индол; вызывает почернение мозговой среды, на кровяном агаре вокруг колоний образуются зоны гемолиза; характеризуется липолитической активностью, но не обладает сахаролитическими свойствами. Палочка спорогенес (Cl. sporogenes) — это крупная палочка с закругленными концами длиной 3–7 и шириной 0,6–0,9 мкм. В мазках она располагается одиночно или формирует цепочки. Палочка спорогенес быстро образует споры, которые сохраняют жизнеспособность после 30-минутного нагревания на водяной бане, а также после 20-минутного выдерживания в автоклаве при 120°С, капсул не образует. Микроб подвижный, грамположительный. На МПА вырастают мелкие вначале прозрачные колонии, по мере старения культуры они становятся непрозрачными. Оптимальная температура роста микроорганизма 37°С, но может расти и при 50°С. Палочка спорогенес обладает очень сильной протеолитической активностью: вызывает гнилостный распад белков с образованием газов; разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко. Микроорганизм образует сероводород, разлагает с образованием кислоты и газа галактозу, мальтозу, декстрин, левулезу, маннит, сорбит, глицерин.Факультативно-анаэробные неспорообразующие палочки. К ним относят палочку протея обыкновенного (Proteus vulgaris) и кишечную палочку (Escherichia coli). Палочка протея обыкновенного (Рг. vulgaris) обладает полиморфностью, то есть может образовывать нити длиной 1;2–3 и шириной 0,5–0,6 мкм. Спор и капсул не формирует. Палочка обладает активной подвижностью (перитрихи), грамотрицательна. При посеве материала, содержащего палочку протея, в конденсационную воду свежескошенного агара (метод Шукевича) через несколько часов отмечается роение микроба, ползучий рост (Н-форма). Поверхность МПА покрывается тонкой нежной, прозрачной пленкой. Посев по методу Шукевича широко применяют в диагностических лабораториях при выделении палочки протея из объектов внешней среды и продуктов. Этот микроорганизм сбраживает глюкозу с образованием кислоты и газа, но не ферментирует лактозы и маннита. Расщепляет мочевину, разжижает желатин, выделяет сероводород, образует индол, сбраживает мальтозу. Кишечная палочка (Е. coli) — это короткая (длина 1–3, ширина 0,5–0,8 мкм), полиморфная, грамотрицательная, не образующая спор, подвижная палочка. Хорошо растет на простых питательных средах: на МПА — колонии прозрачные, с серовато-голубым отливом, легко сливающиеся между собой. В МПБ микроорганизм дает обильный рост при значительном помутнении среды, образует пристеночное кольцо, пленка на поверхности бульона обычно отсутствует. На плотной дифференциально-диагностической среде Эндо, содержащей лактозу, кишечная палочка образует плоские красные колонии с темным металлическим блеском. Не разжижает желатина, не дает роста на средах, содержащих лимонную кислоту или ее соли, свертывает молоко, расщепляет пептоны с образованием аминов, аммиака, сероводорода, индола, обладает высокой ферментативной активностью по отношению к лактозе, глюкозе и другим сахарам, а также спиртам.Грибы. В природе насчитывается более 100 тыс. видов грибов. В основном это сапрофиты. Плесневые грибы и многие виды дрожжей могут быть возбудителями пороков пищевых продуктов. Плесневые грибы. Они являются постоянными обитателями внешней среды, на поверхности субстрата образуют ползучие, стелющиеся, бархатистые, пушистые, войлокообразные колонии, которые сливаются в сплошной налет. Наиболее благоприятные условия для развития плесневых грибов — свободный доступ кислорода и кислая реакция среды. Они могут развиваться при влажности окружающей среды 10–15 %, рН 1,5–11, температуре до –11°С (из рода мукоровых), высоком осмотическом давлении, а отдельные виды плесневых грибов — при ограниченном доступе кислорода. Плесневые грибы обладают ферментативной активностью (протеолитической, липолитической и др.), вызывают глубокий распад белков и белковых веществ, разлагают жиры до жирных кислот и альдегидов. При их развитии на мясе происходит его ослизнение и плесневение, сопровождающиеся химическими превращениями, которые обусловливают изменение его запаха и вкуса. Снижается товарный вид мяса.Дрожжи. Это факультативные анаэробы, лучше развиваются в кислой среде, оптимальная температура роста 20–30°С, но многие из них способны развиваться и при -10°С. Вегетативные формы дрожжей погибают при 60–65°С, а споры — при 70–75°С. Дрожжи распространены во внешней среде, откуда попадают на продукты. Различные виды дрожжей сбраживают большинство углеводов (глюкозу, лактозу, сахарозу, декстрозу, мальтозу). Микроорганизмы рода микодерма (Mycoderma), не сбраживающие углеводов, получили название пленчатых дрожжей. Клетки пленчатых дрожжей имеют вытянутую форму. Эти дрожжи широко распространены в природе, попадая на продукты, вызывают их порчу. Так, развиваясь на мясе, дрожжевые клетки используют молочную кислоту, изменяют рН мяса, а также портят его товарный вид. При расщеплении жиров образуются свободные жирные кислоты, что ведет к прогорканию продукта. Многие дрожжи обладают липолитической способностью. Гнилостной порчи эти микроорганизмы не вызывают, но в результате плесневения и ослизнения мяса сокращаются сроки его хранения в охлажденном и замороженном состоянии. Представителей рода дебариомицес (Debaryomyces) выделяют из мяса, колбас и других продуктов. Характерной особенностью этих дрожжей являются их способность развиваться в средах с 24 % NaCl и возможность использовать для жизнедеятельности белковые вещества мясных сред. Единичные клетки дрожжей могут остаться в консервируемом продукте при нарушении процесса тепловой обработки и обнаруживаться в готовых консервах.Актиномицеты. Большинство видов актиномицетов хорошо развиваются при 25–30°С, для патогенных видов температурный оптимум составляет 37–40°С. Актиномицеты широко распространены в природе — это одни из многочисленных гнилостных микроорганизмов. Они способны вызывать гниение белковых субстратов, гидролиз жира. Развиваясь на мясе при –2. –3°C , актиномицеты придают ему неприятный землистый запах.Микрококки. Семейство микрококкацее (Micrococcaceae) включает роды: микрококкус (Micrococcus), стафилококкус (Staphylococcus), capцина (Sarcina). Кокки этого семейства обычно имеют форму шара. Большинство представителей семейства микрококкацее — аэробы и факультативные анаэробы. Небольшое число видов относится к облигатным анаэробам. Микроорганизмы семейства микрококкацее широко распространены в природе. Наряду с сапрофитными обнаруживаются и патогенные виды, которые могут вызвать различные патологические процессы в организме человека и животного, а также быть причиной пищевых отравлений. Микрококки — строгие аэробы в отличие от стафилококков. На МПА образуют средней величины круглые белого, желтого или розового цвета колонии. Встречаются также различные оттенки от красного до оранжевого цвета. Большинство сапрофитов выделяют розовый и желтый пигменты. Оптимальная температура развития 20–25°С. Многие виды могут развиваться при 5–8°С. Отдельные штаммы микрококков могут выдерживать нагревание при 63–65°С в течение 30 мин и кратковременную пастеризацию. Микрококки характеризуются высокой устойчивостью к соли и сахару. Некоторые микрококки обладают устойчивостью к ионизирующему излучению. Микрококки относятся к пептонизирующим микроорганизмам. Некоторые виды разлагают жир и придают продукту прогорклый вкус.Молочные бактерии. Молочнокислые бактерии широко распространены в природе. В определенных условиях они могут вызвать порчу многих пищевых продуктов. По морфологическим признакам их делят на стрептококки и палочки. В каждой группе имеются гомо- и гетероферментативные бактерии Таблица. Номенклатура молочнокислых бактерий Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|