Гентамицин от кишечной палочки отзывы
СТАЙЛАБ предлагает тест-системы Gentamicin Plate Kit для анализа содержания гентамицина в молоке, меде и других продуктах, в том числе, предназначенных для детского питания.
| ||||||
Гентамицин – аминогликозидный антибиотик, продукт жизнедеятельности бактерии Micromonospora purpurea. Он является смесью нескольких веществ, среди которых основными являются гентамицины C1, C1A и C2. Этот антибиотик эффективен против различных видов кишечной палочки, сальмонелл и шигелл (возбудитель бактериальной дизентерии), стафилококков, стрептококков и многих других бактерий.
Гентамицин был открыт в 1963 году в лаборатории Корпорации Шеринг (Schering Corporation) в Блумингтоне, Нью-Джерси. Эта корпорация, в основном, исследовала стероиды и не занималась поиском новых антибиотиков. В 1957 году к организации присоединился исследователь Джордж Людеманн (George Luedemann), научный руководитель которого, Карпентер, исследовал почвенные микроорганизмы рода Micromonospora. Через год в компанию пришел еще один микробиолог из лаборатории Карпентера, Америко Войцежес (Americo Woyciesjes). Людеманн и Войцежес начали исследовать для компании различные виды Micromonospora. В течение нескольких лет они проанализировали продукты жизнедеятельности более 300 культур этих бактерий. 15 из них вырабатывали новые антибиотики. Самым важным из них оказалась смесь веществ, которую Войцежес хотел назвать рикомицином. Однако компания, получив патент на использование этого антибиотика, дала этой смеси название гентамицин и не указала в нем авторство Войцежеса. Надо сказать, что после этого Войцежес отсудил у корпорации большую сумму, которую он затем вложил в свою лабораторию.
В США гентамицин используется, в основном, в больницах для лечения тяжелых инфекций легких, костей, мочеполового тракта, а также и перитонитов. Гентамицин менее токсичен, чем стрептомицин, потому при необходимости его можно применять в терапии серьезных заболеваний у новорожденных детей. Этот антибиотик эффективно уничтожает бактерии, устойчивые к пенициллину. Даже небольшие дозы гентамицина действуют весьма эффективно.
Во многих странах, в том числе, и в России, гентамициновую мазь используют для лечения заболеваний глаз, ушей, а также для обеззараживания ран и ожогов. В норме он практически не всасывается в желудочно-кишечном тракте, но легко проникает в организм через поврежденную кожу. Если необходимо добиться системного действия гентамицина, его вводят внутримышечно или внутривенно.
В животноводстве и ветеринарии этот антибиотик применяют для лечения крупного и мелкого рогатого скота, лошадей и свиней, в том числе, их молодняка, а также собак и кошек. Гентамицин используют при возникновении сепсиса, перитонита, пиелонефрита, а также желудочно-кишечных, респираторных и кожных заболеваний.
Попав в организм, гентамицин достаточно быстро распространяется по нему. Наибольшие его концентрации создаются в печени, легких и почках, а также в различных жидкостях организма. В меньшей степени этот антибиотик обнаруживается в мышцах, костях, жировой ткани, молоке. Он способен преодолевать плацентарный барьер и действовать на плод.
При длительном введении гентамицин способен накапливаться в организме – в основном, во внутреннем ухе и в почках.
Основные побочные эффекты гентамицина – ототоксический и нефротоксический. В отличие от стрептомицина, этот антибиотик редко вызывает глухоту; однако лечение гентамицином или его длительное употребление может привести к снижению слуха, шуму в ушах и вестибулярным отклонениям. Нефротоксический эффект гентамицина проявляется достаточно часто (по некоторым данным, до 30% случаев) и может варьироваться от протеинуремии и воспалений почек до некрозов. Также он способен вызывать патологии крови, в том числе, анемию. У детей среди побочных эффектов гентамицина отмечали психозы. При местном применении для лечения болезней глаз гентамицин может вызвать повреждения сетчатки. Иногда отмечают случаи аллергии на это вещество.
Терапевтическая активность низких концентраций гентамицина хороша тем, что его можно использовать в малых дозах. Однако даже небольшое количество этого антибиотика может вызвать побочные эффекты. Поэтому его содержание в продуктах животного происхождения необходимо контролировать.
В Российской Федерации и странах Таможенного Союза "Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)" устанавливают максимально допустимую концентрацию гентамицина в мясе на уровне 0,05 мг/кг (50 мкг/кг), в молоке – 0,1 мг/л (100 мкг/л). Такие же нормы приняты в странах Евросоюза.
Для определения гентамицина в пробах удобно использовать иммуноферментный метод анализа, поскольку он позволяет быстро получить результат и обладает высокой чувствительностью. Тест-система Gentamicin Plate Kit позволяет анализировать содержание гентамицина в концентрациях от 0,19 мкг/кг.
МОСКВА, 7 мая — РИА Новости, Альфия Еникеева. Супербактерии, устойчивые к антибиотикам, — одна из главных проблем современной медицины. Возбудители гонореи, стафилококка, пневмококка мутировали, и теперь непонятно, как с ними бороться. Согласно прогнозам, особо стойкие инфекции угрожают миллионам жизней, поэтому перед наукой поставлена задача — разработать более мощные средства борьбы, а также альтернативу антибиотикам.

Обычная бактерия кишечной палочки Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков. Видео, снятое в ходе эксперимента учеными Гарвардской медицинской школы, показывает, как постепенное увеличение концентрации препарата превращает ее в супермикроб, неуязвимый для любых лекарств.
Вырабатывать антибиотики и уметь им сопротивляться — естественная стратегия выживания в мире бактерий. Но в природе стойкие к антибиотикам штаммы оказывались в проигрыше, поскольку размножались медленнее "диких" бактерий.
В начале XX века Александр Флеминг открыл антибактериальные свойства пенициллина, и с 1950-х годов антибиотики производятся в промышленных масштабах для медицины и животноводства. Так люди неожиданно помогли мутировавшим штаммам микробов победить в эволюционной борьбе и подставили себя под удар. В 2017 году Всемирная организация здравоохранения (ВОЗ) объявила о наступлении "постантибиотиковой эры" и обнародовала список особо стойких инфекций.
Откуда берутся супербактерии
Антибиотики действуют на наименее устойчивые бактерии, а вот мутировавшие держатся до последнего. И если с ними не бороться, они передают ген устойчивости при размножении. Кроме того, бактерии обмениваются мутациями.
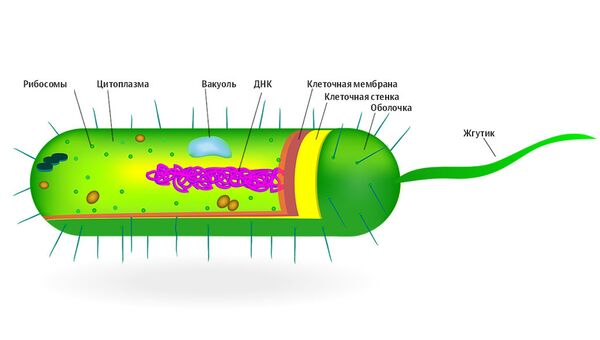
Такой супермикроб вырабатывает ферменты, разлагающие антибиотик. Его клеточная мембрана, по которой раньше лекарства наносили сокрушительный удар, теперь неуязвима. Некоторые супербактерии умеют обманывать антибиотики, выстраивая вокруг себя слой белков, мимикрирующих под рибосомы — внутриклеточные белковые фабрики. Препарат их уничтожает, настоящие же рибосомы продолжают функционировать, а бактерия — жить.
Три смертельно опасных мутанта
Из-за быстрой приспособляемости к антибиотикам супербактерии опаснее для человечества, чем климатические изменения или загрязнение окружающей среды. Уже сегодня, по данным ВОЗ, в мире от заболеваний, вызванных этими микробами, умирает примерно 800 тысяч человек в год. А к 2050-му, по прогнозам специалистов, суперинфекции ежегодно будут уносить до десяти миллионов жизней.
Три супербактерии признаны ВОЗ критически опасными для человека — они показали резистентность практически ко всем антибиотикам, даже к так называемым препаратам последнего резерва, колистину и бета-лактамным антибиотикам широкого спектра. Это акинетобактерия Баумана, приводящая к пневмонии и инфекциям крови, синегнойная палочка, вызывающая кожную сыпь, ушные инфекции у здоровых людей, серьезные кровяные инфекции, пневмонии у пациентов в больницах, а также энтеробактерии, населяющие кишечник человека, в частности сальмонелла и кишечная палочка.
Сильно опасными ВОЗ считает более распространенные золотистый стафилококк (Staphylococcus aureus), пневмококк (Klebsiella pneumoniae) и гонококк (Neisseria gonorrhoeae), вызывающий гонорею. Кстати, первый случай супергонореи, от которой не помогают антибиотики, недавно зафиксировали в Великобритании. Пациент, чье имя не раскрывают, заразился инфекцией после полового контакта с жительницей Юго-Восточной Азии.
Ученые также опасаются супербактерии туберкулеза, поскольку почти половина штаммов этого патогена устойчива к изониазиду и другим средствам противотуберкулезной терапии. Шестнадцать процентов штаммов не поддаются воздействию ни одного из имеющихся антибиотиков. Такие суперустойчивые туберкулезные палочки выявлены в Индии и Ираке.
Суперантибиотики против супербактерий
Для борьбы с супербактериями ученые создают новые антибиотики либо модифицируют существующие под генетические изменения в конкретных микроорганизмах. Именно этот путь выбрали исследователи МГУ, разработавшие принципиально новый гибридный антибиотик — митохондриально направленный антиоксидант, воздействующий на мембранный потенциал, который обеспечивает бактериальные клетки энергией.
Другой перспективный препарат создан на основе теиксобактина — антибиотика, открытого в 2015 году в образцах почвы. Совсем недавно ученые успешно применили его синтетическую форму для лечения бактериальной инфекции у лабораторных мышей. Предполагается, что это лекарство поможет в борьбе с метициллин-резистентным стафилококком и энтерококком, устойчивым к ванкомицину.
Помимо антибиотиков, ученые разрабатывают и совершенно новые классы препаратов. Так, исследователи из российско-американской лаборатории биомедицинской химии ИХБФМ СО РАН создали аналоги нуклеиновых кислот — фосфорилгуанидины, умеющие проникать в клетку и вступать во взаимодействие с ДНК и РНК, уничтожая бактерию. Ученые отмечают, что в будущем такие вещества можно будет создавать под каждый конкретный патоген на основе анализа его генома.
Еще один точечный метод — бактериофаги, то есть вирусы, поражающие бактериальные клетки. Совсем недавно команда ученых из ИБХ РАН, ИТЭБ РАН и ИБФМ имени Г. К. Скрябина РАН научила фермент бактериофага Т5 разрушать клеточные стенки бактерии кишечной палочки даже с утолщенной из-за мутаций мембраной. Кроме того, исследователи выяснили, что фермент эффективнее уничтожает бактерии, когда ему помогает агент (например, хлоргексидин в очень низких концентрациях).
Эксперты все же считают, что с супербактериями лучше бороться с помощью антибиотиков. Но необходимо ограничивать их свободную продажу в аптеках и применение в сельском хозяйстве — иначе даже новые высокоэффективные препараты не помогут.

Кишечная палочка (эшерихия коли, лат. Escherichia coli; общепринятое сокращение E. coli) — вид грамотрицательных палочковидных бактерий, факультативных анаэробов, входящий в состав нормальной микрофлоры желудочно-кишечного тракта человека.
Вид эшерихия коли (E. coli) включён в род эшерихии (лат. Escherichia), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Кишечные палочки (Escherichia coli) устойчивы во внешней среде, длительное время сохраняются в почве, воде, фекалиях. Хорошо переносят высушивание. Кишечные палочки обладают способностью к размножению в пищевых продуктах, особенно в молоке. Быстро погибают при кипячении и воздействии дезинфицирующих средств (хлорной извести, формалина, фенола, сулемы, едкого натра и др.). 
Кишечные палочки более устойчивы во внешней среде по сравнению с другими энтеробактериями. Прямой солнечный свет убивает их в течение нескольких минут, температура 60°С и 1 % раствор карболовой кислоты — в течение 15 минут.
Часть кишечных палочек имеет жгутики и подвижны. У других кишечных палочек жгутики и способность к движению отсутствуют.
Число кишечных палочек Escherichia coli среди других представителей микрофлоры кишечника не превышает 1%, но они играют важнейшую роль в функционировании желудочно-кишечного тракта. Кишечные палочки E. coli являются основными конкурентами условно-патогенной микрофлоры в отношении заселения ими кишечника. Кишечные палочки E.coli забирают из просвета кишечника кислород, который вреден для полезных для человека бифидо- и лактобактерий. Кишечные палочки E. coli вырабатывают ряд необходимых для человека витаминов: В1, В2, В3, В5, В6, биотин, В9, B12, К, жирные кислоты (уксусную, муравьиную, а ряд штаммов также молочную, янтарную и другие), участвует в обмене холестерина, билирубина, холина, желчных кислот, оказывает влияние на всасывание железа и кальция.
Escherichia coli в кишечнике человека появляются в первые дни после рождения и сохраняются на протяжении жизни на уровне 10 6 -10 8 КОЕ/г содержимого толстой кишки. В фекалиях здорового человека кишечные палочки (типичные) выявляются в количестве 10 7 -10 8 КОЕ/г, при этом количество лактозонегативных кишечных палочек не должно превышать 10 5 КОЕ/г, а гемолитические кишечные палочки должны отсутствовать.
Отклонения от указанных значений является признаком дисбактериоза:
- снижение типичных кишечных палочек до 10 5 -10 6 КОЕ/г, или повышение содержания типичных эшерихий до 10 9 -10 10 ; КОЕ/г определяется, как первая степень микробиологических нарушений
- повышение концентрации гемолитических кишечных палочек до 10 5 -10 7 КОЕ/г определяется, как вторая степень микробиологических нарушений
При избыточном росте кишечной палочки, как следствии дисбактериоза, кроме бактериофагов, при медикаментозной терапии применяются различные пробиотки (Бифидумбактерин, Лактобактерин, Ацилакт, Аципол и др.) и/или адекватные конкретному штамму e. coli и причине дисбактериоза антибиотики (у взрослых).
Патогенные серотипы кишечных палочек могут быть причиной эшерихиозов — различных инфекционных заболеваний, протекающих с интоксикацией, лихорадкой, обычно с поражением желудочно-кишечного тракта, реже — мочевыводящих, желчевыводящих путей, других органов или с развитием сепсиса. Эшерихиозы чаще встречаются у детей раннего возраста. Механизм распространения эшерихиозов ЖКТ — фекально-оральный. Чаще всего заражение происходит через загрязнённую пищу или воду.
Escherichia coli (кишечная палочка) — наиболее часто встречающийся возбудитель спонтанного бактериального перитонита — воспаления брюшной полости при отсутствие очевидного источника инфекции.
Энтеропатогенная кишечная палочка имеет два важных фактора вирулентности:
- фактор колонизации, за счет которых происходит прилипание ETEC к энтероцитам тонкой кишки
- токсический фактор: штаммы ETEC продуцируют термолабильные (LT) и/или термостабильные (ST) энтеротоксины, вызывающие секрецию сока и электролитов, что приводит к водянистой диарее. ETEC не разрушают кисточковую кайму и не внедряются в слизистую оболочку кишечника
Энтерогеморрагические кишечные палочки (EHEC) являются причиной геморрагического колита, а также тяжелого заболевания — гемолитико-уремического синдрома (микроангиопатической гемолитической анемии, сочетающейся с почечной недостаточностью; аббревиатура ГУС или HUS).
Для геморрагического колита характерно острое начало в виде сильных спастических болей в животе и водной диареи, которая вскоре становится кровавой. Лихорадка обычно отсутствует, но у некоторых температура тела может достигать 39 °С. В легких случаях геморрагический колит продолжается 7–10 дней. Приблизительно в 5 % случаев геморрагический колит осложняется геморрагическим синдромом, острой почечной недостаточностью и гемолитической анемией.
Источником инфекции мая 2011 года в Германии и других европейских странах являлся штамм продуцирующей шига-токсин STEC (синоним: продуцирующей веротоксин - VTEC) энтерогеморрагической кишечной палочки.

Заражение STEC или VTEC-кишечной палочкой происходит чаще всего через продукты питания или при близком контакте с больными людьми или животными. Для начала заболевания достаточно небольшого числа STEC/VTEC Escherichia coli.
Установлено, что возбудителем европейской инфекции мая 2011 года является кишечная палочка серологической группы E. coli O104 (серотип E. coli O104:H4), имеющая в своем геноме ген, ответственный за продукцию шига-подобного токсина 2-го типа. В отличие от классических энтерогеморрагических кишечных палочек (E. coli О157:Н7), штаммы E.coli O104:H4 не имеют еае-гена, ответственного за продукцию белка интимина, который является фактором адгезии.
Штаммы E. coli O104:H4, выделенные от пациентов, характеризовались резистентностью к бета-лактамным антибиотикам за счет продукции бета-лактамазы расширенного спектра, но оставались чувствительными к группе аминогликозидов (гентамицин) и фторхинолонам.
После заражения энтерогеморрагической кишечной палочкой инкубационный период длится чаще всего от 48 до 72 часов, но может быть и от 1 до 10 дней. Симптомы заражения включают схваткообразные боли в животе и диарею, нередко с кровью. Могут наблюдаться лихорадка и рвота. Большинство больных выздоравливают в течение 10 дней. Иногда инфекция может приводить к опасным для жизни состояниям, таким как гемолитико-уремический синдром.
Инфицирование кишечными палочками (а также другими уропатогенными микробами, обитающими в кишечнике) мочеполовых органов, особенно у женщин, часто происходит непосредственно из желудочно-кишечного тракта при недостаточном соблюдении гигиены или применении специфических сексуальных практик. Кишечные палочки являются причиной:
- около 80 % внебольничных инфекций мочевыводящих путей
- 64 % всех заболеваний острым простатитом
- 80 % всех хронических простатитов
- для пациентов старше 35 лет — большей части всех эпидидимитов (воспалительный процесс в придатке яичка), орхитов (воспаление яичка) и эпидидимоорхитов (сочетанное воспаление яичка и придатка яичка)
- 70-95 % инфекций мочевых путей, достигающих мочевого пузыря или почки восходящим путем
- других заболеваний мочеполовых органов
При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. В частности, при наличии клинической симптоматики (лихорадка, озноб, тошнота, рвота, боли в поясничной области, дизурия) и выделении не менее 10 лейкоцитов в 1 мкл мочи, критерием для диагностики острого пиелонефрита является наличие не менее 10 4 кишечных палочек (или других патогенных энтеробактерий) в 1 мл свежевыпущенной мочи. Острый цистит диагностируется при наличии соответствующей клинической симптоматики, выделении не менее 10 лейкоцитов в 1 мкл мочи и обнаружении не менее 10 2 кишечных палочек (или других колиформных бактерий) в 1 мл мочи.

Штамм кишечной палочки Escherichia coli Nissle 1917 (DSM 6601) считается наиболее эффективным пробиотиком, помогающим уменьшить воспаление и оттянуть следующий приступ язвенного колита (Пробиотики. Что это такое и что они могут дать?). Этот штамм входит, в частности, в состав пробиотика Mutaflor (фирма Ardeypharm).
Специально подобранные штаммы эшерихии коли входят в состав лекарств: Хилак форте (штамм DSM 4087), Бификол (штамм М-17), Колибактерин (штамм М-17) и других.
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении кишечной палочки: амоксициллин, левофлоксацин, нифурател, нифуроксазид, рифаксимин, фуразолидон, ципрофлоксацин, норфлоксацин, офлаксацин, моксифлоксацин, доксициклин (не все штаммы).
Escherichia coli устойчива к клотримазолу.
Резистентность возбудителей амбулаторных инфекций мочевыводящих путей по данным многоцентровых микробиологических исследований UTIAP-I и UTIAP-II
В.В. Рафальский 1 , Л.С. Страчунский 1 , О.И. Кречикова 2 , И.А. Эйдельштейн 1 , Л.И. Ахметова 3 , П.А. Бабкин 4 , Е.Н. Гугуцидзе 5 , В.Н. Ильина 6 , М.И. Коган 7 , В.В. Копылов 7 , И.В. Малев 8 , С.Б. Петров 4 , Л.В. Рафальская 8 , Н.М. Фурлетова 9
РЕЗЮМЕ
Цель исследования. Изучить структуру возбудителей и чувствительность штаммов E.coli, выделенных у взрослых амбулаторных пациентов с неосложненными ИМП в различных регионах России.
Материалы и методы. В многоцентровое проспективное эпидемиологическое исследованиее включали взрослых пациентов с неосложнёнными инфекциями верхних или нижних отделов мочевыводящих путей. Определяли МПК антибиотиков методом разведения в агаре в соответствии с рекомендациями NCCLS, 2000-2002.
Результаты. Наиболее частым возбудителем неосложнённых ИМП является E.coli - 85,9%. Другие микроорганизмы встречаются значительно реже - K.pneumoniae - 6%, Proteus spp. - 1,8%, Staphylococcus spp. - 1,6%, P.aeruginosa - 1,2%, Enterococcus spp. - 1,0%. Выявлен высокий уровень резистентности E.сoli к ампициллину - 37,1%, ко-тримоксазолу - 21%. Максимальный уровень резистентности к ним определялась в Санкт-Петербурге - 51,9 и 31,5%, соответственно. Максимальной активностью в отношении E.сoli обладают следующие пероральные антибиотики - норфлоксацин и ципрофлоксацин - 4,3%, цефуроксим - 2,4%, амоксициллин/клавуланат - 2,6%, нитрофурантоин - 1,2%.
Заключение. Выявлена высокая резистентность основного возбудителя неосложненных ИМП - E.coli к ампициллину и ко-тримоксазолу, высокой микробиологической активностью бладают фторхинолоны, амоксициллин/клавуланат, нитрофурантоин, цефуроксим. С учётом полученных данных, фармакокинетических особенностей и профиля безопасности, препаратами выбора для терапии неосложнённых ИМП в России являются пероральные фторхинолоны.
ВВЕДЕНИЕ
Инфекции мочевыводящих путей (ИМП) относятся к одним из наиболее распространённых бактериальных инфекций в амбулаторной практике урологов, акушер-гинекологов и терапевтов. Распространённость ИМП в России составляет около 1000 случаев на 100000 населения в год [1].
Среди амбулаторных пациентов чаще встречаются неосложнённые ИМП, которые в большей степени поражают женщин, что обусловлено анатомо-физиологическими особенностями, ведущими к более лёгкому, по сравнению с мужчинами, попаданию микрофлоры кишечника в периуретральную область. Этиология неосложнённых ИМП (цистит, пиелонефрит) хорошо изучена - в 70-95% случаев они вызываются E.сoli. Реже, в 5-20% случаев, встречаются S.saprophyticus, K.pneumoniae [2]. Иногда ИМП могут вызываться другими энтеробактериями - протеями, серрациями и др., энтерококками, синегнойной палочкой. Поэтому, для формирования представления о состоянии устойчивости уропатогенов к антибиотикам, в первую очередь необходимо анализировать данные по резистентности - E.coli.
Во многих странах мира, в последние годы отмечается тенденция к значительному повышению устойчивости микрофлоры к ко-тримоксазолу и ампициллину [3,4]. Данные по устойчивости уропатогенов к антибиотикам важны, в первую очередь, для адекватного эмпирического выбора терапии. Показано, что при использовании ко-тримоксазола для терапии неосложнённых ИМП, вызванных устойчивыми к этому антибиотику штаммами E.coli, клиническая и микробиологическая эффективность терапии снижается в 2 раза [5]. Считается, если уровень резистентности уропатогенных штаммов E.coli к антибиотику составляет в регионе более 10-20%, то это является предпосылкой ограничения его использования как препарата выбора [6].
Эпидемиологические исследования по резистентности возбудителей ИМП постоянно проводятся во многих странах мира и являются либо самостоятельными, либо частью более масштабных проектов, например SENTRY. Нередко эти исследования являются многоцентровыми международными, например, проект ECO-SENS, который проводится на территории стран Европы и в Канаде [3,4].
Настоящая публикация является обобщением результатов двух первых в России многоцентровых эпидемиологических исследований по изучению этиологии и резистентности возбудителей ИМП к антибиотикам - и , проведённых в 1998-2001 гг. в 8 городах Российской Федерации.
Целью настоящего исследования явилось разработать пути оптимизации антимикробной терапии на основании изучения структуры возбудителей и их чувствительности к антибиотикам, выделенных у взрослых амбулаторных пациентов с неосложнёнными инфекциями мочевыводящих путей (ИМП) в различных регионах России.
МЕТОДЫ
В ходе исследования на каждого пациента заполнялась регистрационная карта, в которой отмечались нозологическая форма (цистит, пиелонефрит), тяжесть (лёгкая, средняя, тяжёлая), клиническая форма инфекции (осложнённая, неосложнённая), данные о проводимой пациенту антибиотикотерапии в течение последнего года.
Уровень антибиотикорезистентности определялся с помощью программы M-Lab (НИИАХ).
РЕЗУЛЬТАТЫ
В 96,3% неосложнённые ИМП были вызваны одним возбудителем. Наиболее частым уропатогеном является Escherichia coli, которая встречается у 85,9% пациенток (рис. 1). Другие микроорганизмы встречаются значительно реже. Так, Klebsiella pneumoniae выделена у 6%, Proteus spp. - 1,8%, Staphylococcus spp. - 1,6%, P.aeruginosa - 1,2%, Enterococcus spp. - 1,0%.
| Рисунок 1. | Структура возбудителей неосложнённых ИМП у амбулаторных пациентов в России |
Другие возбудители выделялись менее чем в 1% случаев. Значимых различий в спектре возбудителей ИМП между центрами не наблюдалось, несколько чаще в Москве, чем в других центрах, выделяли K.pneumoniae, а в Екатеринбурге K.pneumoniae, Staphylococcus spp. и P.aeruginosa, однако данные отличия не носили статистически значимых различий (P>0,05). В связи с этим, наибольший интерес представляет исследование антибиотикорезистентности E.сoli, как основного уропатогена.
| Таблица 1. | Пограничные значения МПК и резистентность E.coli, выделенной у пациентов с неосложнёнными амбулаторными ИМП в России (сводные данные) |
| Антибиотик | Пограничные значения МПК | E.coli, N=428 | ||||||
|---|---|---|---|---|---|---|---|---|
| S | I | R | МПК90 | МПК50 | S | I | R | |
| Ампициллин | ≤ 8 | 16 | ≥ 32 | 256 | 4 | 62,9 | 0,0 | 37,1 |
| Амоксициллин/клавуланат | ≤ 8 | - | ≥ 16 | 16 | 4 | 84,4 | 13 | 2,6 |
| Цефуроксим | ≤ 8 | 16 | ≥ 32 | 8 | 4 | 96,4 | 1,2 | 2,4 |
| Цефотаксим | ≤ 8 | 16 | ≥ 64 | 1 | 1 | 97,6 | 1,2 | 1,2 |
| Налидиксовая к-та | ≤ 16 | - | ≥ 32 | 8 | 2 | 93,1 | 0,0 | 6,9 |
| Пипемидовая к-та | ≤ 8 | - | ≥ 16 | 4 | 3 | 93,9 | 0 | 6,1 |
| Ципрофлоксацин | ≤ 1 | 2 | ≥ 4 | 1 | 1 | 95,5 | 0,2 | 4,3 |
| Норфлоксацин | ≤ 4 | 8 | ≥ 16 | 1 | 1 | 95,5 | 0,0 | 4,3 |
| Гентамицин | ≤ 4 | 8 | ≥ 16 | 2 | 1 | 93,6 | 0,7 | 5,7 |
| Ко-тримоксазол | ≤ 2 | - | ≥ 4 | 128 | 1 | 79 | 0 | 21 |
| Нитроксолин | ≤ 1 | - | ≥ 32 | 6 | 4 | 7,1 | 92,9 | 0,0 |
| Нитрофурантоин | ≤ 32 | 64 | ≥ 128 | 32 | 16 | 95,7 | 3,1 | 1,2 |
S - чувствительные штаммы (%); I - умеренночувствительные штаммы (%); R - резистентные штаммы (%);
МПК90 - минимальная подавляющая концентрация для 90% исследованных штаммов,
МПК50 - минимальная подавляющая концентрация для 50% исследованных штаммов.
При анализе данных по резистентности E.сoli к различным антибиотикам (табл. 1), обращает на себя внимание высокая частота выделения резистентных штаммов E.сoli к ампициллину (37,1%), ко-тримоксазолу (21%), а также высокая частота выявления штаммов умереннорезистентных к нитроксолину (92,9%) (табл. 1). Частота выявления устойчивых к данным антибиотикам микроорганизмов отличалась между центрами. Максимальный уровень резистентности к ампициллину и ко-тримоксазолу определялась в Санкт-Петербурге (51,9 и 31,5%, соответственно), минимальный к ампициллину в Москве - 28,6%, к ко-тримоксазолу в Новосибирске - 13,5% (табл. 2).
| Таблица 2. | Резистентность E.coli, выделенной у пациентов с неосложнёнными амбулаторными ИМП в России (данные по центрам) |
| Антибиотик | Центры | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Смоленск, n=107 | Москва, n=105 | n=54 | n=53 | Екатеринбург, n=20 | Новосибирск, n=89 | |||||||||||||
| S | I | R | S | I | R | S | I | R | S | I | R | S | I | R | S | I | R | |
| Ампициллин | 67,3 | 0 | 32,7 | 71,4 | 0 | 28,6 | 48,1 | 0 | 51,9 | 52,8 | 0 | 47,2 | 60 | 0 | 40 | 62,9 | 0 | 37,1 |
| Амоксициллин/ клавуланат | 86,9 | 11,2 | 1,9 | 86,7 | 11,4 | 1,9 | 75,9 | 18,5 | 5,6 | 84,9 | 9,4 | 5,7 | 86,7 | 13,3 | 0 | 83 | 15,9 | 1,1 |
| Цефуроксим | 99,1 | 0 | 0,9 | 94,3 | 2,9 | 2,9 | 94,4 | 0 | 5,6 | 100 | 0 | 0 | 100 | 0 | 0 | 94,3 | 2,3 | 3,4 |
| Цефотаксим | 99,1 | 0,9 | 0 | 97,1 | 1 | 1,9 | 96,3 | 3,7 | 0 | 98,1 | 1,9 | 0 | 100 | 0 | 0 | 96,6 | 0 | 3,4 |
| Наликсовая к-та | 97,2 | 0 | 2,8 | 92,4 | 0 | 7,6 | 83,3 | 0 | 16,7 | 90,6 | 0 | 9,4 | 100 | 0 | 0 | 95,5 | 0 | 4,5 |
| Пипемидовая к-та | 96,3 | 0 | 3,7 | 96,2 | 0 | 3,8 | 83,3 | 0 | 16,7 | 90,6 | 0 | 9,4 | 100 | 0 | 0 | 95,5 | 0 | 4,5 |
| Ципрофлоксацин | 98,1 | 0,9 | 0,9 | 98,1 | 0 | 1,9 | 87 | 0 | 13 | 90,6 | 0 | 9,4 | 100 | 0 | 0 | 96,6 | 0 | 3,4 |
| Норфлоксацин | 98,1 | 0 | 0,9 | 98,1 | 0 | 1,9 | 87 | 0 | 13 | 90,6 | 0 | 9,4 | 100 | 0 | 0 | 96,6 | 0 | 3,4 |
| Гентамицин | 90,7 | 0,9 | 8,4 | 98,1 | 1 | 1 | 92,6 | 0 | 7,4 | 90,6 | 1,9 | 7,5 | 100 | 0 | 0 | 93,3 | 0 | 6,7 |
| Нитрофурантоин | 96,3 | 0,9 | 2,8 | 98,1 | 1 | 1 | 88,9 | 9,3 | 1,9 | 92,5 | 7,5 | 0 | 100 | 0 | 0 | 97,8 | 2,2 | 0 |
| Ко-тримоксазол | 77,6 | 0 | 22,4 | 82,9 | 0 | 17,1 | 68,5 | 0 | 31,5 | 71,7 | 0 | 28,3 | 80 | 0 | 20 | 86,5 | 0 | 13,5 |
| Нитроксолин | 5,6 | 94,4 | 0 | 7,6 | 92,4 | 0 | 14,8 | 85,2 | 0 | 1,9 | 98,1 | 13,3 | 86,7 | 5,6 | 94,4 | 0 | ||
S - чувствительные штаммы (%); I - умеренночувствительные штаммы (%); R - резистентные штаммы (%).
Активность налидиксовой и пипемидовой кислот и фторхинолонов (норфлоксацин и ципрофлоксацин) варьировали в зависимости от региона и изменялись однонаправлено. Максимальный уровень устойчивости отмечался в Санкт-Петербурге (налидиксовая кислота - 16,7%, пипемидовая кислота - 17,7%, нофлоксацин - 13%, ципрофлоксацин - 13%), несколько ниже в Ростове-на-Дону. В других городах частота выделения устойчивых к хинолонам и фторхинолонам штаммов была низкая (табл. 2).
Также значительные колебания между регионами имели место в резистентности к гентамицину, цефуроксиму и амоксициллину/клавуланату, хотя в целом по всем центрам частота выделения резистентных штаммов была невысокой: гентамицин - 5,7%, цефуроксим - 2,4%, амоксициллин/клавуланат - 2,6%. Чаще всего E.coli, резистентная к цефуроксиму, вызывала ИМП в Санкт-Петербурге- 5,6%, Москве - 2,9%, Новосибирске - 3,4%. В остальных центрах (Екатеринбург, Ростов-на-Дону, Смоленск) частота выделения устойчивых штаммов не превышала 1%. Самая высокая частота резистентных к амоксициллину/клавуланату штаммов выявлена в Санкт-Петербурге (5,6%) и Ростове-на-Дону (5,7%), значительно ниже в Смоленске (1,9%), Москве (1,9%), Новосибирске (1,1%). В Екатеринбурге штаммов E.coli, устойчивых к этому антибиотику, выявлено не было.
Резистентность E.coli к цефотаксиму и нитрофурантоину определялась на низком уровене во всех центрах с колебаниями от 0-1,9% для цефотаксима и 0-2,8% для нитрофурантоина.
Резистентность K.pneumoniae к ко-тримоксазолу составила 27,3%, выявлен высокий уровень устойчивости к налидиксовой (24,2%) и пипемидовой (21,2%) кислотам, а также нитрофурантоину (42,4%). Резистентность K.pneumoniae к гентамицину (6,1%) и амоксициллину/клавуланату (3,1%) практически не отличалась от устойчивости E.coli. В то же время, не было выделено ни одно штамма K.pneumoniae, резистентного к фторхинолонам (норфлоксацин, ципрофлоксацин) и цефалоспоринам.
ОБСУЖДЕНИЕ
Анализируя результаты по устойчивости E.coli к возбудителям ИМП в России, можно выделить 2 группы препаратов. К первой группе относятся антибиотики, уровень резистентности к которым превышает 20% - ампициллин и ко-тримоксазол. Согласно сложившимся в настоящее время критериям, если резистентность E.coli к антибиотику превышает 10-20%, препарат не может рассматриваться как препарат выбора для терапии неосложнённых ИМП [6]. Поэтому ампициллин и ко-тримоксазол не могут быть рекомендованы для терапии неосложнённых ИМП в России. Это относится и к амоксициллину, так как он не имеет микробиологических преимуществ перед ампициллином.
Выявление высокого уровня резистентности уропатогенной E.coli к ко-тримоксазолу и ампициллину у амбулаторных пациентов в России является отражением тенденции, характерной практически для всех стран. Например, в США за период с 1989-1991 гг. по 1995-1997 гг. частота выделения устойчивых к ампициллину и ко-тримоксазолу штаммов возросла с 29 и 7% до 35 и 18%, соответственно [3,4]. Аналогичные данные получены в европейских странах и Канаде [3,9]. Очевидно, данный факт отражает длительное и повсеместное использование этих антибиотиков не только для лечения ИМП, но и при других заболеваниях, прежде всего, при инфекциях дыхательных путей [10]. Особенно важен, на наш взгляд, в формировании высокого уровня устойчивости фактор безрецептурного отпуска антибиотиков в России и бесконтрольное использование этой группы препаратов населением [11].
Во вторую группу можно отнести антибиотики, обладающие высокой микробиологической активностью в отношении основных возбудителей неосложнённых ИМП (в первую очередь E.coli) у амбулаторных пациентов - амоксициллин/клавуланат, фторхинолоны (ципрофлоксацин, норфлоксацин), гентамицин, цефалоспорины II-III поколения (цефуроксим, цефотаксим), нитрофурантоин.
Не все из перечисленных препаратов, несмотря на высокую микробиологическую активность, имеют одинаковое клиническое значение для терапии неосложнённых ИМП. Кроме уровня резистентности в регионе, необходимо учитывать такие характеристики антибиотиков, как безопасность и переносимость, фармакокинетический профиль, доказанную в клинических испытаниях эффективность препарата.
Читайте также:


