Диссертации по кишечной палочке

















480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация - 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Содержание к диссертации
ГЛАВА 1. Современные возможности иммуномодулирующей терапии хронического бактериального цистита у женщин 14
1.1. Актуальные вопросы этиологии и патогенеза хронического бактериального цистита 14
1.2. Методы оценки иммунной системы организма
1.2.1. Комплексный анализ системы Toll-подобных рецепторов 28
1.2.2. Методы определения эффекторных молекул (цитокинов, противомикробных пептидов) 31
1.3. Роль иммунотерапевтических препаратов в лечении хронического
бактериального цистита 36
ГЛАВА 2. Материалы и методы исследования .47
2.1. Общая характеристика клинических наблюдений 47
2.2. Методы обследования больных
2.2.1. Методы общеклинического и урологического обследования 56
2.2.2. Специальные методы обследования
2.3. Характеристика методов лечения .62
2.4. Статистическая обработка данных .64
ГЛАВА 3. Состояние врожденного и адаптивного иммунитета у женщин с хроническим бактериальным циститом .65
Глава 4. Влияние препарата бактериального лизата штаммов кишечной палочки на показатели иммунного статуса больных хроническим бактериальным циститом .77
4.1. Влияние препарата бактериального лизата 18 штаммов кишечной палочки на параметры адаптивного клеточного и гуморального иммунитета .77
4.2. Влияние препарата бактериального лизата 18 штаммов кишечной палочки на показатели врожденного системного и местного (мукозального) иммунитета у больных хроническим бактериальным циститом 88
ГЛАВА 5. Сравнительная оценка иммунотерапии препаратом бактериального лизата 18 штаммов кишечной палочки и стандартной антибактериальной терапии на параметры иммунного статуса и эффективность лечения женщин, страдающих хроническим бактериальным циститом 98
5.1. Сравнительная оценка влияния иммунотерапии препаратом бактериального лизата 18 штаммов кишечной палочки и стандартной антибактериальной терапии на показатели состояния иммунитета больных хроническим рецидивирующим циститом 98
5.2. Оценка клинической эффективности иммунотерапии препаратом бактериального лизата 18 штаммов кишечной палочки в сравнении со стандартной антибактериальной терапией женщин с хроническим рецидивирующим циститом 117
ГЛАВА 6. Заключение 129
Практические рекомендации .145
Комплексный анализ системы Toll-подобных рецепторов
При происшедшей адгезии нормальный ток мочи не смывает бактерии, в результате чего происходит колонизация микроорганизмов на слизистой оболочке мочевого пузыря [97]. Условиями персистенции являются определенные биологические свойства микроорганизма и дефектность иммунной защиты хозяина, что обусловливает бактерионосительство (персистенция возбудителей, асимптоматическая бактериурия) и хронизацию воспалительного процесса (частые рецидивы заболевания). Снижая вирулентность или изолируясь в очагах локального иммунодефицита, бактерии могут уклоняться от действия факторов защиты человека. Подавление же факторов защиты хозяина идет за счет повышения вирулентных свойств бактерий или в результате диссеминации в иммунокомпрометированном организме [70, 89]. Уропатогенные штаммы E. coli имеют факторы вирулентности, с помощью которых они способны преодолевать защитные механизмы слизистой мочевого пузыря у женщин, что зависит от состояния врожденного иммунного ответа слизистых оболочек [118, 115, 136]. Высокая приспосабливаемость микроорганизмов к постоянно меняющимся условиям существования особенно проявляется при антибиотикотерапии – обесцениваются целые классы антибиотиков за счет селекции резистентных штаммов микроорганизмов [71].
В настоящее время в литературе активно обсуждается концепция внутриклеточных бактериальных сообществ. Многие виды бактерий способны паразитировать внутриклеточно, проявляя тропность к различным клеткам хозяина – факультативный паразитизм. E. coli, проникая в эпителиальную клетку мочевого пузыря, может формировать в цитоплазме внутриклеточные бактериальные сообщества (ВБС) [71, 133].
Во внутриклеточных бактериальных сообществах резистентность к антибиотикам может быть обусловлена как ограниченным проникновением антимикробных веществ в ВБС, так и низкой метаболической активностью бактерий. [141, 144].
Методы общеклинического и урологического обследования
На первом этапе исследования всем пациенткам было проведено общеклиническое и урологическое обследование. Выполнялись следующие общепринятые клинические методы исследования, такие как: 1. сбор жалоб, анамнеза заболевания и анамнеза жизни больных рецидивирующим бактериальным циститом; 2. субъективная оценка клинического состояния пациентки; 3. объективный осмотр, физикальное обследование; 4. общеклиническое обследование (общий анализ крови и общий анализ мочи); 5. культуральное исследование мочи на флору и чувствительность к антибиотикам; 6. консультация гинекологом и микроскопическое исследование мазка из уретры и цервикального канала; 7. ПЦР диагностика на инфекции, передаваемые половым путем; 8. УЗИ мочевого пузыря и почек (по показаниям); 9. урофлоуметрия (по показаниям). Для клинического и бактериологического анализов мочи пациентки сдавали среднюю порцию утренней мочи, после тщательного туалета наружных половых органов и рук. Определяли микробиологическую обсемененность мочи и чувствительность к антибактериальным препаратам выделенных уропатогенов. Этиологически значимым считали микробное число 103 КОЕ/мл.
Кроме того, всем пациенткам выполняли влагалищное исследование, в ходе которого оценивали состояние слизистой оболочки уретры и влагалища, определение топографии наружного отверстия уретры, оценивалось наличие или отсутствие пролапса стенок влагалища при натуживании. Проводилась пальпаторная оценка состояния мочеиспускательного канала, шейки мочевого пузыря и парауретральных тканей. Ультразвуковое исследование мочевого пузыря и почек проводилось трансабдоминальным способом с наполненным мочевым пузырем с использованием абдоминального датчика 3 МГц. В ходе исследования в первую очередь проводилась оценка формы мочевого пузыря, толщина стенки, а также содержимого мочевого пузыря и количество остаточной мочи. При УЗИ почек исключались аномалии развития, новообразования почек и мочекаменная болезнь.
Для исключения нарушений мочеиспускания проводили урофлоуметрию, позволяющую оценить процесс опорожнения мочевого пузыря, наличие или отсутствие препятствий к оттоку мочи в области шейки и в уретре. Всем пациенткам урофлоуметрия выполнялась при наличие естественного позыва к мочеиспусканию в спокойной обстановке без присутствия медперсонала. Объективным считалось мочеиспускание объемом не менее 150 мл и не более 400 мл. Оценивались следующие показатели: максимальная объемная скорость потока, время мочеиспускания, выделенный объем мочи, средняя скорость потока, характер кривой урофлоуметрии.
Оценка показателей врожденного и адаптивного иммунного ответа в сыворотке крови и в слизистых мочевых путей на 0 день, 30 день лечения, 3 мес. лечения и через 3 мес. наблюдения после окончания лечения (на каждом визите 1, 2, 3, 4). Выполнялись следующие специальные методы исследования: 1. забор биоматериала (соскоб) из уретры для оценки параметров врожденного иммунитета слизистых оболочек до начала лечения, во время и спустя 3 месяца после окончания лечения; 2. забор крови для определения изменения динамики плазмацитоидных и миелоидных дендритных клеток, дефенсинов и иммуноглобулинов периферической крови больных с рецидивирующей инфекцией нижних мочевых путей до начала и в ходе терапии.
Исследования показателей врожденного иммунитета в слизистых оболочках уретры, определение клеточного профиля периферической крови и гуморального профиля иммунной системы больных с рецидивирующей инфекцией нижних мочевых путей в ходе иммунотерапии проводились на базе ГУ НИИ Вакцин и Сывороток им. И.И. Мечникова.
Влияние препарата бактериального лизата 18 штаммов кишечной палочки на показатели врожденного системного и местного (мукозального) иммунитета у больных хроническим бактериальным циститом
Таким образом, иммунотерапия бактериальным лизатом штаммов кишечной палочки не только способствовала нормализации количества TLR-позитивных клеток, но и нормализовала экспрессию генов, кодирующих их синтез. Правда, этот эффект после прекращения терапии постепенно проходил.
Другим важным компонентом системы распознавания чужеродных антигенов являются дендритные клетки циркулирующей крови. Их количество у больных циститом также оказалось достоверно сниженным. Иммунотерапия бактериальным лизатом штаммов кишечной палочки способствовала нормализации этого показателя как в процентном отношении к общему количеству лейкоцитов, так и в абсолютных значениях (Таблица 17). Примечание: М± - средняя арифметическая±стандартное отклонение; Me -медиана значений, LQ-UQ - нижний и верхний квартили.
Таким образом, препарат на основе лизата 18 штаммов кишечной палочки способствовал улучшению системы распознавания чужеродных микробных антигенов в течение периода лечения, но этот эффект оказался не стойким.
Следующим звеном в реализации иммунного ответа является система цитокинов, продукция которых резко усиливается после активации рецепторов иммунокомпетентных клеток.
Исследования показали, что среди Th1 цитокинов уровень TNF- и IL-1 у больных в острый период был резко повышен. Под влиянием иммунотерапии лизатом 18 штаммов кишечной палочки отмечалась тенденция к их снижению, но изменения до уровня нормы не происходило (за исключением IL-1 через 1 мес. после применения лизата 18 штаммов кишечной палочки). Противоположная картина отмечалась в отношении других Th1 цитокинов: IL-2, IFN-, IL-12p70. Изначально их уровни были существенно ниже границ нормы. Препарат приводил к нормализации уровней IL-2, IFN- и IL-12 на протяжении всего периода, за исключением IFN-, когда показатели снова начинали снижаться ниже контрольных значений уже через 4 месяца после лечения (Таблица 18).
Уровень Th1 цитокинов в сыворотках больных с рецидивирующей инфекцией нижних мочевых путей до и после лечения препаратом бактериального лизата 18 штаммов кишечной палочки.
В отношении Th2 цитокинов - IL-4, IL-6 и IL-10 достоверного снижения их изначально повышенных уровней не происходило, при этом концентрации IL-5 статистически значимо снижались, но не достигали уровня контрольных значений здоровых лиц. Значимое снижение повышенных концентраций наблюдалось только в отношении IL-13 (Таблица 19). То есть, в случае Th2 цитокинов наблюдалась малозначимая корреляция иммунного ответа.
Уровень Th2 цитокинов в сыворотках больных с рецидивирующей инфекцией нижних мочевых путей до и после лечения препаратом бактериального лизата 18 штаммов кишечной палочки.
В отношении цитокинов Th9/17/22 при терапии бактериальным лизатом 18 штаммов кишечной палочки происходила постепенная нормализация показателей, причем эта тенденция сохранялась даже после прекращения приема препарата (до 6 месяцев) (Таблица 20).
Уровень Th9/17/22 цитокинов в сыворотках больных с рецидивирующей инфекцией нижних мочевых путей до и после лечения препаратом бактериального лизата 18
Определение профиля иммуноглобулинов на фоне терапии бактериальным лизатом не выявило его достоверного влияния на уровни IgA и IgM в сыворотке крови больных в течение всего срока исследования, как на фоне приема препарата, так и в течение 3 месяцев после его прекращения (Рисунок 2 и 3 ). Если до начала лечения уровни IgA и IgM составили 708±48,5 мкг/мл и 462,9±27,9 мкг/мл соответственно, то через 6 месяцев их уровень был 727±37,51 мкг/мл и 473,8±40,7 мкг/мл. соответственно, что оставалось достоверно выше нормальных значений (423±38,8 мкг/мл и 466,5±50,3 мкг/мл соответственно).
Оценка клинической эффективности иммунотерапии препаратом бактериального лизата 18 штаммов кишечной палочки в сравнении со стандартной антибактериальной терапией женщин с хроническим рецидивирующим циститом
При оценке антибиотикограммы через 1 месяц лечения в группе терапии бактериальным лизатом чувствительность возбудителя, а именно E.Coli и Klebsiella pn., к антибиотикам в сравнении с исходными данными не изменилась.
Таким образом через 1 месяц иммунотерапии бактериальным лизатом 18 штаммов кишечной палочки положительный бактериологический результат достигнут в 96,7% случаев.
В группе больных, получавших стандартную антибактериальную терапию, из 25 пациенток, у которых до начала лечения в моче высевалась E.coli, эрадикация возбудителя достигнута в 20 случаях (80%). У 3 пациенток (12%) при повторном бактериологическом исследовании снизилось микробное число незначительно – с 106до 105 КОЕ/мл, а у 2 больных (8%) даже повысился на 2 lg– с 104 и 105 КОЕ/мл до 106 и 107 КОЕ/мл. У 1 больной, у которой до начала терапии в моче высевался Proteus mirabilis в титре 106 КОЕ/мл, при повторном исследовании титр возбудителя снизился лишь незначительно – до 105 КОЕ/мл. Похожая картина выявлена у пациентки, у которой до лечения в моче высевался Enterococcus faecalis – титр возбудителя в моче снизился с 106 до 105 КОЕ/мл. У остальных 2 больных, у которых в моче обнаруживали Staphylococcus epidermidis и Staphylococcus spp. при повторном бактериологическом исследовании роста микрофлоры не обнаружили.
В этой группе антибиотикограмма выделенных возбудителей осталась такой же, как и до начала терапии, несмотря на то, что отмечено снижение титра возбудителя на 2-3 логарифма. Учитывая, что пациентки этой группы получали антибиотики, обладающие бактерицидным действием (фосфомицина трометамол, фторхинолоны), цель которых – добиться полной эрадикации возбудителей из мочевых путей, выявление роста микроорганизмов в моче при повторном микробиологическом исследовании следует рассматривать как неудачу проведенной антибактериальной терапии. Исходя из этого, эффективность традиционной антибактериальной терапии оказалась равной 73,3%.
После завершения курса иммунотерапии бактериальным лизатом (3 месяца) при обследовании у 5 женщин этой группе в моче высеяли кишечную палочку в титре 103- 105 КОЕ/мл, однако, по сравнению со значениями титра до начала лечения эти показатели были все же ниже на 1-3 логарифма. При этом у всех 5 этих женщин E.coli выделяли в моче и через 1 месяц после начала терапии. При этом у 3 женщин он остался на прежнем уровне (у 2 – 103 и у 1 – 105 КОЕ/мл), а у 2 он повысился с 103 КОЕ/мл до 104 и 105 КОЕ/мл. У остальных женщин, у которых ранее в моче выделяли E.coli, после 3-месячной терапии моча оказалась стерильной.
У всех 3 пациенток, у которых до начала лечения в моче высевалась Klebsiella pneumonia, этот возбудитель высеян и через 3 месяца в титре 103, 105 и106 КОЕ/мл. То есть, у 1 больной титр возбудителя остался на том же уроне, что и через 1 месяц после начала лечения, а у 2 – повысился на 2 и 3 логарифма.
Таким образом, если в отношении E.coli иммунотерапия препаратом бактериального лизата 18 штаммов кишечной палочки показала достаточно высокую эффективность – эрадикация возбудителя достигнута в 76,1%, а еще у 14,3% микробное число стойко снизилось, то в отношении Klebsiella pneumonia результаты оказались существенно хуже – у всех 3 пациенток возбудитель продолжал высеваться из мочи, причем только в 1 случае – в постоянном титре, а у 2 других женщин микробное число в моче возрастало. Общая эффективность иммунотерапии в этой группе составила 73,3%.
Анализ чувствительности и резистентность к антибиотикам при выявлении бактериурии в эти сроки и после окончания терапии оценивали по следующим антибактериальным препаратам: нитрофурантоин, цефалексин, ко-тримоксазол, ципрофлоксацин, фосфомицина триметамол, амикацин, фуразидин\ фуразидин калия. При оценке спектра чувствительности и резистентности к антибиотикам в данной группе изменений не получено в сравнении с исходными данными.
В группе пациенток, получавших стандартную антибактериальную терапию, через 3 месяца у 4 пациенток в ранее стерильной моче вновь стала высеваться E.coli в титре 104-106 КОЕ/мл. Еще у 4 больных титр возбудителя незначительно снизился по сравнению со значениями, полученными через 1 месяц лечения – с 105-106 КОЕ/мл до 104-105 КОЕ/мл. У 2 больных, у которых ранее высевался протей и стафилококк, эти возбудители продолжали высеваться из мочи примерно в том же титре.
Таким образом, у 10 из 30 больных этой группы после 3-месячной антибактериальной терапии в моче продолжали высеваться бактериальные возбудители, преимущественно кишечная палочка. Чувствительность и резистентность выделенных возбудителей при этом не менялась по сравнению с исходными характеристиками. Соответственно эффективность антибактериальной терапии к этому сроку в данной группе составила 66,7%.
Кишечная палочка – это бактерия, которая может причинить вред вашему здоровью. Если вы узнаете о способах уничтожения и профилактики кишечной палочки, вы сможете снизить риск заражения и не допустить ее распространения.
Кишечная палочка: симптомы
Кишечная палочка — это палочковидная бактерия, которая обитает в кишечнике человека и имеет множество разновидностей. Большинство из них — это безвредные микроорганизмы, но есть и такие, которые влекут за собой серьезные проблемы со здоровьем. Кишечная палочка возникает из-за несоблюдения гигиены и чистоты, поэтому использование хлоросодержащих моющих средств, таких как Domestos, необходимо.
Кишечная палочка: причины
- Зараженная еда: Зараженные бактерии можно обнаружить в мясе крупного рогатого скота, включая говядину и баранину, так как бактерии кишечной палочки могут находиться в кишечнике животных. Кроме того, может быть заражена и фермерская продукция: зелень, фрукты и овощи.
- Зараженная вода: Подхватить кишечную палочку очень просто, выпив воды из зараженного источника.
Кишечная палочка передается?
Присутствие безвредных разновидностей кишечной палочки является нормой для микрофлоры кишечника человека. Такие бактерии полезны для здоровья, так как препятствуют появлению других болезнетворных бактерий в кишечнике. Однако при нарушении работы пищеварительного тракта безвредная норма кишечной палочки может увеличиться и тогда необходима консультация доктора.
К сожалению, кишечная палочка заразна и тем самым еще более опасна. Кишечная палочка передается от человека к человеку воздушно-капельным и половым путем. Помимо прямого контакта с зараженным человеком, инфекция может передаваться путем употребления некачественной еды или загрязненной воды.
Кишечная палочка: профилактика с помощью личной гигиены
Чтобы остановить распространение кишечной палочки, нужно обязательно мыть руки:
- После обращения с животными
- После любого контакта с зараженным человеком
- Перед и после приготовления еды
- После замены подгузников, грязной одежды или постельного белья
- После использования туалета
- После уборки
Кишечная палочка: профилактика дома
Теперь перейдем к домашней уборке – важной части профилактики кишечной палочки. Следуйте этим простым советам, чтобы защитить свой дом:
- Тщательно убирайте ванную комнату и туалет – пользуйтесь хлорсодержащими чистящими средствами при уборке раковин, сантехники и всех твердых поверхностей. Особое внимание стоит уделить туалету, так как он – один из основных источников распространения кишечной палочки. Использование Domestos поможет убить все вредоносные бактерии в вашем туалете и ванной. Такое чистящее средство сэкономит ваше время, а также позаботится о вашем здоровье. Однако, перед использованием любого нового средства, не забудьте его протестировать и внимательно читайте инструкцию.
- Вытирайте все ручки в доме, чтобы не допустить распространения бактерий.
- Протирайте стиральную машину после стирки грязной одежды и постельного белья.
Когда дело касается дезинфекции вашего дома, хлорсодержащие чистящие средства становятся основным способом поддержания гигиены. Многочисленные исследования не раз показывали эффективность геля Domestos, содержащего хлор, в уничтожении вредных бактерий и в борьбе по предотвращению кишечных инфекций.
Не стоит забывать и про использование туалетных блоков, которые помогут поддержать гигиеническую чистоту и предотвратить распространение бактерий. Туалетные блоки Domestos идеально встраиваются под ободок унитаза, плотно прилегая в самом критичном, с точки зрения грязи и микробов, месте.
Максимальный эффект защиты вашего туалета может быть достигнут благодаря совместному использованию чистящего геля и туалетных блоков Domestos. Результат - чистый и опрятный туалет 24/7*!
*Защита от загрязнений (благоприятной среды для микробов) 24 часа в сутки, 7 дней в неделю при использовании согласно инструкции. По результатам инструментальных тестов Unilever, Италия, 2016
03 февраля 2020
- 954
- 0,0
- 0
- 3
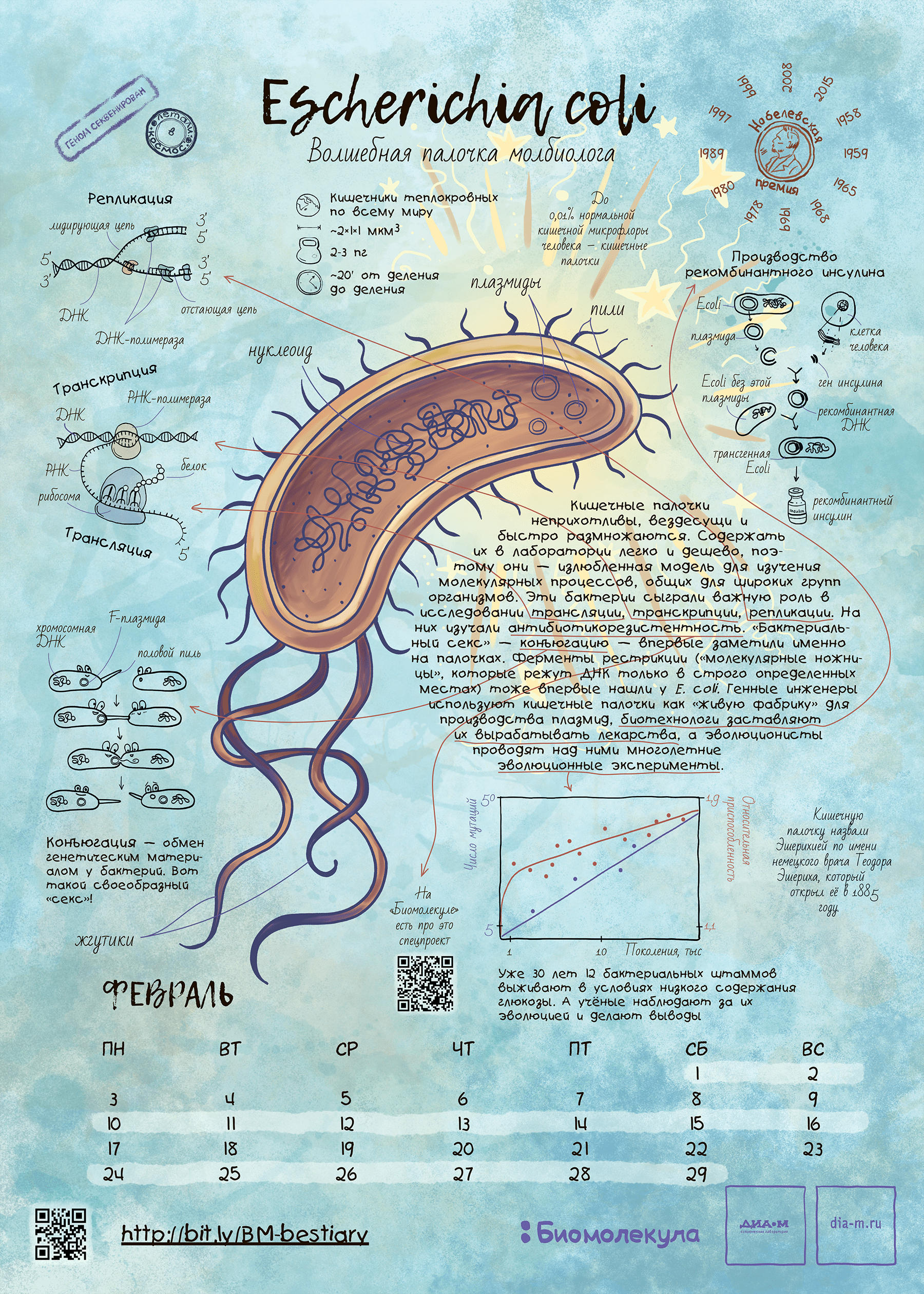
Герой февраля: кишечная палочка Escherichia coli
Скромная бактерия за полстолетия с момента ее открытия в конце XIX в. стала настоящей волшебной палочкой для молекулярной биологии. Сейчас результаты опытов с ее использованием занимают главы и тома профессиональных и популярных изданий. Конечно, в нашем путеводителе по модельным организмам E. coli должна была занять свое почетное место.

Двенадцать модельных организмов
Escherichia и Eschrichtius — Болезнь путешественников — Главная модельная бактерия — Учебник молекулярной генетики — Невезение с CRISPR/Cas
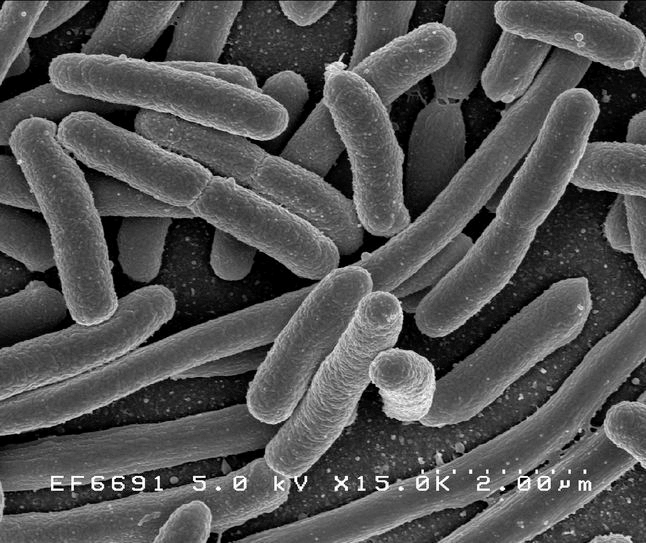
Рисунок 1а. Escherichia длиной 2 мкм

Рисунок 1б. Теодор Эшерих (1857–1911)

Рисунок 1в. Eschrichtius длиной 14 метров

Рисунок 1г. Даниэль Фредрик Эшрихт (1798–1863)
Клетки с относительно тонкой клеточной стенкой, не окрашивающиеся красителем генцианом фиолетовым (окраской бактерий по методу датского микробиолога Кристиана Грама).
Зачем же такую опасную бактерию сделали модельной? Дело в том, что в условиях культивирования кишечная палочка часто теряет патогенность, становится неспособной жить в естественных для себя условиях (то есть одомашнивается). И этим свойством в 1940-е годы воспользовались микробиологи, проведя с лабораторными штаммами E. coli (например, со знаменитым штаммом К12) много прорывных для науки экспериментов.
Так, манипулируя мутированными штаммами кишечной палочки, которые уже научились получать при помощи облучения, Джошуа Ледерберг и Эдуард Лаури Тейтем в 1947 году обнаружили способность разных штаммов обмениваться генетическим материалом и спасать друг друга от образовавшихся дефектов, проявлявшихся в неспособности расти на минимальной питательной среде. Так был открыт процесс конъюгации бактерий, который затем послужил важным инструментом для картирования бактериального генома . Ведь тогда это можно было делать только косвенными, микробиологическими методами — сама природа генетического кода была неизвестна.
Кстати, Джошуа Ледерберг был некоторое время мужем Эстер Ледерберг, первооткрывательницы бактериофага лямбда [3].
С начала 1950-х годов исследования по молекулярной генетике с использованием кишечной палочки и ее вирусов в качестве основного инструмента росли как снежный ком. Не будет преувеличением сказать, что к 70-м годам E. coli написала учебник молекулярной генетики! Вспомним открытие генетического кода, в котором участвовало несколько коллективов физиков и молекулярных биологов, в том числе Френсис Крик, Георгий Гамов и другие выдающиеся люди того времени [6]. Основные эксперименты по расшифровке кода велись на бесклеточных лизатах кишечной палочки.
Позднее обнаружилось, что E. coli хорошо подходит для зародившейся в 1960–1970-е годы биотехнологии [7]. Бактерия хорошо переносит введение в свою клетку гетерологичных (то есть чужеродных) генов и во многих случаях способна синтезировать их продукты без вреда для себя. Белки, полученные таким способом, стали называть рекомбинантными, и теперь они широко используются в медицине и других практических задачах.
Кишечная палочка — возможно, самый исследованный организм с точки зрения молекулярной биологии. Тем не менее у элементов ее генома до сих пор обнаруживают новые свойства. Это одновременно плохо (как же мало мы знаем!) и хорошо (будет чем заняться!). Совсем недавно на защите диссертации я услышал о том, как у одной из генных кассет эшерихии, участвующей в каскаде переработки сульфолипидов, также обнаружена и лактазная активность [8]. До этого такая активность была известна только у знаменитого лактозного оперона Жакоба и Моно, описанного в 1961 году!
Кажется, что E. coli — модельный организм без недостатков. Тем не менее биотехнологам не повезло, что у этой бактерии от природы нет системы бактериального иммунитета CRISPR/Cas [9], о которой я уже упоминал в эссе о бактериофаге лямбда [3]. Именно поэтому эту систему, ныне незаменимую в генной инженерии, открыли относительно поздно.
Кишечная палочка-выручалочка — это здорово (рис. 2). Но теперь пора переместиться в мир ядерных организмов. Удобным инструментом для молекулярной биологии и генетики эукариот оказались одноклеточные грибы — дрожжи — и гаплоидный плесневый гриб — нейроспора. Как они дошли до такой одноклеточной и гаплоидной жизни и что было открыто с их помощью — читайте в следующем материале нашего путеводителя по модельным организмам через месяц.
Благодарность

Установление причинной роли кишечных палочек в возникновении острых кишечных заболеваний довольно затруднительно, поскольку эти микроорганизмы широко распространены в природе, постоянно присутствуют в кишечнике здоровых людей [9] и животных, очень устойчивы к различным физико-химическим факторам и способны развиваться на самых разнообразных средах, в том числе и на пищевых продуктах. Кишечные палочки являются по существу комменсалом человека и важным антагонистическим фактором для гнилостных микроорганизмов, ограничивающим их развитие в кишечнике. Характерно, что по количеству микробов различные отделы желудочно-кишечного тракта здорового человека резко различаются. Количество микроорганизмов возрастает по направлению от желудка к толстому отделу кишечника. При нормальном функционировании желудка микрофлора в нем почти полностью отсутствует. Желудочный сок обладает чрезвычайно выраженными бактерицидными свойствами. В толстом отделе кишечника содержится колоссальное количество микробов. В составе микрофлоры кишечника взрослых людей обнаружено более 260 видов микроорганизмов. Основную массу (96 - 99 %) составляют анаэробные бактерии (бифидобактерии, бактероиды). На факультативно-анаэробную микрофлору, к которой относятся кишечная палочка, лактобациллы, энтерококки, приходится около 1 - 4 % всей кишечной микрофлоры. Менее 0,01 - 0,001 % составляет так называемая остаточная микрофлора [6]. Кишечная палочка играет, безусловно, положительную роль в процессе пищеварения, витаминном балансе, а также в создании местного, кишечного, иммунитета. Большое значение имеет она и в построении общего иммунитета, предполагающего выработку специфических и неспецифических антител. Однако при известных обстоятельствах этот вид микроорганизма способен вызвать различные патологические состояния: колиты, энтериты, циститы, холециститы, сепсис. Иными словами, существует возможность превращения симбиозов нормально биологических в симбиозы патологические. Условно-патогенные микроорганизмы начинают играть роль паразита в том случае, если после окончания заболевания у макроорганизма не установятся с ним вновь симбиотические взаимоотношения [8].
Кишечная палочка (Escherichia coli) впервые была выделена из испражнений человека Т. Эшерихом в 1885 году [3]. Заболевания, вызываемые кишечной палочкой, называют коли-инфекциями, или эшерихиозами [6]. Кишечные инфекции, занимающие ведущее положение в структуре эшерихиозов, связаны с четырьмя различными группами, Е. coli-энтеротоксигенными (ЭТКП), энтероинвазивными (ЭИКП), энтеропатогенными (ЭПКП) и энтерогеморрагическими (ЭГКП) кишечными палочками. Штаммы этих групп различаются прежде всего по факторам патогенности, а также по клиническим проявлениям заболеваний, возбудителями которых они являются.
Энтеротоксигенные штаммы Е. coli вызывают диарею с выраженным болевым синдромом за счет воздействия на ганглиозидные рецепторы энтероцитов продуцируемых ими термолабильного и термостабилыюго энтеротоксинов, что приводит к активизации аденилатциклазиой системы, внутриклеточному накоплению цАМФ и, как следствие, секреции жидкости и электролитов в просвет кишечника [4].
Энтероинвазивные E. coli. обладают способностью к проникновению, инвазии, в слизистую оболочку кишечника и ведут себя в патогенетическом отношении как возбудители дизентерии [6]. Наиболее часто при этом заболевании выделяются О -124 [2], О-136 и О-144 серотипы кишечных палочек [5].
Энтеропатогенные эшерихии, группируемые в 2 класса на основе характера взаимодействия с клеточными культурами НЕр-2 и HeLa, колонизируют эпителий слизистой оболочки тонкой кишки, вызывая возникновение эрозий на его поверхности. Наличие у микроорганизмов плазмидокодируемого О-полисахарида с молекулярной массой 54 мДа способствует антифагоцитарной устойчивости возбудителей и развитию бактериемии.
Патогенез диареи, вызванной энтерогеморрагическими E. coli, связан с синтезом изолятами этой группы двух типов веротоксина, один из которых (SLT-1) имеет структурное и антигенное сродство с токсином S. dysenteriae
серовара 1.
В настоящее время в самостоятельную группу выделяют так называемые энтероадгезивные или аутоагглютинирующие штаммы Е. coli, однако их роль в развитии инфекций ЖКТ выяснена не до конца.
Штаммы патогенных эшерихии различаются также по антигенной структуре [4]. Они имеют три антигена:
- О-антиген (соматический) - термостабильный, не разрушается при длительном кипячении и автоклавировании при температуре
120 °С. - К-антиген - комплекс поверхностно расположенных антигенов, среди которых различают термолабильные (L,В,Vi) и термостабильные (А, М) антигены.
- Н-антиген - жгутиковый термолабильный антиген.
Диагностическое значение имеют все три комплекса антигенов. К настоящему времени патогенные формы кишечных палочек подразделяются на 149 разновидностей по О-антигену, на 94 серологическую разновидность по К-антигену и на 56 серологических разновидностей по Н-антигену [5].
Болезнь, вызываемая ЭПКП, ЭИКП и ЭТКП, клинически проявляется в основном одинаково, варьируя от умеренной диареи до тяжелого холероподобного состояния. Некоторые данные позволяют предположить, что болезнь, вызванная штаммами ЭТКП, вырабатывающими только термостабильный энтеротоксин, протекает быстрее, чем вызванная теми штаммами ЭТКП, которые вырабатывают оба энтеротоксина - термостабильный и термолабильный [6].
Инкубационный период длится от 3 до 6 дней (чаще 4-5 дней) [2]. Начало болезни чаще всего острое. Обычно заболевание начинается с болей в животе, поноса, рвоты и повышения температуры [7], протекая в форме энтерита. Энтерит может быть легкий, среднетяжелый и тяжелый. Стул бывает 3 - 5 раз, иногда до 15 раз в сутки. Испражнения жидкие, пенистые, зловонные. Выздоровление наступает через 5 - 7 дней. Относительно часто бывают рецидивы. В разгар заболевания наблюдаются небольшое повышение СОЭ, умеренный лейкоцитоз со сдвигом влево, моноцитоз, иногда повышение гематокрита [6]. В легких случаях явления токсикоза выражены слабо, температура повышается только до субфебрильной [2]. Среднетяжелые и особенно тяжелые формы сопровождаются повторной рвотой, упорными поносами и повышением температуры до 38 - 39 °С. В результате резкого обезвоживания (IV степень, потеря жидкости, составляющая 10 % массы тела) может наступить гиповолемический шок.
В диагностике эшерихиоза решающее значение приобретает высев возбудителя. Пробы (испражнения для выделения копрокультуры) от больного следует брать с 1 дня заболевания до принятия им антибиотиков или других химиотерапевтических препаратов, которые снижают возможность выделения возбудителя. Испражнения больных собирают в индивидуальное чистое подкладное судно или горшок (у грудных детей - с пеленок). Сбор материала можно производить, не дожидаясь дефекации, с помощью ректальных ватных или ватно-марлевых тампонов (укрепленных на деревянной палочке или проволочной петле), стеклянной ректальной трубки (длина трубки 15 - 20 см диаметр для детей 5 мм, для взрослых 10 мм). Ректальный тампон или трубку вводят в прямую кишку детям на 8-10 см, взрослым - на 10 - 15 см, укладывая больных на левый бок с полусогнутыми коленями [6].
Профилактические мероприятия сводятся к соблюдению санитарногигиенического режима и правил личной гигиены. Специфическую профилактику не проводят. Для лечения используют левомицетин, неомицин и другие антибиотики. При хронической инфекции применяют бактериофаги и аутовакцину. При кишечном дисбактериозе используют колибактерии, приготовленный из живой культуры штамма кишечной палочки М17 [1].
Читайте также:


