Аскаридоз свиней обзор литературы







480 руб. | 150 грн. | 7,5 долл. ', MOUSEOFF, FGCOLOR, '#FFFFCC',BGCOLOR, '#393939');" onMouseOut="return nd();"> Диссертация - 480 руб., доставка 10 минут , круглосуточно, без выходных и праздников
Автореферат - бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Яруллин Азат Кадимович. Патогенез аскаридоза свиней и коррекция физиологических процессов организма переболевших животных : диссертация . кандидата биологических наук : 03.00.19 / Яруллин Азат Кадимович; [Место защиты: Башкир. гос. аграр. ун-т].- Уфа, 2009.- 137 с.: ил. РГБ ОД, 61 10-3/330
Введение к работе
Актуальность темы. В связи с современными задачами обеспечения страны продуктами животноводства отечественного производства немалую роль играет развитие такой высокопродуктивной отрасли, как свиноводство. Для выполнения поставленной задачи необходимо обеспечивать животных высококачественными кормами, создавать должные условия их содержания и проводить мероприятия, направленные на ликвидацию различных заболеваний, в том числе и паразитарного характера. В настоящее время производство свинины в России ведётся на промышленных комплексах, в хозяйствах с традиционной технологией, а также в крестьянских и фермерских хозяйствах. Современные технология, применяемые в свиноводстве, способствуют изменению эпизоотической ситуации, что отражается на заражённости животных.
Исследования ряда авторов (Е.Е. Шумакович, 1975; И.С. Дахно, 1987; Р.И. Аюпов, 1983; Р.Т. Сафиуллин, 1990; Т.И. Брезгинова, 1995; А.Г.Григорьев, 1999; В.А.Габдулин, 2000) свидетельствуют, что ситуация по гельминтозам в разных типах свиноводческих хозяйств заметно отличается. Например, в традиционных хозяйствах свиньи наиболее сильно заражены аскаридами и трихоцефалами, а на промышленных комплексах у животных преобладает аскаридоз и эзофагостомоз. Эпизоотическая ситуация по основным гельминтозам свиней в крестьянско–фермерских хозяйствах изучена недостаточно. Для успешной борьбы с гельминтозами необходимо знать особенности эпизоотического процесса в разных типах хозяйств и на основе знании эпизоотологии должны разрабатываться профилактические мероприятия.
Успех в борьбе и профилактике аскаридоза зависит от знания биологии возбудителя, особенностей эпизоотического процесса в конкретных природно-климатических условиях с учетом технологии выращивания животных. В литературе имеется сообщения о широком распространении аскаридоза на территории Российской Федерации и соседних государств как форме микстинвазий (В.Ш.Шакорян,1979; М.В.ЯкубовскиВ,1960,1984,1987; И.С.Дахно,198б; А.Н.Жумакаева,1966; А.М.Сазанов, Р.Т.Сафиуллин, 1988,1991; Н.И.Олехнович,1990 и др.).
В хозяйствах страны для борьбы с гельминтозами, ветеринарными специалистами проводится большая лечебно-профилактическая работа. Однако дегельминтизации нередко проводятся без учета конкретной гельминтозной ситуации, в связи с этим эффективность противопаразитарных обработок значительно снижается (Р.Т.Сафиуллин, 1999). Кроме того, согласно данным А.А.Черепанова (1998), при постоянном применении одних и тех же антгельминтиков у паразитов развивается устойчивость к действию препаратов, что говорит о необходимости внедрения в производство новых высокоэффективных препаратов а также коррекции физиологических процессов организма переболевших аскаридозом.
Цель и задачи исследований. Учитывая огромный экономический ущерб, причиняемый свиноводству аскаридозом, мы поставили перед собой цель изучить аспекты распространения, патогенеза аскаридоза и коррекции физиологических процессов переболевших аскаридозом свиней. Для достижения этой цели были поставлены следующие задачи:
- изучить распространенность аскаридоза свиней в хозяйствах Республики Башкортостан с различной технологией содержания животных;
- изучить сезонную и возрастную динамику аскаридоза свиней в хозяйствах Республики Башкортостан;
- изучить вопросы биологии аскарид;
- динамику гематологических и биохимических показателей крови у свиней при аскаридозе;
- изучить патогистологические изменения в органах больных аскаридозом свиней;
- динамику восстановительных процессов после дегельминтизации;
- изучить способы коррекции физиологических процессов после дегельминтизации свиней
Научная новизна. Изучены распространение, сезонная и возрастная динамика аскаридоза свиней в различных по технологии содержания животных в хозяйствах Республики Башкортостан. Установлено, что аскаридоз является широко распространенным заболеванием свиней на фермах подсобных хозяйств, на откормочных предприятиях. На промышленных комплексах с отлаженной технологией производства свинины зараженность свиней аскаридами значительно ниже.
Установлено, что на свинофермах с традиционным ведением отрасли (подсобные хозяйства, свинофермы СПК) пик инвазии наблюдается в августе-сентябре у 4-6-месячных поросят. На крупных промышленных комплексах с замкнутым циклом производства свинины пик инвазии наблюдается в декабре-феврале у 2-4-месячных поросят.
Установлено, что по мере развития патологического процесса, обусловленного аскаридозной инвазией, в крови больных животных снижается количество эритроцитов, гемоглобина, общего белка, повышается количество лейкоцитов, концентрация альфа-, бета- и гамма-глобулинов. Установлено, что у больных животных отмечается патогистологические изменения в легких, печени и тонком отделе кишечника, причиной которых являются механическое повреждение, нарушения функции органов кроветворения, эндокринной, пищеварительной и других систем, а также интенсивные иммунологические процессы, происходящие в ответ на действие антигенов аскарид, а также аутотоксинов - продуктов распада тканей самого хозяина.
Установлено, что после освобождения, животных от аскарид функции органов и систем у переболевших поросят восстанавливаются через 30 суток после проведенного лечения, при коррекции физиологических процессов организма препаратом Микосорб.
Практическая ценность. Данные, полученные при изучении распространения аскаридоза свиней в хозяйствах Республики Башкортостана, патогенеза болезни и коррекции физиологических процессов организма свиней переболевших аскаридозом, послужили основой для разработки рекомендаций по борьбе с аскаридозом свиней в хозяйствах Республики Башкортостана. (Утверждено Управлением Ветеринарии при МСХ РБ, 02 апреля 2007)
На защиту выносятся следующие положения:
1. Особенности распространенности аскаридоза в Республики Башкортостан с различной технологией содержания свиней.
2. Динамика гематологических и отдельных биохимических показателей крови у свиней при аскаридозе.
3. Патогистологические изменения в органах при аскаридозе свиней
4. Разработка способа коррекции физиологических процессов организма свиней переболевших аскаридозом.
ИНФЕКЦИОННЫЕ РЕСПИРАТОРНЫЕ БОЛЕЗНИ СВИНЕЙ: ЭТИОЛОГИЯ, ДИАГНОСТИКА И ПРОФИЛАКТИКА
Орлянкин Б.Г., Мишин А.М. Научно-исследовательский институт диагностики и профилактики болезней человека и животных, г. Москва
Алипер Т.И. НПО НАРВАК, г. Москва
Инфекционные респираторные болезни свиней широко распространены практически во всех странах мира с развитым свиноводством и причиняют большой экономический ущерб. В естественных условиях респираторные болезни чаще отмечают у поросят 1,5-4-месячного возраста, реже болеют поросята месячного и старше 5-месячного возраста. В различных хозяйствах заболеваемость поросят обычно составляет 30-70%, летальность может достигать 40%. Наибольший отход регистрируют у поросят 60-90-дневного возраста. Частота и тяжесть респираторных болезней зависит от численности свиней в хозяйстве, их иммунного статуса и технологии производства (2, 4).
Возбудителями респираторных болезней свиней являются вирусы и бактерии. Возможно поражение легких метастронгилюсами и личинками аскарид (9, 11).
Все вирусные респираторные патогены, в зависимости от способности вызывать заболевание, подразделяют на три группы (6). В первую группу входят основные или первичные патогены, индуцирующие клинические признаки и поражения легких. К этой группе относят вирус репродуктивного и респираторного синдрома свиней (РРСС), циркови-рус свиней типа 2 (ЦВС-2), вирус гриппа свиней (ВГС), вирус болезни Ауески (ВБА) и респираторный коронавирус свиней (РКВС).
Во вторую группу входит цитомегаловирус свиней, который цирку-лирует практически во всех свиноводческих хозяйствах, однако пато-генное действие он проявляет только у поросят с низким иммунным статусом, или при инфицировании их другими вирусами и бактериями.
Третья группа включает вирусы, редко обнаруживаемые при респираторных болезнях, и играющие второстепенную роль в патологии респираторного тракта. В эту группу входят парамиксовирус, парвови-рус, аденовирус, реовирус и вирус энцефаломиокардита свиней.
Наиболее широко в хозяйствах циркулируют вирус РРСС и ЦВС-2. Они играют главную роль в развитии респираторных болезней. Вирус РРСС впервые изолирован голландскими исследователями в 1991 г. Выделенные в дальнейшем в различных странах мира штаммы вируса РРСС отличаются вирулентностью, антигенной структурой и последовательностью нуклеотидов в геномной РНК. Обнаружены два генотипа вируса РРСС - европейский и американский; первый вначале циркулировал в странах Европы, а второй - в странах Северной Америки и Юго-Восточной Азии. В настоящее время во всех этих регионах циркулируют оба генотипа вируса РРСС.
Вирус РРСС длительно персистирует в организме свиней. Его обнаруживают в крови в течение 35-56 дней после заражения, в сперме - 92, в миндалинах - 251 день.
В 2006-2008 гг. в ряде стран мира (Китай, Вьетнам, Таиланд, Филиппины) наблюдали массовые вспышки атипичного РРСС, сопровождавшиеся высокой лихорадкой, анорексией, респираторными расстройствами, диареей, абортами, рождением мертвых и слабых поросят. Заболеваемость поросят в периоды доращивания и откорма составляла 50-100%, летальность - 20-100%. В Китае погибло более 1 млн и отбраковано около 20 млн голов свиней различного возраста. От заболевших животных выделено более 50 высокопатогенных изолятов вируса РРСС. Все они относятся к американскому генотипу, но в отличие от прототипного штамма VR-2332 имеют две делеции длиной 3 и 87 нуклеотидов в гене неструктурного белка 2 (10).
Вспышки атипичного РРСС в центральном регионе США в 2007 г. сопровождались очень высокой летальностью: 50-100% среди поросят и 10-20% среди свиноматок. Выделенный высокопатогенный штамм вируса РРСС отличается от китайских изолятов. Он имеет только одну делецию длиной 3 нуклеотида в гене неструктурного белка 2.
В России первая вспышка атипичного РРСС установлена в августе 2007 г. в Иркутской области (1). Заболевание сопровождалось массовыми абортами и рождением мертвых поросят. Выделенный вирус имеет высокую степень гомологии нуклеотидной последовательности с высокопатогенными китайскими изолятами и содержит две делеции в гене неструктурного белка 2.
ЦВС-2 широко распространен практически во всех странах мира. Впервые он был изолирован из тканей поросят в 1998 г. ЦВС-2 активно размножается в клетках иммунной системы и приводит их к гибели и развитию иммунодефицитного состояния. У таких поросят создаются условия для возникновения вторичных инфекций, вызываемых условно-патогенными микробами.
В последние годы в ряде стран мира (США, Франция, Швейцария, Канада) выделены варианты ЦВС-2, вызывающие в естественных условиях тяжелые поражения лимфатических узлов, селезенки, легких и почек. В свиноводческих хозяйствах США в 2000 г. цирковирус-ассоцииро-ванные болезни поросят в периоды доращивания и откорма составляли в среднем 5,7% и 3,6%. Через 6 лет (2006 г.) число заболевших резко возросло и составило соответственно 22,3% и 31,1%, т.е. увеличилось в 3,9 и 8,6 раза. Чаще болели поросята 60-110-дневного возраста. В Великобритании в инфицированных ЦВС-2 хозяйствах летальность поросят в период откорма к 2006 г. увеличилась почти в 2 раза (с 3,3% до 6,5%) и примерно в половине хозяйств она составляла 9,7% (5).
ВГС широко распространен во многих странах мира. Различают 9 подтипов этого вируса: H1N1, H1N2, H1N7, H3N1, H3N2, H3N3, H4N6, H5N1, H9N2. Наиболее часто среди свиней циркулируют три подтипа ВГС: H1N1, H1N2 и H3N2. Заболеваемость свиней гриппом очень высокая, но летальность низкая. Выздоровление наступает в течение короткого периода времени. При инфицировании поросят ВГС и вирусом РРСС увеличивается тяжесть и продолжительность болезни.
ВБА длительно (возможно пожизненно) персистирует в организме свиней и выделяется во внешнюю среду под влиянием различных стрессовых факторов. Вирус вызывает поражения головного и спинного мозга и респираторного тракта. При одновременном инфицировании поросят ВБА и другими вирусными и бактериальными патогенами тяжесть поражений легких возрастает.
РКВС является природным делеционным мутантом вируса трансмиссивного гастроэнтерита свиней (ТГС) и был впервые выделен в Бельгии в 1984 г. В отличие от вируса ТГС он хорошо размножается в эпителиальных клетках респираторного тракта и практически не размножается в эпителиальных клетках желудочно-кишечного тракта. По способности поражать легкие все изолированные штаммы РКВС подразделяют на авирулентные, слабовирулентные, умеренновирулентные и высоковирулентные, которые, кроме авирулентных, вызывают соответственно легкую, среднюю и тяжелую формы пневмоний. Тяжесть поражений легких увеличивается при одновременном заражении поросят РКВС и другими респираторными патогенами.
Все бактериальные респираторные патогены, в зависимости от способности вызывать заболевание, подразделяют также на три группы (4, 8, 9). В первую группу входят основные (первичные) вдыхаемые бактериальные патогены, при введении которых в трахею поросятам развивается пневмония. Они имеют факторы вирулентности, преодолевающие естественную защиту в легких. К этой группе относят Mycoplasma hyopneumoniae, Actinobacillus pleuropneumoniae, Bordetella bronchiseptica.
Вторая группа включает второстепенные (вторичные) вдыхаемые патогены, при введении которых в трахею поросятам не развивается пневмония. Для ее развития требуются повреждения легких, обусловленные пневмотропными вирусами или микоплазмами. В эту группу входят Pasteurella multocida, Haemophilus parasuis, Streptococcus suis, Mycoplasma hyorhinis.
В третью группу входят бактериальные патогены, переносимые кровью при развитии септицемии. К этой группе относят Salmonella choleraesuis, Actinobacillus suis, Actinomyces pyogenes (Arcanobacterium pyogenes).
Mycoplasma hyopneumoniae (МН) - главный бактериальный респираторный патоген. Она поражает эпителиальные клетки респираторного тракта, нарушает функцию бронхиального аппарата по удалению вдыхаемых частиц пыли и микробов и совместно с одним или несколькими второстепенными бактериальными патогенами вызывает бронхопневмонию. Заболевание, обусловленное МН и второстепенными бактериальными патогенами, называют энзоотической пневмонией. Поражения легких при этой болезни обнаруживают у 30-80% свиней при убое. МН сама по себе обладает минимальной патогенностыо, однако она усиливает поражения легких, вызываемые другими респираторными патогенами.
Actinobacillus pleuropneumoniae - АРР (ранее Haemophilus pleuropneumoniae) широко циркулирует в свиноводческих хозяйствах и чаще вызывает субклиническую инфекцию, чем развитие геморрагической некротизирующей пневмонии и фибринозного плеврита. В хронически инфицированных хозяйствах заболевание чаще регистрируют у поросят 2-3-месячного возраста. Вспышки плевропневмонии происходят после воздействия различных стресс-факторов, нарушения параметров микроклимата и инфицировании поросят другими респираторными патогенами.
Различают 15 капсульных серотипов АРР, из которых пять (1, 5, 9, 10, 11) обладают большей вирулентностью, чем другие серотипы. АРР продуцирует 4 экзотоксина, обладающие гемолитической и цитотокси-ческой активностью. При разрушении бактериальных клеток выходит эндотоксин, играющий важную роль в развитии болезни.
Bordetella bronchisерtica (ВВ) также широко циркулирует в свиноводческих хозяйствах. Ее часто обнаруживают в носовой полости здоровых поросят и других млекопитающих, включая собак и кошек. Размножаясь в носовой полости, бордетелла выделяет цитотоксин, который вызывает атрофию раковин и создает условия для размножения пастерелл. ВВ является первичным легочным патогеном для молодых поросят (до 4-недельного возраста) и второстепенным патогеном для поросят в период доращивания и откорма. Она повышает чувствительность поросят к другим респираторным патогенам.
Pasteurella multocida (РМ) циркулирует почти во всех свиноводческих хозяйствах. Здоровые свиньи часто являются носителями пасте-релл; их, как правило, обнаруживают в носовой полости и миндалинах.
Различают пять капсульных серотипов РМ (А, В, Д, Е, F) три из которых (А, В, Д) обнаружены у свиней. Серотип В не встречается у свиней в странах Европы и Северной Америки. Его изредка обнаруживают у свиней в странах Юго-Восточной Азии. Из пораженных легких часто выделяют серотип А и реже серотип Д. Различают также 16 соматических серотипов РМ, из которых третий и пятый изолируют чаще. В комбинации с другими патогенами тяжесть поражений легких увеличивается.
Haemophilus parasuis (HP) обнаруживают в носовой полости у 40-70% здоровых свиней. Патогенное действие HP проявляет только у поросят с пониженной резистентностью организма. У них развиваются поражения серозных оболочек в грудной и брюшной полостях, а также суставов и головного мозга (болезнь Глессера). Различают 15 сероти-пов HP, из которых три (4, 5, 13) широко циркулируют в свиноводческих хозяйствах Европы, Северной Америки, Японии и Австралии. Между различными серотипами возможна перекрестная защита.
Streptococcus suis (SS) часто обнаруживают в миндалинах и носовой полости здоровых поросят. Различают 35 капсульных серотипов SS и только один из них (второй) широко циркулирует в свиноводческих хозяйствах многих стран и обладает наибольшей вирулентностью. Заболевание возникает примерно у 5% инфицированных поросят 5-10-не-дельного возраста и сопровождается развитием септицемии, артритов и пневмоний. Из пораженных легких, наряду с SS, часто выделяют другие бактериальные патогены.
Mycoplasma hyorhinis (MHR) обнаруживают в носовой полости примерно 10% здоровых свиноматок и 30-40% нормальных поросят в период доращивания. Она вызывает фибринозный полисерозит и артриты у поросят 3-10-недельного возраста. В пораженных легких, наряду с MHR, также обнаруживают М.hyopneumoniae и P.multocida.
Salmonella choleraesuis (SC) обнаруживают в миндалинах, слепой и ободочной кишках здоровых свиней, где возбудитель персистирует в течение нескольких месяцев. Вспышка заболевания обычно происходит после воздействия стресс-факторов; болеет менее 10% поросят в период доращивания. SC размножается в макрофагах и быстро разносится ими по всему организму (септицемия). Бактерии продуцируют эндотоксин, который вызывает поражения различных органов, в том числе и легких, с развитием бронхопневмонии.
Actinobacillus suis (AS) обнаруживают в миндалинах, носовой полости и на слизистой оболочке влагалища здоровых свиней. Возбудитель вызывает пневмонию, перикардит, плеврит и перитонит у поросят в период доращивания и откорма. AS продуцирует экзотоксин, который по своим свойствам сходен с экзотоксинами A.pleuropneumoniaе.
Actinomyces pyogenes (АР) постоянно обнаруживают на коже и слизистой оболочке респираторного и генитального трактов здоровых свиней. АР вызывает артриты и множественные абсцессы в легких.
В настоящее время для обнаружения патогенов, связанных с респираторными болезнями свиней, широко используют множественную (мультиплексную) полимеразную цепную реакцию. Пробы легких вынужденно убитых больных поросят одновременно исследуют на наличие 6-9 вирусных и бактериальных патогенов. Наиболее часто в пораженных легких обнаруживают ЦВС-2 (18-65%), вирус РРСС (12-42%), М.hyopneumoniae (14-51%) и P.multocida (22-51%). В большинстве случаев (76-88%) в легких выявляют два и более патогенов (11).
Для специфической профилактики инфекционных респираторных болезней свиней разработаны живые и инактивированные вакцины, которые производятся как моно- и комбинированные препараты (2, 3, 7). В связи с тем, что респираторные болезни свиней вызываются различными вирусами и бактериями, для их профилактики следует разрабатывать вирусо-бактериальные комбинированные вакцины.
В НПО НАРВАК для профилактики респираторных болезней свиней разработаны и производятся инактивированные вакцины против репродуктивного и респираторного синдрома, болезни Ауески, сальмонеллеза, пастереллеза и стрептококкоза. В ряде крупных хозяйств применялась так называемая аутовакцина - инактивированная тканевая вакцина, которая обеспечивала снижение отхода поросят в период доращивания примерно в 2 раза, по сравнению с невакцинированными животными. В последние годы разработаны и испытываются в свиноводческих комплексах рекомбинантная вакцина против цирковирусной болезни свиней и комбинированная инактивированная вакцина против пастереллеза, гемофилезного полисерозита и актинобациллезной плевропневмонии свиней (ПГА). Рекомбинантная вакцина против цирковирусной болезни свиней обеспечивала высокую сохранность поросят (более 90%) в период доращивания. В контрольной группе поросят, иммунизированных тканевой вакциной против респираторных болезней, сохранность составляла 82%. Вакцина ПГА снижала заболеваемость поросят респираторными болезнями в периоды доращивания и откорма в 1,5-2 раза по сравнению с невакцинированными животными.
Вакцинопрофилактика инфекционных респираторных болезней свиней не всегда позволяет предупреждать их возникновение. Это связано с низким иммунным статусом свиней в результате воздействия различных факторов, вызывающих ослабление защитных сил организма. К таким факторам относят нарушения технологии производства, параметров микроклимата и скармливание комбикорма, содержащего микотоксины.
Чувствительность животных к микотоксинам предопределена генетически. Из всех сельскохозяйственных животных свиньи, особенно супоросные и подсосные свиноматки и поросята в период доращива-ния, наиболее чувствительны к микотоксинам. Практически все известные микотоксины, даже при низких концентрациях в кормах, подавляют гуморальный и клеточный иммунитет и естественную резистентность свиней. В связи с этим снижается профилактическая эффективность вакцинаций и повышается чувствительность свиней к вирусным и бактериальным патогенам. Подавление иммунной системы свиней мико-токсинами приводит к развитию иммунодефицитного состояния и возникновению вторичных инфекций, вызываемых условно-патогенными микробами. Для минимизации негативного влияния микотоксинов на свиней следует использовать адсорбенты.
Заключение. Инфекционные респираторные болезни свиней широко распространены и причиняют значительный экономический ущерб. В большинстве случаев они протекают как смешанные виру-со-бактериальные инфекции, и для их профилактики необходимы комплексные вакцины. Вакцинопрофилактика респираторных болезней свиней наиболее эффективна в хозяйствах, где соблюдается технология производства, животные обеспечены полноценными кормами и имеют нормальный иммунный статус.
Список литературы
- Кукушкин С.А., Байбиков Т.З., Фомин А.Е. Атипичный (высокопатогенный) репродуктивно-респираторный синдром свиней (обзор литературы)//Ветеринарная патология.-2008.-N°4.-С.37-41.
- Шевцов А.А., Русалеев В.С., Ширяев Ф.А., Потехин А.В. Экономически значимые болезни свиней бактериальной этиологии, методы их диагностики и средства профилактики// Промышленное и племенное свиноводство.-2008.-N°4.-С.31-35.
- Desrosiers R. Control of bacterial respiratory diseases//Proc. 15th IPVS Ojngress.-1998.-P.21-25.
- Done S.H. Porcine respiratory disease complex (PRDC)// The Pig Journal.-2002.-N50.-P.174-196.
- Gillespie J., Opriessnig T., Meng X.J. et al. Porcine circovirus type 2 and porcine cirovirus-associated disease// J. Vet. Intern. Med.- 2009.-Vol.23.-P.1151-1163.
- Halbur P.G. Porcine viral respiratory diseases//Proc. 15th IPVS Congress.-1998.-P.1-9.
- Scheidt A. Control of viral respiratory diseases//Proc. 15th IPVS Congress.-1998.-P.27-31.
- Stevenson G.W. Bacterial pneumonia in swine//Proc. 15th IPVS Congress.-1998.-P.11-20.
- Thacker E.L. Immunology of the porcine respiratory disease complex//Vet. Clin. North America: Food Anim. Pract.-2001.-Vol.17.-P.551-565.
- Tong G.Z., Zhou Y.J., Hao X.F. et al. Highly pathogenic porcine reproductive and respiratory syndrome, China//Emerg. Infect. Dis.-2007.-Vol.13.-P.1434-1436.
- Choi Y.K., Goyal S.M., Joo H.S. Retrospective analysis of etiologic agents associated with respiratory diseases in pigs//Can. Vet.J.-2003.-Vol.44.-P.735-737.
Реферат. В обзорной статье рассмотрены вопросы этиологии, диагностики и профилактики инфекционных респираторных болезней свиней.
Ключевые слова: респираторные болезни свиней, этиология, диагностика, профилактика.
The etiology, diagnostics and prophylactic methods of respiratory infections of pigs has been discussed.
Key words : porcine respiratory diseases, etiology, diagnostics, prophylactic.
Сведения об авторах:
Орлянкин Б.Г., заведующий лабораторией АНО "НИИДПБ"
тел.: (499) 190-75-61
Алипер Т.И., генеральный директор НПО НАРВАК
тел.: (495) 916-00-51
Мишин А.М., старший научный сотрудник АНО "НИИДПБ"
тел.: (499) 190-75-61
4 курса 1а группы
Воронеж
2.Краткие литературные данные о болезни……………. 3
2.2.Возбудитель и его жизнееый цикл……….………………………………. 4
2.3. Эпизоотология заболевания………………………….……………………..6
2.4. Диагностика, профилактика терапия и меры борьбы …………..………. 7
2.5 Экономические потери от заболевания..…………………………………..11
3.1. краткая характеристика хозяйства…………………………..…………….11
3.2. Анализ эпизоотологической обстановки в хозяйстве………..…………..12
3.5. Патологоанатомический диагноз………………….………………………12
3.6. Гельминтологическое вскрытие…………………………………………. 12
3.8. Профилактика заболевания………………………………………………..13
4. Экономическая эффективность……………………………. ……………. 15
Список использованной литературы……………………………………….….18
1.Введение.
Инвазионные болезни имеют широкое распространение среди домашних и диких млекопитающих животных. Фактически мы не знаем ни одного хозяйства, в котором не встречались бы паразитарные болезни. Наиболее распространенными из них являются аскаридатозы, причиняющие значительный экономический ущерб животноводству. У поросят, зараженных аскаридами, снижается привес на 30 и более процентов. Вспышки инвазий сопровождаются значительной гибелью молодняка свиней и нередко взрослого поголовья. Очень опасна закупорка кишечника и его разрыв при суперинвазии аскаридами. В связи с этим в системе противогельминтозных мероприятий важное место занимает углубленное изучение вопросов прижизненной и посмертной диагностики аскаридатозов животных.
2. Краткие литературные данные о болезни
Гельминты живут на нашей планете давно и встречаются во всех климатических зонах, за исключением районов вечной мерзлоты, высокогорий и пустынь. Многие из них были хорошо известны еще задолго до открытия и описания возбудителей других заболеваний: микробов, вирусов, грибков, простейших. Первые сведения об аскаридах содержатся в папирусе Эберса (VI в. до н. э.). Гиппократу (460-470 г. до н. э.) были известны симптомы, характерные для разных классов гельминтов. Об аскаридах имел представление Аристотель, живший в 384-342 гг. до н. э. Ибн-Сина, известный в Европе как Авиценна, изучал возможности лечения людей, пораженных гельминтами. Предлагая использовать для этой цели растительные средства; горькую полынь, тмин, капусту с соком люпина, папоротник мужской, кору свежих веток гранатника и цейлонской корицы. Сейчас науке известно более 270 видов гельминтов. На территории России их более 67 видов, но чаще всего встречаются 18-20 видов.
2.2Возбудитель и его жизненный цикл.
В
озбудители болезни — крупные бледно-серого цвета с желтоватым оттенком нематоды, достигающие в длину до 30 см и более. Самцы по размерам несколько меньше самок (10—22 см.). Тело их с противоположного головному конца сильно изгибается в виде запятой. Самки имеют веретенообразную форму.
Р
азмножение аскарид происходит путем откладывания яиц. Яйца желто-золотистого цвета, имеют округлую форму и довольно крупные размеры (0,056—0,087х0,046—0,057 мм). Наружный слой оболочки усеян выступами — бугристый. В свежевыделенном яйце имеется зародышевое вещество мелкозернистой структуры
Аскариды развиваются прямым путем, т. е. без участия промежуточного хозяина, но с обязательной миграцией личинок в организме дефинитивного хозяина по кровеносному руслу через легкие.
Находясь в тонком кишечнике, половозрелые самки откладывают яйца, которые, продвигаясь по кишечнику и перемешиваясь с калом, выбрасываются во внешнюю среду. Одна самка аскарид в течение суток способна отложить до двух и более тысяч яиц. Свежевыделенные яйца аскарид не представляют опасности для животных и человека. Однако при достаточном наличии во внешней среде тепла, кислорода, влажности воздуха не ниже 60 % в них формируются личинки. Такие яйца уже являются инвазионными, т. е. способными вызвать заражение животных. Срок созревания яиц до инвазионной стадии разный.
Н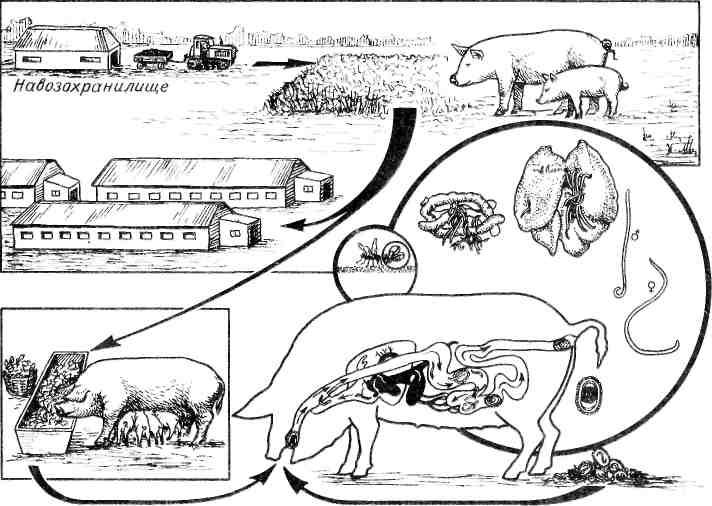
апример, при температуре почвы плюс 30°С, наличии в ней влаги и кислорода воздуха образование подвижных личинок в яйцах аскарид происходит за 9 дней, при температуре 18—24 °С — за 21, а при температуре 12—18 °С — в течение 40 дней (Р. С. Чеботарев, 1972). Заражение происходит при заглатывании инвазионных яиц аскарид вместе с загрязненными кормами и водой
Это часто происходит в свинарнике, когда свиньи вместе с загрязненным кормом и водой проглатывают яйца аскарид. Возможно оно также на пастбище и возле свинарников, вокруг которых почва насыщена яйцами паразита. В кишечнике животных из яиц вылупляются личинки. Последние прободают слизистую оболочку кишечника, попадают в кишечные вены и с током крови через воротную вену заносятся в печень. Из печени личинки через полую вену, правое сердце и легочную артерию проникают в капилляры легких, где задерживаются некоторое время, подрастают и внедряются в легочные альвеолы, мигрируют в бронхиолы, бронхи и трахею, а затем из трахеи откашливаются в ротовую полость и заглатываются со слюной. Через 1,5 – 2,5 месяца в тонком кишечнике они превращаются во взрослых самцов и самок.
В тонком отделе кишечника аскариды противостоят волне перистальтики, дугообразно изгибаясь и упираясь головным и хвостовым концами тела в стенку пищеварительной трубки. Питаются аскариды поверхностным слоем слизистой оболочки и содержимым кишечника. После 7 – 10 месяцев паразитирования аскариды самопроизвольно покидают кишечник, выделяясь с фекалиями. Неблагоприятные для гельминтов условия (инфекционные заболевания поросят, повышенная температура их тела и некоторые корма) сокращают срок пребывания их в теле дефинитивного хозяина. В кишечнике поросят количество аскарид может колебаться от единичных экземпляров до нескольких сотен и тысяч нематод.
2.3 Эпизоотология возбудителя.
Аскаридоз свиней распространен повсеместно. Наибольшая напряженность инвазии наблюдается у поросят-сосунов и молодняка в возрасте до 6 -7 месяцев. Взрослые свиньи болеют аскаридозом редко и чаще являются паразитоносителями. Животные заражаются аскаридозом чаще в стойловый период в помещениях с деревянным полом, реже на пастбищах, проглатывая с загрязненным кормом и водой инвазионные яйца аскарид. Наибольшее заражение аскаридозом происходит в хозяйствах, в которых свинарники расположены на песчаных и супесчаных рыхлых и скудных почвах. Неполноценное кормление, особенно недостаток в рационе витаминов А и В1, снижает устойчивость животных к заражению и способствует массовому переболеванию поросят с высокой интенсивностью инвазии и большим процентом смертности. Плохие санитарные условия содержания животных, несвоевременная уборка навоза, нерегулярная очистка свинарников способствуют распространению инвазии. Инвазионные яйца аскарид механически разносятся на ногах и коже зараженных животных, лапках мух; вместе с пылью они попадают в корма и воду. Кроме кольчатых червей, личинки возбудителя аскаридоза свиней длительное время сохраняются в организме мух, личинках жуков и других насекомых. Яйца аскарид очень устойчивы к воздействию на них неблагоприятных факторов внешней среды. Они до 2,5 лет могут сохраняться в песчаной и супесчаной почве. Яйца весьма устойчивы и к химическим веществам. Они развиваются в 2 % растворе формалина, хотя инвазионных свойств при этом не приобретают, противостоят 4 – 5 % раствору щелочи, растворам сулемы. Губительно воздействуют на яйца аскарид 3 – 5 % горячие растворы (60 0 С) щелочей, негашеная известь в момент гашения, 4 – 5 % раствор карболовой кислоты при экспозиции не менее 24 ч. Горячая вода (60 0 С) при кратковременном воздействии убивает лишь до 40 – 50 % яиц аскарид. Инвазионные яйца аскарид свиней представляют большую опасность для человека.
2.4 Диагностика, профилактика, терапия и методы борьбы.
В самом начале развития болезни, когда в фекалиях животных еще невозможно обнаружить яйца аскарид, диагноз ставят предположительный. Основанием должны служить эпизоотологические данные хозяйства по этому гельминтозу, возраст заболевших животных и клиническое проявление болезни.
Окончательное определение болезни в ранней стадии может базироваться на результатах иммунобиологического обследования больных. С этой целью внутрикожно в области наружной поверхности ушной раковины вводят антиген, приготовленный из аскарид. Вокруг места введения антигена у зараженных аскаридами поросят через 5 мин на коже появляется вишневого цвета ободок, который сохраняется 30 — 40 мин, а иногда и более. По размерам, длительности сохранения и интенсивности окраски названного ободка судят о степени выраженности реакции, а следовательно, и интенсивности заражения животного аскаридами. Если на месте введения антигена припухлость и покраснение не появляются, аллергическая проба считается отрицательной. При помощи внутрикожной реакции выявляют аскаридозную инвазию у поросят уже на 11—21-й день после заражения.
Свиньи, зараженные трихоцефалами, эзофагостомами и другими нематодами, на аскаридный антиген не реагируют. Достоверность реакции при преимагинальном аскаридозе 85,5.%.
Для определения зараженности или постановки диагноза на аскаридоз в более поздний период жизни животного применяют копрологическое обследование свиней по методу Фюллеборна, Дарлинга или Щербовича. Молодняк до двухмесячного возраста так обследовать не рекомендуется, так как к этому времени аскариды еще не достигают половой зрелости и не выделяют яйца. Яйца овальной формы, темно-коричневого или серого цвета, покрыты толстой скорлупой, состоящей из четырех оболочек: наружной бугристой, двух средних и внутренней. Яйца Ascaris suum – 0,050 – 0,087 мм длиной и 0,040 – 0,050 мм шириной.
Посмертный диагноз основывается на обнаружении (при вскрытии трупов) взрослых аскарид и тех изменений, которые они способны вызвать в организме животного на разных стадиях паразитирования.
В период миграции личинки находят в лимфатических узлах, печени, легких. Поверхность печени покрывается множеством беловатых очажков или пятен величиной 2 – 5 см (бело-пятнистая печень). Очаги кровоизлияний и пневмонические фокусы в легких также придают им пятнистый вид. Гистологически на поверхности печени обнаруживают мелкие и крупные узелки с некрозом в центре и точечные кровоизлияния. Некротические очаги представляют собой участки печеночной паренхимы, захватывающие десятки долек с распадом в центре как паренхиматозных клеток, так и клеток инфильтрата, состоящего преимущественно из эозинофилов. Междольковая соединительная ткань расширена и инфильтрирована эозинофилами в различной степени, в зависимости от количества личинок. Гистологические изменения в легких выражены в форме очаговой инфильтрации гистиоцитного характера, слущивания альвеолярного эпителия, увеличения числа альвеолярных фагоцитов
и появления эпителиоидных и гигантских клеток.
Компрессорным способом или методом Бермана можно обнаружить личинок и взрослых аскарид в легочной и печеночной тканях (Рис 2)Взрослые аскариды при большом скоплении вызывают катаральное воспаление слизистой оболочки тонкого отдела кишечника.
Проводят гельминтологическое вскрытие тонкого отдела кишечника с последующим промыванием содержимого кишечника методом последовательных смывов. Аскариды – крупные гельминты, и их видно визуально. Гельминтов собирают, подсчитывают и, если нужно для сохранения, фиксируют в жидкости Барбагалло (3 % раствор формалина в изотоническом растворе поваренной соли).
При лечении рекомендуется применять Новомек 1% в дозе 1 мл на 50 кг массы тела подкожно, однократно.
В настоящее время для лечения свиней при аскаридозе рекомендуются многие химиопрепараты, обладающие сравнительно высокой антгельминтной эффективностью и наименьшей токсичностью для организма животного. К таким препаратам относятся пиперазин-гексагидрат и его соли (пиперазин-фосфат, сульфат, адипинат, цитрат). Его назначают 2 раза в день по 0,3 г/кг утром и вечером вместе с кормом групповым методом молодняку весом до 50 кг в течение двух дней. Нужное количество препарата в расчете на группу свиней необходимо тщательно перемешать с небольшой порцией корма и затем объединить его со всем объемом корма, предназначенного для разовой дачи. С целью более полного поедания препарата количество корма в день проведения дегельминтизации уменьшают наполовину. Тяжелобольных, слабых поросят дегельминтизируют небольшими группами.
Для удобства дегельминтизации можно приготавливать комбикорм с примесью пиперазина (15 кг/т корма) и скармливать его как обычный корм из расчета 40 г на 1 кг веса животного, но не более 2 кг такого корма в течение одного дня. Молодняку лечебный корм следует сдабривать молоком, обратом, молочной сывороткой или мясным бульоном. Употребление воды не ограничивают, слабительных средств не назначают.
Однако, несмотря на высокую эффективность, экономический фактор (дороговизна препарата и большие дозы его) нередко диктует замену пиперазина другими препаратами.
Применяют кремнефтористый натрий, который назначают групповым методом по двухдневной схеме в дозах: поросятам-сосунам весом 15—20 кг — 0,3 г, поросятам весом 20—40 кг — 0,5 г и весом более 40 кг — 0,7 г на прием три раза в день (утром, днем и вечером). Массовое отхождение аскарид наблюдается на 3—4-й день после дачи препарата.
Разработан метод косвенного дозирования кремне-фтористого натрия при кормлении свиней сухими кормами из самокормушек
(Ю. Я. Дольников, 1970). При этом к суточному объему корма, рассчитанному для данной группы свиней, в течение трех дней подряд примешивают 0,25 % препарата к весу сухого корма и задают его в самокормушки. Установлено, что в течение этого времени животные поедают медикаментозного корма по 33— 35 г/кг, в котором содержится 83—88 мг кремнефтористого натрия. Указанная доза обеспечивает у поросят весом 20—45 кг и у свиней 50—70 кг экстенсэффективность (ЭЭ) 92—100%. При постепенном поедании в течение дня сухого корма с препаратом животные легко переносят более высокие дозы последнего.
Кремнефтористый пиперазин (КФП) содержит в своем составе два разных по химической природе антгельминтных начала — основание пиперазина (37,4,%) и анион кремнефтористой кислоты (62,6%). Препарат синтезирован в Сибирском научно-исследовательском ветеринарном институте. По данным Ю. Я. Дольникова, при даче внутрь поросятам сухого комбикорма с примесью 0,35 % кремнефтористого пиперазина в течение трех дней они освобождаются от аскарид на 100 %. Тиабендазол применяют в дозе 50—70 мг/кг два раза в сутки в течение двух дней подряд.
Тетрамизол назначают в дозах 10—15 мг/кг, тетрамизол-гранулят 20 %-ный в дозе 125 мг/кг по одному разу в сутки два дня подряд с кормом групповым методом. Экстенсэффективность достигает 100%.
В литературе имеется много сообщений, что препараты диптерекс, хлорофос, галаксон, атгард У и другие, относящиеся к группе фосфорорганических соединений, обладают высокой антгельминтной эффективностью, малой токсичностью для теплокровных животных. Диптерекс при назначении в смеси с кормом в дозах 0,1 г/кг (по АДВ-80|) один раз в сутки два дня подряд групповым методом скармливания обеспечивает при аскаридозе экстенс- и интенс- эффективность, равную 100%, и губительно действует на других нематод.
Гигромицин Б — это пока единственный антибиотик, обладающий антгельминтным свойством. Скармливание его в течение 1,5 месяца в смеси с кормом из расчета 12 млн. ЕД на одну тонну корма предупреждает появление аскаридоза. Корм с добавлением гигромицина Б в указанной дозе или кормового гигроветина из расчета 1,4 кг/т (19 000 ЕД/г) следует приготавливать на комбикормовых заводах. Такой способ назначения препарата удобен для применения на крупных свиноводческих фермах.
Кормовой люпин, клевера разных сортов, хвойная мука, тыква, амарантус и некоторые другие растения при использовании их в корм в свежем виде, а также приготовленные из них силос или мука подавляют биологическую активность аскарид в организме свиней. Кроме того, на фоне таких рационов повышается лечебная эффективность химических антгельминтиков.
Читайте также:


