Синдром хронической бактериальной интоксикации

Стрептококковая инфекция развивается в ротовой полости, в желудочно-кишечном тракте и в глотке. Бактерии, относящиеся к данному виду, распространены также в области половых органов женщин и дыхательных путях.
Стрептококк вызывает ряд заболеваний, проникая в различные ткани, системы и органы (мочевыводящие пути, мозг, сердце и кровь).
Проявляется стрептококковая инфекция в виде различной симптоматики. Человек может быть носителем инфекции, что в последнее время является очень распространенным. В данном случае носитель не ощущает на себе патогенного воздействия стрептококков, так как его иммунитет способен справляться с данными бактериями.
Стрептококковая инфекция представляет собой группу заболеваний: скарлатина, рожа, генерализованные и местные гнойные и воспалительные процессы (абсцесс, фурункул, флегмона, раневая инфекция, остеомиелит, эндокардит и стрептококковый сепсис). Стрептококки являются причиной возникновения ревматизма и воспалительного процесса в области почек. Болезнетворным воздействием стрептококка является способность произведения ядов (токсинов). Патогенный микроорганизм негативно воздействует на ткани сердца и кровяные клетки, вызывая расширение мелких сосудов.
Клиническая классификация стрептококковых инфекций: первичные – респираторные инфекции (фарингиты, ангина, ОРЗ, отиты), кожные инфекции (эктима, импетиго, стрептодермии), скарлатина, рожа. Вторичные – негнойные, обладающие аутоиммунным механизмом (ревматизм, васкулиты, гломерулонефрит), токсико-септические, не имеющие аутоиммунного компонента (перитонзиллярный и метатонзилярный абсцесс, некротическое поражение тканей, септические осложнения). Редкие – миозит, некротический фасцит, энтерит, синдром токсического шока, первичный перитонит, очаговое поражение внутренних органов, сепсис.
В практике инфекциониста из стрептококковых инфекций наиболее часто встречаются стрептококковые ангины и рожа. Значимость изучения этих заболеваний определяется их нередко тяжелым течением, осложнениями и неблагоприятными последствиями. Острое течение и обострение хронического течения этих заболеваний могут осложниться развитием нагноений, развитием сепсиса и инфекционно-токсического шока [9]. Хроническое рецидивирующее течение рожи может привести к развитию слоновости и инвалидизации пациентов. Перенесенная ангина способствует возникновению так называемых тонзиллярных заболеваний (ревматизм, гломерулонефрит, пиелонефрит, миокардит и др.) [3, 10-12].
Стрептококковые инфекции сопровождаются развитием синдрома интоксикации, степень которой нередко определяет исходы заболеваний и тактику терапии, выбираемую врачом.
Одним из основных показателей тяжести патологического процесса при инфекционной патологии и в частности у больных со стрептококковыми инфекциями, является синдром интоксикации. При его правильной и своевременной оценке в более ранние сроки назначается адекватная терапия и соответственно повышается эффект от проводимого лечения, в более короткие сроки купируются патологические симптомы, уменьшается время пребывания больного в стационаре.
Синдром эндогенной интоксикации играет значительную роль в патогенезе ряда заболеваний ка инфекционной, так и неинфекционной природы и часто определяя их течение и прогноз. Эндогенная интоксикация представляет собой сложный процесс, обусловленный биологической активностью большой и разнообразной группы веществ, в норме вовремя удаляемых из организма (мочевина, креатинин, промежуточные продукты метаболизма, накапливающиеся в повышенной концентрации, продукты свободнорадикального окисления и т.д.). В последние годы эндогенную интоксикацию стали сопоставлять с низко- и среднемолекулярными белками и именно их считают маркерами эндогенной интоксикации [1, 4-7].
Цель исследования. Изучить в патогенезе стрептококковых инфекций роль накопления в биологических жидкостях организма веществ низкой и средней молекулярной массы и стадии интоксикации в зависимости от периода и тяжести течения заболеваний.
Материалы и методы. Было обследовано 38 больных рожей и 25 стрептококковыми ангинами в возрасте от 27 до 62 лет, находившихся на лечении в инфекционном стационаре. У 21 больного ангинами выявлены стрептококки группы А (гемолитический стрептококк и др.), у 4 – одновременно высеяны стрептококк и золотистый стафилококк. У всех больных рожей было диагностировано первичное заболевание, эритематозная и эритематозно-буллезная форма. Все больные ангинами поступили в остром периоде болезни. С учетом местных изменений у 5 больных диагностирована катаральная ангина, у 11 – фолликулярная, у 9 – лакунарная. У всех пациентов заболевания протекали в среднетяжелой и тяжелой форме.
Уровень веществ низкой и средней молекулярной массы определяли по методу М. Я. Малаховой (1996) с использованием подсчета по О. Л. Гребневой с соавт. (2003) [2, 3]. Для характеристики закономерных фаз развития эндогенной интоксикации, заключающихся в количественном нарастании и распределении ВН и СММ между плазмой и эритроцитами и выведении их с мочой у части больныхопределяли коэффициенты интоксикации К1, К2 и К3 [6]. Больные были обследованы в периоде разгара, угасания клинических симптомов и ранней реконвалесценции.
В ходе проведенных исследований было обнаружено максимальное повышение ВН и СММ во всех биологических средах организма в периоде разгара заболевания у всех обследованных больных. Однако у больных с рожей в среднем изменения были выражены больше (при роже в плазме крови значения ВН и СММ в среднем превышали показатели у здоровых в 1,9, в эритроцитах в 1,5, а в моче – в 1,9 раз, тогда как при ангине: в плазме крови в 1,5; в эритроцитах в 1,3, а в моче – в 1,6 раз) (таблица). У незначительного количества больных исследуемые показатели оказались близки к норме.
Содержание ВН и СММ в плазме крови, эритроцитах и моче у больных рожей и стрептококковой ангиной (усл. ед.)

Еще в XIX в. врач Понтер заметил нездоровый цвет лица некоторых больных, наличие у них невротических расстройств, анемии, нарушений пищеварения. При этом в последствии выявилось, что у всех пациентов в полости рта имелись зубы с некротизированной пульпой. После удаления таких зубов наступило значительное улучшение состояния больного или полное выздоровление. В 1910 г. Гюнтер сформулировал понятие об очаговой инфекции полости рта и ротовом сепсисе, которое быстро распространилось за рубежом и имело много сторонников.
В XX в. в работах американских ученых Биллингса и Розенау была разработана доктрина ротового сепсиса. В своей работе ученые обращали внимание на то, что стрептококки и стафилококки могут изменять свою вирулентность в зависимости от условий внешней среды, а именно от содержания в ней кислорода. Кроме этого, патогенные микроорганизмы через ток крови могут проникать из очага одонтогенной инфекции во внутренние органы, по отношению к которым они обладают определенным сродством. Отсюда следовал вывод, что любой зуб с некротизированной пульпой подлежит обязательному удалению. На практике данная доктрина проявлялась массовым удалением зубов с хроническими очагами одонтогенной инфекции и некрозом пульпы.
В дальнейшем доктрина подверглась критике, так как были получены новые данные и вскрыт ряд методических ошибок в экспериментах, проведенных Биллингсом и Розенау. Также были разработаны новые методы консервативного лечения, направленные на сохранение зубов.
Под понятием эндогенная интоксикация подразумевают нарушение жизнедеятельности, вызванное токсическими веществами, образовавшимися в организме. В качестве токсических веществ могут выступать активированные ферменты, продукты обмена веществ в высоких концентрациях, продукты перекисного окисления липидов, медиаторы воспаления, компоненты комплемента, бактериальные токсины [5].
Важную роль в этиологии хронических очагов одонтогенной инфекции играет микробный фактор. В очагах одонтогенной инфекции обнаруживаются ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий.

Микроорганизмы рода Микроорганизмы рода
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. Выделяемые токсины нарушают тонус периферических сосудов, механические свойства форменных элементов крови, вследствие этого развивается тканевая гипоксия, которая является одним из важных звеньев патогенеза эндогенной интоксикации [4]. Токсины также блокируют места связывания молекул альбумина, это в свою очередь приводит к снижению эффективности медикаментозного лечения, так как данный белок является транспортным агентом для многих фармакологических препаратов.
В течение последних лет были выяснены некоторые механизмы хронизации острых инфекционных одонтогенных. Данные механизмы заключается в том, что в период острого воспаления в периодонте накапливаются антигены, прежде всего эндотоксины грамотрицательных бактерий. Эндотоксины оказывают антигенное воздействие на иммунное состояние периодонта и окружающих его тканей. Реакция тканей периодонта на непрерывное раздражение антигенами, поступающими из канала корня зуба, проявляется в виде антигенозависимых и клеточно-обусловленных процессов [4]. К антигенозависимым относятся иммунокомплексы реакции типа Артюса и IgЕ-обусловленные реакции, к клеточно-обусловленным — реакции гиперчувствительности замедленного типа [2].
Хроническое воспаление в периодонте при нормальном состоянии иммунной системы рассматривается как защитный барьер, предотвращающий распространение продуктов распада тканей, микроорганизмов и их токсинов в общий кровоток из зоны инфекционного воспаления.
Масштаб иммунного ответа может быть различным, он может протекать на уровнях всего организма, то есть генерализовано или быть локализованным, например, при пульпите отмечаются изменения в иммунологических показателях преимущественно материала из десневой борозды, в меньшей степени — в иммунограмме ротовой жидкости, и совсем едва заметные сдвиги — в иммунограмме периферической крови [4].
К хроническим стоматогенным очагам инфекции относят верхушечные периодонтиты, околокорневые и фолликулярные кисты зубов, многие заболевания краевого пародонта и слизистой оболочки полости рта (гингивиты, пародонтиты, язвенно-некротические стоматиты и т. п.), кариес зубов и др. Хронические стоматогенные очаги инфекции составляют более 50 % очагов хронической инфекции организма.
При появлении стоматогенной инфекции происходит мобилизация защитных сил организма человека, которая достаточна для компенсации влияния этого очага за его пределами. Такое состояние компенсации может поддерживаться неопределенно длительное время. Однако самые различные экзогенные и эндогенные факторы, чаще неспецифического характера (перегревание или переохлаждение организма, переутомление, резкое изменение микроклимата или условий труда и быта человека, перенесенные заболевания и т. п.), приводят к быстрому истощению компенсаторных возможностей организма, активизации инфекции и возникновению обусловленных заболеваний [3].
Взаимосвязь очага хронической стоматогенной инфекции и организма имеет весьма сложный характер. Условно можно выделить несколько основных патогенетических механизмов.
1. Рефлекторный механизм.
Главным фактором является сам инфекционный агент (микробы и их токсины), который создает в очаге активные рецепторные поля раздражения. Рецепторные поля в свою очередь рефлекторно через центры головного мозга вызывают нарушение функции вегетативной нервной системы и регуляции работы внутренних органов и систем организма с последующим развитием в них функциональных и дистрофических изменений.
В клинической практике можно наблюдать такое явление, как проглатывание больным гноя, выделяющегося из зубодесневых карманов при пародонтите или из свища при хроническом гранулематозном или гранулирующем периодонтите и околокорневой кисте челюсти.
3. Низкий уровень иммунологической реактивности организма человека.
Под этим механизмом подразумевается, что микробы из очага стоматогенной инфекции проникают в кровеносное русло, что клинически определяется как острый сепсис. С целью подтверждения диагноза проводят бактериологическое исследование, то есть посев крови на питательные среды для выявления возбудителя и определения его антибиотикорезистентности.
Поступление в кровь токсинов микроорганизмов, находящихся в очаге хронической стоматогенной инфекции, обусловливает затяжной субфебрилитет, изменения в картине крови и другие характерные клинические симптомы.
5. Аллергические механизмы.
Бактерии, находящиеся в очагах инфекции, вызывают образование специфических антител и как следствие, сенсибилизацию организма. При вторичном инфицировании человека тем же видом микроорганизма возникают более выраженные симптомы воспалительной реакции.
6. Аутоиммунный механизм.
В крови человека появляются цитотоксины (антигены тканевого происхождения), которые образуются вследствие повреждения тканей и распада белка. Цитотоксины, являясь аутоантигенами, также изменяют чувствительность организма человека и вызывают его сенсибилизацию и хронизацию воспалительного процесса.
Воспалительные процессы, локализующиеся в челюстно-лицевой области, сопровождаются эндогенной интоксикацией, которая связана с поступлением в кровь эндотоксинов лизосомального происхождения, продуктов распада тканей, токсинов микроорганизмов и других токсических продуктов, которые образуются в самом организме в результате нарушений жизненных функций.
Клинические симптомы эндогенной интоксикации могут быть вариабельны, они зависят от иммунологической реактивности организма человека.
К субъективным проявлениям хронической стоматогенной интоксикации относятся головная боль, головокружение, быстрая утомляемость, чувство тяжести в голове, общая слабость, дрожание рук, потливость, плохой сон.
К объективным проявлениям относятся субфебрильная лихорадка, лимфаденит в области подчелюстных и подбородочных лимфатических узлов, изменения в картине крови. Отмечается лабильность лейкоцитарной формулы (лимфо- и моноцитоз, лейкопения, эозинофилия). Уменьшается количество гемоглобина и снижается количество эритроцитов (вторичная анемия). СОЭ возрастает до 40 мм/ч и более. Отмечаются сдвиги в белковых фракциях крови за счет увеличения процента глобулинов [1].
Для определения нарушений капиллярного кровообращения в очаге воспаления были предложены: 1) методика капилляроскопии;
2) гистаминовая проба;
4) проба на конгорот;
5) определение чувствительности к адреналину;
6) вакцинодиагностика и некоторые другие.
Наиболее доступным методом является гистаминовая проба. Ее проводят в виде гистаминового подслизистого теста, для этого в слизистую оболочку десны в области предполагаемого хронического одонтогенного очага вводят 0,3—0,5 мл гистамина (1: 1000). Через 1 - 2 ч в области пораженного периодонтитом зуба появляются самопроизвольные боли, а также положительная перкуторная реакция (боли при накусывании).
Более практичным методом является конъюнктивальная гистаминовая проба, для ее проведения в конъюнктивальный мешок закапывают 1 - 2 капли гистамина в разведении 1: 100 000 или 1 :500 000 [1]. При наличии в челюстно-лицевой области очагов хронической интоксикации уже через 1 мин появляется расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Реакция не сопровождается неприятными ощущениями и исчезает через 10 мин.
Однако, по мнению многих авторов, чувствительность этой пробы недостаточна высока, так как положительная реакция может наблюдаться у лиц с аллергическими заболеваниями.
Более точным способом является электротест. Методика проведения заключается в том, что пассивный электрод от аппарата постоянного тока больной удерживает в руке, а активным электродом в виде кисточки, смоченной в изотоническом растворе хлорида натрия, проводят по обследуемому участку кожи в течение нескольких секунд. Сила тока при проведении исследования доводят до 15 мА, а напряжение в пределах 15—25 В. При наличии очага на коже лица появляется реакция в виде покраснения с одновременным покалыванием в области проекции больного зуба [1,2].
Лечение при стоматогенных очагах инфекции и интоксикации оно должно быть строго индивидуально. Больной с подозрением на ротовую интоксикацию должен быть детально обследован в условиях стационара.
Выявление одонтогенных очагов производится по следующей схеме:
1) клинически выявляют все зубы с некротизированной пульпой и находящиеся под искусственными коронками;
2) производят рентгенологическое обследование всех корней и каждого в отдельности зуба, подозреваемого на первичный инфекционный очаг;
3) выявляют десневые и пародонтальные карманы, особенно те, которые вызывают обострение воспалительного процесса;
4) исследуют регионарные лимфатические узлы (подбородочные, подчелюстные, шейные);
5) производят анализ крови;
6) делают гистаминовую пробу, электротест и т. д.
На первом этапе стоматологической санации проводят хирургическое удаление инфекционных околозубных очагов воспаления. Стоматологическое вмешательство должно сочетаться с лечением основного заболевания. Клинические проявления обострений ликвидируются уже на 3—4-й день после хирургического удаления стоматогенных очагов инфекции, а восстановление биохимических показателей наблюдается через 1,5—2 недели [2].
На втором этапе санации проводят консервативное лечение кариеса зубов, а также болезней пародонта, хронических заболеваний слизистой оболочки рта.
В качестве профилактики хронической стоматогенной интоксикации служит плановая санация полости рта как у организованного населения (в детских садах, школах, на промышленных предприятиях), так и у всех лиц, обратившихся за стоматологической помощью. Необходимо 2 раза в год проводить профилактические осмотры, которые позволяют выявить новые инфекционные локальные очаги хронической инфекции и интоксикации организма и своевременно провести их консервативное или хирургическое лечение.

Что же касается интоксикации, то этот термин означает отравление любыми вредными веществами – от угарного газа и алкоголя до несвежих продуктов. Интоксикация может быть острой – и в этом случае необходимо обращаться к врачам. Но постоянное поступление небольших количеств вредных веществ в организм вызывает хроническую интоксикацию. Они накапливаются в организме и постепенно начинают влиять на обмен веществ, состояние всех органов и систем. Но так как это происходит не за один день, человек не всегда может заметить происходящие с ним перемены.
Почему возникает хроническая интоксикация?
- Рассмотрим наиболее распространенные источники поступления вредных веществ:
- Хронические инфекции, гельминтозы и т.д. Постоянное нахождение в организме патологических микроорганизмов или гельминтов означает, что они все время выделяют в кровь те самые токсины, которые являются ядами для человека.
![]()
Нездоровое питание: жирная пища, фаст-фуд, продукты с большим содержанием консервантов, усилителей вкуса и транс-жиров.- Лекарственные препараты. Они необходимы и это бесспорно. Но многие лекарства негативно действуют на органы выделения (печень и почки) и, с одной стороны, в целом ухудшают выведение всех вредных веществ из организма, а с другой стороны, сами находятся в организме дольше. Продукты распада многих лекарств также влияют на обмен веществ и отравляют организм. Особенно опасны с точки зрения интоксикации антибиотики и гормональные препараты.
- Загрязненный воздух и вода.
- Алкоголь.
- Табакокурение.
- Употребление наркотических веществ.
Симптомы хронической интоксикации
Основные симптомы состояния хронической интоксикации:
![]()
Снижение иммунитета, частые болезни, обострение хронических заболеваний.- Синдром хронической усталости: низкая работоспособность, ухудшение памяти, вялость, раздражительность, слабость. Ощущение усталости не исчезает даже после качественного отдыха.
- Нарушение работы ЖКТ: поносы, запоры, метеоризм, ощущение тяжести.
- Потливость, нарушение терморегуляции.
- Налет на языке, неприятные ощущения во рту, неприятный запах из ротовой полости.
- Неприятный запах тела.
- Кожные заболевания: акне, различные сыпи, повышенная жирность или сухость кожи.
- Аллергические реакции.
- Нарушение режима сна.
- Изменения во внешности – ухудшение состояния кожи, волос, ногтей.
Как справиться?

Единственный способ избавиться от вредных веществ в организме – принимать сорбенты. Это вещества, которые поглощают и выводить из организма вредные вещества: яды, продукты метаболизма лекарств, аллергены, продукты жизнедеятельности вредных микроорганизмов и паразитов и т.д.
Выбирая сорбент, рассчитывайте, что вам придется принимать его две недели. Поэтому избегайте тех сорбентов, которые могут вызывать запоры, раздражение кишечника или имеют неприятный вкус.

Необходимо учесть, что эффект, полученный даже с помощью самого действенного сорбента, будет кратковременным, если не изменить образ жизни и отношение к своему здоровью. Очень важно минимизировать поступление вредных веществ в организм – перестать употреблять нездоровую пищу, избавиться от вредных привычек, соблюдать питьевой режим, стимулировать обменные процессы организма активным образом жизни. Каждый раз, когда организм подвергается усиленной атаке (после курса лекарств, болезни, нахождения в зоне повышенного промышленного загрязнения, злоупотребления алкоголем или вредной тяжелой едой) необходимо устраивать ему небольшой сеанс детоксикации, с помощью эффективных и безопасных сорбентов.

Системные проявления инфекционного процесса наблюдаются при многих острых и хронических заболеваниях печени вирусной, аутоиммунной, токсической и наследственной этиологии. Описан большой спектр внепечёночных поражений при HCV-инфекции. Частота их, по результатам исследований больших групп больных хроническим вирусным гепатитом С (ХВГС), составляет в странах Европы от 40 до 74 %, в Северной Америке - 38 %, в России - 47 %. Обнаружена репликация HCV в мононуклеарных клетках крови, в клетках костного мозга, в лимфоидной ткани лимфатических узлов и селезенки, яичниках и яичке. Роль HCV, как основного или одного из этиологических факторов, доказана при смешанной криоглобулинемии (СКГ), мезангиокапиллярном гломерулонефрите, узелковом периартериите, В-клеточной неходжкинской лимфоме, иммунной тромбоцитопении, синдроме Шагрена, сахарном диабете II типа, аутоиммунном тиреоидите, поздней кожной порфирии, красном плоском лишае [6].
HCV-индуцированная СКГ характеризуется широким спектром клинико-лабораторных проявлений - это васкулиты, периферическая невропатия, болезнь Рейно. Часто у больных наблюдается сочетание прогрессирующей общей слабости, артрита или артралгий и двухсторонней пальпируемой пурпуры (более 90 % случаев), поражающей чаще голени, имеющей рецидивирующее течение [5]. Артралгии встречаются в 33-44,7 % случаях и локализуются в пястнофаланговых, проксимальных межфаланговых, бедренных, коленных и голеностопных суставах [7]. Дистальная сенсорная полинейропатия определяется у 5-45 % пациентов, а при использовании элекромиографического исследования и определения скорости проведения возбуждения по нерву - у 70-80 % больных [4]. Поражение симметрично, и возможно как в отсутствии криоглобулинемии, так и с её наличием в 21-41 % случаев [7]. Наиболее частым почечным проявлением HCV-инфекции является мембранопролиферативный гломерулонефрит (до 75-80 %), как правило, в сочетании с СКГ, реже мезангиопролиферативный (до 25 %) и ещё реже мембранозный гломерулонефрит без СКГ (до 5,49 %). У 50 % больных отмечались изолированная протеинурия и микрогематурия, в 25 % случаев имел место выраженный нефротический синдром [2]. Поражения кожи в виде некротизирующего васкулита с папулезными или петехиальными высыпаниями, обусловленный отложением криоглобулинов, наиболее четко ассоциирован с HCV-инфекцией. Иногда васкулит может поражать и другие органы: почки, печень, сердце, центральную нервную систему [4]. Поражение ЖКТ чаще выражается в абдоминалгиях (до 20 % случаев), связанных с васкулитом сосудов брыжейки [5]. Доказан тропизм HCV к слюнным железам. Среди лиц с HCV-инфекцией синдром Шегрена обнаруживается чаще. Сиалоаденит встречается у 14-57 % больных ХГС [6].
Воздействие инфекционного агента и его токсинов на многие органы и системы у больных HCV-инфекцией является одним из факторов, обусловливающих возникновение внепечёночных проявлений [3]. Синдром эндогенной интоксикации (СЭИ) начинает формироваться при ОВГ вследствие цитолиза гепатоцитов и нарастающего снижения дезинтоксикационной и белоксинтезирующей функции печени. Оценка степени СЭИ может проводиться на основе показателей связывающей способности сывороточного альбумина, выполняющего, в том числе, транспортную и дезинтоксикационную функцию [1].
Мало освещены в литературе вопросы влияния степени тяжести ВГС и формы патологического процесса на частоту появления и вариантах внепечёночных поражений. Накопленные данные по срокам возникновения внепечёночных проявлений при HCV-инфекции не имеют чёткой закономерности. Существует проблема малой диагностической настроенности клинициста по выявлению внепечёночных поражений при вирусных гепатитах.
Цель исследования: оценить характер внепечёночных проявлений у больных HCV-инфекцией и определить степень выраженности СЭИ.
Материалы и методы исследования
В исследовании участвовали 146 человек с HСV-инфекцией. Среди пациентов у 38 диагностирован острый ВГС, у 108 - хронический ВГС. По половому признаку больные распределились соответственно: 101 (64,6 %) мужчина и 45 (35,4 %) женщин. Средний возраст составил 31,3 ± 1,5 лет. Критериями включения являлись:
1. Серологическое подтверждение HСV-инфекции методом ИФА.
2. Обнаружение RNA HСV в сыворотке крови методом ПЦР.
3. Выявление внепечёночных поражений: поражение суставов, появление различных вариантов экзантемы, наличие узелкового периартериита, клинико-инструментальные данные поражения сердечно-сосудистой системы, клинико-лабораторные признаки нефритического или нефротического синдромов начиная с преджелтушного периода при ОВГС и после подтверждения диагноза ХВГС.
Жалобы отслеживали в динамике: при поступлении и в течение первых суток госпитализации (1-4 сутки болезни), в период разгара желтухи (8-15 сутки болезни) и в период реконвалесценции перед выпиской из стационара (20-31 сутки болезни). Пациентам с поражением сердечно-сосудистой системы трёхкратно проведён ЭКГ мониторинг и рентгенологическое исследование однократно.
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
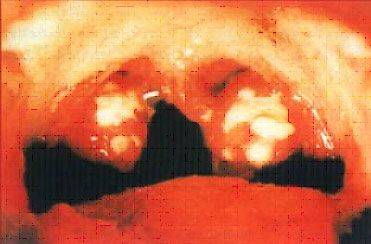
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
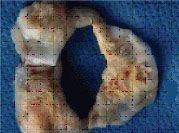
Аортальный клапан
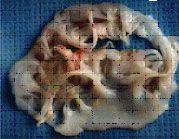
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Читайте также:




