Интоксикация при хроническом лимфолейкозе
ЧТО ТАКОЕ ХРОНИЧЕСКИЙ ЛИМФОЛЕЙКОЗ?
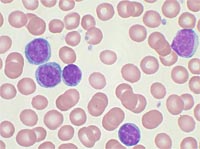
Хронический лимфолейкоз - это онкологическое заболевание лимфатической ткани, при котором опухолевые лимфоциты накапливаются в периферической крови, костном мозге и лимфатических узлах. В отличие от острых лейкозов, опухоль растет достаточно медленно, вследствие чего нарушения кроветворения развиваются лишь в поздних стадиях развития заболевания.
СИМПТОМЫ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА
- Слабость
- Увеличение лимфатических узлов
- Тяжесть в животе (в левом подреберье)
- Склонность к инфекциям
- Потливость
- Снижение массы тела
Чаще всего первым симптомом хронического лимфолейкоза является увеличение размеров лимфатических узлов. Вследствие увеличения селезенки, возможно возникновение ощущения тяжести в животе. Нередко больные испытывают значительную общую слабость, теряют вес, у них повышена частота развития инфекционных заболеваний. Симптомы развиваются постепенно, в течение длительного времени. Примерно в 25% случаев заболевание обнаруживают случайно при анализе крови, назначенном по другому поводу (диспансеризация, обследование по поводу негематологического заболевания).
ДИАГНОСТИКА ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА
Для того чтобы поставить диагноз хронического лимфолейкоза, необходимо осуществить следующие исследования:
- Врачебный осмотр
- Клинический анализ крови с подсчетом лейкоцитарной формулы
- Исследование костного мозга позволяет выявить характерную для этого заболевания картину поражения.
- Иммунофенотипирование клеток костного мозга и периферической крови выявляет специфические иммунологические маркеры, характерные для опухолевых клеток при хроническом лимфолейкозе.
- Биопсия пораженного лимфатического узла с его морфологическим и иммунологическим исследованием.
- Определение уровня β 2-микроглобулина помогает прогнозировать течение заболевания.
- Цитогенетический анализ позволяет получить данные о характеристике опухолевых клеток, которые в ряде случаев имеют прогностическое значение.
- Определение уровня иммуноглобулинов позволяет определить, насколько велик риск развития инфекционных осложнений у данного пациента.
СТАДИИ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА
Существует несколько подходов к определению стадий хронического лимфолейкоза - системы Rai, Binet и Международной рабочей группы по хроническому лимфолейкозу. Все они учитывают то факт, что продолжительность жизни больных хроническим лимфолейкозом зависит от степени распространенности опухоли (числа пораженных групп лимфатических узлов) и степени нарушения кроветворения в костном мозге. Нарушение костномозгового кроветворения, вызванное опухолевым ростом в костном мозге, ведет к развитию анемии (снижению числа эритроцитов в крови) и тромбоцитопении (снижению числа тромбоцитов). Определение стадии хронического лимфолейкоза позволяет принять решение о необходимости начать лечение и выбрать наиболее приемлемый для данного больного режим терапии.
В соответствии с современной системой стадирования хронического лимфолейкоза, предложенной Международной рабочей группой по хроническому лимфолейкозу, выделяют три стадии:
- Стадия А - лимфоцитоз при поражении не более 2-х групп лимфатических узлов (или в отсутствие их поражения); тромбоцитопения и анемия отсутствуют.
- Стадия В - поражены 3 и более группы лимфатических узлов; тромбоцитопения и анемия отсутствуют.
- Стадия С - наличие тромбоцитопении или анемии независимо от числа пораженных групп лимфатических узлов.
В зависимости от наличия тех или иных симптомов, к буквенному обозначению стадии хронического лимфолейкоза могут быть добавлены римские цифры:
- I - при наличии лимфаденопатии
- II - при увеличении селезенки (спленомегалии)
- III - при наличии анемии
- IV - при наличии тромбоцитопении
В отличие от многих других опухолей, считают, что при хроническом лимфолейкозе не целесообразно проведение терапии в ранних стадиях заболевания. Это обусловлено тем, что у большинства пациентов в начальных стадиях хронического лимфолейкоза заболевание носит "тлеющий" характер, и больные могут долгое время обходиться без лечения, нормально себя чувствуя и сохраняя привычный образ жизни. Лечение необходимо начинать лишь при появлении признаков прогрессирования заболевания, к которым относят:
- Быстрое нарастание числа лимфоцитов в крови
- Прогрессирующее увеличение лимфатических узлов
- Значительное увеличение селезенки
- Нарастание анемии и тромбоцитопении
- Появление симптомов опухолевой интоксикации - лихорадки, ночных потов, потери веса, выраженной слабости
Существует несколько подходов к лечению хронического лимфолейкоза:
- Химиотерапия препаратом хлорбутин до недавнего времени являлась стандартным методом лечения хронического лимфолейкоза. В настоящее время доказана более эффективно использование новой группы препаратов, так называемых пуриновых аналогов, представителем которой является Флудара.
- К эффективным методам лечения хронического лимфолейкоза относят биоиммунотерапию с применением моноклональных антител. Введение этих препаратов позволяет селективно уничтожать опухолевые клетки, не повреждая здоровые ткани организма.
- При неудовлетворительной эффективности других методов лечения, может быть осуществлена высокодозная химиотерапия с трансплантацией кроветворных стволовых клеток.
- Лучевая терапия применяется в качестве вспомогательного метода лечения при наличии большой опухолевой массы.
- Удаление селезенки (спленэктомия) иногда показана при значительном увеличении этого органа.
Выбор метода лечения - это очень важное решение, которое должно основываться на точных данных, касающихся диагноза, с учетом индивидуальных особенностей больного. Обсуждение вопросов лечения с больным и, по его желанию, с его близкими является неотъемлемым элементом утверждения общей программы лечения.

К лимфопролиферативным заболеваниям относятся две большие группы заболевания, которые в зависимости от места первичного возникновения разделяют на опухоли, возникающие в костном мозге (лейкозы), и опухоли лимфоидной природы (лимфомы) [1, 9, 10]. Одним из факторов, влияющих на иммунитет (иммунный статус больных), является эндогенная интоксикация. В связи с этим введено понятие метаболического иммунодефекта как неспецифического синдрома нарушений иммунной защиты в условиях эндогенной интоксикации. При этом под действием эндотоксинов нарушаются регуляция иммунопоэза, пролиферация клеток (предшественников лимфоцитов и макрофагов), повреждаются клеточные структуры и метаболизм иммуноцитов, нарушается ауторегуляция иммунного ответа [7].
При острых лейкозах и лимфопролиферативных заболеваниях достаточно часто выявляется патология печени. Причиной поражения печени у данных больных является опухолевая инфильтрация печени [2]. Так же вклад в поражение печени привносит специфическое воздействие цитостатиков, однако следует отметить, что это относится не только к лимфопролиферативным заболеваниям, но и вообще к опухолевой болезни, требующей химиотерапевтического лечения. Все вышесказанное вызывает нарушение функционирования механизмов естественной детоксикации [6, 8].
Целью настоящего исследования является оценка состояния системы эндотоксикоза у онкологических больных с лимфопролиферативными заболеваниями.
Материалы и методы исследования
Результаты биохимических исследований у онкологических больных в зависимости от локализации опухолевого процесса были распределены на следующие анализируемые группы: неходжинские лимфомы (II-IV стадии) – 34 больных (16 мужчин, 18 женщин, от 20 до 78 лет); лимфома Ходжкина (IIВ-IVА стадии) – 45 больных (25 мужчин, 20 женщин, от 20 до 70 лет); хронический лимфолейкоз – 54 больных (29 мужчин, 25 женщин, от 55 до 80 лет).
Для оценки уровня эндогенной интоксикации у больных исследовали содержание молекул средней массы (МСМ) и функциональные свойства альбумина. Содержание МСМ в плазме крови определяли по модифицированному методу Н.И. Габриэлян и В.И. Липатовой (1984) при двух длинах волн – 254 нм и 280 нм. Общую концентрацию альбумина (ОКА) определяли унифицированным колориметрическим методом с использованием набора реагентов Ольвекс Диагностикум (Санкт-Петербург). Эффективную концентрацию альбумина (ЭКА), то есть его транспортную функцию, определяли модифицированным методом с использованием конго красного. Степень сорбции токсических лигандов (резервную связывающую способность альбумина – ССА), соответствующую отношению величин свободных связей пула молекул альбумина к общему количеству его связей, оценивали по отношению ЭКА/ОКА • 100 %. Баланс между накоплением в плазме крови и связыванием токсических лигандов оценивали с помощью коэффициента интоксикации (КИ), который рассчитывали по формуле КИ = (МСМ254/ЭКА) • 1000 [5]. Все показатели определялись в плазме крови больных.
Статистическую обработку результатов проводили с использованием пакета программ Statistica 6.0. Различия считали статистически значимыми при p p > 0,05.
Результаты исследования и их обсуждение
Из обследованных 34 больных неходжинскими лимфомами нодальные поражения выявлены у 12 человек, экстранодальные у – 22 человек.
Как видно из табл. 1, у больных неходжкинскими лимфомами большинство показателей эндогенной интоксикации статистически значимо отличались от уровня доноров. У больных с нодальным поражением (первая группа больных) ЭКА и ССА были ниже значений у людей без онкопатологии на 34,5 % и на 33,9 %, а у больных с экстранодальным поражением (вторая группа больных) – на 22,9 % и на 26,2 % соответственно. В первой группе имело место увеличение содержания обеих фракций МСМ на 13,6 % и 28,6 %, во второй группе статистически значимо увеличенной на 30,1 % оказалась только фракция среднемолекулярных пептидов. Увеличение КИ имело место в обеих группах: в 1-ой – на 117 %, во 2-ой – на 39,3 %. Однако, при сопоставлении полученных данных по содержанию МСМ и альбуминовым показателям между группами больных с нодальным и экстранодальным поражением статистически значимых различий не выявлено. Это позволяет прийти к заключению, что локализация опухолевых очагов существенно не влияет на интенсивность эндотоксикоза.
Показатели эндогенной интоксикации у больных неходжкинскими лимфомами с нодальным и экстронодальным поражением
Аннотация научной статьи по клинической медицине, автор научной работы — Бахтина Варвара Ивановна, Демко И.В., Крапошина А.Ю., Соловьева И.А., Сиротина Т.А.
Хронический лимфолейкоз самый частый вид лейкоза у взрослых. В последние годы благодаря современным высокоэффективным методам лечения существенно увеличилась продолжительность жизни больных, однако чаще стали наблюдаться случаи трансформации одного опухолевого заболевания крови в другое. Представлено клиническое наблюдение развития лимфомы Ходжкина у пациентки с первичным диагнозом: хронический лимфолейкоз .
Похожие темы научных работ по клинической медицине , автор научной работы — Бахтина Варвара Ивановна, Демко И.В., Крапошина А.Ю., Соловьева И.А., Сиротина Т.А.
COMBINED CHRONIC LYMPHOLEUKOSIS AND HODGKIN LYMPHOMA
Chronic lympholeukosis is the commonest form of leucosis in adults. Recent highly efficient methods of its treatment markedly increased life expectancy of the patients but simultaneously contributed to transformation of one tumour species into another. The article describes a case of Hodgkin lymphoma in a patient with the primary diagnosis chronic lympholeukosis .
Clinical notes and case reports
Заметки и наблюдения из практики
Бахтина В.И.12, Демко И.В.12, Крапошина А.Ю.1, Соловьева И.А.12, Сиротина Т.А.2, Гордеева Н.В.12
СОЧЕТАНИЕ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА И ЛИМФОМЫ ХОДЖКИНА
Хронический лимфолейкоз — самый частый вид лейкоза у взрослых. В последние годы благодаря современным высокоэффективным методам лечения существенно увеличилась продолжительность жизни больных, однако чаще стали наблюдаться случаи трансформации одного опухолевого заболевания крови в другое. Представлено клиническое наблюдение развития лимфомы Ходжкина у пациентки с первичным диагнозом: хронический лимфолейкоз.
Ключевые слова : лимфолейкоз; лимфома; лимфоциты; лимфатические узлы.
Для корреспонденции: Бахтина Варвара Ивановна — аспирант каф. внутренних болезней №2; e-mail: doctor.gem@mail.ru
Bakhtina V.I.12, Demko I.V.12, Kraposhina A.Yu.1, Solov'eva I.A.12, Sirotina T.A.2, Gordeeva N.V.1,2
COMBINED CHRONIC LYMPHOLEUKOSIS AND HODGKIN LYMPHOMA
1 V.F. Voyno-Yasenetsky Krasnoyarsk State Medical University, Krasnoyarsk;
2Regional Clinical Hospital, Krasnoyarsk, Russia
Chronic lympholeukosis is the commonest form of leucosis in adults. Recent highly efficient methods of its treatment markedly increased life expectancy of the patients but simultaneously contributed to transformation of one tumour species into another. The article describes a case of Hodgkin lymphoma in a patient with the primary diagnosis chronic lympholeukosis. K e y w o r d s: chronic lympholeukosis; lymphoma; lymphocytes; lymph nodes.
Received 21.11.16 Accepted 17.01.17
В последние десятилетия проблема полинеоплазий приобрела особое значение в связи с наблюдаемым повышением частоты вторых и последующих опухолей без тенденции к снижению или стабилизации [1].
Хронический лимфолейкоз /лимфома из малых лимфоцитов (ХЛЛ/ЛМЛ) — лимфопролиферативное заболе -вание, морфологическим субстратом которого являются опухолевые клональные лимфоидные клетки, имеющие размер и морфологию зрелого лимфоцита и коэкспрес-сирующие антиген CD5 и В-клеточные маркёры CD19, CD20, CD23 [2].
Хронический лимфолейкоз (ХЛЛ) — самый частый вид лейкоза у взрослых. Частота его составляет 2—4:100 000 в год и непосредственно связана с возрастом [3]. У людей старше 80 лет она составляет > 30:100 000 в год; медиана возраста на момент установления диагноза составляет 69 лет [4, 5]. В России ХЛЛ выявляется реже и медиана возраста на момент установления диагноза меньше соразмерно меньшей продолжительности жизни россиян. Мужчины болеют в 2 раза чаще женщин [6]. В настоящее время ХЛЛ неизлечим.
В последние годы благодаря современным высокоэффективным методам лечения существенно увеличилась продолжительность жизни пациентов, в связи с чем стали чаще встречаться случаи трансформации одного опухолевого заболевания крови в другое [7]. Иногда наблюдается развитие вторичных опухолей, индуцированных предшествующим лечением алкилирующими агентами, ингибиторами топоизомеразы, препаратами платины. Риск развития вторичных опухолей существенно повышается при использовании комбинации химиотерапевтических агентов, высокодозовой химиотерапии с последующей трансплантацией гемопоэтических стволовых клеток и тем более с добавлением к лечению лучевой терапии [8]. У 3—5% больных ХЛЛ развивается более агрессивная диффузная В-крупноклеточная лимфома (крупноклеточная лимфома), что известно как синдром Рихтера [9, 10].
Переход в лимфому Ходжкина встречается реже и называется ходжкинским вариантом трансформации Рихтера, более известным как ходжкинская трансформация.
Самое большое число ходжкинской трансформации было описано MD Anderson Center (Cancer 3): из 4121
Клиническая медицина. 2017; 95(10)
Заметки и наблюдения из практики
пациента с ХЛЛ только у 18(0,4%) развилась лимфома Ходжкина [11—13].
В ещё одном сообщении 2000 г. описано 3 наблюдения ходжкинской трансформации, которые показали хороший ответ на терапию с достижением полной ремиссии [14].
Существует 2 типа трансформации ХЛЛ: 1-й тип характеризуется наличием клеток Ходжкина и Рида— Штернберга, рассеянных на фоне лимфоцитов [11]. При трансформации 2-го типа клетки Рида—Штернберга отмечаются на типичном полиморфном воспалительном фоне, отдельном от лимфоцитов [12]. Ходжкинская трансформация имеет неблагоприятный исход по сравнению со случаями de novo лимфомы Ходжкина.
Приводим собственное клиническое наблюдение развития лимфомы Ходжкина у пациентки с первичным диагнозом ХЛЛ.
В течение четырёх лет больная находилась под амбулаторным наблюдением гематолога, в гемограмме уровень лейкоцитов сохранялся прежним, показатели гемоглобина, тромбоцитов в пределах нормы. В мае 2010 г. при повторном обследовании впервые отмечено нарастание лейкоцитоза до 30 • 109/л, самочувствие пациентки сохранялось удовлетворительным. Лимфаденопатии, гепатоспленомегалии при объективном обследовании и ультразвуковом исследовании (УЗИ) не обнаружено. Назначена циторедуктивная терапия хлорамбуцилом. В августе 2012 г. отмечено ухудшение состояния — увеличение подмышечных, подчелюстных лимфатических узлов (ЛУ). В течение 2 мес наблюдались стойкая гипертермия до 38°C, слабость, потливость, похудение. В пунктате костного мозга от 04.10.12 г. лимфоцитов 61%, тени Боткина—Гумпрехта. При мультиспиральной компьютерной томографии (МСКТ) средостения дополнительных образований не выявлено.
Для дальнейшего обследования 22.11.12 г. больную госпитализировали в отделение гематологии. При поступлении состояние тяжёлое, что обусловлено выраженным синдромом опухолевой интоксикации, прогрессирующей лимфаденопатией — ЛУ подчелюстные слева до 1,5 см, плотные, безболезненные. В правой подмышечной области конгломерат ЛУ до 8 см с выраженным отёком до подключичной области (рис. 1, см. вклейку).
Гемограмма: Hb 118 г/л, тр. 120 • 109/л, л. 46,2 • 109/л, п. 2%, с. 44%, мон. 5%, лимф. 49%; СОЭ 50 мм/ч. Активность лактатдегидрогеназы 348 Ед/л. По данным проточной цитометрии, опухолевые клетки крови коэкспресси-ровали CD5/CD19/CD23, CD38 — 13,4%.
Ультразвуковое исследование (УЗИ) внутренних органов: правая доля печени 17,4 х 12,8 см, левая — 8 х 5 см; селезёнка — 12,3 х 6,9 см, в воротах печени ЛУ
размером до 3,5 х 2,1 см, парапанкреатические ЛУ до 2,6 см, парааортальные ЛУ — до 3 см. УЗИ периферических ЛУ: в подмышечной области справа ЛУ в виде конгломератов размером 7,6 х 5,7 см, слева по ходу сосудистого пучка — до 1,5 см, слева в проекции подчелюстной слюнной железы — до 2,5 см.
Выполнена двусторонняя трепанобиопсия. При цитологическом исследовании в пунктате костного мозга лимфоциты 61%.
Гистологическое исследование трепанобиоптата: кле-точность костного мозга достигает 80% за счёт разрастания клеток типа малого лимфоцита, тип поражения — интерстициальный (рис. 2, см. вклейку). При иммуногис-тохимическом (ИГХ) исследовании трепанобиоптата лим-фоидные элементы, формирующие нодулярные и интер-стициальный инфильтрат, экспрессируют CD23 (100%), CD20 (100%), CD5 (100%), Bcl-2 100% (100%) и не экспрессируют Cyclin-D1, CD3, Glycophorin A, Ki-67 (до 10%).
В связи с прогрессией заболевания начата терапия по программе RFC, препараты введены в полной дозе. Проведено 2 курса химиотерапии с соблюдением межкурсового периода. Лечение пациентка перенесла удовлетворительно, без развития агранулоцитоза. После первого курса иммунохимиотерапии отмечено обострение хронического тонзиллита с повышением температуры тела до 38°C. На фоне антибактериальной терапии осложнение купировано. Лечение дало положительный, но непродолжительный эффект — лихорадка регрессировала, картина крови нормализовалась, ЛУ сократились на 30%. Через 3 нед после окончания последнего курса отмечено резкое ухудшение состояния: лихорадка до 38—39°C, прогрессирующий рост ЛУ, больная похудела на 7 кг в течение 1 мес. В гемограмме анемия (Hb 66 г/л), лейкопения (2 • 109/л), тромбоцитопения (140 • 109/л). Активность лактатдегидрогеназы 686 Ед/л.
МСКТ грудной клетки, брюшной полости: увеличенные подмышечные ЛУ до 7 см, селезёнка 17 х 52 х 145 мм. Определяются конгломераты парааортальных и поясничных ЛУ размером до 43 х 45 мм (рис. 3, см. вклейку).
В миелограмме лимфоциты 14%. В трепанобиоптате признаков поражения костного мозга нет.
С учётом B-симптомов и ухудшения состояния на фоне стандартной терапии ХЛЛ выполнена биопсия подмышечного ЛУ с целью исключения трансформации ХЛЛ в лимфому.
По данным гистологического исследования, структура ЛУ стёртая за счёт диффузной пролиферации лим-фоидных клеток среднего и крупного размера, часть которых имеют морфологические черты центробластов, а также дискретно распределённые клетки с морфологией атипичных клеток, LP-клеток, клеток, напоминающих клетки Ходжкина. Видны очаги склероза и гиалиноза.
При ИГХ-исследовании определяются дискретно распределённые укрупнённые клетки, напоминающие клетки Ходжкина, а также LP- клетки, экспрессирую-щие мембранные и dot-like CD15. В заметно большем ко -личестве выявляются одно- и многоядерные гигантские клетки CD30-положительные (мембранная и dot-like-реакция). В этих клетках выявляется слабая экспрессия PAX5. Количество CD20- позитивных B-лимфоцитов
резко уменьшено. Имеет место рыхлая диффузная инфильтрация мелкими лимфоидными клетками CD 3-положительными. Все опухолевые клетки CD10-, CD20-, CD23- и В^- отрицательные.
Полученные результаты гистологического и ИГХ- исследования свидетельствовали в пользу ремиссии ХЛЛ.
Установлен диагноз: лимфома Ходжкина (трансформация из ХЛЛ от 04.2013 г.), вариант — нодулярный склероз 2-го типа, стадия ШВ с вовлечением подмышечных ЛУ, парааортальных ЛУ, поясничных ЛУ, селезёнки. Состояние после двух курсов RFC.
Сопутствующий диагноз: хронический тонзиллит (ремиссия).
С апреля 2013 г. начата базисная терапия ВЕАСОРР. На 3-й день 1-го курса лихорадка регрессировала. Курс осложнился миелотоксическим агранулоцитозом, сопровождающимся лихорадкой, реактивацией вируса простого герпеса, анемией. На фоне противовирусной, антибактериальной, заместительной терапии (эритроцитарная взвесь № 3) состояние нормализовалось.
Последующие 2 курса больная перенесла удовлетворительно, после 4-го курса впервые диагностирован вирусный гепатит В. Развился тромбоз наружной подкожной вены левой голени. По данным дуплексного сканирования с цветовым допплеровским картированием вен левой нижней конечности: в просвете наружной подкожной вены LP — клеток тромбомассы, при цветовом доп-плеровском картировании пристеночная реканализация, проксимальный конец тромба чётко не визуализируется. На фоне гепаринотерапии осложнения купированы.
Всего выполнено 8 курсов полихимиотерапии, последний курс окончен в ноябре 2013 г. При проведении контрольного рестадирования (февраль 2016 г.) общее состояние удовлетворительное, жалоб не предъявляет. Периферические ЛУ, селезёнка не пальпируются, печень не увеличена. Больная поправилась на 10 кг.
Контрольная гемограмма: НЬ 118 г/л, тр. 210 • 109/л, л. 5,7 • 109/л, эоз. 1%, п. 3%, с. 60%, лимф. 27%,мон. 9%,; СОЭ 10 мм/ч.
МСКТ органов грудной и брюшной полости с контрастированием: умеренная спленомегалия (14 х 4,6 х 12 см).
Цитологическое исследование стернального пунк-тата: костный мозг клеточный, лимфоцитов 10%.
На данный момент у больной сохраняется ремиссия и планируется дальнейшее наблюдение в динамике.
Представленное наблюдение в нашей практике — первый опыт лечения больной с лимфомой Ходжкина, трансформировавшейся из ХЛЛ. Несмотря на получение ремиссии, изначально не исключается возможного наличия двух заболеваний одновременно. Возможно, проведение биопсии ЛУ с гистологическим и ИГХ-исследованием в дебюте заболевания помогло бы ответить на этот вопрос. Особенность демонстрируемого случая заключается в том, что стандартная терапия по программе ВЕАСОРР по -зволила достичь длительной стойкой ремиссии, что крайне редко при ходжкинской трансформации.
Важно помнить, что при появлении симптомов опухолевой интоксикации, увеличении ЛУ на фоне проводимой химиотерапии необходимо выполнение биопсии ЛУ. Проведение гистологического и ИГХ-исследования в
Clinical notes and case reports
первую очередь поможет дифференцировать первичную резистентность с трансформацией одного лимфопроли-феративного заболевание в другое.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки.
(остальные источники см. REFERENCES)
1. Секержинская Е.Л., Лазарев А.Ф., Петрова В.Д. Факторы риска развития первично-множественных злокачественных новообразований. Российский биотерапевтический журнал. 2009; 8(2): 85—91.
2. Волкова М.А., ред. Клиническая онкогематология. М.: Медицина; 2007.
5. Никитин Е.А. Хронический лимфолейкоз: новое в понимании биологии хронического лимфолейкоза, новые подходы к лечению. Онкогематология. 2006; 1(2): 124—7.
7. Романенко Н.А., Бессмельцев С.С., Ругаль В.И., Потихонова Н.А^ Зенина М.Я., Абдулкадыров К.М. Сочетание множественной ми-еломы и первичного миелофиброза с последующей трансформацией в острый миелоидный лейкоз (обзор и случай из практики). Медицинский академический журнал. 2011; 11(1): 46—57.
1. Sekerzhinskaya E.L., Lazarev A.F., Petrova V.D . Risk factors for multiple primary cancers . Rossiyskiy bioterapevticheskiy zhurnal. 2009; 8(2): 85—91. (in Russian)
2 . Volkova M .A. , ed . Clinical oncogematology. Moscow: Meditsina. 2007. (in Russian)
3. Dores G.M., Anderson W.F., Curtis R.E., Landgren O., Ostroumova E . , Bluhm E . C . et al . Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br. J. Haematol. 2007; 139(5): 809—19.
4. Kalil N., Cheson B.D. Management of chronic lymphocytic leukaemia Drugs Aging. 2000; 16(1): 9—27.
5. Nikitin E.A. Chronic lymphocytic leukaemia: new understanding of the biology of chronic lymphocytic leukaemia, new approaches to the treatment. Onkogematologiya. 2006; 1(2): 124—7. (in Russian)
6. Robak T., Kantarjian H., Robertson L., Lerner S., Keating M.J. Therapy of chronic lymphocytic leukaemia with purine nucleoside analogues: facts and controversies . Drugs Aging. 2005; 22(12): 983—1012.
7. Romanenko N.A., Bessmel'tsev S.S., Rugal' V.I., Potikhonova N.A., Zenina M.Ya., Abdulkadyrov K.M. Combination of multiple myeloma and primary myelofibrosis with transformation to acutemyeloid leukemia (review and case report) . Meditsinskiy akademicheskiy zhurnal. 2011; 11(1): 46—57. (in Russian)
8. Takada M., Umeda M., Shikoshi K., Shirai T. IgG lambda-type multiple myeloma associated with myelofibrosis accompanied by throm-bocytosis . RinshoKetsueki. 1991; 32(9): 1001—5.
9. Richter M.N. Generalized reticular cell sarcoma of lymph nodes associated with lymphatic leukemia . Am. J. Pathol. 1928; 4(4): 285—92.
10. Harousseau J.L., Flandrin G., Tricot G., Brouet J.C., Seligmann M., Bernard J . Malignant lymphoma supervening in chronic lymphocytic leukemia and related disorders. Richter's syndrome: a study of 25 cases . Cancer. 1981; 48(6): 1302—8.
11. Tsimberidou A.M., O'Brien S., Kantarjian H.M., Koller C., Hagemeister F.B., Fayad L. et al. Hodgkin transformation of chronic lymphocytic leukemia: the M . D . Anderson Cancer Center experience . Cancer. 2006; 107(6): 1294—302.
12. Reddy N., Thompson-Arildsen M.A. Hodgkin's lymphoma: Richter's transformation of chronic lymphocytic leukemia involving the liver J. Clin. Oncol. 2010; 28(29): e543—4.
13. Adiga G.U., Abebe L., Wiernik P.H. Partially successful treatment of a patient with chronic lymphocytic leukemia and Hodgkin's disease: case report and literature review. Am. J. Hematol. 2003; 72(4): 267—73.
14. Serratrice De Roux C., Coso D., Bouabdallah R., Serratrice J., Dis-dier P., Weiller P.J. Chronic lymphocytic leukemia and Hodgkin's disease . Clinicopathologic study of three cases with good prognosis . Haematologica. 2000; 85(8): 878—9.
Поступила 21.11.16 Принята в печать 17.01.17

В числе раковых болезней особняком держатся лейкозы. Заболевание не щадит ни взрослых, ни детей.
Так что же такое лейкозы? Это многочисленные опухоли кроветворной системы, возникающие из кроветворных клеток и поражающие костный мозг. Лейкозы делятся на две основные группы – острые и хронические.
Причиной возникновения острых лейкозов человека могут быть нарушения состава и структуры хромосомного аппарата, наследственно обусловленные или приобретенные под влиянием некоторых мутагенных факторов (одним из них является ионизирующая радиация), химических мутагенов.
Доказано учащение острых лейкозов среди лиц, подвергавшихся воздействию бензола, среди больных, получавших иммунодепрессанты (имуран, циклофосфан, лейкаран, сарколизин, мустарген и др.). При этом частота острых лейкозов среди пациентов повышается в сотни раз! Роль наследственных дефектов проявляется в том, что наследуется не сам лейкоз, а повышенная изменчивость – нестабильность хромосом клетки.
Для всех острых лейкозов характерны нарастающая “беспричинная” слабость, недомогание, иногда одышка, головокружение, обусловленные анемией, при некоторых формах – повышение температуры тела, интоксикация. Увеличение лимфатических узлов, печени и селезенки в развернутой стадии бывает не при всех острых лейкозах, но может развиваться независимо от формы острого лейкоза в терминальной стадии. Нередки кровоточивость слизистых оболочек, петехиальная сыпь на коже, особенно голеней, обусловленные резким снижением количества тромбоцитов в крови. В легких, миокарде и других тканях и органах могут появляться инфильтраты. Наиболее частые формы острого лейкоза у взрослых – миелобластный и миеломонобластный лейкозы, у детей – лимфобластный.
Острый промиепоцитарный лейкоз встречается довольно редко. Ему присущи выраженная интоксикация, кровоточивость и снижение уровня фактора свертываемости в крови. Лимфатические узлы, печень и селезенка обычно не увеличены. Непосредственной причиной смерти больного чаще всего бывает кровоизлияние в мозг.
При остром лейкозе показана срочная госпитализация. Лечат больных для достижения ремиссии с помощью комбинированного введения цитостатиков с целью ликвидации всех явных и предполагаемых лейкемических очагов.
Среди хронических лейкозов чаще отмечаются лимфолейкоз, миелолейкоз, миеломная болезнь, эритремия, реже – хронический сублейкемический миелоз (остеомиелосклероз, миелофиброз), хронический моноцитарный лейкоз. При хроническом миелолейкозе опухолевым процессом поражается как гранулоцитарный, так и тромбоцитарный и эритроцитарный ростки костного мозга. Процесс распространяется на печень, селезенку, а в терминальной стадии пораженной может оказаться любая ткань. В клиническом течении хронического миелолейкоза выделяют развернутую и терминальную стадии. Вначале у больного отсутствуют жалобы, не увеличена или незначительно увеличена селезенка, состав периферической крови изменен. Развернутая стадия может продолжаться в среднем четыре года.
При правильной терапии состояние больных остается удовлетворительным, они сохраняют трудоспособность, ведут обычный образ жизни (при амбулаторном наблюдении и лечении). В терминальной стадии течение приобретает черты злокачественности: высокая лихорадка, быстро прогрессирующее истощение, боль в костях, резкая слабость, быстрое увеличение селезенки, печени, иногда увеличение лимфатических узлов. Характерно также быстрое нарастание таких признаков, как анемия, тромбоцитопения, осложняющаяся кровотечениями, инфекцией, некрозами слизистых оболочек.
Длительность жизни больных в этой стадии обычно не превышает 6-12 мес. Лечение хронического миелолейкоза проводят с момента установления диагноза. В развернутой стадии эффективна терапия миелосаном. При неэффективности миелосана назначают миелобромол. При переходе процесса в терминальную стадию используют комбинации цитостатических препаратов, винкристин и преднизолон, ВАМП, цитозар и рубомицин. В начале терминальной стадии нередко эффективен миелобромол.
Причины возникновения лейкозов недостаточно изучены. важное значение, на наш взгляд, имеет профилактика заболеваний, прежде всего обеспечение экологически благоприятной среды для проживания людей.
Читайте также:


