Интоксикация от печени в головной мозг
Острая печеночная недостаточность – это тяжелое, быстро развивающееся нарушение работы печени. Ее причиной является быстрая массивная гибель клеток печени. В результате она не справляется со своими функциями, что приводит к нарушению работы всех органов, в частности головного мозга, то есть к энцефалопатии.
Печеночная недостаточность считается острой, если энцефалопатия развивается в течение 8 недель после первых симптомов болезни у людей без предшествовавших заболеваний печени или в течение 3 недель после появления желтухи у людей с предшествовавшими заболеваниями печени.
Это достаточно редкое, но очень опасное для жизни состояние, требующее незамедлительной медицинской помощи. Оно развивается быстро – от 48 часов до нескольких дней или недель. Зачастую ранняя диагностика острой печеночной недостаточности вызывает трудности, так как в начале заболевания отсутствуют ее специфические симптомы.
Прогноз заболевания напрямую зависит от того, насколько быстро начато лечение. К сожалению, смертность при острой печеночной недостаточности достигает 60-70 %.
Молниеносная печеночная недостаточность, фульминантная печеночная недостаточность.
Синонимы английские
Acute liver failure, acute hepatic failure, fulminant hepatic failure, fulminant hepatitis.
Острая печеночная недостаточность может развиваться очень быстро даже у людей, ранее не страдавших заболеваниями печени. При первых признаках болезни необходимо срочно обратиться к врачу для определения точной причины их возникновения. Основные симптомы включают в себя:
- желтушность кожи и склер;
- боль и тяжесть в правом подреберье;
- тошноту, рвоту;
- повышенную кровоточивость;
- слабость;
- отеки;
- чрезмерную сонливость, дезориентацию.
Общая информация о заболевании
Печень – это жизненно важный орган в правой верхней части брюшной полости, под диафрагмой, который граничит с желудком, петлями кишечника и правой почкой. Она состоит из двух основных долей – правой и левой.
Основные функции печени
- Обезвреживание токсинов, аллергенов, ядов. Кровь от органов желудочно-кишечного тракта поступает по воротной вене в печень, где очищается от всех чужеродных вредных веществ, а также токсичных продуктов обмена.
- Синтез белков крови (компонентов свертывающей и противосвертывающей систем крови), гормонов, ферментов, холестерина, жиров и их производных.
- Регуляция уровня гормонов и витаминов посредством хранения запасов жирорастворимых витаминов, микроэлементов, разрушения избытка гормонов.
- Участие в обмене углеводов за счет хранения запасов гликогена – полисахарида, образованного молекулами глюкозы.
- Участие в пищеварении – синтез желчи, которая необходима для переваривания жиров. Желчь вырабатывается клетками печени, накапливается в желчном пузыре и по желчным протокам попадает в кишечник.
В основе печеночной недостаточности лежит гибель большого количества клеток печени. В результате ткань печени не успевает восстанавливаться (регенерироваться), что приводит к нарушению всех ее основных функций.
Причины повреждения клеток печени бывают следующими.
- Прием лекарственных препаратов – противоэпилептических, противотуберкулезных, некоторых антибиотиков, нестероидных противовоспалительных средств (аспирина, ибупрофена), обезболивающих (парацетамола).
- Вирусные гепатиты – чаще гепатит В и А, реже С, D, Е, а также вирус Эпштейна – Барр, цитомегаловирус.
- Отравление ядовитыми грибами.
- Заболевания других органов и систем: инсульт, инфаркт миокарда, массивное кровотечение, тяжелая инфекция, обезвоживание.
- Рак печени.
- Сосудистые заболевания: тромбоз воротной вены и синдром Бадда – Киари (нарушение оттока крови от печени по печеночной вене).
- Болезни обмена веществ: болезнь Вильсона – Коновалова (врождённое нарушение обмена меди, которая накапливается в печени и других органах, нарушая их работу), синдром Рейе (тяжелое поражение печени и головного мозга у детей после перенесенных вирусных инфекций, в основе которого лежит нарушение работы ферментов клеток печени).
Все эти факторы могут вызывать разрушение клеток печени, что приводит к симптомам острой печеночной недостаточности. Печень увеличивается в размерах, воспаляется. Это сопровождается тяжестью, болью в правом подреберье. Нарушается ток крови по печеночным сосудам, и возникает портальная гипертензия – затруднение тока крови и повышение давления в воротной вене, по которой кровь от органов пищеварения попадает в печень. В результате кровь направляется в сосуды пищевода, геморроидальные и околопупочные вены. Эти сосуды из-за увеличенного тока крови могут расширяться, что в сочетании с нарушением синтеза в печени факторов свертывания и повышенной кровоточивостью грозит серьезным кровотечением.
Следствием нарушения оттока крови от органов пищеварения может быть асцит – скопление большого количества жидкости в брюшной полости. При асците живот увеличивается, растягивается, расширяются вены на животе, растет масса тела.
Повреждение клеток печени и то, что кровь от органов желудочно-кишечного тракта течет в обход печени и не очищается, приводит к попаданию токсических веществ в другие органы, в частности в головной мозг. Интоксикация и отек головного мозга вызывают печеночную энцефалопатию – она проявляется дезориентацией, сонливостью, нарушениями речи, двигательными нарушениями, затруднением мышления и восприятия и даже комой.
Отеки возникают из-за нарушения синтетической функции печени, то есть из-за уменьшения синтеза белка. Из-за пониженного количества белка в плазме крови (гипопротеинемии) жидкость выходит из сосудов в ткани, и образуются отеки.
Желтушность кожи, слизистых оболочек, склер при острой печеночной недостаточности является следствием повышения уровня билирубина в крови. Билирубин – это вещество желто-коричневого цвета, которое образуется преимущественно при разрушении эритроцитов. В норме он, попадая в печень, связывается с глюкуроновой кислотой и выводится из организма с желчью. При нарушении работы печени увеличивается количество связанного с глюкуроновой кислотой (прямого) билирубина, который попадает в кровь при разрушении клеток печени. Он и определяет характерную желтоватую окраску кожи.
Кто в группе риска?
- Люди, использующие лекарственные препараты в дозах, не предусмотренных инструкцией.
- Употребляющие наркотики.
- Злоупотребляющие алкоголем.
- Не привитые против гепатита А и В.
- Часто контактирующие с высокими дозами токсичных химических веществ – пестицидами, инсектицидами, бытовой химией – без соответствующих средств защиты (маски, перчаток).
- Беременные.
Диагностика острой печеночной недостаточности осложняется тем, что это состояние встречается достаточно редко, развивается стремительно и его симптомы на начальных стадиях носят неспецифический характер, то есть могут быть вызваны другими заболеваниями. При подозрении на печеночную недостаточность большое значение имеют лабораторные исследования.
- АСТ (аспартатаминотрансфераза), АЛТ (аланинаминотрансфераза) – печеночные ферменты, которые попадают в кровь при повреждении ткани печени. При острой печеночной недостаточности могут быть повышены.
- Лактатдегидрогеназа (ЛДГ) – фермент, присутствующий во всех тканях организма и участвующий в энергетическом обмене. При повреждении печени его активность увеличивается.
- Билирубин общий – при острой печеночной недостаточности может быть повышен преимущественно за счет прямой (связанной) фракции.
- Протромбиновый индекс. Протромбин – предшественник тромбина, который участвует в образовании сгустков крови. Анализ применяют, чтобы определить скорость свертываемости крови. При острой печеночной недостаточности протромбиновый индекс может быть повышен, что указывает на увеличение времени свертывания крови.
- Фибриноген – фактор свертываемости крови, который синтезируется клетками печени. При повреждении печеночной ткани его уровень может быть снижен.
- Общий белок сыворотки. При острой печеночной недостаточности уровень общего белка бывает снижен за счет уменьшения количества альбуминов – основных белков плазмы крови, которые синтезируются в печени. Снижение их количества говорит о повреждении клеток печени и нарушении ее синтетической функции.
- Холестерол общий – вещество, которое синтезируется в печени и является элементом клеточных мембран, предшественником желчных кислот и некоторых гормонов. При печеночной недостаточности уровень холестерола может быть понижен, что указывает на нарушение синтетической функции печени.
- Гепатиты А, В, С. Гепатит рассматривается как возможная причина острой печеночной недостаточности.
- Скрининговое исследование на предмет наличия наркотических, психотропных и сильнодействующих веществ. Определение соединений, которые могли стать причиной разрушения клеток печени.
Дополнительные методы исследования
- УЗИ органов брюшной полости. Его используют для того, чтобы выявить увеличение печени, наличие жидкости в брюшной полости (асцит), внутренние кровотечения.
- Биопсия печени. Взятие образца ткани печени с помощью тонкой полой иглы, которая вводится через кожу брюшной стенки после анестезии. При микроскопии взятого образца определяется нарушение структуры печени, повреждение клеток.
Пациенты с подозрением на острую печеночную недостаточность должны быть госпитализированы как можно скорее. Лечение направлено на поддержание основных функций организма до восстановления печеночной ткани. При особенно тяжелом течении проводится трансплантация печени. Если известна причина острой печеночной недостаточности, лечение заключается в устранении этого первичного фактора. Часто главной задачей бывает борьба с такими осложнениями заболевания, как отек головного мозга, кровотечения.
- Своевременная вакцинация против гепатита А, В.
- Отказ от алкоголя и наркотиков.
- Использование средств защиты при контакте с токсичными веществами.
- Использование индивидуальных средств гигиены (зубные щетки, бритвы).
- Использование презервативов.
- При пирсинге, татуировках необходимо удостовериться в стерильности используемых инструментов.
- Следование предписаниям врача при приеме любых лекарств.
Проблемы с выведением из организма и обезвреживанием токсинов начинаются при достижении их концентрации критического значения. В результате такого сбоя в организме человека происходит накопление токсических веществ, что отражается на общем самочувствии.
Если игнорировать сигналы организма, указывающие на интоксикацию, то могут возникнуть осложнения, которые негативно отразятся на органах и внутренних системах человека. Проблем такого рода можно избежать, если знать об основных признаках отравления организма и начать лечение своевременно.
Распознать острую интоксикацию достаточно просто - ее симптомы проявляются очень ярко и практически сразу после проникновения возбудителя в организм. Выявление хронической интоксикации затруднен, и на это может потребоваться достаточно большое количества времени, так как симптомы отличаются неоднозначностью и вялостью. Тем временем токсины все глубже проникают в организм и продолжают свое негативное воздействие.
Первые признаки
На интоксикацию организма указывает появление вялости и слабости, которая не проходит. Даже после продолжительного и полноценного отдыха облегчение не наступает.
Ночной сон ухудшается, и утром человек чувствует себя разбитым. При любых нагрузках, связанных с умственной или физической деятельностью, быстро наступает переутомление, ухудшается память и возникает рассеянность. Заметно снижается активность головного мозга, что приводит к затруднениям при восприятии информации. Человек испытывает затруднения при необходимости сосредоточиться, и все попытки завершаются появлением тупой головной боли.
В некоторых случаях наблюдается повышенная потливость и снижение половой функции. Как правило, происходит ухудшение аппетита, возникают головокружения и заметно увеличивается нервозность. Кроме этого, могут страдать волосы - они становятся ломкими и утрачивают блеск.
Следует понимать, что эти симптомы, указывающие на хроническую интоксикацию, появляются не одновременно, а нарастают постепенно на протяжении довольно длительного времени. Именно в таком характере процесса кроется опасность, так как человек практически не ощущает дискомфорта и долгое время не обращает внимания, что в организме происходят негативные изменения. Со временем он привыкает к их присутствию и игнорирует их.
Большинство людей считают, что постоянная слабость и вялость - это следствие образа жизни и загруженности на работе, поэтому думают, что чашечка утреннего кофе поможет взбодриться. Когда действие кофе не дает ожидаемого результата, наступает черед рюмки спиртного для улучшения сна, седативных препаратов, стимуляторов. Если облегчение наступает, то оно носит временный характер, а интоксикация только нарастает.
Вторичные симптомы
Дальнейшая интоксикация продолжает отражаться на головном мозге и может привести к нарушению памяти и даже искажению восприятия реальности. Засыпание становиться мучительным процессом, а его длительность не превышает получаса. При этом возникает калейдоскоп мыслей, которые появляются одна за другой, а долгожданный сон не наступает. Человек для облегчения состояния вынужден увеличивать дозу седативных средств, которые не всегда помогают.
Интенсивность головных болей постоянно нарастает, особенно после стресса, все это сопровождается головокружением. Состояние может ухудшиться до такой степени, что человек теряет возможность трудиться. С течением времени симптомы могут быть дополнены появлением апатии, отсутствием желания общения с окружающими, что нередко перерастает в невроз и депрессию. Не исключены и другие отклонения в психике.
В одних случаях появление указанных признаков происходит постепенно вследствие постепенной интоксикации организма, а в других - это остаточные явления острого отравления токсинами. Последний случай может сопровождаться изменением массы тела в сторону увеличения или уменьшения, сбоями деятельности пищеварительной системы. Появление горьковатого привкуса и неприятного запаха во рту, а также обложенный язык свидетельствуют о неправильной работе желудочно-кишечного тракта.
При хронической интоксикации нередко ухудшается состояние кожного покрова. На коже возникает сыпь, аллергия и могут развиться дерматологические заболевания. Общее состояние организма существенно ухудшается - резко падает иммунитет, происходит сбой в обменных процессах и нарушается доставка кислорода к тканям. Снижение защитных свойств организма и его ослабление приводит к увеличению частоты вирусных заболеваний и увеличивает вероятность развития хронических болезней.
Интоксикация у детей
Развитие хронической интоксикации у детей - это прямое следствие игнорирование проблемы длительное время. Такое состояние требует особого подхода и сопровождается сложностями, а последствия проявляются в более тяжелой форме, чем у взрослых. При появлении тревожных признаков интоксикации самолечение недопустимо, требуется квалифицированная медицинская помощь.
При интоксикации у ребенка появляются признаки в общем схожие с симптомами у взрослых, находящихся в аналогичном состоянии. Детский организм реагирует быстрой утомляемостью, ухудшением памяти, появлением головокружений и головных болей.
Появление других ярких признаков необязательно, поэтому снизить риск развития осложнений позволит посещение врача. Квалифицированная консультация поможет определить, что происходит с малышом - легкое недомогание или серьезное заболевание.
Как восстановить здоровье?
Мы отмечали, что хроническая интоксикация появляется в том случае, когда организм не способен справиться с выведением и нейтрализацией токсинов. Это говорит об отравлении ими, поэтому прием лекарственных препаратов может только усугубить ситуацию и привести к ухудшению состояния человека.
Для выработки тактики лечения проводится комплекс диагностических мероприятий, в результате которых определяется характер отравления и степень поражения органов и систем. Врачи рекомендуют проводить детоксикацию регулярно - два раза в год даже в том случае, если признаков отравления не наблюдается.
Для лечения хронической интоксикации, как правило, проводят терапевтические мероприятия, направленные на выведение токсинов, в сочетании с приемом иммуномодулирующих препаратов. При этом должно соблюдаться условие - состояние больного находится под постоянным контролем, а его изменения изучаются в динамике. Правильный подход при решении этой проблемы позволит человеку вернуть бодрость и силу. При этом происходит постепенное выведение токсинов, а лимфоток и возможности самостоятельной регенерации восстанавливаются.
При отсутствии осложнений хроническая интоксикация довольно быстро излечивается, улучшается самочувствие и нормализуется сон.

Качественная одежда требует не только грамотного пошива, но и правильного выбора ткани.
Назначение вещи зависит от используемого материала, поэтому для каждого случая требуется определенная ткань.

Базовый гардероб — это комплект одежды, состоящий из нейтральных вещей, которые можно комбинировать.
Зная правила его составления, вы без труда создадите интересные комбинации, которые будут актуальными не один сезон.




Получая ежедневное оповещение о событиях, россияне всегда отлично экономят семейный бюджет в интернет-магазине "Эгерия".
Печеночная недостаточность и ее влияние на мозг
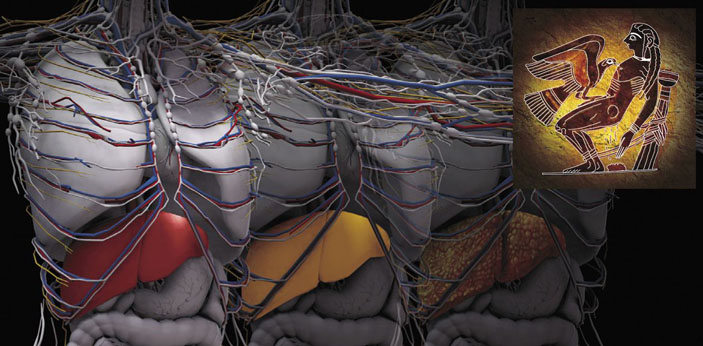
Связь болезней печени с нарушениями функций мозга была впервые отмечена еще 2,5 тыс. лет назад знаменитым древнегреческим врачом Гиппократом. Согласно современным представлениям, именно печеночная недостаточность, обусловленная фиброзным (циррозом) или жировым перерождением печени в результате вирусного, токсического или лекарственного поражения, служит основной причиной хронических и острых энцефалопатий. Эти генерализованные заболевания, начинающиеся с апатии, агрессии и спутанности сознания, чаще всего заканчиваются гибелью больных.
Нейропсихиатрические нарушения возникают благодаря тому, что печень утрачивает функции активного фильтра и становится неспособной нейтрализовать поступающие в кровь токсины, в первую очередь — ион аммония. Рост внутриклеточных концентраций этого токсина вызывает разбалансировку работы ряда метаболических и сигнальных систем, что, в конечном итоге, пагубно влияет на когнитивные и моторные функции мозга. Современная и, надо сказать, не слишком успешная терапия направлена на снижение количества иона аммония в организме, а также ингибирование процессов, им вызываемых. Однако более действенным может оказаться стратегия, направленная на восстановление функций разрегулированных систем, в том числе использование веществ, способных снижать гиперактивность нейронных сетей путем активации тормозных рецепторов мозговых нейронов.

Владимир Владимирович Дынник — кандидат физико-математических наук, ведущий научный сотрудник Института теоретической и экспериментальной биофизики РАН (Пущино, Московская обл.). Автор и соавтор 67 научных работ и 2 патентов.
Судя по письменным источникам, связь болезней печени и нарушений функций мозга впервые отметил знаменитый древнегреческий врач Гиппократ, живший 2,5 тыс. лет назад, хотя не исключено, что подобные явления задолго до этого были известны шумерам, древним египтянам и китайцам. Конечно, энцефалопатии мозга могут вызываться болезнями и других органов (например, почек), а также недостаточным кровообращением или прямой инфекцией мозга, но эти причины менее распространены.
Начало современным медико-биологическим исследованиям печеночных энцефалопатий было положено в конце XIX в. Последующие за ними 120 лет, отмеченные открытиями и заблуждениями, упорным трудом и невезеньем одних и удачей других, в какой-то мере напоминают вековую историю поиска европейцами морских путей в Индию.
Различают несколько стадий хронических печеночных энцефалопатий (Ferenci et al., 1999). На нулевой стадии заболевания клинических и психометрических признаков нет. На стадии минимальной печеночной энцефалопатии отмечаются небольшие изменения концентрации внимания и моторных функций мозга, обнаруживаемые только с помощью специальных тестов. Следующие стадии характеризуются спектром явно выраженных психических, поведенческих и двигательных нарушений. Сначала появляется забывчивость и рассеянность, бессонница или сонливость, дискоординация и утомляемость. Затем — апатия, летаргия, тремор рук, сбивчивая речь, эксцентричное поведение. За ними следует дезориентация во времени и пространстве, амнезия, приступы ярости, гиперрефлексия. И, наконец, потеря сознания, утрата рефлексов и кома.
Отсчет экспериментального изучения связей между заболеваниями печени и поражением мозга следует вести с 1877 г., когда образованнейший русский врач того времени Н. В. Экк, желая разгрузить печеночный кровоток, разработал хирургический метод создания путей оттока крови из воротной вены, несущей кровь от органов пищеварения в нижнюю полую вену, минуя печень. Однако из восьми прооперированных им собак семь погибли в течение нескольких дней после операции.

Оказалось, что прооперированные собаки не могут переносить пищу с высоким содержанием белков. Раздражительность, агрессивность, хлопающая и шатающаяся походка, блуждающий взгляд и слепота быстро сменялись ступором, судорогами, комой и гибелью животных. При отсутствии мяса (а следовательно, и избытка азота) в пище симптомы исчезали.
Используя модель печеночного шунта Павлова, известный польский биохимик М. Ненски провел собственные исследования, выявившие ключевую роль накапливающихся количеств азота (иона аммония) в исследуемых процессах (Nencki & Zaleski, 1895). К концу 1890-х гг., когда стало понятно, что все наблюдаемые эффекты могут быть связаны с накапливающимся в крови ионом аммония, была опубликована итоговая совместная работа ученых относительно баланса азота в организме (Nencki et al., 1896). В ней было постулировано, что аммоний метаболизируется в печени до мочевины, и что нарушения этого процесса при шунтировании печеночного кровотока приводят к развитию дисфункции мозга.
Было установлено, что резкое увеличение концентрации иона аммония в крови может происходить при септическом шоке, остановке работы сердца, интенсивных физических нагрузках, вообще при кислородном голодании (Parnas et al., 1926; Nelson et al., 1953). Также обнаружилось, что энцефалопатии могут возникать у пациентов и в отсутствие цирроза, например, при скоротечном жировом перерождении печени (Brain et al., 1927; Mann еt al., 1962; Reye et al., 1963).
Наконец, во второй половине XX в. были разработаны экспериментальные модели печеночных энцефалопатий на лабораторных животных, на которых стали проводиться исследования механизмов токсического действия иона аммония и вторичных токсинов и поиска защитных терапевтических средств. В последней четверти прошлого столетия с появлением методов прижизненных клеточных исследований с использованием флуоресцентной микроскопии, а также методов иммунохимии и генной инженерии, фокус исследований сместился на субклеточный и молекулярный уровень.
Печеночные энцефалопатии классифицируются на острые и хронические в зависимости от типа печеночных нарушений, послуживших их причиной.

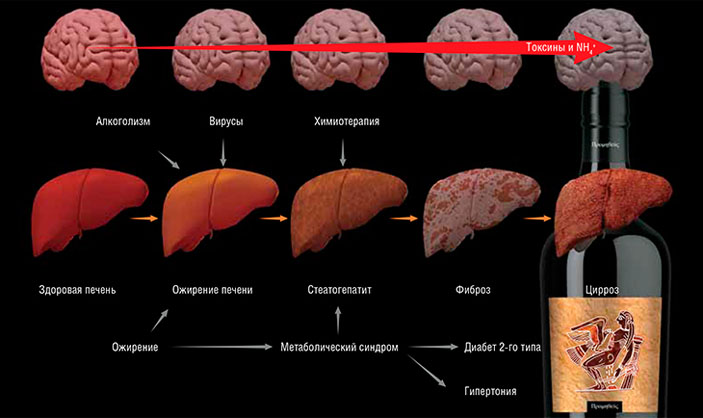
Цирроз может развиться в результате ряда болезней: алкогольного или неалкогольного (при диабете 2-го типа) стеатогепатита (воспалительного процесса, вызванного жировым перерождением печени), вирусных гепатитов, аутоиммунных заболеваний. Срок жизни пациентов с прогрессирующим циррозом печени не превышает 3–6 лет. В России смертность от этих болезней составляет не менее 75–100 тыс. человек в год, хотя официальная статистика по ним не ведется.
Среди опаснейших осложнений цирроза — портальная гипертензия, синдром повышенного давления в системе воротной вены, вызванного нарушением кровотока, которая приводит к развитию желудочно-кишечных кровотечений, увеличению селезенки и т. д. И конечно, хронические печеночные энцефалопатии, которые отмечаются у 80% таких пациентов. Проходя последовательные стадии развития болезни: гепатит — фиброз — цирроз, печень постепенно утрачивает функции активного фильтра. Избыток иона аммония и сопряженных с ним вторичных токсинов (жирных кислот, провоспалительных цитокинов, нейростероидов и др.) воздействует на клетки мозга и других органов, приводя к развитию медленно текущего генерализованного заболевания, заканчивающегося неизбежной гибелью пациента.
Острые печеночные энцефалопатии возникают, когда печень утрачивает свои функции активного фильтра за очень короткий промежуток времени, от нескольких часов до нескольких суток. Такая острая печеночная недостаточность может быть вызвана вирусными, токсическими или лекарственными поражениями печени, сопровождающимися ее жировым перерождением. В некоторых случаях причиной являются врожденные дефекты ферментов различных метаболических путей, вследствие чего в организме накапливаются токсичные метаболиты, способные вызвать дисфункцию печени.

Гистологические срезы печени лабораторных мышей демонстрируют все стадии острого токсического поражения печени, характеризующегося некрозом гепатоцитов, микрокапельным ожирением и прорастанием соединительной ткани: а — норма; б — острый токсический гепатит; в — хронический стеатогепатит (желтым цветом показаны скопления капель жира — липидов); г — фиброз (темные скопления)
Особое внимание заслуживают лекарственные поражения печени. Сегодня из более чем 12 тыс. лекарств, находящихся в мировом фармацевтическом обороте, около тысячи потенциально токсичны при передозировке и, что еще более опасно, в сочетании с другими повреждающими факторами. К таким веществам относятся антибиотики, интерфероны, антиконвульсанты, трициклические антидепрессанты, противовоспалительные препараты, наркотические вещества и т. д.
Характерный пример — обычный аспирин, введенный в медицинскую практику в конце XIX в. и являющийся в настоящее время одним из двадцати наиболее востребованных препаратов. На фоне некоторых вирусных заболеваний прием аспирина может привести к быстрому микрокапельному ожирению клеток печени и других органов и тканей с развитием синдрома Рейе и других подобных заболеваний.
Отек мозга — в чем причины?
К настоящему времени опубликованы сотни тысяч работ, посвященных исследованиям механизмов патогенеза печеночных энцефалопатий и поискам средств и методов их коррекции. Предложены десятки теорий, в которых отражены скорее тренды научных исследований текущих десятилетий, чем глубина понимания проблемы.
Именно отек мозга, приводящий к повышению внутричерепного давления, рассматривается в качестве основной причины развития комы и последующей гибели организма на фоне острой печеночной энцефалопатии. При этом молекулярные механизмы, приводящие к нарушению сигнальных функций нейронных сетей мозга при коматозных состояниях, до сих пор не установлены.
При хронических формах печеночной энцефалопатии действие избытка иона аммония и вторичных токсинов на клетки мозга, других органов и тканей может приводить к развитию медленно текущего, многостадийного генерализованного заболевания с характерными спектрами метаболических, сигнальных и нейропсихических нарушений. Медленное угасание таких пациентов заканчивается неизбежной гибелью.
В этом случае необратимость патологических процессов в печени, а также в мозге и других органах и тканях связано не только с прямым действием токсинов на известные клеточные мишени, но и с изменением экспрессии ключевых генов различных метаболических, транспортных и сигнальных систем. Однако исследование подобных механизмов только стоит на повестке дня.
Синдром Рейе — редкое, но угрожающее жизни острое состояние, возникающее у детей и подростков на фоне лечения вирусного заболевания (грипп, корь, ветряная оспа) препаратами, содержащими ацетилсалициловую кислоту, такими, как аспирин. Заболевание характеризуется развитием жировой инфильтрации печени и быстро прогрессирующей энцефалопатией вследствие отека головного мозга. Механизмы действия всего комплекса токсинов и жирового перерождения печени в этих случаях до сих пор изучены недостаточно. При отсутствии соответствующего лечения состояние больного может быстро ухудшиться вплоть до развития комы и остановки дыхания. Высокая смертность в 1980-е гг. детей, принимавших аспирин на фоне вирусной инфекции, привела к появлению во многих развитых странах запрета использовать аспирин как жаропонижающее и противовоспалительное средство детям до 12 лет.
Как лечить
Наиболее эффективный на сегодня метод лечения печеночных энцефалопатий — хирургический, т. е. пересадка донорской печени (Bajaj, 2010). При этом в случае острых состояний трансплантация должна быть проведена практически немедленно, в течение первых 3–4 дней заболевания (Lee, 2003).
Увы, в России за год проводится почти столько операций по трансплантации печени, сколько, например, в Испании за неделю. Хирургический метод декомпрессии портальной системы, предложенный Экком, в силу серьезных побочных эффектов не получил широкого распространения. В наши дни для декомпрессии портальной системы используют вазоконстрикторы (вещества, вызывающие сужение кровеносных сосудов и уменьшение кровотока) и лигирование (наложение латексных колец) варикозных сосудов.
Методы снижения концентрации аммония в крови, разработанные для лечения печеночной энцефалопатии еще в середине прошлого века, остаются актуальны и востребованы и на сегодняшний день (McDermott, 1958; Rose, 2012). Эти методы базируются на подавлении продукции этого токсичного метаболита кишечными бактериями, а также активации его превращения в мочевину в цикле мочевины (цикле Кребса — Хензелейта) в клетках печени и в аминокислоту глутамин — в различных органах и тканях.
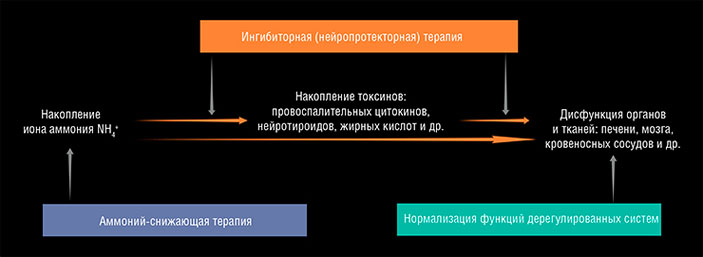
Первичным токсическим метаболитом, вызывающим поражение печени и печеночную энцефалопатию, является ион аммония. Рост его концентрации в клетках вызывает разбалансирование работы ряда метаболических и сигнальных систем, что в итоге пагубно влияет на когнитивные и моторные функции мозга. Современная терапия обычно направлена на снижение количества иона аммония в организме, а также ингибирование процессов, им вызываемых. Однако более действенным может оказаться комбинированная стратегия, направленная на снижение содержания иона аммония и на восстановление функций разрегулированных систем
Наряду с этими средствами, в условиях стационара при реанимации могут также использоваться гипотермия, инъекции глюкокортикоидов, противовоспалительных и других фармацевтических препаратов. В результате сочетанного применения подобных методов в клинической практике Европы и США за последние двадцать лет удалось в три раза уменьшить число летальных исходов, связанных с отеком мозга при острых формах печеночной энцефалопатии (Shawcross, 2012).
До последнего времени развитие прогрессирующего цирроза печени было связано в основном с алкоголизмом и вирусными заболеваниями печени (гепатитами B, C, E) у пациентов старше 40 лет. Однако в ближайшие годы ожидается резкое увеличение числа таких больных среди других групп населения, что связано со все большим распространением ожирения и диабета 2-го типа. По оценкам ВОЗ, число пациентов с диабетом 2-го типа в нашей стране на сегодня превышает 16 млн человек, четверть из которых — дети и подростки.
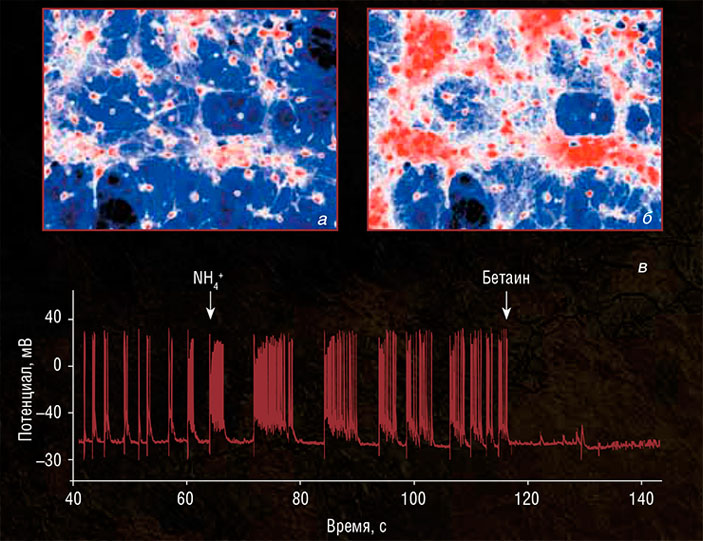
В исследованиях на культуре клеток гиппокампа лабораторных крыс показана возможность подавления избыточной импульсной активности нейронов, вызванной высокими концентрациями иона аммония, витаминоподобным веществом бетаином. На иллюстрации — активность нейронной сети, регистрируемая в культуре клеток гиппокампа крыс по свечению кальция: до введения аммония (а) и при гипераммонемии (б), а также запись электрической активности отдельного нейрона (в) до и после введения аммония (NH4 + ) и бетаина. По: (Кононов и др., 2013)
Предварительные исследования, проведенные в Институте биофизики клетки, Институте теоретической и экспериментальной биофизики и Институте биоорганической химии РАН (Пущино, Московская область), показали, что ион аммония вызывает гиперактивацию нейронных сетей, задействуя несколько типов клеточных рецепторов и каналов (Кононов и др., 2012, 2013; Dynnik et al., 2015). И чтобы уменьшить этот эффект, не обязательно ингибировать синтез глутамина или блокировать возбуждающие глутаматные рецепторы.
Действительно, зачем вызывать поломку двигателя несущегося автомобиля, имея исправные тормоза? На сегодня известен целый класс веществ, способных снижать гиперактивность нейронных сетей путем активации тормозных рецепторов нейронов мозга. К тому же комбинации этих веществ обладают аммоний-снижающим эффектом (Толмачева и др., 2011; Grishina et al., 2015). Комплексные соединения на их основе могут служить прототипами при разработке новых средств терапевтического лечения печеночной энцефалопатии (Богомолов и др., 2013).
В настоящее время на фоне отсутствия хорошо проработанных и широко доступных клеточных технологий эффективной регенерации больной печени перспективным, очевидно, является одновременное использование нескольких стратегий терапевтического лечения, направленных на снижение содержания токсинов и активацию разрегулированных метаболических и сигнальных клеточных систем, а также систем регуляции ключевых генов.
Литература
1. Экк Н. В. К вопросу о перевязке воротной вены // Воен. мед. журн., 1877. 130, 2:1.
2. Al Sibae M. R., McGuire B. M. Current trends in the treatment of hepatic encephalopathy // Ther. Clin. Risk Manag. 2009. Vol. 5(3). P. 617–626.
3. Hahn M., Massen O., Nencki M. et al. Die Ecksche Fistel zwi der unteren Hohlvene und der Pfortader und ihre Folgen fur den Organismus // Arch. Exp. Pathol. Pharmacol. 1893. Vol. 32. P. 161–210.
4. Leise M. D., Poterucha J. J., Kamath P. S., et al. Management of hepatic encephalopathy in the hospital // Mayo Clin. Proc. 2014. Vol. 89(2). P. 241–53.
5. Nencki M., Pavlov I. P., Zaleski J. Uber den Ammoniakgehalt des Bluttes und der Organe. Die Harnstoffbildung bei den Saugetieren // Arch. Exp. Pathol. Pharmacol. 1896. Vol. 37. P. 26–51.
6. Rose C. F. Ammonia-lowering strategies for the treatment of hepatic encephalopathy // Clin. Pharmacol. Ther. 2012. Vol. 92(3). P. 321–331.
7. Ryan J. M., Tranah T., Mitry R. R., et al. Acute liver failure and the brain: a look through the crystal ball // Metab. Brain Dis. 2013. Vol. 28(1). P. 7–10.
8. Review. Sturgeon J. P., Shawcross D. L. Recent insights into the pathogenesis of hepatic encephalopathy and treatments // Expert Rev. Gastroenterol. Hepatol. 2014. Vol. 8(1). P. 83–100.
Читайте также:


