Интерфероны в лечение грибовидного микоза

Первичные Т-клеточные лимфомы кожи (ПКТКЛ) представляют собой гетерогенную группу лимфопролиферативных заболеваний, характеризующихся клональной пролиферацией Т-лимфоцитов в коже. ПКТКЛ являются самостоятельными клинико-морфологическими формами экстранодальных неходжкинских лимфом и отличаются от нодальных гистологических аналогов характером течения, прогнозом и подходами к терапии. Наиболее распространенной формой ПТКЛ являются грибовидный микоз, частота его встречаемости среди всех ПКТКЛ составляет 50–72%.

Грибовидный микоз в большинстве случаев характеризуется хроническим медленно прогрессирующим течением с чередованием периодов обострения и клинического улучшения. Характер кожных поражений при грибовидном микозе может быть разнообразным и зависит от клинического варианта заболевания и стадии опухолевого процесса.При ранних стадиях заболевания могут наблюдаться разнообразныеэритематозные пятна, уртикароподобные, псориазо- и парапсориазоподобные, экземоподобныекожные элементы. Поздние стадии грибовидного микоза характеризуются появлением опухолевидных образований на коже, нередко с изъязвлениями, экстрадермальными очагами поражения, лейкемизацией опухолевого процесса.
Для правильного выбора терапевтической тактики необходимо руководствоваться принципами терапии грибовидного микоза, сформулированными Американским консорциумом по кожным лимфомам (UnitedStatesCutaneousLymphomaConsortium – USCLC, 2011) в 2011 г.:
1. Т-клеточные лимфомы кожи, в частности грибовидный микоз, отличаются от нодальныхлимфом характером течения заболевания, прогнозом, подходами к терапии;
2. Масса опухоли и скорость прогрессии определяют подходы к лечению;
3. Максимально сохранить собственный иммунный ответ;
4. Использовать иммунотерапию до тех пор, пока возможен контроль над заболеванием. Химиотерапия должна назначаться только тогда, когда исчерпаны другие ресурсы;
5. Всегда должна рассматриваться возможность комбинированного лечения (иммунотерапия + местная терапия);
6. Своевременное применение антибиотиков (колонизация кожи Staphylococcusaureus);
7. Сохранение качества жизни – лечение кожного зуда.
Т-клеточные лимфомы кожи, в частности грибовидный микоз, отличаются от нодальных лимфом характером течения заболевания, прогнозом, подходами к терапии.Поздние стадии грибовидного микоза, проявляющиеся образованием опухолевидных образований, изъязвлений кожи, экстрадермальной локализацией очагов поражения, необходимо отграничить от нодальных лимфом, протекающих с первичным поражением лимфоузлов и метастатическим поражением кожи. Важно помнить, что пациент с грибовидным микозом может обратиться к врачу на любой стадии опухолевого процесса. При поздних стадиях грибовидного микоза одновременно с опухолевыми образованиями, изъязвлениями будут наблюдаться эритематозные пятна и бляшки на коже, характерные для ранних стадий. Вид кожных элементов при метастатическом поражении кожи при нодальных лимфомах будет одинаковым. Тщательной анализ клинической картины и сбор анамнеза, комплексное обследование помогут разграничить первичное и метастатическое поражение кожи, верифицировать диагноз, а значит, выбрать правильную тактику лечения.
Своевременное применение антибиотиков (колонизация кожи Staphylococcusaureus). Нарушение барьерной функции кожи при грибовидном микозе, а также колонизация Staphylococcusaureus, приводит к развитию тяжелых инфекционных процессов. Своевременное назначение антибактериальной терапии уменьшает количество фатальных осложнений.
Сохранение качества жизни – лечение кожного зуда. Большинство пациентов на ранних и/или поздних стадиях заболевания испытывают мучительный кожный зуд. Снижение интенсивности зуда и различных нейропатий (ощущений жжения, боли, стягивания кожи, парестезий) для больных грибовидным микозом имеет важное психоэмоциональное значение. Для уменьшения этих ощущений используются увлажняющие кремы и антигистаминные препараты. При выраженном зуде рекомендовано назначение габапентина – препарата, используемого для лечения нейропатических болей. Кроме того, побочный эффект в виде седации нормализует ночной сон. Несоблюдение вышеизложенных принципов терапии снижает продолжительность и качество жизни пациентов и доставляет им мучительные страдания.
закономерность, чем больше курсов полихимиотерапии проводится, тем быстрее начинает прогрессировать заболевание.Нужно заметить, что на ранних стадиях грибовидного микоза, мы наблюдаем хрупкий баланс между опухолью и иммунитетом: часть появляющихся пятен регрессирует без какой-либо терапии. Не следует спешить назначать системную терапию, а эскалация противоопухолевого воздействия должна быть поэтапной, соответствующей характеру и распространенности кожных элементов. Системную терапию назначают только тогда, когда все виды наружной терапии исчерпаны и/или появились опухолевидные образования на коже и экстрадермальные очаги поражения. Необходимо объяснять пациентам, что не всегда нужно добиваться полного исчезновения проявлений заболевания, наличие косметических дефектов (пятен) не повод к экстренному проведению терапии. Цитостатическая терапия изменяет количество и функциональные характеристики иммунокомпетентных клеток. С каждым новым видом терапии сокращается продолжительность ремиссий.
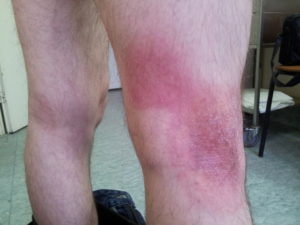
Другой распространенной ошибкой в лечении грибовидного микоза является длительная терапия глюкокортикоидами. Помимо побочных эффектов, таких как стероидный сахарный диабет, синдром Иценко-Кушинга, артериальная гипертензия, мы наблюдаем большее количество тяжелых инфекционных осложнений вследствие колонизации кожи Staphylococcusaureus и снижения количественных и функциональных характеристик иммунной системы. Кроме того, возможность проведения цитостатической терапии у пациентов с развившимися осложнениями после длительной терапии глюкокортикостероидами крайне ограничена. Глюкокортикостероиды могут быть включены в схему лечения коротким курсом продолжительностью 7-10 дней для усиления противоопухолевого эффекта цитостатической терапии и/или уменьшения симптомов воспаления, кожного зуда.
Мало внимания уделяется психоэмоциональному состоянию больных грибовидным микозом. Каждому больному необходимо объяснить характерные особенности заболевания и принципы лечения. Некоторые больные грибовидным микозом не могут смириться с неизлечимым характером заболевания, ходят от врача к врачу, подсознательно пытаясь найти того, кто пообещает вылечить от неприятного недуга.Как правило, обращаются к парамедицинским личностям (шаманы, народные целители и т.д.), прекращая при этом рекомендованную врачом терапию. В некоторых случаях находится малоопытный врач, который назначает полихимиотерапию, тем самым сокращая жизнь больного.
Грибовидный микоз являются редкой формой экстранодальных неходжкинских лимфом. Заболеваемость грибовидным микозом за последние десятилетия растет, значит, будет увеличиваться количество пациентов с этой нозологией.Своевременная верификация диагноза, правильно выбранная тактика лечения, коррекция кожного зуда позволят увеличить продолжительность жизни и обеспечить социальную адаптацию больных.

Дата публикации: 14.11.2015 2015-11-14
Статья просмотрена: 1774 раза
В данной статье рассматривается описание теоретического материала, методов лечения и диагностики грибовидного микоза.
Ключевые слова: грибовидный микоз, злокачественные лимфомы кожи, кожная T-клеточная лимфома, синдром Сезари.
Грибовидный микоз клинически и морфологически относится к неоднородной группе опухолей — злокачественные лимфомы кожи, которые развиваются вследствие пролиферации лимфоцитов в коже. Лимфомы кожи составляют заболевания, которые возникают первично и делятся на два больших класса: Т — и В — клеточные лимфомы кожи.
При Т — клеточной лимфоме Т — лимфоциты локализуются преимущественно в эпидермисе и верхних слоях дермы, а при В — клеточных лимфомах В — лимфоциты располагаются в средних и глубоких слоях дермы.
Самым распространенным заболеванием в группе Т — клеточных лимфом является грибовидный микоз. Это злокачественная опухоль лимфоидной ткани с первичным очагом в коже. В дальнейшем в патологический процесс могут вовлекаться лимфоузлы, костный мозг и внутренние органы.
Затем, в 1876 году французский дерматолог А. Базен подробно описал клинически картину так называемой классической формы грибовидного микоза.
В России первое клиническое наблюдение больного грибовидным микозом было представлено в 1889 г. профессором Киевского университета М. И. Стуковенковым.
Грибовидный микоз — заболевание людей старшего возраста. Более 75 % случаев грибовидного микоза наблюдаются у пациентов старше 50 лет.
Средний возраст дебюта заболевания составляет 55–60 лет. Могут болеть дети и подростки, но это наблюдается лишь в 1 % случаев. Соотношение заболевших мужчин и женщин составляет 1, 6–2, 0: 1
Генетический фактор (риск заболевания возрастает у родственников первой линии больных Т — клеточной лимфомы кожи);
Ухудшение экологической обстановки;
Длительно протекающие хронические дерматозы (нейродермит, атопический дерматит, псориаз), которые приводят к нарушению барьерной и иммунологической функции кожи. Это способствует проникновению инфекционных агентов, которые усиливают поломки в иммунной системе кожи, что приводит к развитию опухолевого процесса.
Вирус Т — клеточного лейкоза человека типа 1 (HTLV-1) — основной этиологический фактор, инициирующий развитие Т-клеточных злокачественных лимфом кожи.
Цитокины, вырабатываемые лимфоцитами, эпителиальными клетками и клетками макрофагальной системы, обладают провоспалительным и пролиферативным действием:
ИЛ — 1 — отвечает за дифференцировку лимфоцитов;
ИЛ — 2 — фактор Т — клеточного роста;
ИЛ — 4 и ИЛ — 5 — усиливают приток в очаги поражения эозинофилов и их активацию.
В результате притока в очаг поражения Т-лимфоцитов образуются микроабсцессы Потрие. Это микроскопическое скопление атипичных лимфоцитов и гистиоцитов в эпидермисе при грибовидном микозе.
С усилением пролиферации лимфоцитов происходит угнетение активности клеток противоопухолевой защиты:
дендритических клеток, в частности клеток Лангерганса;
цитокинов (ИЛ — 7, ИЛ — 15) — ингибиторов опухолевого роста.
- Различают три клинические формы заболевания: классическую, эритродермическую и обезглавленную.
Для Т — клеточных лимфом кожи характерен полиморфизм высыпаний в виде пятен, бляшек, опухолей. Все виды высыпаний сопровождаются зудом.
Классическая форма грибовидного микоза характеризуется 3 стадиями развития: эритематозно — сквамозной, бляшечной и опухолевой [1; 2]
В первой стадии высыпания чаще всего представлены эритематозными пятнами на коже туловища или ягодиц. Их количество увеличивается, со временем процесс принимает характер эритродермии. Высыпания могут существовать годами.
Во второй стадии на месте пятнистых высыпаний появляются бляшки (форма округлая или неправильная, цвет интенсивно — фиолетовый, четко отграничены от здоровой кожи, поверхность плотная, шелушащаяся). Некоторые бляшки могут спонтанно разрешаться, оставляя участки темно — бурой гиперпигментации или атрофии. Зуд более интенсивный и мучительный, отмечается лихорадка и снижение массы тела, наблюдается лимфоаденопатия.
В третьей стадии появляются безболезненные опухоли, консистенция плотно — эластическая, цвет желто — красный, форма сферическая или приплюснутая, напоминает шляпки грибов. Появляются повсеместно, количество от 1 до десятка, размеры от 1 до 20 см в диаметре.
Слабость и снижение массы тела. Характерен резко выраженный лейкоцитоз до 100 000 клеток в 1 мм 3, в лимфоцитограммах — не менее 10 % клеток Сезари. Эти клетки представляют собой малигнизированные Т — хелперы, ядра которых со складчатой церебриформной поверхностью, с глубокими инвагинациями ядерной мембраны. Летальный исход через 2–4 года.
Обезглавленная форма — начинается внезапным появлением опухолей без предшествующих высыпаний. Характеризуется высокой степенью малигнизации и расценивается как проявление лимфосаркомы. Летальный исход наступает в течение 1 года.
- Для подразделения лимфом кожи по стадиям используют классификацию TNM (T — кожа, N — лимфатические узлы, M — внутренние органы)
TNM — классификация кожных Т-клеточных лимфом (1987 год) [3]
Т: Кожа Т0 Клиническое и\или гистологическое подозрение на грибовидный микоз
Т1 Экзематозные очаги, бляшки: менее 10 % поверхности тела
Т2 Экзематозные очаги, бляшки: более 10 % поверхности тела
Т3 Опухолевидные образования (более одного)
N: Лимфоузлы N0 Лимфоузлы не пальпируются
N1 Лимфоузлы пальпируются; гистологически нет данных за кожную Т-клеточную лимфому (далее КТКЛ)
N2 Лимфоузлы не пальпируются; гистологический инфильтрат КТКЛ
N3 Лимфоузлы пальпируются; гистологический инфильтрат КТКЛ
B: Кровь В0 Атипичные лимфоциты в крови отсутствуют ( 5 %)
M: Внутренние органы М0 Внутренние органы не поражены
M1 Гистологически подтверждается поражение внутренних органов.
Вторичный сифилис (особенно у пациентов, инфицированных ВИЧ — 1);
Псевдолимфома (обусловленная приемом некоторых лекарственных средств, например, противосудорожные препараты — фенобарбитал, карбамазепин, фенитоин, может имитировать грибовидный микоз по комплексу гистологических и клинических признаков)
Атопический дерматит, псориаз, розовый лишай (на ранних стадиях)
Не существует лабораторных критериев, позволяющих четко определить дозы, сроки или эффективные комбинации препаратов.
ЦОП — блео (циклофосфан, винкристин, преднизолон, блеомицин);
ЦХОП (циклофосфан, винкристин, доксорубицин, преднизолон),
МОПП (мехлорэтамин, винкристин, прокарбазин, преднизолон)
Антиметаболиты — метотрексат, меркаптопурин, пуринетол;
Замедляющие нуклеиновый обмен и рост активно пролиферирующих тканей;
Алкилирующие агенты (циклофосфан, тиофосфамид),
Действующие непосредственно на ДНК клетки;
Вещества растительного происхождения (винкристин, винбластин);
Блокирующие деление клеток на стадии метафазы;
Синтетические противоопухолевые антибиотики (спиробромин, проспидин);
Противоопухолевые антибиотики (адриамицин, блеомицин, брунеомицин).
- Проспидинотерапия (проспидин и небольшие дозы кортикостероидов) — отсутствие серьезных побочных эффектов, действие на мембраны клеток, но длительное применение приводит к привыканию.
- ПУВА-терапия — применении фотосенсибилизаторов в комбинации с УФ-облучением в области А. Зона воздействия УФА-света находится в пределах эпидермиса и верхней трети дермы. Применение данного метода в доопухолевых стадиях заболевания. В опухолевой стадии используют сочетание УФ-облучения с полихимиотерапией или рентгеновским облучением.
- Электронно-лучевая терапия — облучении быстрыми электронами, воздействовать на опухолевый субстрат в глубоких отделах кожи
На ранних стадиях используют ретиноиды (изотретиноин, этретинат, тигазон), действие которых направлено на процессы созревания Т-хелперов.
Гормоны тимуса: Т-активин, тимопоэтин, тимозин, тималин, тимоген;
Леакадин — обладает противоопухолевым и иммуномодулирующим действием
Интерфероны (α-интерферон — виферон, реальдирон, вэллферон; β-интерферон — ребиф 22, бетаферон, лейкинферон; γ-интерферон — имукин) — противоопухолевая активность, модуляция механизмов гуморальной регуляции иммунного ответа, активируют макрофагальную и комплементарную системы организма, нормализуют продукцию провоспалительных цитокинов, воздействуют на экспрессию генов и антигенов главного комплекса гистосовместимости;
- Ламоткин И. А. Типы клинического течения грибовидного микоза// Междунар. мед. журн. — 2001. — № 5. — С. 427–428.
- Кутасевич Я. Ф. Особенности патогенеза, методы ранней диагностики и рациональной терапии грибовидного микоза: Автореф. дис. докт. мед. наук, 1989. — С. 33.
- Kerl H, Sterry W (1987) Classification and staging. In: EORTC/BMBF Cutaneous Lymphoma Project Group: Recommendations for staging and therapy of cutaneous lymphomas (G. Burg and W. Sterry, eds.) pp 1–10
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходит
Одной из наиболее актуальных задач современной дерматологии является изучение механизмов развития, разработка ранних критериев диагностики и дальнейшее совершенствование методов лечения злокачественных Т-лимфом. Среди них наибольший удельный вес приходится на грибовидный микоз (ГМ). Согласно современным взглядам, биологическая сущность ГМ, вне зависимости от клинических проявлений и стадии процесса, определяется как пролиферация трансформированных Т-лимфоцитов [3, 6]. Причем ГМ относится к лимфомам низкой степени злокачественности.
Разнообразие клинических проявлений, отсутствие единых критериев систематизации патологического процесса, а также изменение представлений о кроветворении объясняют разнообразие различных классификаций злокачественных лимфом кожи. Так, L. Fuks оценивает степень тяжести ГМ следующим образом: I стадия — поражение только кожи; II стадия — поражение кожи и дерматопатический лимфаденит; III стадия — поражение кожи, регионарных лимфоузлов и/или селезенки; IV стадия — кожные и внекожные поражения с или без вовлечения в патологический процесс лимфоузлов и селезенки. Группа исследователей из ФРГ выделяет 5 стадий ГМ: I–III стадии — кожный ГМ (I — экзематоидные очаги поражения, II — папулы и бляшки, III — опухолевидные очаги поражения); IV стадия — кожный ГМ с лимфоаденопатией; V стадия — любые клинические проявления при наличии поражения внутренних органов. В основу классификации, применяемой в США, положена оценка степени выраженности следующих элементов лимфопролиферативного процесса: клиническая характеристика кожного процесса (T — tumor); наличие или отсутствие клинической и гистологической патологии лимфоузлов (N — nodus); наличие или отсутствие патологии внутренних органов (M — metastasis). Каждый элемент имеет несколько градаций, обозначаемых цифрами, которые отражают степень или распространенность патологического процесса. Учитывая несовершенство многочисленных классификаций ГМ, до настоящего времени в дерматологии широко применяется деление ГМ на 3 стадии: экзематоидно-эритродермическую, инфильтративно-бляшечную и туморозную [4, 5].
Таким образом, анализ литературного материала показал, что ГМ выделяется в самостоятельную нозологию и рассматривается как экстранодальная, поражающая преимущественно кожу, эпидермотропная лимфома, представленная инфильтрацией Т-хелперных клеток, имеющая своеобразную клинику, течение и патогистологическую картину.
Этиология и патогенетические механизмы ГМ до сих пор не ясны. До настоящего времени не известны побудительные мотивы неконтролируемой Т-клеточной пролиферации. Предполагается, что возникновение ГМ может быть связано с персестирующей вирусной инфекцией. Так, в ряде работ сообщается о выявлении в первичной клеточной культуре, полученной из лимфоузла больного в инфильтративно-бляшечной стадии ГМ, вирусных частиц, морфологически характерных для ретровирусов типа С [15]. Кроме того, в ДНК первичных клеточных культур, полученных от больных ГМ, выявлено наличие последовательности, родственной гену gag HTLV-1.
Определенную роль в возникновении злокачественных лимфом отводят генетическим факторам. Доказано, что развитие различных видов солидных опухолей и лейкемий связано с появлением и дальнейшим нарастанием хромосомных аномалий. В последние годы появились публикации о хромосомных перестройках при ГМ, которые способствуют активации онкогенов и инактивации генов опухолевой супрессии при развитии лимфопролиферативного процесса. В настоящее время в литературе широко обсуждается положение о том, что значимые патогенетические факторы ГМ могут быть носителями ксеногенной информации, приводящей к патологическим сбоям в функционировании различных систем и клеток макроорганизма [13]. В первую очередь такие изменения наблюдались со стороны иммунокомпетентных клеток, эпидермоцитов, макрофагальных элементов кожи, рецепторного аппарата кожи и продукции цитокинов. Имеющиеся в отечественной и зарубежной литературе сведения о состоянии иммунного гомеостаза убедительно свидетельствуют о стойких патологических сдвигах как в клеточном, так и в гуморальном звеньях иммунитета. Анализ иммунного статуса показал, что у большинства больных ГМ при нормальном количестве в сосудистом русле В-лимфоцитов среднее содержание Т-клеток значительно снижено по сравнению с показателями здоровых доноров. Отмечено снижение как Т-супрессорных, так и Т-хелперных лимфоцитов, причем количество последних снижается более существенно. Относительную лимфопению многие авторы рассматривают как наиболее часто встречающийся гематологический признак ГМ. Другие, кроме того, отмечают наличие абсолютной лимфопении в опухолевой стадии заболевания. Функциональная активность лимфоцитов у больных ГМ, по данным ряда авторов, снижена. Другие сообщают об отсутствии достоверных различий в характере пролиферации лимфоцитов периферической крови больных и здоровых лиц. Установлено, что течение патологического процесса при ГМ сопровождается снижением активности естественных киллеров.
Разноречивы результаты исследований состояния гуморального звена иммунитета. В ряде работ не выявлено существенных нарушений в продукции В-лимфоцитами иммуноглобулинов. Вместе с тем есть указания на наличие при ГМ явного IgМ- и скрытого IgA- и IgG-дефицита антителообразования. Другие исследователи выявили увеличение в крови больных ГМ количества IgA, IgМ, а также значительный рост концентрации IgG. При этом увеличение уровня иммуноглобулинов объясняют хелперным фенотипом опухолевого субстрата при ГМ. Таким образом, изменения показателей иммунного статуса у больных ГМ характеризуются значительной вариабельностью и отсутствием признаков, имеющих безусловное диагностическое значение.
В последние годы достигнут значительный прогресс в терапии ГМ, однако лечение больных с этим тяжелым, неуклонно прогрессирующим заболеванием представляет значительные сложности. Ситуация усложняется еще и тем, что не существует лабораторных критериев, позволяющих четко определить дозы, сроки или эффективные комбинации препаратов. Руководствуясь принципом интенсивной терапии опухолевых процессов, для лечения ГМ используют различные полихимиотерапевтические схемы: ЦОП — блео (циклофосфан, винкристин, преднизолон, блеомицин), ЦХОП (циклофосфан, винкристин, доксорубицин, преднизолон), МОПП (мехлорэтамин, винкристин, прокарбазин, преднизолон). Противоопухолевые средства, вошедшие в практику лечения ГМ, относятся к различным группам: антиметаболиты (метотрексат, метотрексат лахема, метотрексат-эбеве, меркаптопурин, пури-нетол), замедляющие нуклеиновый обмен и рост активно пролиферирующих тканей; алкилирующие агенты (циклофосфан, циклофосфамид-тева, циклофосфан-ЛЭНС, тиофосфамид), действующие непосредственно на ДНК клетки; вещества растительного происхождения (винкристин, винкристин ликвид-рихтер, винбластин, винбластин-рихтер), блокирующие деление клеток на стадии метафазы; синтетические противоопухолевые антибиотики (спиробромин, проспидин); противоопухолевые антибиотики (адриамицин, блеомицин, брунеомицин).
Препараты назначались в общепринятых для лечения онкологических заболеваний дозировках и режимах введения. Однако различные осложнения (чаще всего угнетение костно-мозгового кроветворения), а также недостаточная эффективность явились основанием для исключения из практики ряда цитостатических препаратов.
Высокой терапевтической эффективностью в сочетании с небольшими дозами кортикостероидов при лечении ГМ обладает проспидин. Существенным достоинством проспидинотерапии, отличающим ее от лечения другими химиопрепаратами, является отсутствие серьезных побочных эффектов. Это связано с тем, что основной мишенью действия проспидина являются не ДНК клеток, а их мембраны. Однако длительное применение препарата приводит к привыканию, в связи с чем эффективность терапии заметно снижается.
Для лечения больных ГМ широко используется ПУВА-терапия, основанная на применении фотосенсибилизаторов в комбинации с УФ-облучением в области А [7, 11]. Учитывая тот факт, что зона воздействия УФА-света находится в пределах эпидермиса и верхней трети дермы, целесообразно применение данного метода в доопухолевых стадиях заболевания. В опухолевой стадии ГМ обычно используют сочетание УФ-облучения с полихимиотерапией или рентгеновским облучением. Для лечения больных ГМ применяется также электронно-лучевая терапия, основанная на облучении быстрыми электронами. Данная методика позволяет воздействовать на опухолевый субстрат в глубоких отделах кожи, что значительно повышает эффективность лечебных мероприятий при ГМ. На ранних стадиях ГМ часто используются ретиноиды (изотретиноин, этретинат, тигазон), действие которых направлено на процессы созревания Т-хелперов [12].
В последние годы большое внимание уделяется разработке иммунокоррегирующих методов лечения ГМ. Иммуномодулирующее воздействие гемосорбции, плазмафереза, лейкофереза, фотофореза при ГМ позволяет сократить разовые и курсовые дозы цитостатиков, что в определенной степени способствует снижению частоты побочных эффектов химиотерапии. Мы изучали влияние тимодепрессина на состояние иммунного статуса у 12 больных ТМ. Препарат вводился ежедневно всем по 2 мл в течение 3 семидневных курсов лечения с недельным перерывом. Изучение иммунного статуса больных ГМ показало, что тимодепрессин сдерживает развитие пула атипичных Т-лимфоцитов, устраняя воспалительные и пролиферативные изменения в эпидермодермальном пространстве пораженных участков кожи. После окончания терапии состояние клинической ремиссии было достигнуто у 5 больных, значительное клиническое улучшение — у 6 пациентов, в течение года состояние клинической ремиссии сохранялось у 4 больных, еще у 4 больных возникли рецидивы ГМ спустя 3–6 мес после лечения. Повторное назначение тимодепрессина во всех случаях позволило купировать патологический процесс.
В терапевтические схемы лечения ГМ нередко включаются гормоны тимуса: Т-активин, тимопоэтин, тимозин, тималин, тимоген и др. Применяется также леакадин, обладающий противоопухолевым и иммуномодулирующим действием. Широко используются при лечении ГМ интерфероны [8, 14]. Они обладают выраженной противоопухолевой активностью, обусловленной не только прямым цитостатическим действием на опухолевые клетки, но и модуляцией механизмов гуморальной регуляции иммунного ответа. Установлено, что препараты данной группы (α-интерферон — виферон, реальдирон, вэллферон; β-интерферон — ребиф 22, бетаферон, лейкинферон; γ-интерферон — имукин) активируют макрофагальную и комплементарную системы организма, нормализуют продукцию провоспалительных цитокинов, воздействуют на экспрессию генов и антигенов главного комплекса гистосовместимости.
Сравнительный анализ терапевтических возможностей различных методов лечения ГМ позволил американской медицинской ассоциации рекомендовать следующую тактику ведения больных ГМ. На ранних стадиях лимфопролиферативного процесса показаны наружное применение кортикостероидов (локоид, полькортолон, фторокорт, целестодерм-в, флуцинар, элоком, адвантан, кутивейт, дермовейт), ПУВА-терапия, локально наносимые цитостатики, радиотерапия быстрыми электронами и мягколучевая рентгенотерапия. При прогрессировании ГМ используется системная терапия в виде комбинации ПУВА-терапии с ретиноидами или рекомбинантным α-интерфероном. При эритродермической форме ГМ рекомендован экстракорпоральный фотофорез в сочетании с α-интерфероном или ретиноидами. Таким образом, анализ литературного материала убедительно показал целесообразность дальнейшего изучения биологической сущности ГМ и разработки более эффективных схем его лечения.
- Гостева И. В. Фотофорез в комплексной терапии Т-клеточных злокачественных лимфом кожи: Автореф. дис. . канд. мед. наук. — 1995. — С. 22.
- Вавилов А. М., Лезвинская Е. М. Иммунокомпетентные структуры кожи и их роль в развитии первичных кожных лимфом//Архив патологии. 1996. — № 6. — С. 7–2.
- Ершов В. И., Бочкарникова О. В., Соколова И. Я. Кожные лимфомы//Актуальные вопросы внутренней медицины и педагогики: Сб. науч. тр. — 2000. — C. 232–240.
- Ламоткин И. А. Типы клинического течения грибовидного микоза// Междунар. мед. журн. — 2001. — № 5. — С. 427–428.
- Кутасевич Я. Ф. Особенности патогенеза, методы ранней диагностики и рациональной терапии грибовидного микоза: Автореф. дис. . докт. мед. наук, 1989. — С. 33.
- Трофимова И. Б. Т-клеточные злокачественные лимфомы кожи: иммунофенотипические особенности и терапия// Автореф. дис. . докт. мед. наук, 1994. — С. 34.
- Самсонов В. А., Вавилов А. М., Васина Н. И. Эффективность фотохимиотерапии в сочетании с лейкинфероном на различных стадиях Т-клеточных злокачественных лимфом кожи: Сб. науч. тр. — Астрахань, 1998. — С. 117–118.
- Самсонов В. А., Чистякова И. А., Аверина Л. В. Гаммаферон в терапии больных грибовидным микозом// Вестник дерматологии и венерологии, 1995. — № 5. — С. 4 — 6.
- Хасан Хамад А., Попова О. Н., Силуянова С. Н., Белушкина Н. Н. Исследование апоптоза лимфоцитов периферической крови больных с Т-клеточной лимфомой кожи и ангиитами кожи// Вопр. биол. мед. и фармац. химии. — 2000. —№ 4. — С. 22 — 25.
- Чиарион В., Бонони А., Форнаса К. Вторая фаза исследования применения интерферона-альфа с ПУВА-терапией у больных Т-клеточной лимфомой кожи// Журнал клинической онкологии. — 2002. — № 15. — С. 2876 — 2880.
- Carretero C. D., Fivenson D. P. A complement and durable response to denileukin diftitoх in a patient with micosis fungoides. J. Acadam Dermatol., 2003; 48, 275 — 276.
- Eichmuller S., Usener D. Tumor-specific antigens in cutaneous T-cell lymphoma. Int. J. Cancer. — 2003; 104. Р. 482 — 487.
- Kim Y., Martines G. Topical nitrogen mutard in management of micosis fungoides. Arch.Dermatol. — 2003; 139. Р. 165 — 173.
- Ferenczi K. Increased CCR4 expression in cutaneous T cell lymphoma. J. Invest Dermatol. 2002; 119; 1405 — 1410.
- Mucher J. Vaccination therapy for cutaneous T-cell lymphoma. Clin Exp. Dermatol. 2002; 27; 602 — 607.
- Rook A., Wysocka M. Citokines and other biologic agents as immunotherapeutics for cutaneous T-cell lymphoma. Adv. Dermatol. 2002; 18; 29 — 43.
Н. Г. Короткий, доктор медицинских наук, профессор
М. В. Уджуху
РГМУ, Москва
Читайте также:


