Аллергический бронхолегочный аспергиллез что это
| Аспергиллез – заболевание, вызываемое плесневыми грибами рода Aspergillus, поражающее преимущественно органы дыхания – легкие и околоносовые пазухи, а также, в некоторых случаях, и другие органы – кожу, почки, головной мозг, органы зрения. Его считают второй по частоте после кандидомикоза микотической инфекцией [8]. |
| В общем, в большинстве случаев диагноз различных форм аспергиллеза остается предположительным по совокупности признаков. Иногда приходится назначать лечение, особенно тяжелым больным с иммунологическими нарушениями, не обладая убедительными доказательствами в пользу аспергиллеза [7]. |
Лечение. Прежде всего, следует заметить, что большинство плесневых грибов, в том числе и Aspergillus, нечувствительны к флуконазолу.
При бессимптомной аспергилломе показано наблюдение. При развитии или высоком риске осложнений (повторное кровохарканье, легочное кровотечение, инвазивный рост) показано хирургическое удаление аспергилломы.
Однако нужно учесть, что в ряде случаев аспергилломы редуцируются и исчезают без оперативного лечения. В то же время, нередки осложнения и рецидивы после операции.
Для терапии инвазивного аспергиллеза легких (а также аспергилломы), в частности, с целью предоперационной подготовки, в случаях множественных аспергиллом, препаратом выбора является амфотерицин В в дозе 1,0-1,5 мг/кг/сутки внутривенно до стабилизации процесса. Средняя курсовая доза препарата составляет 1,5-2,0 г. Затем назначают итраконазол в дозе 400 мг/сутки на протяжении 2-6 мес [8].
У больных с менее выраженной иммуносупрессией возможна терапия с использованием только итраконазола: по 600 мг/сутки в течение 4 дней, затем по 400 мг/сутки 2-6 мес.
Амфотерицин В обладает рядом серьезных побочных эффектов: часто вызывает озноб и лихорадку, нефротоксичен, гастротоксичен, вызывает появление высыпаний на коже, нарушение ритма сердца и так далее. К тому же эффект препарата при инвазивных формах аспергиллеза не очень высок и составляет 10-40%. Итраконазол лучше переносится, но эффективность тоже невелика.
В последние годы на отечественном фармацевтическом рынке появился новый препарат из группы триазолов: вориконазол, обладающий широким антимикотическим действием, демонстрирующий большую клиническую эффективность по сравнению с итраконазолом и амфотерицином и меньшую токсичность, чем амфотерицин.
Препарат вводится в дозе 6 мг/кг два раза в первые сутки, затем – 4 мг/кг два раза в день на протяжении 7 дней (до 4 нед), а в дальнейшем – перорально по 200 мг два раза в сутки на срок от 4 до 24 нед.
Иная тактика используется для лечения аллергического бронхолегочного аспергиллеза. Купирование и профилактика бронхиальной обструкции, а также эозинофильных инфильтратов проводится с помощью системных кортикостероидов в дозе 0,5 мг/кг/сутки внутрь с последующим снижением до поддерживающей дозы (5-10 мг/сутки) на протяжении 3-6 мес.
Применение итраконазола по 200-400 мг/сутки на период от 1 до 6 мес после купирования синдрома бронхиальной обструкции способно снизить дозу и продолжительность приема кортикостероидов.
Возможно также лечение с использованием амфоглюкамина (амфотерицин В + метилглукамин), кетоконазола, флуцитозина, десенсибилизация аспергиллезными экстрактами [4].
Недавно для лечения инвазивных микозов разрешено использование нового эхинокандина – капсофунгина, выпускаемого во флаконах по 50 мг препарата, который разводится в 0,9% растворе хлорида натрия. В первый день вводится 70 мг один раз в сутки, потом 50 мг один раз в день внутривенно. Препарат может вызывать побочные действия (лихорадка, флебиты, головная боль, тошнота, высыпания на коже, повышение активности печеночных ферментов, иногда анафилаксия), но переносится лучше, чем амфотерицин В. Изучается возможность применения других эхинокандинов: микафунгина, анидулазофунгина [5].
| Бронхолегочный аспергиллез – не особо редкое, но трудно диагностируемое, в силу ряда причин, заболевание, которое часто (главным образом в случае инвазивного процесса), представляет непосредственную угрозу жизни пациента. Назначение адекватной антимикотической терапии позволяет в ряде случаев спасти жизнь больного. |
Выявление микотического компонента в этиологии тяжелой бронхиальной астмы, экзогенного аллергического альвеолита может служить основой для проведения элиминационных мероприятий.
Лечение аллергического бронхолегочного аспергиллеза проводится с использованием кортикостероидов и других противоастматических средств [6]. Однако использование антифунгальной терапии может значительно улучшить прогноз таких больных, хотя ее назначение в острый период, на фоне симптомов тяжелой астмы способно ухудшить течение процесса.
Роль аспергиллов в развитии различных бронхолегочных заболеваний требует дальнейшего изучения.
Victor E. Ortega
, MD, PhD, Center for Genomics and Personalized Medicine Research, Wake Forest School of Medicine;
, MD, Wake Forest School of Medicine
Last full review/revision March 2017 by Victor E. Ortega, MD, PhD; Emily J. Pennington, MD


АБЛА развивается в том случае, если дыхательные пути пациента с бронхиальной астмой или муковисцидозом колонизирует Aspergillus (грибы находятся в почве).
Патофизиология
По неясным причинам колонизация у этих пациентов вызывает выработку антител (IgE и IgG) и реакции клеточного иммуни-тета (реакции гиперчувствительности I, III и IV типа) на антигены Aspergillus, что приводит к частым, повторным обострениям бронхиальной астмы. Со временем, иммунные реакции, в сочетании с прямым токсическим действием гриба, приводят к повреждению дыхательных путей с развитием дилатации и, в конечном счете, бронхоэктазов и фиброза. Гистологически заболевание характеризуется обтурацией дыхательных путей слизью, эозинофильной пневмонией, инфильтрацией альвеолярных перегородок плазматическими и мононуклеарными клетками и увеличением количества бронхиолярных слизистых желез и кубических клеток.
В редких случаях другие грибы, такие как Penicillium, Candida, Curvularia, Helminthosporium и Drechslera, приводят к развитию идентичного синдрома, который носит название аллергический бронхопульмональный микоз; при этом бронхиальная астма или муковисцидоз отсутствуют.
Aspergillus находится в просвете дыхательных путей, но инвазии не происходит. Таким образом, АБПА нужно дифференцировать с инвазивным аспергиллезом, который встречается у пациентов с ослабленным иммунитетом; аспергилломами, которые представляют собой скопления Aspergillus у пациентов с кавернами или кистами легких; с редкой аспергиллезной Aspergillus пневмонией, которая встречается у больных, длительно получающих низкие дозы преднизолона (например, больные с ХОБЛ). Несмотря на явные различия, наблюдались совпадающие синдромы.
Клинические проявления
Симптомы аналогичны таковым при обострении бронхиальной астме или легочного муковисцидоза; также наблюдается кашель с мокротой грязно-зеленого или коричневого цвета, иногда – кровохарканье. Лихорадка, головная боль и анорексия – частые системные симптомы тяжелого заболевания. Симптомы – это проявления обструкции дыхательных путей, специфичными являются хрипы и удлинение выдоха, которые наблюдаются и при обострении бронхиальной астмы.
Диагностика
Бронхиальная астма в анамнезе
Рентген грудной клетки или КТ с высоким разрешением
Инъекционная кожная проба сантигенами Aspergillus
AspergillusПреципитины Aspergillus в крови
Положительный посев мокроты на наличие видов Aspergillus (или, реже, других грибков)

Заболевание следует заподозрить у пациентов с бронхиальной астмой при частых обострениях, наличии мигрирующих или неразрешающихся инфильтратов по данным рентгенографии органов грудной клетки (за счет ателектаза, обусловленного наличием слизистой пробки и закупорки бронха), признаках бронхоэктазов по данным визуализирующих методов, положительном результате посева мокроты на A. fumigatus или выраженной эозинофилии периферической крови.

Было предложено несколько диагностических критериев ( Диагностические критерии аллергического бронхопульмонального аспергиллеза), но практически в каждом случае оценивают не все критерии.
Когда диагноз уже заподозрен, оптимальным первым шагом будет кожная инъекционная проба с антигенами Aspergillus. Немедленная реакция на пробу есть поводом к измерению уровней сывороточного IgE и антител к Aspergillus (преципитинов), поскольку до 25% пациентов с астмой без аллергического бронхолёгочного аспергиллеза могут иметь положительный кожный тест. Уровень IgE > 1000 нг/мл (> 417 МЕ/мл) и положительная преципитация указывают на диагноз, который должен быть подтвержден измерением специфических иммуноглобулинов к Aspergillus (до 10% здоровых пациентов имеют циркулирующие преципитины). В случае подозрения на АБПА, диагноз подтверждает концентрация специфичных антител IgG и IgE к A. fumigatus, если она, по крайней мере в два раза выше, чем у пациентов без АБПА.
В случаях, когда результаты анализов расходятся, например, когда уровень IgE в сыворотке повышен, однако не выявлены иммуноглобулины, специфичные к A. fumigatus, анализ следует повторить, и пациента следует наблюдать в течение длительного времени, чтобы подтвердить или опровергнуть диагноз.

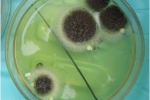
Эта публикация переработана автором оригинальной статьи, чтобы пояснить пациентам, что же такое аспергиллезная инфекция легких. Использован собственный опыт ведения более 100 пациентов с аспергиллезом в условиях стационара НИИ пульмонологии.
В этой статье не будут представлены тяжелые формы аспергиллезной инфекции, которая встречается у пациентов с иммунодефицитом или после трансплантации органов. Мы затронем аллергические, не инвазивные формы аспергиллёзной инфекции – это АБЛА, бронхиальную астму с гиперчувствительностью к аспергиллам.
Аспергиллы – это плесневые грибы, свободно проживающие рядом с нами. Они необходимая часть биосферы. Плесневые грибы распространены повсеместно. И неизбежно при вдыхании воздуха человек может контактировать со спорами грибов. Не все из них могут нанести вред человеку. Плесневые грибы Aspergillus в основном населяют верхний слой почвы, где есть перегной. Так же они встречаются в домах людей — старый пол, обои, протекающие краны в ванной, теплицы и т.п. Но не все люди даже при контакте с грибами могут заболеть. Для неблагоприятного развития ситуации, прежде всего у человека, должен быть иммунологический дефект — снижена защита или имеется аллергическая реакция на плесневые грибы (например, при длительном контакте с плесенью). И количество плесневых спор попавших в дыхательные пути человека должно быть значительным.
Как развивается АБЛА?
Впервые аллергический бронхолегочный аспергиллез (АБЛА) был описан в 1952 г. Термин АБЛА стал широко известен среди пульмонологов и аллергологов. Это заболевание не всегда четко диагностируется или пропускается вовсе. В эпоху отсутствия современной иммунологии, КТ диагностики легких этот факт был объясним. По моим наблюдениям невысокая диагностика АБЛА связана с тем, что заболевание считалось редко встречаемым. При этом бронхолёгочный аспергиллез включает в себя ряд схожих симптомов и проявлений, характерных для других болезней.
АБЛА возникает при колонизации плесневыми грибами аспергиллами (A. fumigatus) дыхательных путей с обязательной комбинированной аллергической реакцией организма. Это не просто аллергическая реакция, которая выражается в аллергическом насморке, чихании или даже атопической астме. Это сложный воспалительный процесс, приводящий к мощному выбросу медиаторов воспаления, эозинофильному воспалению и повреждению тканей легкого.
Колонизация гриба становится возможной из-за повреждения стенок бронха, снижению иммунной защиты. Это позволяет плесневому грибу активно размножаться. При прорастании грибов, по аналогии с обычными грибами в лесу, из спор образуются т.н. гифы (или если угодно аналог грибницы). Прорастая, гифы разрушают стенки бронхов, защитные и эвакуаторные способности бронхов резко снижаются, нарушается отхаркивание мокроты, создаются условия для размножения грибов. Все процессы вместе еще больше снижают защитные возможности иммунитета пациента. В норме макрофагам человека удается быстро справиться и удалить из организма споры грибов.
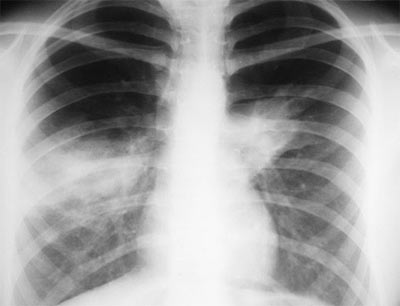
На фото рентгенография легких у пациента с АБЛА.
Сочетание бронхиальной астмы (синдром бронхиальной обструкции) плюс выявление специфических антител к грибам рода аспергиллюс, с большой достоверностью указывают на наличие у пациента АБЛА. Проведение накожных аллерго-проб к плесневым грибам Aspergillus помогает подтвердить диагноз.
Можно выделить несколько ситуаций у пациента, требующих исключения диагноза АБЛА:
- Устойчивая к лечению бронхиальная астма или тяжелая гормонозависимая БА.;
- Эозинофильные инфильтраты в легких;
- Сочетание бронхиальной астмы с инфильтратами в легких и/или с бронхоэктазами.
Бронхиальная астма с гиперчувствительностью к аспергиллам
Бронхиальная астма с гиперчувствительностью к аспергиллам (БА)- это обычная бронхиальная астма, которая обостряется при контакте с аллергенами – плесневыми грибами. При этом у пациента отсутствуют легочные эозинофильные инфильтраты, отсутствует лихорадка, высокие значения эозинофилов и антител.
Для лечения грибковой БА мы используем стандарты по лечению бронхиальной астмы, которые освещены отдельно на нашем сайте. Противогрибковой терапии не применяют.
Можно ли вылечить аспергиллез?
Да, своевременно поставленный диагноз и назначенное лечение всегда дает положительный результат.
Комбинации современных противогрибковых средств, ингаляционно или системно, позволяют эффективно сражаться с грибковой инфекцией в легких. Грамотно подобранная терапия противовоспалительными средствами, позволить контролировать обструктивный синдром у пациентов с АБЛА.
Полный текст:
Изучение роли различных иммунологических медиаторов в формировании хронического аллергического воспаления у больных аллергическим бронхолегочным аспергиллезом (АБЛА) необходимо для выявления возможных мишеней, для терапевтического вмешательства и своевременной диагностики заболевания.
Цель – определить особенности регуляции иммунного ответа и выявить диагностические маркеры развития АБЛА у больных бронхиальной астмой, оценить клинико-иммунологическую эффективность антимикотической терапии.
Проведено обследование 13 больных АБЛА, 14 больных бронхиальной астмой с микогенной сенсибилизацией (БАМС), 17 больных бронхиальной астмой (БА) и 12 условно здоровых лиц. Содержание тимического стромального лимфопоэтина (Thymic stromal lymphopoietin; TSLP), тимусассоциированного регуляторного хемокина (Thymus and activation-regulated chemokine; TARC), IL-8, количество эозинофилов, уровни общего IgE и специфических IgE к Aspergillus fumigatus (A. fumigatus) определяли в сыворотке крови иммуноферментным методом. Проведен мониторинг иммунологических маркеров на фоне антимикотической терапии.
У больных АБЛА установлены достоверно более высокие значения числа эозинофилов, уровней общего IgE и sIgE к A. fumigatus, а также TARC и IL-8 в сыворотке крови по сравнению с больными БА. Не установлено различий в содержании TSLP между обследованными группами пациентов. Положительная корреляционная связь уровня sIgE к A. fumigatus с содержанием TARC и IL-8, числом эозинофилов, а также уровнем общего IgE подтверждает важное диагностическое значение показателей провоспалительных цитокинов у больных АБЛА. На фоне применения итраконазола выявлена положительная клинико-иммунологическая динамика у больных АБЛА. После 12 недель терапии установлено достоверное повышение показателей АСТ, ОФВ1 и индекса Тиффно, снижение числа эозинофилов, уровней общего IgE и тенденция к уменьшению содержания TARC и IL-8. Это указывает на эффективность антифунгальных препаратов в лечении хронического аллергического воспаления у больных АБЛА.
Использование современных иммунологических биомаркеров, наряду с традиционными показателями, позволит дифференцированно подходить к оценке вероятности развития АБЛА у больных бронхиальной астмой, доказательно выделять ранние стадии заболевания и судить об эффективности проводимой терапии.
к.м.н., доцент кафедры клинической микологии, аллергологии и иммунологии,
194291, Санкт-Петербург, ул. Сантьяго-де-Куба, 1/28
к.м.н., заведующая НИЛ иммунологии и аллергологии, Научно-исследовательский институт медицинской микологии имени П.Н. Кашкина,
к.м.н., старший научный сотрудник НИЛ иммунологии и аллергологии, Научноисследовательский институт медицинской микологии имени П.Н. Кашкина,
к.м.н., старший научный сотрудник НИЛ иммунологии и аллергологии, Научноисследовательский институт медицинской микологии имени П.Н. Кашкина,
к.х.н., ведущий научный сотрудник НИЛ иммунологии и аллергологии, Научноисследовательский институт медицинской микологии имени П.Н. Кашкина,
к.х.н., ведущий научный сотрудник НИЛ иммунологии и аллергологии, Научноисследовательский институт медицинской микологии имени П.Н. Кашкина,
д.м.н., профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии,
1. Климко Н.Н., Козлова Я.И., Хостелиди С.Н., Шадривова О.В., Борзова Ю.В., Васильева Н.В. Распространенность тяжелых и хронических микотических заболеваний в Российской Федерации по модели LIFE program // Проблемы медицинской микологии, 2014. № 1. С. 3-8. [Klimko N.N., Kozlova Ya.I., Khostelidi S.N., Shadrivova О.V., Borzova Yu.V., Vasilyeva N.V. The prevalence of serious and chronic fungal diseases in Russian Federation on LIFE program model. Problemy meditsinskoy mikologii = Problems in Medical Mycology, 2014, no. 1, pp. 3-8. (In Russ.)]
2. Козлова Я.И., Соболев А.В., Фролова Е.В., Аак О.В., Бурыгина Е.В., Климко Н.Н. Аллергический бронхолегочный аспергиллез у больных бронхиальной астмой // Российский аллергологический журнал, 2015. № 2. С. 37-46. [Kozlova Ya.I., Sobolev A.V., Frolova E.V., Aak O.V., Burygina E.V., Klimko N.N. Allergic bronchopulmonar aspergillosis in asthmatic patients. Rossiyskiy allergologicheskiy zhurnal = Russian Allergology Journal, 2015, no. 2, pp. 37-46. (In Russ.)].
3. Agarwal R. Severe asthma with fungal sensitization. Curr. Allergy Asthma Rep., 2011, Vol. 11, no. 5, pp. 403-413.
4. Agarwal R.A., Chakrabarti A., Shah D., Gupta D., Meis J.F., Guleria R., Moss R., Denning D.W. For the ABPA complicating asthma ISHAM working group 2013. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clinical and Experimental Allergy, 2013, Vol. 43, no. 8, pp. 850-873.
5. Becerra-Díaz M., Wills-Karp M., Heller N.M. New perspectives on the regulation of type II inflammation in asthma. F1000Res, 2017, Vol. 6, p. 1014.
6. Carsin A., Romain T., Ranque S., Reynaud-Gaubert M., Dubus J.-C., Mège J.-L., Vitte J. Aspergillus fumigatus in cystic fibrosis: An update on immune interactions and molecular diagnostics in allergic bronchopulmonary aspergillosis. Allergy, 2017, Vol. 72, no. 11, pp. 1632-1642.
7. Chai R., Liu B., Qi F. IL-31, IL-33, and TSLP expression and relation to severity of asthma and rhinitis in Chinese allergic patients. Int. J. Clin. Exp. Pathol., 2017, Vol. 10, no. 2, pp. 1774-1782.
8. Chaudhary N., Marr K.A. Impact of Aspergillus fumigatus in allergic airway diseases. Clin. Transl. Allergy, 2011, Vol. 1, no. 1, p. 4.
9. Chauhan A., Singh M., Agarwal A., Paul N. Correlation of TSLP, IL-33, and CD4+CD25+FOXP3+T regulatory in pediatric asthma. J. Asthma, 2015, Vol. 52, no. 9, pp. 868-872.
10. Denning D.W., Pashley C., Hartl D., Wardlaw A., Godet C., Del Giacco S., Delhaes L., Sergejeva S. Fungal allergy in asthma-state of the art and research needs. Clin. Transl. Allergy, 2014, Vol. 15, no. 4, p. 14.
11. Gibson P.G., Wark P.A., Simpson J.L., Meldrum C., Meldrum S., Saltos N., Boyle M. Induced sputum IL-8 gene expression, neutrophil influx and MMP-9 in allergic bronchopulmonary aspergillosis. Eur. Respir. J., 2003, Vol. 21, pp. 582-588.
12. Goh K.J., Yii A.C.A., Lapperre T.S., Chan A.K., Chew F.T., Chotirmall S.H., Koh M.S. Sensitization to Aspergillus species is associated with frequent exacerbations in severe asthma. J. Asthma Allergy, 2017, Vol. 21, no. 10, pp. 131-140.
13. Hartl D., Latzin P., Zissel G., Krane M., Krauss-Etschmann S., Griese M. Chemokines indicate allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Am. J. Respir. Crit. Care Med., 2006, Vol. 173, no. 12, pp. 1370-1376.
14. Hogan C., Denning D.W. Allergic bronchopulmonary aspergillosis and related allergic syndromes. Semin. Respir. Crit. Care Med., 2011, Vol. 32, no. 6, pp. 682-692.
15. Kennedy J.L., Steinke J.W., Liu L., Negri J., Borish L., Payne S.C. Failure of itraconazole to prevent T-helper type 2 cell immune deviation: Implications for chronic rhinosinusitis. Am. J. Rhinol. Allergy, 2016, Vol. 30, no. 6, pp. 379-384.
16. Latzin P., Hartl D., Regamey N., Frey U., Schoeni M.H., Casaulta C. Comparison of serum markers for allergicbronchopulmonary aspergillosis in cystic fibrosis. Eur. Respir. J., 2008, Vol. 31, pp. 36-42.
17. Margalit A., Kavanagh K. The innate immune response to Aspergillus fumigatus at the alveolar surface. FEMS Microbiol. Rev., 2015, Vol. 39, no. 5, pp. 670-687.
18. Masaki K., Fukunaga K., Matsusaka M., Kabata H., Tanosaki T., Mochimaru T., Kamatani T., Ohtsuka K., Baba R., Ueda S., Suzuki Y., Sakamaki F., Oyamada Y., Inoue T., Oguma T., Sayama K., Koh H., Nakamura M., Umeda A., Kamei K., Izuhara K., Asano K., Betsuyaku T. Characteristics of severe asthma with fungal sensitization. Ann Allergy Asthma Immunol., 2017, Vol. 119, no. 3, pp. 253-257.
19. McAllister F., Henry A., Kreindler J.L., Dubin P.J., Ulrich L., Steele C., Finder J.D., Pilewski J.M., Carreno B.M., Goldman S.J., Pirhonen J., Kolls J.K. Role of IL-17A, IL-17F, and the IL-17 receptor in regulating growth-related oncogene-alpha and granulocyte colony-stimulating factor in bronchial epithelium: implications for airway inflammation in cystic fibrosis. J. Immunol., 2005, Vol. 175, no. 1, pp. 404-412.
20. Murdock B.J., Shreiner A.B., McDonald R.A., Osterholzer J.J., White E.S., Toews G.B., Huffnagle G.B. Coevolution of Th1, Th 2, and Th 17 responses during repeated pulmonary exposure to Aspergillus fumigatus conidia. Infect. Immun., 2011, Vol. 79, no. 1, pp. 125-135.
21. Porter P., Susarla S.C., Polikepahad S., Qian Y., Hampton J., Kiss A., Vaidya S., Sur S., Ongeri V., Yang T., Delclos G.L., Abramson S., Kheradmand F., Corry D.B. Link between allergic asthma and airway mucosal infection suggested by proteinase-secreting household fungi. Mucosal Immunol., 2009, Vol. 2, no. 6, pp. 504-517.
22. Shah A., Paniabi C. Allergic bronchopulmonary aspergillosis: a perplexing clinical entity. Allergy Asthma Immunology Res., 2016, Vol. 8, no. 4, pp. 282-297.
23. Wang Y.H., Liu Y.J. Thymic stromal lymphopoietin, OX40-ligand, and interleukin-25 in allergic responses. Clin. Exp. Allergy, 2009, Vol. 39, no. 6, pp. 798-806.
24. Wark P.A., Hensley M.J., Saltos N., Boyle M.J., Toneguzzi R.C., Epid G.D., Simpson J.L., McElduff P., Gibson P.G. Anti-inflammatory effect of itraconazole in stable allergic bronchopulmonary aspergillosis: A randomized controlled trial. J. Allergy Clin. Immunol., 2003, Vol. 111, no. 5, pp. 952-257.
25. Ying S., O’Connor B., Ratoff J., Meng Q., Fang C., Cousins D., Zhang G., Gu S., Gao Z., Shamji B., Edwards M.J., Lee T.H., Corrigan C.J. Expression and cellular provenance of thymic stromal lymphopoietin and chemokines in patients with severe asthma and chronic obstructive pulmonary disease. J. Immunol., 2008, Vol. 181, no. 4, pp. 2790-2798.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
| Аллергический бронхолегочной аспергиллез | |
|---|---|
| Специальность | Инфекционное заболевание |
Аллергический бронхолегочный аспергиллез ( АБЛА ) представляет собой состояние , которое характеризуется преувеличенной реакция иммунной системы (а реакция гиперчувствительности ) на грибок Aspergillus (чаще всего аспергилл дымящийся ). Это происходит чаще всего у людей, страдающих астмой или кистозный фиброз . Aspergillus споры широко распространены в почве и обычно встречаются в мокроте здоровых лиц. А. fumigatus отвечает за спектр легочных заболеваний , известных как aspergilloses .
ABPA вызывает дыхательные пути воспаления , что приводит к бронхоэктазам состояния -a отмеченному ненормальным расширением дыхательных путей. При отсутствии лечения, то иммунная система и грибковые споры могут повредить чувствительные ткани легких и привести к образованию рубцов.
Точные критерии для диагностики АБЛУ не согласованы. Грудь рентгеновские лучи и КТ , повышенные уровни в крови IgE и эозинофилов , иммунологические тесты для Aspergillus вместе с мокротой окрашиванием и культурами мокроты могут быть полезными. Лечение состоит из кортикостероидов и противогрибковых препаратов .
содержание
Признаки и симптомы
Почти у всех пациентов с клиническим диагнозом астмы , а также присутствует с хрипами (обычно эпизодическими в природе), кашлем , одышкой и непереносимости физической нагрузке (особенно у пациентов с муковисцидозом ). Умеренные и тяжелые случаи имеют симптомы , указывающие на бронхоэктазы , в частности толстой мокроты производства (часто содержащий коричневые слизистые пробки ), а также симптомы зеркалирования рецидива инфекции , такие как плевритная боль в груди и лихорадка . У пациентов с астмой и симптомами текущей инфекции, которые не отвечают на лечение антибиотиками, следует подозревать в АБЛА.
патофизиология
Aspergillus споры маленькие (2-3 мкм в диаметре) и может проникать глубоко в дыхательную систему в альвеолярном уровне. У здоровых людей, врожденные и адаптивные реакции иммунной системы вызваны различными иммунных клеток ( в частности нейтрофилах , альвеолярных резидентных макрофагов и дендритных клеток ) обращается к месту инфекции многочисленных воспалительных цитокинов и нейтрофильных аттрактантов (например, CXCR2 лигандов рецепторов). В этой ситуации, мукоцилиарный клиренс инициирует и споры успешно фагоцитоз , очищая инфекцию от хозяина.
У людей с предрасполагающими заболеваниями легких , такие-как персистирующая астма или муковисцидозом (или более редкими заболеваниями , такими как хроническое гранулематозным заболевание или синдром гипера-IgE ) -несколько факторы приводят к повышенному риску АБЛУ. К ним относятся иммунные факторы (например, атопии или иммуногенной HLA -ограниченных фенотипов ), а также генетические факторы (такие как ген CFTR мутаций в обоих астматиков и больных муковисцидозом). Допуская Aspergillus спор сохраняться в легочных тканях, что позволяет успешное прорастание , что приводит к Гифы растут в слизистых пробок.
Есть гиперчувствительность реакции, как тип I отклика (атопический, с образованием иммуноглобулина Е, или IgE) и типа III реакции гиперчувствительности (с образованием иммуноглобулина G или IgG). Реакция IgE с Aspergillus антигенов приводит к клеточной дегрануляции тучных с бронхоспазма и повышенной проницаемости капилляров . Иммунные комплексы (тип III реакции) и воспалительные клетки осаждаются в пределах слизистых оболочек дыхательных путей, что приводит к некрозу (отмиранию тканей) и эозинофильной инфильтрации. Тип 2 Т - хелперов - видимому, играют важную роль в АБЛА из - за повышенной чувствительности к интерлейкин (IL) 4 и IL-5 . Эти цитокины вверх регулируют дегрануляцию тучных клеток, усугубляя дыхательную снижение.
Aspergillus также использует ряд факторов , чтобы продолжить уклонение от ответов хоз ина, в частности , использование протеолитических ферментов , которые прерывают IgG антитела , направленные к нему. Другой важной особенностью является его способность взаимодействовать и интегрироваться с эпителиальных поверхностей, что приводит к массовым провоспалительного контр-ответа со стороны иммунной системы , включающей IL-6 , IL-8 и МСР-1 (а CCL2 рецептора лиганда). Протеазы , выпущенные как гриба и нейтрофилы вызывают дальнейшее повреждение эпителия дыхательных путей, что приводит к инициации ремонта механизмов (например, приток сыворотки и внеклеточным матриксом (ECM) белков) в месте инфекции. Aspergillus споры и гифы могут взаимодействовать с ECM белков, и это предположение , что этот процесс облегчает связывание спор поврежденных участков дыхательных путей.
Поскольку концентрации Aspergillus протеаза увеличиваются, иммунологический эффект переходит от провоспалительных к тормозному, а также уменьшает фагоцитарную способность очистить Aspergillus . В конечном счете, повторные острые эпизоды приводят к более широким масштабам повреждению легочных структур ( паренхимы ) и функций через необратимое ремоделирование легкого. При отсутствии лечения, это проявляется как прогрессивная бронхоэктаза и легочный фиброз , который часто наблюдается в верхних долях , и может привести к подобному радиологическому внешнему виду произведенного туберкулеза .
диагностика
Точные критерии для диагностики АБЛУ еще не универсально согласованы, хотя рабочие группы предложили конкретные рекомендации.
АБЛА следует подозревать у пациентов с предрасполагающим заболеванием легкого -Большей обычно астмой или муковисцидозом - и часто связан с хроническим ограничением дыхательных путей (CAL). Пациенты обычно с симптомами рецидивирующей инфекции , такие как лихорадка , но не реагируют на обычную терапию антибиотиками. Плохо управляемая астма частая находка, с серией случаев только найти 19% пациент ABPA с хорошо контролируемой астмой. Одышка и кровохарканье (кашель с кровью) общие черты, и слизи закупорка наблюдается в 31-69% пациентов.
Первый этап включает воздействие на коже аспергилл дымящихся антигены; немедленная реакция является признаком АБЛУ. Тест должен выполняться первым испытанием укола кожи, а если отрицательно следует с внутрикожной инъекцией. В целом чувствительность процедуры составляет около 90%, хотя до 40% больных бронхиальной астмы без АБЛА все еще может показать некоторую чувствительность к Aspergillus антигенам (явление, вероятно, связанное с менее тяжелой формой АБЛУ называют тяжелую астму с грибковой сенсибилизацией (SAFS)) ,
Сыворотка анализы крови является важным маркером тяжести заболевания, а также полезны для первичной диагностики АБЛУ. Когда сывороточный IgE является нормальным (и пациенты не проходят лечение с помощью глюкокортикоидных препаратов , ), АБЛА исключена в качестве причины симптомов. Поднятая IgE повышает подозрение, хотя не существует общепризнанной отсечки значения. Значения могут быть указаны в международных единицах (МЕ / мл) или нг / мл, где 1 МЕ равна 2,4 нг / мл. Поскольку исследования начали документировать уровни IgE в АБЛА в течение 1970 - х годов, различные предохранителями между 833-1000 МЕ / мл, были использованы как для исключения ABPA и , чтобы гарантировать дальнейшее серологическое тестирование. Текущий консенсус в том , что отсечка 1000 МЕ / мл следует использовать, так как более низкие значения встречаются в SAFS и астматического сенсибилизации .
IgG - антитела преципитации тестирование из сыворотки полезно, так как положительные результаты находятся в между 69-90% пациентов, хотя и в 10% астматиков с и без SAFS. Следовательно, он должен быть использован в сочетании с другими тестами. Существуют различные формы, в том числе иммуноферментного анализа (ELISA) и флуоресцентный фермент иммуноанализа (Feia). Оба они более чувствительны , чем обычные встречный иммуноэлектрофорез . IgG не может быть полностью специфичны для АБЛА, так как высокие уровни также находятся в хронической легочной аспергиллез (CPA) , наряду с более серьезными рентгенологических данных.
До недавнего времени , периферическая эозинофилия (высокие эозинофилы отсчетов) считалась частично свидетельствуют о АБЛА. Более поздние исследования показывают , что только 40% людей, страдающих ABPA присутствующих с эозинофилией, и , следовательно , низкое количество эозинофилов не исключает необходимости ABPA; например , у пациентов , перенесших стероидной терапии , имеют более низкие число эозинофилов.
При использовании высокого разрешения КТ, может быть лучше оценка распределения и структуры бронхоэктазы в легких, и, следовательно, это инструмент выбора в радиологической диагностике АБЛА. Центральный (ограниченный медиальные две трети медиальной половины легкой) бронхоэктазы, что периферический сужающийся бронхи считаются необходимым условием для ABPA патофизиологии, хотя до 43% случаев имеются значительное расширение на периферию легкого.
Мукоидного сдавление верхних и нижних дыхательных путей является общим открытием. Пробки гиподенсные , но появляются на КТ с высоким затуханием (более 70 Хаунсфилд единиц ) в до 20% больных. Где присутствует это сильный диагностический фактор АБЛУ и отличает признаки от других причин бронхоэктазы.
КТ может выявить более редко мозаичный внешний вид затухание , центродолевая узелки , дерево-в-зародыша помутнение и Плевролегочную фиброз (нахождения в соответствии с CPA, заболевание с АБЛА в качестве известного предшественника). Редко другие проявления можно увидеть на КТ, в том числе военных узелковых затемнений, perihilar затемнений (которые имитируют внутригрудной лимфаденопатии ), плевральный выпот и легочных масс. Кавитация и аспергиллома являются более редкие находки, не более 20% пациентов, и , вероятно , представляют собой переход от АБЛА к CPA , если оно сопровождается плевральной утолщение или fibrocavitary болезни.
Культивирование грибов из мокроты является благоприятным тестом в диагностике АБЛУ, но не 100% конкретная для АБЛА , как А. fumigatus повсеместно и часто изолирован от отхаркивающего легкого у других заболеваний. Тем не менее, между 40-60% пациентов действительно имеют положительные культуры в зависимости от количества образцов , взятых.
Новые критерии по ABPA в осложненной Астме Isham Рабочую группу предлагает критерий 6-ступенчатый для диагностики АБЛУ, хотя это еще не формализовано в официальные руководящие принципы. Это заменит нынешний золотой стандарт протокола промежуточной изобретенный Паттерсона и коллег. Стадия 0 будет представлять собой бессимптомную форму АБЛУ, с контролируемой астмой , но до сих пор выполняет основные диагностические требования положительного теста кожи с повышенной общей IgE (> 1000 МА / мл) в. Этап 6 является передовым ABPA, с наличием дыхательной недостаточности типа II или легочного сердца , с радиологических признаков тяжелого фиброза в соответствии с АБЛА на КТ с высоким разрешением. Он должен быть диагностирован после исключения других, обратимых причин острой дыхательной недостаточности .
лечение
В основе заболевания необходимо контролировать, чтобы предотвратить обострение и ухудшение АБЛУ, и у большинства пациентов это состоит в управлении их астмой или CF. Любые другие сопутствующие заболевания, такие как синусит или ринит, также должны быть решены.
Гиперчувствительность механизмы, как описана выше , способствует прогрессированию болезни с течением времени , и, когда его не лечить, приводит к обширному фиброзу легочной ткани. Для того чтобы уменьшить это, кортикостероидами терапия является основой лечения (например , с преднизолоном ); Однако исследования с участием кортикостероидов в АБЛА ограничены небольшими когортами и часто не двойные слепые . Несмотря на это, существует доказательства того, что острое начало ABPA улучшается при лечении кортикостероидов , как это уменьшает эпизоды консолидации . Есть проблемы , связанные с длительной терапией кортикостероидами-которые могут вызывать сильную иммунную дисфункцию при использовании хронически, а также метаболическими нарушениями, и подходы были разработаны для управления ABPA ряда потенциальных побочных эффектов от кортикостероидов.
Наиболее часто описывается метод, известный как диуретики, включает использование противогрибкового агента для очистки спор из дыхательных путей , прилегающей к кортикостероидной терапии. Противогрибковый аспект направлен на снижение грибковых причин бронхиального воспаления, в той же время сводя к минимуму дозы кортикостероида , необходимую для снижения вклада иммунной системы до прогрессирования заболевания. Убедительное доказательство (двойное слепое рандомизированное , плацебо контролируемая испытания) для итраконазол два раза в день в течение четырех месяцев, что привело к значительному клиническому улучшению по сравнению с плацебо, и зеркальными в больных МВ. Использование итраконазола , кажется, перевешивает риск от долгосрочного и высоких доз преднизолона. Новый триазол препараты, такие как позаконазол или вориконазол -У еще не изучены в углубленном через клинические испытания в этом контексте.
Хотя преимущества использования кортикостероидов в краткосрочной перспективе примечательны, а также улучшить качество жизни баллов, есть случаи АБЛУ конвертирования в инвазивный аспергиллез пока проходит лечение кортикостероидов. Кроме того, при одновременном использовании с итраконазолом, есть потенциал для взаимодействия наркотиков и индукции синдрома Кушинга в редких случаях. Нарушение обмена веществ, такие как сахарный диабет и остеопороз , а также может быть вызвано.
Для того , чтобы смягчить эти риски, кортикостероидные дозы уменьшаются каждые две недели , не предполагающие дальнейшего прогрессирования заболевания после каждого сокращения. При отсутствии обострений от этого заболевания не наблюдаются в течение трех месяцев после отмены кортикостероидов, пациент считается в полной ремиссии . Исключение из этого правила является пациентами , которые диагностированы с передовым АБЛОЙ; в этом случае удаления кортикостероидов почти всегда приводит к обострению и эти пациенты продолжали низкую дозу кортикостероидов (предпочтительно на графике через день).
Сыворотка IgE может быть использована для назначения лечения, а также уровни проверяются каждые 6-8 недель после стероидного лечения начинается, а затем каждые 8 недель в течение одного года. Это позволяет для определения базовых уровней IgE, хотя это важно отметить , что большинство пациентов не полностью снизить уровень IgE к исходному уровню. Рентген грудной клетки или КТ выполняются после 1-2 месяцев лечения , чтобы гарантировать инфильтраты решаем.
эпидемиология
Там ограничены национальные и международные исследования в бремя АБЛУ, затруднялись нестандартизированными диагностическими критериями. Оценки между 0,5-3,5% были сделаны для нагрузки ABPA при астме, и 1-17.7% в CF. Пять национальных когорты, выявления распространенности ABPA при астме ( на основе GINA оценок), были использованы в недавнем мета-анализе , чтобы произвести оценку глобального бремени ABPA осложняющих астмы. Из 193 миллионов людей, страдающих астмой во всем мире, распространенность ABPA астмы оценивается между крайностями 1.35-6.77 млн больных, используя 0.7-3.5% ставки истирания. Также было предложено компромиссное на 2,5% убыли, размещая глобальное бремя на уровне около 4,8 миллиона человек , пострадавших. Восточное Средиземноморье имела самый низкий оценочный уровень распространенности, с прогнозируемым случае бремя 351,000; коллективно, Америка самого высокое прогнозируемого бремени в 1,461,000 случаях. Они, вероятно , занижены общая распространенность, учитывая исключения пациентов и детей с МВ из исследования, а также диагностическое тестирование ограничиваются в менее развитых регионах.
Читайте также:


