Виферон или генферон что лучше от герпеса на

Генферон и Виферон считаются эффективными иммуностимулирующими и противовирусными средствами.
Препарат Генферон
Генферон относится к иммуномодулирующим средствам. Он проявляет высокую противомикробную активность. Медикамент выпускается в виде свечей. Они бывают ректальными и вагинальными. В одной дозе содержится 1000, 25000 или 125000 МЕ интерферона. В продаже есть упаковки по 5 и 10 шт. В составе присутствует несколько главных биоактивных компонентов:
- человеческий интерферон;
- таурин;
- бензокаин.
Альтернативой последнему компоненту может быть анестезин (данные вещества обладают одинаковым воздействием). Основой суппозиториев является твердый жир. Благодаря ему обеспечивается стабилизация активных компонентов и их быстрое попаданию в общий кровоток.
Интерферон усиливает естественные защитные силы организма. Он активизирует лейкоциты, находящиеся в слизистых. Тем самым ускоряется уничтожение инфекции и нормализуется выработка иммуноглобулина.
Регенерацию тканей и клеток ускоряет таурин. Он обладает противовоспалительным действием.
Бензокаин является анестетиком. Он уменьшает проводимость клеточных структур. Вещество снижает чувствительность нервов, блокируя болевые ощущения.
Основными показаниями к применению являются инфекционные болезни мочеполовой системы:
- хламидиоз;
- микоплазмоз;
- уреаплазмоз;
- молочница;
- генитальный герпес;
- вульвовагинит;
- баланит;
- цервицит и др.

Генферон проявляет высокую противомикробную активность.
Генферон используется как в составе комплексной терапии, так и самостоятельно. Лекарство способно накапливаться в отдельных органах.
Свечи почти не имеют подобных действий. Однако иногда они вызывают индивидуальную непереносимость, которая является одним из противопоказаний к лечению. Также к ним относятся аутоиммунные нарушения, первый триместр беременности и возраст до 7 лет. Не рекомендуется применять суппозитории при обострении аллергии.
Желательно, чтобы дозировку определял врач на основании точного диагноза. В зависимости от него схема терапии может отличаться. Женщинам подходит Генферон Лайт. Он выпускается по 250, 500 и 1000 МЕ. Его используют 2 раза в день ректально или вагинально. Курс лечения длится 10 дней. Иногда врач продлевает его.
Виферон
Виферон обладает таким же эффектом, что и предыдущий препарат. Он выпускается в форме свечей, мази и геля наружного применения. Свечи вводятся ректально. Дозировки различные: 150000 и 500000 МЕ. Также есть 1 млн и 3 млн МЕ. Главными активными веществами являются:
- рекомбинантный интерферон;
- витамины А и C.
Благодаря сочетанию активных компонентов Виферон оказывает комплексное действие на организм. Аскорбиновая кислота и токоферола ацетат являются мощными антиоксидантами. Они усиливают эффект интерферона. В результате этого результат лечения оказывается выраженным и стойким.
Средство используют для борьбы со множеством болезней. Им лечат:
- ОРВИ (в т.ч. осложненную инфекцией);
- хронические вирусные гепатиты;
- герпес различных видов;
- инфекционно-воспалительные болезни у маленьких детей;
- урогенитальные патологии.

Благодаря сочетанию активных компонентов Виферон оказывает комплексное действие на организм.
Медикамент разрешен к применению для детей с годовалого возраста. В исключительных случаях лечение допустимо и раньше. Единственным противопоказанием является повышенная чувствительность к компонентам состава. Схему терапии и форму выпуска рекомендует врач.
Сравнительная характеристика Генферона и Виферона
Оба медикамента содержат интерферон и оказывают аналогичное фармакологическое действие. Первый выпускается только в виде свечей. Второй можно приобрести и в форме наружной мази. Генферон применяется ректально и вагинально, а Виферон – лишь первым способом. Порой мазь оказывается более удобной, чем суппозитории.
Второе средство обладает более широким спектром применения. Оно подходит для борьбы с бактериальными инфекциями. Входящий в Виферон интерферон надежно защищает клетки от вирусов и других патогенных микроорганизмов. Он эффективен при мочеполовых болезнях. Медикамент может использоваться для лечения годовалых детей.
Генферон разрешен только с 7 лет. Он является более действенным при урогенитальных инфекциях. Лекарство ускоряет выздоровление и уменьшает неприятные симптомы: зуд, жжение, раздражение и пр.
Виферон и Генферон по-разному эффективны при вагинальном кандидозе. Каждый препарат уничтожает какие-то разновидности грибка, а против остальных он бессилен.
Важным является и психологический комфорт пациента. Кому-то бывает неприятно применять свечи. В случае лечения Вифероном их можно заменить мазью или гелем.
Что лучше: Генферон или Виферон
Побочные эффекты реже вызывает Виферон. Однако по фармакологическому действию разницы почти нет. Средства хорошо переносятся детьми. Виферон разрешен годовалым пациентам. Генферон имеет больше противопоказаний. Поэтому при выборе иммуностимулирующего препарата важно учитывать их наличие.
Отзывы врачей и пациентов
Елена Аркадьевна, терапевт, Санкт-Петербург
Виферон назначаю почти каждый день. Он подходит и детям, и беременным, и кормящим мамам. Аллергию вызывает редко и переносится хорошо. Единственным недостатком можно назвать только высокую цену.
Валентина, гинеколог, Сочи
Нередко прописываю Генферон женщинам. Он эффективный, но порой пациентки жалуются на сильную аллергию. Приходится назначать другие иммуномодуляторы.
Александра, 25 лет, Ростов-на-Дону
Часто болела герпесом. Сходила к врачу и обследовалась. Прописали Виферон в виде мази. Никакой аллергии не было. Прошло уже 2 месяца, и болячка пока не беспокоит. Правда, цена кусается, но эффект того стоит.
Светлана, 36 лет, Москва
Уже несколько лет страдаю хронической молочницей. Лечение мало помогало. Подруга посоветовала Генферон. Применяла 2 раза в течение 10 дней. Уже прошло 8 месяцев, и пока обострений не было.
Вадим, 24 года, Новороссийск
Заболел уреаплазмозом и хламидиозом одновременно. Уролог назначил комплексную терапию. В ней был Генферон. Через неделю неприятные симптомы прошли. Еще через несколько дней сдал анализы, и пока все чисто.
Фармацевтический рынок предлагает широкий ассортимент противовирусных средств. Однако выбор резко сужается, если препарат нужен малышу до года. Ведь требования к лекарствам для маленьких пациентов очень высокие: эффективность должна сочетаться с бережным действием на организм, а кроме того, средство должно быть удобно для применения.
Противовирусные препараты для маленьких детей: проблема выбора
Как известно, чем раньше начинается лечение, тем легче купировать болезнь. Но как понять, что у малыша вирусная инфекция? Мамы без труда улавливают малейшие изменения в поведении своего чада. Если, казалось бы, беспричинно снижается аппетит, ребенок капризничает, отказывается играть, выглядит вялым, это может быть сигналом надвигающейся болезни. В большинстве случаев ОРВИ начинаются с резкого повышения температуры до 38–39°С. В числе симптомов также — чихание и кашель, выделения из носа, слезоточивость и покраснение глаз.
Назначение терапии — прерогатива исключительно врача-педиатра! Но знания о противовирусных средствах для малышей лишними не будут.
Итак, медикаменты, использующиеся для лечения ОРВИ у детей, делятся на четыре группы:
- препараты прямого противовирусного действия;
- препараты, стимулирующие выработку интерферонов (иммуномодуляторы);
- препараты готовых интерферонов;
- гомеопатические лекарственные средства.
Основными критериями выбора препарата являются:
- возраст ребенка и его соответствие ограничениям по приему препарата,
- состояние иммунной системы малыша, иными словами — иммунологический статус.
Чем старше ребенок, тем шире перечень лекарств, которые ему можно назначить. Для применения у младенцев разрешено ограниченное число препаратов. Это, например:
Из всех лекарственных форм для применения у детей наиболее предпочтительны свечи. В числе их преимуществ:
Как правильно ставить свечи детям
Процедуру стоит проводить после того, как ребенок опорожнит кишечник. Вымойте и вытрите насухо область ануса. Уложите ребенка на спину, подожмите ноги к животику. Осторожно введите свечу в задний проход. Протрите область вокруг анального отверстия влажной салфеткой и наденьте на малыша подгузник. Дайте ребенку полежать на спине пару минут. Имейте в виду: противовирусные свечи для детей рекомендуется вводить в одноразовых перчатках.
Данное вещество вырабатывается организмом для иммунного ответа на попадание внутрь чужеродных агентов, в том числе вирусов. При этом действие интерферона направлено на все вирусные частицы в целом, а не на возбудителя лишь какой-то конкретной болезни.
В норме человек самостоятельно справляется с ОРВИ, а в качестве лечения назначается только симптоматическая терапия, обильное питье и покой. Когда речь заходит о детях, особенно о совсем маленьких, мы сталкиваемся с несколькими нюансами:
- Иммунная система малышей не развита. Ответ на внедрение в организм вирусов или бактерий может быть неадекватно слабым или отсутствовать вовсе.
- Собственный интерферон вырабатывается при температуре тела от 38,5°С. Для детей такая температура несет опасность фебрильных судорог. Именно поэтому малышам назначают жаропонижающие препараты.
Химики и фармакологи научились выделять интерферон искусственно и добавлять его в лекарства. Так рекомбинантный интерферон альфа-2b обладает противовирусным, антипролиферативным и иммуномодулирующим свойствами. Это означает, что он способствует уничтожению вируса в организме, препятствует его размножению и стимулирует работу собственного иммунитета человека.
Отметим, что препараты с содержанием интерферона требуют определенных условий хранения. Это должно быть темное прохладное место, оптимальная температура — 2–8°C.
Это важно
Детские свечи на основе интерферона необходимо хранить в холодильнике. В условиях повышенной температуры, впрочем, как и слишком низкой, суппозиторий может потерять не только форму, но и лечебный эффект. Чтобы снизить дискомфорт для малыша, перед применением, не снимая упаковки, разогрейте свечку в ладонях.
Рассмотрим самые известные противовирусные свечи для детей, разрешенные к применению с первого дня жизни. Все они основаны на одном действующем веществе — интерфероне. Однако различия у препаратов все-таки есть.
- КЛЮЧЕВЫЕ СЛОВА: урогенитальные инфекции, кондиломатоз, герпес, вагиноз, Генферон, Циклоферон
Больные с данной вирусной патологией входят в группу риска хронических воспалительных заболеваний половых органов, осложнений после инвазивных манипуляций, онкологических заболеваний половых органов. Тяжелое течение, частые рецидивы наносят серьезный психологический ущерб, вызывая снижение эмоциональной и физической активности больных, а также нарушение их социальной адаптации. Генитальный кондиломатоз и генитальный герпес нередко способствуют развитию диспластических изменений в эпителии гениталий с последующим перерождением в рак (5, 8, 16).
Герпетическая инфекция, связанная с присутствием в организме вируса простого герпеса I или II серотипов, является наиболее распространенной латентно протекающей вирусной инфекцией человека. Она характеризуется многообразием клинических проявлений с поражением кожи, слизистых оболочек, ЦНС, глаз. Герпетическая инфекция нередко вызывает патологию беременности, родов, гибель плода и генерализованную инфекцию новорожденных детей (4, 6).
Папилломовирусная инфекция (ПВИ) поражает поверхностный слой кожи и слизистых оболочек. В конце инкубационного периода ДНК вируса размножается в ядре клетки, что сопровождается появлением экзофитных разрастаний. Пусковым моментом является микротравма кожи и слизистых оболочек, чаще всего – во время половых контактов. Большинство случаев рака шейки матки связаны с ПВИ (имеет значение тип ВПЧ, продолжительность инфекционного процесса) (11, 14).
Инфицирование возбудителями генитального герпеса и ПВИ и последующее развитие заболевания тесно связаны с иммунным статусом организма. В свою очередь, вирусы сами инициируют формирование иммунодефицита, в результате чего снижается противовирусный иммунитет. Это приводит к длительной персистенции возбудителя в организме больного и рецидивам заболевания (8, 10).
Раннее начало половой жизни, частая смена половых партнеров, а также партнер, имеющий множественные половые связи, являются значимыми факторами риска заражения.
Изменение среды влагалища и аномального состояния поверхностного слоя эпителия способствует проникновению вируса в клетки. Снижение защитных сил организма ведет к заражению и проявлению вирусных урогенитальных инфекций (1, 4, 12).
Учитывая сложный этиопатогенез урогенитальных инфекций, терапия должна способствовать ускорению регенерации, нормализации микрофлоры влагалища, профилактике рецидивов заболевания. Лекарственный препарат должен хорошо переноситься пациентками, и быть удобен в применении.
В настоящее время одним из приоритетных и наиболее эффективных методов терапии герпес- и папилломавирусной инфекции является иммунотерапия. Кроме того, наличие выраженной симптоматики делает необходимым проведение симптоматической терапии (7, 8, 10).
В последние годы в лечении генитального герпеса и генитального кондиломатоза нашли широкое применение иммуномодуляторы, препараты α-, β- и γ-интерферона, обладающие противовирусным, иммуномодулирующим и антипролиферативным действиями, а также индукторы эндогенных интерферонов (2, 3, 9, 15).
Применение препаратов интерферона в комплексной терапии больных рецидивирующим генитальным герпесом приводит не только к улучшению клинического состояния больных, но также и к восстановлению иммунного статуса. При этом следует отметить обратимый характер изменений иммунной реактивности, показатели которой нормализуются после лечения, что сочетается с обратным развитием клинических признаков заболевания. Заместительное применение препаратов α-ИФН приводит к уменьшению продолжительности и остроты рецидивов. Однако при парентеральном введении препаратов α-ИФН могут возникать существенные побочные реакции (артралгии, депрессии, кожный зуд, гриппоподобный синдром и др.) (3).
Существенно меньшими побочными эффектами экзогенной интерферонизации обладают лекарственные формы интерферона для местного применения (10), в связи с чем область их применения в клинической практике быстро расширяется. Одним из препаратов данной группы является Генферон, нашедший свое применение в терапии инфекционно-воспалительных заболеваний урогенитального тракта, в том числе генитального герпеса, папилломовирусной инфекции, хламидиоза, уреаплазмоза, микоплазмоза, рецидивирующего вагинального кандидоза, бактериального вагиноза, трихомониаза и др.
Генферон − комбинированный препарат, действие которого обусловлено лечебными свойствами компонентов (ИФН α-2; таурин, анестезин), входящих в его состав. Интерферон α-2 повышает активность естественных киллеров, Т-хелперов, фагоцитов, а также интенсивность дифференцировки В-лимфоцитов, непосредственно ингибирует репликацию и транскрипцию вирусов, хламидий. Таурин обладает регенерирующими, репаративными, мембрано- и гепатопротективными, антиоксидантными и противовоспалительными свойствами. Анестезин − местный анестетик, препятствует возникновению болевых ощущений. Данное сочетание компонентов весьма рационально для лечения герпес- и папилломовирусной инфекции в связи с наличием при обострении герпетической инфекции и после местной деструктивной терапии кондилом выраженного болевого синдрома и изменений в микрофлоре влагалища. В связи с этим большой интерес представляет сравнение эффективности Генферона и суппозиториев с интерфероном-альфа, имеющих другой компонентный состав. Кроме того, остается неизученным вопрос о сравнительной эффективности препаратов интерферона и индукторов эндогенного интерферона, а также их комбинации.
Целью нашего исследования явилось сравнительное изучение клинической эффективности препаратов Генферон, Виферон и индуктора интерферона – Циклоферон при лечении больных генитальным герпесом и генитальным кондиломатозом. Критериями излеченности в соответствии с общепринятыми стандартами лечения, являлись устранение клинических проявлений заболевания, прекращение или снижение остроты воспалительных реакций и элиминация инфекционного агента.
Пациенты и методы
Препарат Генферон назначался в течение 10 дней параллельно с проведением комплексной терапии – женщинам в дозе 500 000 МЕ 2 раза в сутки вагинально, мужчинам – в дозе 1 000 000 МЕ
2 раза в сутки ректально. Виферон применялся в дозе 1 000 000 МЕ
2 раза в сутки ректально в течение 10 дней параллельно стандартной терапии. Циклоферон вводился внутримышечно в дозе 250 мг 1 раз в день на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-й дни лечения.
Помимо исследуемых препаратов больные генитальным герпесом получали традиционную базовую терапию ацикловиром 400 мг 3 раза в день в течение 7 дней. У больных генитальным кондиломатозом в первый день лечения проводилась местная деструкция очагов поражения: диатермокоагуляция при поражении шейки матки или солкодерм при поражении аногенитальной области. Все пациентки имели сопутствующие воспалительные заболевания влагалища. При бактериальном вагинозе назначался орнидазол 500 мг 2 раза в день в течение 3 дней, при вагинальном кандидозе − микосист 150 мг
2 раза с интервалом 7 дней. На протяжении всего исследования пациенты пользовались методами барьерной контрацепции. В течение 40 дней с момента включения в исследование, не разрешалось применение других иммуномодулирующих препаратов, помимо исследуемых.
В общей сложности в исследование было включено 120 пациентов, находящихся на амбулаторном лечении (60 мужчин и 60 женщин). У 94 пациентов поставлен диагноз генитального герпеса, у 26 – диагноз генитального кондиломатоза. Распределение пациентов по группам проводилось рандомизированно – методом случайной выборки. В процессе рандомизации проводилась стратификация больных по полу, природе и тяжести заболевания. Было сформировано 3 группы пациентов, каждая из которых включала 40 больных (20 мужчин и 20 женщин).
В первой группе из 40 пациентов в дополнение к стандартной терапии применялся препарат Генферон, во второй – Виферон, в третьей – Циклоферон.
В процессе исследования проводилось физикальное обследование, ПЦР-диагностика вирусов простого герпеса I и II типов, а также вирусов папилломы человека, микроскопия мазков, окрашенных по Граму, цитологическое исследование мазков, окрашенных по Папаниколау, кольпоскопия и изучение качества жизни с помощью опросника
SF-36. Обследование проводилось до начала лечения, повторно – через 10 дней (кроме ПЦР-диагностики) и через 40 дней после начала лечения.
Результаты контрольного исследования методом ПЦР (PCR Amp/Cycle Graf for FAM-490) продемонстрировали высокую эффективность проведенного лечения (таблица 1, рисунок 1).
В группе пациентов, в комплексном лечении которых применялся Генферон, была достигнута более высокая частота элиминации инфекционного агента, чем при применении других иммунотропных лекарственных препаратов. Повторное выявление возбудителя через 40 дней после начала лечения Генфероном наблюдалось лишь у одного мужчины с генитальным герпесом и одной женщины с генитальным кондиломатозом. При этом у данных пациентов отсутствовали какие-либо клинические проявления заболевания.
В то же время при применении Виферона положительный результат ПЦР через 40 дней после начала лечения наблюдался у 6 из 40 больных, при применении Циклоферона – у 12 из 40 пациентов.
У 19 из 20 женщин, имевших проявления неспецифического вульвовагинита и бактериального вагиноза, через 40 дней после начала применения Генферона полностью исчезали указанные состояния, в то время как после использования Виферона клинические проявления этих заболеваний сохранялись у 2 женщин, а после курса Циклоферона – у 5 пациенток (рисунок 2).
При наблюдении за течением раневого процесса после процедуры деструкции кондилом у больных урогенитальным кондиломатозом отмечено также противовоспалительное действие Генферона – региональный отек и признаки воспаления были менее выраженными по сравнению с соответствующими проявлениями у пациентов других групп.
Анализ динамики самочувствия пациентов обоего пола показал, что наибольшее количество случаев значительного улучшения в ранние сроки после начала лечения было зарегистрировано у пациентов, применявших Генферон, что, вероятно, связано со снижением остроты болевых ощущений под влиянием входящего в состав препарата анестезина.
Несмотря на наличие обширного спектра противовирусных и иммуномодулирующих препаратов, проблема рецидивирующих урогенитальных инфекций вирусной этиологии актуальна до сих пор.
Анализ результатов данного исследования свидетельствует о том, что комплексная терапия урогенитальных инфекций вирусной этиологии с использованием препарата Генферон имеет наибольшую эффективность. Применение Генферона позволило достичь негативного результата ПЦР у 95% пациентов. Большая доля ВПГ- и ВПЧ-негативных результатов в группе пациентов, принимавших Генферон, по сравнению с препаратами Виферон и Циклоферон, является показателем более высокой антивирусной и иммуномодулирующей активности Генферона.
Применение препарата Генферон в комбинации со средствами стандартной терапии хорошо переносится пациентами, не вызывает местных и системных реакций, уменьшает болевой синдром, способствует элиминации возбудителя и быстрому заживлению пораженных тканей, а также снижает вероятность рецидивов заболевания.
Результаты исследования позволяют сформулировать следующие рекомендации для применения препарата Генферон при генитальном герпесе и генитальном кондиломатозе:
- Комплексная терапия женщин с генитальным герпесом: Генферон в дозе 500 000 МЕ 2 раза в сутки вагинально в течение 10 дней параллельно с назначением ацикловира 400 мг 3 раза в день в течение 7 дней или фамвира 250 мг 3 раза в день в течение 7 дней.
- Комплексная терапия женщин с папилломовирусной инфекцией: Генферон в дозе 500 000 МЕ 2 раза в сутки вагинально в течение 10 дней параллельно с проведением диатермокоагуляции, применением солкодерма или аналогов.
- Комплексная терапия мужчин с аналогичными заболеваниями включает в себя назначение Генферона ректально в дозе 1 000 000 МЕ 2 раза в сутки в течение 10 дней параллельно с проведением этиотропной терапии или деструктивных методов.
- При возникновении рецидива заболевания возможно проведение повторного курса лечения Генфероном по описанной выше схеме или в виде монотерапии.
- Для профилактики рецидивов заболевания при неполной элиминации вирусов (положительный тест ПЦР в контроле после проведенного лечения) рекомендуется проведение повторного курса лечения Генфероном по описанной выше схеме в виде монотерапии через 25-30 дней после окончания предыдущего курса.
Никаких должным образом проведенных клинических исследований в отношении генферона, виферона и гриппферона нет. Доказательств эффективности этих препаратов не представлено.
Учитывая те микроскопические дозы интерферона, которые попадают в организм ребенка с этими препаратами, можно сказать, что эти препараты безвредны.
Противовирусным действием обладают значительно большие дозы интерферона-альфа. Так, лет 20 назад для лечения гепатита С использовался интерферон в дозе 3 млн. МЕ 3 раза в неделю подкожно. Такие дозы интерферона сами по себе вызывают лихорадку выше 38 градусов и плохое самочувствие. От упомянутых свечей температура почему-то не повышается.
Что касается назальных спреев, то в США проводились исследования интерферона-альфа для лечения и профилактики риновирусной инфекции (банального насморка). Доза 20 млн.МЕ/мл была эффективной для профилактики, но вызывала носовые кровотечения. Доза 10 млн.МЕ/мл была безопасной, но неэффективной. Гриппферон содержит 10 тыс.МЕ/мл. По-моему, все ясно.
5 · Хороший ответ
Насчет пользы или вреда для иммунитета ничего сказать не могу. по мне так лучше просто витаминами его поддерживать. У нас, например, витамишки иммуно+еще дополниельные меры для профилаткики предпринимаем-закаливаемся, стараемся больше гулять. В итоге и не болеем практически)
2 · Хороший ответ
2 6 · Хороший ответ
Если лекарственный препарат эффективен, то в научных базах данных можно найти множество исследований данного препарата в разных популяциях. Но поискав статьи о Кагоцеле, я нашла только российские статьи, причем все авторы из одного НИИ, который возглавляет сам создатель данного лекарства. В одной статье автор даже не смог определиться как написать на английском кагоцел и написал вначале kagocel а потом kogocel (это мое личное наблюдение:)
Я, как приверженец доказательной медицины, не могу сказать, что данный препарат рекомендован для профилактики и лечения орви и гриппа. Меня статьи не убедили.
Попробуйте сами поискать на PubMed.
2 6 · Хороший ответ
Уважаемый Игорь! В домашней аптечке для профилактики и лечения ОРВИ наличие иммуномодуляторов не является необходимым. Если мы обратимся к Клиническим рекомендациям по диагностике и лечению ОРВИ, то ни один из наиболее распространенных препаратов данной группы (например, Ингавирин, Амиксин, Лавомакс, индукторы интерферона, не говоря уже о других иммуномодуляторах) не имеет доказательной базы в отношении их эффективности при лечении вирусных респираторных инфекций, отсутствуют сравнительные клинические исследования (уровень доказательности по применению данных препаратов – С-Д, то есть это мнение отдельных экспертов). В зарубежной литературе также нет показаний для назначения иммуномодуляторов для профилактики и лечения ОРВИ лицам, не имеющим иммунодефицитных состояний и заболеваний. У здоровых людей ОРВИ не сопровождаются изменениями в иммунном статусе, поэтому назначение иммуномодуляторов не имеет соответствующей точки приложения, и не оказывает действия на течение и продолжительность инфекционного заболевания
1 3 · Хороший ответ
Оциллококцинум - наше все. Волшебные таблетки с не менее волшебным экстрактом печени и сердца (и руки) сказочной "барбарийской утки". Судя по указанным объёмам действующего вещества, на все уже- и ещё не произведённые гранулы хватило ровно одной несчастной утки - видимо, потому что выловить это сказочное животное очень непросто. Зато сказочность и волшебство с лихвой компенсируют малый объём! Ну, так производители говорят. Почти так.
Лично для меня главным вопросом по поводу этих таблеток остаётся одно - можно ли их есть веганам? С одной стороны, экстракт печени этого несчастного несуществующего создания представлен там в столь малых объёмах, что его как бы и нет, а с другой стороны - написано, что есть!
И что делать веганам, неясно.
1 3 · Хороший ответ
Мастурбация, действительно, положительно влияет на мозг, особенно у женщин. Она сокращает уровень кортизона на время, минут на сорок. Это делает мышление и мужчин, и женщин — но больше это нужно женщинам, — более спокойным, менее агрессивным, помогает спланировать свои действия в социальной сфере. Вообще, если регулярно заниматься мастурбацией, она делает умнее: в большой степени женщин, в меньшей — мужчин. Именно за счёт того, что при ней на треть сокращается кортизон. А это атавистический гормон, он нам вообще-то не нужен и мешает нам мыслить в социальной сфере.
Что за касается иммунной сферы, то никакого влияния мастурбация на неё не оказывает, она идёт совершенно отдельно. Придумать можно все, что угодно, а мы говорим о научных фактах.
Регулярная половая жизнь с хорошей партнершей и хорошими отношениями повышает иммунитет, этот правда. Но это половая жизнь, а не мастурбация. И потом, речь идёт о нескольких годах жизни с хорошей партнершей, которая испытывает оргазм и тем самым передаёт мужчине здоровые импульсы из костного мозга. Но это к мастурбации не имеет никакого отношения.
Так что от коронавируса мастурбация не спасёт абсолютно, не надо выдумывать. Также от коронавируса не спасёт глядение в окно, ковыряние в носу и чесание за ухом. Это все никак не помогает в борьбе с коронавирусом. Правда и не мешает.

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
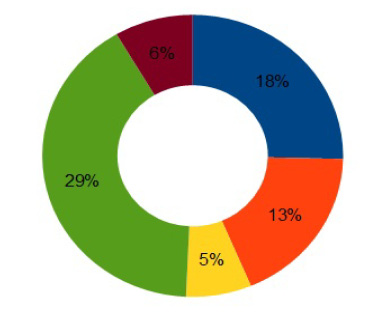

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Читайте также:


