Титры герпеса при цитомегаловирусе
Вирусом герпеса заражено практически все население нашей планеты. Существует несколько видов герпеса, и если одни не особенно опасны, то другие могут создать серьезные проблемы со здоровьем, а в определенных ситуациях, например при беременности, последствия деятельности вируса могут стать фатальными.
Масштабы проблемы и роль диагностики герпеса
Герпес можно назвать самым распространенным вирусным заболеванием в мире. Заразиться им очень просто — он может передаваться при любых контактах (поцелуях, половом акте), во время родов от матери к ребенку, бытовым путем, иногда — воздушно-капельным. К моменту достижения взрослого возраста герпесом заражен практически каждый.
Попадая в кровь, вирус может жить в организме годами, никак не проявляя себя. Но рано или поздно он дожидается момента, когда наша иммунная система слабеет. Спусковым крючком может стать серьезная болезнь, стресс, переутомление и хроническая нехватка сна, переохлаждение, гормональная перестройка, словом, практически любая встряска для организма.
Проявления герпеса зависят от типа вируса.
Существует 8 типов герпеса:
- Герпес 1-го типа. Самый распространенный тип. Именно он вызывает появление зудящих пузырьков, наполненных жидкостью, на губах, языке, слизистых оболочках рта. Иногда за несколько часов перед появлением пузырьков человек чувствует повышение температуры и слабость, хотя очень часто вирус атакует без предупреждения.
Многие считают, что избавиться от герпеса невозможно. И в этом утверждении есть доля истины — но лишь доля. Да, на сегодняшний день нельзя полностью уничтожить вирус в организме. Но можно подавить его деятельность настолько, что проявления не будут вас беспокоить. Лечение обычно комбинированное, используются противовирусные препараты, средства, укрепляющие иммунитет, используются также физиотерапевтические методы (озонотерапия и другие), а при обострении — местные обезболивающие и противовирусные средства.
Диагностировать и лечить герпес необходимо, и это особенно важно для тех, кто готовится стать родителями. Взрослым вирус герпеса причиняет дискомфорт, но для новорожденных детей он может быть смертельно опасным.
Диагностика герпеса разделяется на два этапа — врачебный осмотр и лабораторные исследования, цель которых — найти и идентифицировать вирус герпеса в крови и других биоматериалах.
Зачастую уже при осмотре доктор в состоянии определить, с каким именно типом герпеса он имеет дело. Однако визуальные признаки могут ввести в заблуждение, например, генитальный герпес может походить на сифилис, а для некоторых типов герпеса внешние проявления вообще не характерны. Поэтому врач обязательно направит вас на анализы на герпес.
Лабораторные методы — основа диагностики герпеса. Они позволяют определить наличие вируса даже с том случае, если он неактивен, а также установить тип возбудителя и его концентрацию.
Анализы на герпес следует сдавать регулярно, даже если никаких проявлений болезни нет, — это нормальная мера контроля состояния здоровья. Но в некоторых случаях анализы на герпес обязательны.
- во время планирования и ведения беременности;
- перед подготовкой к трансплантации органов;
- при появлении на коже пузырьков и высыпаний, причину которых сложно определить во время осмотра.
Лабораторная диагностика герпеса включает в себя несколько видов анализов. Какой анализ на герпес необходим в каждом конкретном случае, решает лечащий врач. Иногда для полной уверенности потребуется пройти несколько разных исследований.
- Полимеразная цепная реакция (ПЦР) . Доступный и чрезвычайно простой метод, который позволяет быстро выявить вирус даже в том случае, если его концентрация в крови крайне мала. Методом ПЦР можно исследовать практически любой биоматериал. В основе ПЦР лежит метод многократного копирования части ДНК возбудителя болезни и последующей идентификации вируса и его типа.
- Иммуноферментный анализ (ИФА) . При помощи этого метода можно выявить наличие антител IgM и IgG (качественный ИФА) и подсчитать их концентрацию (количественный ИФА). При обострении высоко содержание IgM, а в хронической стадии — IgG. Таким образом, этот способ дает возможность установить фазу болезни.
- Реакция иммунофлюоресценции (РИФ) . При этом методе биоматериал обрабатывается особым веществом, под воздействием которого антигены начинают светиться и их можно быстро обнаружить при микроскопическом исследовании. Этот способ хорошо работает в том случае, если концентрация возбудителя в крови высока.
- Культуральный метод . Точный и надежный метод, единственным существенным минусом которого является долгое ожидание результатов. При исследовании культуральным методом биоматериал переносится на питательную среду. Вирус начинает активно захватывать здоровые клетки и исследователь, наблюдая за их изменениями, получает возможность идентифицировать вирус. Ложноположительный или ложноотрицательный результат при использовании культурального метода почти исключен, но результата приходится ждать 1–2 недели.
- Серологический метод . Самый распространенный и доступный метод диагностики герпеса, определяющий антитела класса G. Часто назначают при подозрении на герпес 2-го типа (генитальный герпес). Биоматериалом для этого исследования является кровь из вены.
- Иммунограмма . Это не столько анализ на герпес или какой-либо другой вирус, сколько проверка работы иммунной системы. Специалист исследует кровь из вены и определяет общее количество иммунных клеток, а также их соотношение. Этот анализ позволяет определить, каких иммуноглобулинов не хватает. Иммунограмму назначают для подбора правильной терапии для стимуляции защитной системы организма.
- Дот-гибридизация . Метод, во многом похожий на ПЦР — он также направлен на выявление ДНК возбудителя. Способ диагностики можно использовать даже тогда, когда внешних проявлений болезни еще нет.
- Вульвокольпоцервикоскопия . Этот метод относится к качественным и применяется для диагностики генитального герпеса у женщин. Врач осматривает слизистые оболочки влагалища и шейки матки при помощи специального микроскопа — он дает не очень большое увеличение, однако этого достаточно для того, чтобы увидеть характерные для герпеса высыпания.
Стоимость анализов на герпес значительно различается в разных частных лабораториях Москвы, поэтому мы приводим средние расценки.
ПЦР-анализ обойдется примерно в 900–1500 рублей, если анализ проводится на все типы герпеса, и в 300–500 рублей, если анализ проводится на какой-то один тип. ИФА стоит в среднем 750–900 рублей, РИФ — 450–700 рублей.
К стоимости самого анализа нужно добавить и стоимость забора биоматериала — в среднем 200–300 рублей за забор крови и 300–400 рублей за забор мазка.
Традиционный список анализов при герпесе включает в себя ПЦР, ИФА и РИФ. Дополнительные исследования назначаются в том случае, если даже эти три метода в совокупности дали неоднозначный результат, что бывает достаточно редко.

Чтобы результаты анализов были точными, обращайтесь в крупные лаборатории, где строго контролируется весь процесс — от забора биоматериала до проведения исследования. Кроме того, самим пациентам важно соблюдать правила подготовки к анализам. Они достаточно просты — за 8 часов до забора биоматериала нельзя есть и пить (исключение — обычная вода), употреблять алкоголь, заниматься спортом, желательно оградить себя от стрессовых ситуаций.
Синонимы: определение антител IgG к цитомегаловирусу (ЦМВ, CMV), антитела класса IgG к цитомегаловирусу, IgG к ЦМВ, IgG к CMV, Anti-CMV-IgG, CMV Antibody IgG.
Связанные тесты: определение антител IgM к цитомегаловирусу, выявление ДНК цитомегаловируса, определение антител IgМ к вирусу простого герпеса 1 и 2 типа, определение антител IgG к вирусу простого герпеса 1 и 2 типа, выявление ДНК вируса простого герпеса 1 и 2 типа, определение антител IgM к краснухе, определение антител IgG к краснухе, определение антител IgM к токсоплазме, определение антител IgG к токсоплазме, выявление ДНК токсоплазма гондии.
Антитела класса IgG к цитомегловирусу являются маркерами перенесенной в прошлом цитомегаловирусной инфекции. Антитела IgG к цитомегаловирусу вырабатываются в организме в период клинических проявлений заболевания. Как правило, цитомегаловирусная инфекция протекает бессимптомно. Однако, это заболевание представляет опасность при беременности (вызывает патологии в развитии плода, гибель плода) и ВИЧ-инфицированных.
Исследование позволит вашему врачу:
- Диагностировать первичную или рецидивирующую цитомегаловирусную инфекцию;
- Выявить причины внутриутробных инфекций;
- Выявить наличие TORCH-инфекций.
- Установить возбудителя заболевания, похожего на цитомегаловирусную инфекцию.
Исследование рекомендуется проводить при:
- Планировании беременности;
- Скрининге беременных на TORCH-инфекции;
- Беременности, если проявляются симптомы: лихорадка, увеличение лимфоузлов, боли в горле, увеличение печени или селезенки;
- Невынашивании беременности;
- Признаках внутриутробной инфекции, фето-плацентарной недостаточности;
- Выявлении патологий плода на УЗИ обследовании;
- ВИЧ-инфекции, если появляются такие симптомы как общее недомогание, ринит, воспаление пищевода, колит, энцефалит, воспаление сетчатки глаза;
- Симптомах мононуклеоза (лихорадка, боль в горле, увеличение лимфоузлов) и отрицательном тесте на вирус Эпштейна-Барр;
- Новорожденным с симптомами: желтуха, анемия, увеличение селезенки или печени, нарушение слуха или зрения, конвульсии, задержка умственного развития, уменьшенный размер головы;
- Атипичном течении пневмонии у детей;
- Повышенных печеночных ферментах (трансаминаз, щелочной фосфотазы, гамма-глутамилтранспептидаза) и отсутствии маркеров вирусных гепатитов.
Метод:
Иммуноферментный анализ (ИФА).
Материал для исследования:
Подготовка к исследованию
Специальной подготовки не требуется.
Особые условия:
Предварительная запись не требуется.
Формат выдачи результата:
Положительный результат может свидетельствовать о:
- Первичном инфицировании (титр антител IgG со временем увеличивается, при этом IgM к ЦМВ с высокими значениями, авидность IgG – низкая);
- Обострении давней инфекции (титр антител IgG со временем увеличивается, а IgM невысокий, авидность IgG – высокая);
- Обострении латентной формы инфекции (титр IgG остается на постоянном уровне, IgM при этом отсутствуют, авидность IgG – высокая);
- Во время беременности – вероятен риск внутриутробной инфекции;
- До беременности – вероятность осложнений во время беременности низкая.
Отрицательный результат может свидетельствовать о:
- Отсутствии инфекции в данный момент;
- Если исследование проводилось непосредственно после инфицирования, то антитела могли еще не выработаться. Рекомендуется провести повторный тест не менее чем через 2-3 недели.
Комментарий:
Для постановки окончательного диагноза рекомендуется исследовать биологический материал на наличие ДНК цитомегаловируса. Совокупность результатов ИФА, выявления ДНК цитомегаловируса, клиники и эпидемиологии инфекции позволит поставить окончательный диагноз.
Цены на исследования цитомегаловируса
| Исследования | Стоимость, руб. | Срок выполнения | |
|---|---|---|---|
| Антитела класса IgM к цитомегаловирусу | 5.98 | До 7 дней |  |
| Антитела класса IgG к цитомегаловирусу | 5.64 | До 7 дней |  |
| ДНК цитомегаловируса (кровь) | 10.44 | 1-3 дня |  |
| ДНК цитомегаловируса (соскоб) | 10.15 | 1-3 дня |  |
220068, Республика Беларусь,
г. Минск, ул. Червякова 64
E-mail: mail@biomedica.by
Лицензия №02040/6344 от 26 марта 2010г
Время работы центра:
Понедельник - пятница:
08:00 - 20:00
Суббота: 08:00 - 16:00
Воскресенье: выходной
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Герпесвирусы широко распространены в человеческой популяции. После первичного инфицирования вирусы герпесгруппы переходят в латентное состояние и пожизненно персистируют в организме. При неблагоприятных условиях и снижении местного или системного иммунитета может происходить реактивация инфекции, что обусловливает развитие воспаления чаще всего на местном уровне. Разнообразие клинических форм герпесвирусных инфекций постоянно поддерживает научный интерес как в области изучения их патофизиологии, так и в области поиска эффективной противовирусной терапии. Особенно актуально это для β- и γ-герпесвирусов, т. к. группа α-герпесвирусов изучена достаточно хорошо.
Цель исследования: определить эффективность валацикловира в отношении репликации вируса Эпштейна – Барр (ВЭБ), вируса герпеса человека 6 типа (ВГЧ-6), цитомегаловируса (ЦМВ) в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями верхних дыхательных путей (ВДП).
Материал и методы: нами амбулаторно обследованы 80 пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП. Всем пациентам проводились микробиологическое исследование мазков из ротоглотки и оценка вирусной нагрузки в смешанной слюне и цельной крови вне периода обострения. Пациенты получали терапию валацикловиром по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале проводился после окончания лечения.
Результаты и обсуждение: микробный пейзаж ротоглотки часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой. В смешанной слюне обнаруживалась ДНК ВЭБ, ВГЧ-6, но не ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлялась. Применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у часто болеющих взрослых.
Выводы: целесообразно провести дальнейшие исследования по определению режима дозирования и оценке клинической эффективности ациклических нуклеозидов в лечении ВЭБ-инфекции.
Ключевые слова: герпесвирусы, вирус Эпштейна – Барр, вирус герпеса человека, цитомегаловирус, часто болеющие взрослые, вирусная нагрузка, валацикловир.
Для цитирования: Щубелко Р.В., Зуйкова И.Н., Шульженко А.Е. Герпесвирусные инфекции человека: клинические особенности и возможности терапии. РМЖ. 2018;8(I):39-45.
Human herpesviruses infections: clinical features and opportunities of therapy
R.V. Shubelko 1 , I.N. Zuykova 2 , A.E. Shulzhenko 2
1 JSC "K+31", Moscow
2 “National Research Center — Institute of Immunology” Federal Medical-Biological Agency of Russia, Moscow
Herpesviruses are widely spread among the human population. After the primary infection, the herpesviruses become latent and persistent in the human body for life. Adverse conditions and a low local or systemic immunity may reactivate the infection, which causes the inflammation, usually at the local level. The variety of clinical forms of herpesviruses infections constantly supports scientific interest both in the field of studying their pathophysiology and in the search for effective antiviral therapy. This is especially important for β- and γ-herpesviruses, since the α-herpesvirus group has been studied rather well.
Aim: to determine the efficacy of valacyclovir for replication of the Epstein-Barr virus (EBV), human herpesvirus type 6 (HHV-6), cytomegalovirus (CMV) in the oropharynx in frequently ill adults with chronic inflammatory diseases of the upper respiratory tract.
Patients and Methods: 80 patients with frequent recurrences of chronic inflammatory diseases of the upper respiratory tract were examined outpatiently. All patients underwent microbiological examination of swabs from the oropharynx and the viral load in mixed saliva and whole blood not in exacerbation period was assessed. Patients received valacyclovir therapy according to the scheme 500 mg x 3 times a day for 14 days. Control of viral load in the biomaterial was carried out after the end of treatment.
Results and Discussion: out of the period of exacerbation the oropharynx microflora in frequently ill adults is represented mainly by a normal or conditionally pathogenic microflora. EBV DNA, HHV-6, but not CMV DNA, were detected in the mixed saliva. The DNA of the herpesvirus was not detected in the blood samples of these patients. The use of valacyclovir in a dose
of 500 mg 3 times a day significantly reduces the replication of EBV in the oropharynx in frequently ill adults.
Conclusions: it is advisable to conduct further studies to determine the dosage regimen and evaluate the clinical efficacy of acyclic nucleosides in the treatment of EBV infection.
Key words: herpes viruses, Epstein-Barr virus, human herpes virus, cytomegalovirus, frequently ill adults, viral load, valacyclovir.
For citation: Shubelko R.V., Zuykova I.N., Shulzhenko A.E. Human herpesviruses infections: clinical features and opportunities of therapy // RMJ. 2018. № 8(I). P. 39–45.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Только для зарегистрированных пользователей


Цитомегаловирусная инфекция — заболевание, вызванное вирусом из семейства герпеса.
Заразившись им, вы от него не избавитесь. Иммунитет к цитомегаловирусу не формируется! Однако можно снизить количество обострений этой инфекции в организме.
Основным источником цитомегаловирусной инфекции является больной человек, у которого в данный момент идет обострение этого процесса. Пути передачи цитомегаловируса такие же, как и у вируса герпеса (они относятся к одному семейству), т.е.:
- воздушно-капельный,
- половой,
- контактный,
- внутриутробный (траснплацентарный).
Цитомегаловирус в период беременности
Опасность вируса для организма беременной, особенно для плода, представляет острое течение цитомегаловирусной инфекции, т.е. первичное заражение во время беременности.
Заражение от больного человека с острой инфекцией цитомегаловируса — для беременных является худшим вариантом, т.к. из-за отсутствия антител в крови, неослабленный вирус довольно легко проникает через плаценту, повреждающе воздействует на плод (инфицирование плода происходит в 40-50 % случаев)
Обострение скрытого вирусоносительства под воздействием факторов, ослабляющих иммунитет (например, наличие сопутствующих заболеваний, прием препаратов подавляющих иммунитет), является менее опасной ситуацией. Поскольку в борьбу с вирусом вступают уже имеющиеся антитела (IgG, которые имелись всегда при скрытом вирусоносительстве), сам вирус становится ослабленным, что снижает степень проникновения через плаценту и агрессивное воздействие на плод (инфицирование плода происходит лишь в 1-2 % случаев).
Существует определенная зависимость между степенью неблагоприятного воздействия вируса на плод и сроком беременности. Так, например, при инфицировании плода на ранних сроках беременности, существует большая вероятность самопроизвольного выкидыша или аномалии развития ребенка.
Ребенок с цитомегалией
Для ребенка с врожденной цитомегалией характерно наличие желтухи, увеличение размеров печени, селезенки, сниженный гемоглобин (анемия) и другие изменения в анализе крови, также отмечаются, тяжелые поражения центральной нервной системы, поражение глаз и слуха.
Обнаружение у ребенка IgG, в первые три месяца после родов, не считается признаком врожденной цитомегалии, если у его мамы имеет место скрытое вирусоносительство, т.к. эти антитела ему достались от мамы при рождении и через три месяца они у него исчезнут самостоятельно. Обнаружение же у ребенка IgM, служит доказательством наличия острой стадии цитомегаловирусной инфекции.
Как проявляется
Острая фаза цитомегаловирусной инфекции может проявляться у беременной легкими гриппоподобными явлениями, с невысокой температурой, общим недомоганием, которые являются довольно распространенными и для многих других респираторных инфекций.
Диагностика и профилактика
Иммуноглобулины класса G (IgG) выявляются как при латентном течении цитомегаловирусной инфекции, так и при ее обострении или первичной инфекции. Превышение значений, указанных в бланке лаборатории означает наличие ЦМВ-инфекции. Возможна внутриутробная инфекция, но вероятность ее возникновения неизвестна.
Если титры IgG находятся в пределах значений, указанных в бланке лаборатории, это означает, что ЦМВ-инфекция не обнаружена, либо инфицирование произошло в течение предыдущих 3 - 4 недель. Внутриутробная инфекция невозможна, за исключением случаев одновременного присутствия IgM.
Если человек никогда не был инфицирован цитомегаловирусом, то титр IgG будет ниже значения, указанного на бланке анализа. Это означает очень высокую вероятность заражения цитомегаловирусом во время беременности. Женщины, у которых отсутствует титр IgG, входят в группу риска.
После первичного заражения ЦМВ антитела IgG остаются в крови пожизненно. Переход цитомегаловирусной инфекции из латентной формы в активную на фоне ослабленного беременностью иммунитета возможен и при наличии IgG. После первичного инфицирования или активизации инфекционного процесса титры IgG растут (увеличение в 4 и более раз относительно начального уровня), потом очень медленно падают.
Вероятность заражения плода.
Вероятность заражения плода напрямую зависит от концентрации вируса в крови. А концентрация вируса определяется уровнем защитных антител: чем больше антител, тем ниже концентрация вируса. У людей, впервые инфицированных цитомегаловирусом, антител нет, поэтому концентрация вируса очень высока, следовательно, заражение плода наиболее вероятно. У носителей цитомегаловируса есть антитела, поэтому концентрация вируса в крови ниже.
Профилактикой передачи и заражения цитомегаловирусной инфекцией является изоляция больных с острой стадией процесса, как от новорожденных, так и от беременных.
Скрытая угроза: цитомегаловирус
Цитомегаловирус — скрытый бич нашего времени, поражающий новорожденных гораздо чаще нашумевшего вируса Зика. Хотя у здоровых людей заражение часто протекает бессимптомно, вирус вызывает тяжелые осложнения у людей с ослабленным иммунитетом. К сожалению, вылечивать и тем более предотвращать инфицирование современная медицина еще не умеет.
Цитомегаловирус — крупный вирус размером в 150–200 нм, что делает его одним из самых больших по размеру вирусов, известных современной науке. Его геном представлен двухцепочечной ДНК, содержащей информацию для производства более 230 белков.
После заражения вирусные белки начинают синтезироваться в клетке хозяина с вирусной ДНК — ЦМВ так распространяется и поддерживает свою жизнедеятельность.
Один из таких белков (ДНК-полимераза, необходимая для прохождения жизненного цикла вируса) играет роль мишени для использующихся сейчас противовирусных препаратов.
Встречаемость вируса высока везде. Однако этот показатель колеблется в зависимости от возраста, места проживания и социально-экономического статуса: зараженность выше в развивающихся странах и неблагополучных группах населения. Согласно результатам обследований, в среднем в США половина населения от 6 до 49 лет инфицирована ЦМВ. Среди 75–80-летних американцев носителями являются уже девять человек из десяти. В развивающихся же странах среди детей от одного года до пяти лет инфицирован примерно каждый пятый, а у пожилых людей этот показатель может достигать 90–100%.
Поскольку вирус может вызывать врожденные дефекты у детей, эти цифры заставляют специалистов бить тревогу.
Судя по статистике, в группу риска заражения попадает практически любой. Однако серьезные осложнения от вируса грозят в основном людям с пониженной функцией иммунитета: например, пациентам с трансплантированными органами, со СПИДом или новорожденным. Особенно восприимчивы к инфицированию недоношенные дети с низким весом, поскольку их иммунные системы еще не до конца сформированы. Более того, ученые выяснили, что уязвимость для вируса могут повысить некоторые генетические мутации.
Вирус может передаться через выделения из организма инфицированных больных: через слюну, слезы, мочу, фекалии, грудное молоко, сперму и т.д.
Также заразиться можно при переливании крови либо трансплантации органов. Кроме того, на некоторых поверхностях ЦМВ остается жизнеспособным до шести часов, и поэтому изредка можно заразиться и через контакт с предметами.
У здоровых людей симптомов заражения часто нет, и вирус не дает о себе знать. Однако вирус может реактивироваться, и тогда болезнь может проявлять себя в осложнениях различной степени тяжести, от неспецифической фебрильной лихорадки до даже смертельного исхода.
Более того, некоторые ученые считают, что на самом деле вирус сильно недооценен и связан с гораздо большим количеством осложнений, чем можно найти в стандартном описании для врачей.
Клиническую диагностику ЦМВ можно за короткие сроки провести в лаборатории, причем методов обнаружения вируса множество. Диагностика вируса улучшилась и у беременных женщин, хотя, согласно самым последним исследованиям, стандартный тест выявляет отнюдь не все случаи заражения. Одобренного лечения для будущих матерей сейчас нет. Новорожденным с умеренным проявлением симптомов заражения обычно прописывают валганцикловир. Здоровые люди, зараженные ЦМВ, чаще всего не нуждаются в лечении. Лечение обычно назначают пациентам с ослабленной иммунной системой.
Главную угрозу ЦМВ представляет для детей в утробе. Хотя он и уступает по известности вирусу Зика, на самом деле именно цитомегаловирус — самая частая вирусная причина инвалидности и врожденных дефектов у детей в США. Внутриутробное заражение проявляется во многих формах, включая недоношенность, задержку внутриутробного развития, микроцефалию и потерю слуха. Бремя болезни у детей с пожизненной инвалидностью из-за врожденного вируса оценивается в $1,86 млрд в год.
Как отмечает Эми Армстронг-Хеймсот из Университета Северной Аризоны, лишь 13% женщин слышали об этом вирусе. Про то, что его передача от матери ребенку может обернуться трагедией, исследовательница узнала от коллеги с недиагностированным ЦМВ.
Особое внимание направлено на женщин и с ВИЧ, и с ЦМВ, поскольку при таком двойном вирусном заражении риск инфицирования младенца вырастает в разы. Согласно исследованиями, ВИЧ-инфицированные женщины с ЦМВ в моче при родах в пять раз чаще передают ВИЧ младенцам, чем женщины с ВИЧ, но без ЦМВ. Также они в 30 раз чаще заражают новорожденных ЦМВ.
Лучшим методом борьбы с вирусом в перспективе специалисты называют вовсе не лекарства, а вакцины. Они помогут контролировать вирус на уровне популяции — с помощью всеобщей иммунизации. В первую очередь такая стратегия была бы направлена на женщин детородного возраста для предотвращения заражения плода. Однако, конечно, они необходимы и для пациентов с трансплантированными органами и гематопоэтическими стволовыми клетками.
Хотя вакцины пока нет, у исследователей, по-видимому, уже есть достаточное количество фундаментальных знаний для ее создания.
Разработок с различными стратегиями сейчас много — занимаются ими даже такие гиганты фармбизнеса, как Merck и GSK.
Удивительно, как борьба с цитомегаловирусом еще не стала одним из приоритетов международных здравоохранительных учреждений. Разработки вакцин можно было бы ускорить привлечением общественного внимания к этой проблеме и обращением к политическим и экономическим организациям за помощью. Остается надеяться, что многочисленные разработки ученых по созданию эффективной и безопасной вакцины уже близки к успеху — ведь они избавят многие семьи от бремени последствий заражения вирусом и спасут множество жизней.
Цитомегаловирус (ЦМВ) или вирус герпеса 5 типа, – ДНК-содержащий вирус Cytomegalovirus hominis семейства Herpesviridae подсемейства Betaherpesvirinae. Цитомегаловирусная инфекция (ЦМВИ) человека – хроническая антропонозная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса и клинических проявлений – от латентной инфекции до клинически выраженного генерализованного заболевания. Заболевание ЦМВИ классифицируют в зависимости от сроков и механизмов заражения (врожденная и приобретенная инфекция, пренатальная, интранатальная и постнатальная), степени активности вируса (латентная, персистирующая и реактивированная инфекция), первичного или повторного заражения (острая инфекция, реактивация вируса и реинфекция).
Отличительными особенностями инфекции являются возможность ЦМВ персистировать во многих органах и способность его к инфицированию практически всех клеток организма человека, что предопределяет многообразие клинических проявлений, как при врожденной, так и приобретенной формах инфекции. ЦМВ рассматривается в качестве основного возбудителя внутриутробной инфекции, имеющей самые различные исходы: от инфицирования без реализации инфекции, формирования пороков развития и заболевания новорожденных до гибели плода и мертворождения.
ЦМВИ – типичный антропоноз. Источником инфекции является больной человек либо вирусоноситель. Пути передачи: вертикальный, половой, воздушнокапельный, фекально-оральный, артифициальный (парентеральный). Факторами передачи являются кровь, цервикальный и вагинальный секреты, сперма, женское молоко. Вирус выделяется с мочой, фекалиями, слюной, мокротой, в меньшей степени – со слезной жидкостью. Заражение может происходить также при переливании крови, трансплантации органов и тканей. Цитомегалия — широко распространенная инфекция, среди взрослого населения РФ у 73–98% обнаружены АТ-ЦМВ.
ЦМВИ относится к оппортунистическим инфекциям, особую опасность представляет для больных с иммунодефицитами различной природы. Иммуносупрессия приводит к реактивации латентной инфекции и развитию манифестных вариантов болезни с поражением различных органов и систем, способных привести к летальному исходу. Манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов. Данная патология встречается у 20–40% больных СПИДом, не получающих антиретровирусной терапии. Клинически выраженная ЦМВИ — одно из серьезных инфекционных осложнений при трансплантации органов, инфекция обостряет процессы, приводящие к реакции отторжения трансплантата.
При персистенции ЦМВ в организме человека выделяют две стадии, которые сменяют друг друга – продуктивную (с репликацией вируса) и латентную. Выход вируса из латентной стадии означает реактивацию, что может быть предопределено снижением иммунорезистентности либо появлением иных факторов, способствующих его репродукции. Выявление прямых маркеров репликации вируса (виремия, ДНК или АГ) свидетельствует о наличии инфекции.
При первичном заражении на 5–7 день вырабатываются АТ IgM, через 10–14 дней – низкоавидные АТ IgG, затем постепенно авидность этих АТ увеличивается, они становятся высокоавидными. АТ IgM исчезают через один месяц, низкоавидные АТ IgG – через 1–3 месяца, высокоавидные АТ IgG циркулируют в крови носителя пожизненно. При первичном инфицировании в стадии “серологического окна”, до начала синтеза АТ, происходит активная репликация вируса, в этот период единственным маркером инфекции является ДНК вируса в крови. При реактивации возможно появление АТ IgM и/или IgA, а также низкоавидных АТ IgG; в пик реактивации выявляются ДНК либо АГ ЦМВ в плазме крови.
Решающим условием антенатальной ЦМВИ является виремия у матери вследствие первичного или повторного заражением вирусом или его реактивации. ЦМВ способен преодолевать плацентарный барьер и поражать плод в различные сроки беременности, вызывая врожденную инфекцию. По данным различных авторов, активная форма ЦМВИ выявляется у женщин с отягощенным акушерским анамнезом в 35–60% случаев. Входными воротами для вируса в антенатальном и интранатальном периодах течения беременности могут быть плацента и плодные оболочки, в неонатальном периоде и позже – дыхательные пути и пищеварительный тракт, возможно заражение и через кровь.
ЦМВ обладает преимущественно нейротропным, эпителиотропным, гепатотропным и кардиотропным действием на плод. Его воздействие может быть и опосредованным, приводящим к различным нарушениям в плаценте: расстройству маточно- плацентарного кровообращения, отклонению в эволюционном формировании плаценты. Клиническим эквивалентом этих расстройств могут быть сокращение продолжительности беременности и преждевременное родоразрешение, рождение детей с симптомами перенесенной гипоксии или признаками внутриутробной гипотрофии, общая задержка внутриутробного развития.
Наибольшее значение для развития ранних перинатальных поражений плода имеет гематогенный путь инфицирования. Кроме того, для интранатальных и более поздних поражений характерными являются вертикальный и контактный пути передачи ЦМВ, нередки также случаи смешанного инфицирования. Острая ЦМВИ может протекать в виде генерализованной формы с присоединением вторичных инфекций и иметь летальный исход уже в первые недели жизни ребенка. При инфицировании плода во время реактивации латентной ЦМВИ чаще имеют место поздние проявления инфекции в виде нарушений зрения, слуха, задержки психического развития, двигательных нарушений. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием вируса в организме человека. Развитие иммуносупрессии, в частности связанной с ВИЧ-инфекцией, ведет к возобновлению репликации ЦМВ, появлению вируса в крови и манифестации заболевания. Летальность больных ВИЧ-инфекцией, страдающих ЦМВИ, составляет 25–27%.
Клинический диагноз ЦМВ-инфекции требует обязательного лабораторного подтверждения. Выявление в крови пациента АТ-ЦМВ IgМ и/или IgG недостаточно ни для установления факта активной репликации ЦМВ, ни для подтверждения манифестной формы заболевания.
Показания к обследованию
- Женщины, планирующие беременность;
- женщины с отягощенным акушерским анамнезом (перинатальные потери, рождение ребенка с врожденными пороками развития);
- беременные женщины (в первую очередь имеющие УЗИ-признаки внутриутробной инфекции, лимфоаденопатии, лихорадку, гепатит и гепатоспленомегалию неясного генеза);
- беременные женщины с иммунодефицитом, в т. ч. с ВИЧ-инфекцией;
- матери, родившие ребенка с признаками внутриутробной инфекцией или врожденными пороками развития;
- дети, имеющие симптоматику врожденной инфекции, пороки развития или рожденные женщинами из группы риска по внутриутробной передаче ЦМВ;
- пациенты (в первую очередь новорожденные) с сепсисом, гепатитами, менингоэнцефалитом, пневмонией, поражением ЖКТ;
- пациенты с наличием иммунодефицита с клинической картиной органных или генерализованных поражений.
- Врожденная ЦМВИ – краснуха, токсоплазмоз, неонатальный герпес, сифилис, бактериальная инфекция, гемолитическая болезнь новорожденных, родовая травма, наследственные синдромы;
- мононуклеозоподобное заболевание – инфекции, вызываемые вирусом Эпштейна-Барр, герпес-вирусами 6 и 7 типов, острая ВИЧ-инфекция, стрептококковый тонзиллит, дебют острого лейкоза;
- заболевание органов дыхания у детей раннего возраста – коклюш, бактериальный трахеит или трахеобронхит, РС-вирусной инфекция, герпетический трахеобронхит;
- у больных с иммунодефицитом – пневмоцистная пневмония, туберкулез, токсоплазмоз, микоплазменная пневмония, грибковые и герпетические инфекции, бактериальный сепсис, лимфопролиферативные заболевания, ВИЧ-энцефалит, нейросифилис, прогрессирующая многоочаговая лейкоэнцефалопатия;
- полинейропатия и полирадикулопатия – полирадикулопатия, вызванная герпесвирусами 2 и 6 типов, синдром Гийена-Барре, токсическая полинейропатия, связанная с приемом лекарственных средств, алкоголя, наркотических психотропных веществ.
Этиологическая лабораторная диагностика включает микроскопические исследования, выявление возбудителя в культуре клеток, обнаружение АГ или ДНК, определение АТ IgM, IgА, IgG, авидности АТ IgG.
Материал для исследования
- Кровь (сыворотка, плазма), лейкоциты крови, моча, слюна, СМЖ – культуральные исследования, выявление ДНК;
- пуповинная кровь, амниотическая жидкость – выявление ДНК;
- слюна, моча – выявление АГ;
- сыворотка/плазма крови – определение АТ.
Для обнаружения АГ вируса в слюне и моче используют метод РИФ, по количеству светящихся клеток можно приблизительно оценить интенсивность выделения вируса. В связи с персистенцией ЦМВ обнаружение АГ не указывает на активность инфекционного процесса, для ее оценки требуются дополнительные исследования – выявление отдельных АГ вируса (р55, рр65 и др.).
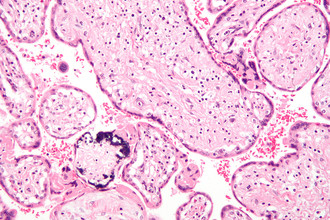
При проведении микроскопического исследования (световая микроскопия) основными морфологическими признаками ЦМВИ являются гигантские клетки с внутриядерными включениями (цитомегалы). Их можно обнаружить в эпителии почечных канальцев, желчных протоках, выводных протоках слюнных желез, поджелудочной железы, ткани легких, клетках глии, нейронах, эндотелиоцитах. Наличие таких клеток указывает на репродукцию вируса, однако они обнаруживаются не во всех случаях активной инфекции. Диагностическая чувствительность метода не превышает 50%.
Определение специфических АТ к вирусу помогает в распознавании заражения человека ЦМВ, но ввиду длительного периода нарастания титра АТ от момента инфицирования, последующего долгого сохранения их в крови, трансплацентарного перехода АТ IgG от матери к плоду (выявляются у ребенка до 1,5 лет) диагностическая ценность исследования ограничена. При наблюдении в динамике (2–4 недели) повышение титра АТ IgG в 4 раза указывает на активную ЦМВИ. Однако необходимость длительного периода наблюдения (до 4 недель) и возможность сохранения повышенного титра АТ на протяжении ряда лет лимитирует использование такого подхода к диагностике.
Дополнительным исследованием при поражении мозга, вызванного ЦМВ, может быть параллельное обнаружение АТ IgG в периферической крови и СМЖ методом ИФА с последующим расчетом их соотношения. Значение соотношения позволяет выявить интратекальную продукцию АТ и соответственно вовлечение в инфекционный процесс ЦНС.
Иммуноблот позволяет детектировать АТ IgM и IgG к отдельным белкам ЦМВ, подтвердить специфичность исследования, следить в динамике за появлением и исчезновением отдельных белков, что имеет высокое диагностическое и прогностическое значение. Наличие АТ к отдельным АГ вируса подтверждает формирование иммунного ответа к ЦМВ.
Показания к применению различных лабораторных исследований и интерпретация их результатов у разных категорий обследуемых
Диагностика первичного заражения, в т. ч. в период беременности, возможна только у пациентов, в крови которых отсутствуют АТ-ЦМВ. Независимо от клинических вариантов заболевания, при первичной ЦМВИ выявляются прямые (присутствие вируса, его ДНК или АГ) и косвенные (АТ-ЦМВ) лабораторные маркеры активной репликации ЦМВ. При обследовании больных при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь) необходимо количественное определение содержания ДНК ЦМВ в крови. Определение ДНК ЦМВ в ликворе, плевральной жидкости, БАЛЖ, биоптатах бронхов, биоптатов органов выполняют при наличии соответствующей органной патологии.
Выявление прямых маркеров репликации вируса (виремия, ДНК или АГ) свидетельствует о наличии инфекции. Выявление ДНК ЦМВ или АГ вируса в крови беременной женщины – основной маркер высокого риска заражения плода и развития врожденной ЦМВИ.
Отсутствие АТ-ЦМВ IgM, IgА и IgG означает отсутствие ЦМВ в организме. Однако у лиц с выраженным иммунодефицитом при активной репликации ЦМВ продукция специфических АТ может быть снижена до неопределяемого уровня.
Выявление АТ-ЦМВ разных классов позволяет определить фазы инфекционного процесса (репликативная или латентная). АТ IgM чаще оценивают как маркер первичной герпес-вирусной инфекции. При выявлении АТ IgM для подтверждения инфицирования ЦМВ рекомендуются дополнительные исследования: определение АТ IgА или авидности АТ IgG, выявление АТ к отдельным белкам с использованием иммуноблота; повторное обследование женщины или ребенка через 2 недели. Выявление АТ IgА и(или) низкоавидных АТ IgG подтверждает наличие инфекции. При повторном выявлении АТ IgM и отсутствии IgА и(или) низкоавидных IgG результат выявления АТ IgM считают ложноположительным.
Выявление АТ IgM и IgG к предранним белкам-антигенам и низкоавидных АТ IgG свидетельствует о первичном инфекционном процессе.
Обнаружение только АТ IgG не позволяет охарактеризовать период заболевания. При наличии иммуносупрессии классического (4-х кратного) увеличения АТ IgG во время рецидива не наблюдают.
Установление факта инфицирования плода осуществляется на основании обнаружения ДНК ЦМВ. Выбор биологического материала определяется с учетом срока гестации, обусловливающего возможность проведения того или иного метода инвазивной пренатальной диагностики: амниотическая жидкость – 16–23 недели, пуповинная кровь – 20–24 недели. Косвенным подтверждением факта инфицирования плода является обнаружение АТ IgM и/или АТ IgА в пуповинной крови (проведение исследования возможно с 22 недели беременности).
Лабораторная диагностика врожденной ЦМВИ основана на обнаружении ЦМВ, его ДНК или АГ в различном биологическом материале (периферическая кровь, моча, слюна, смывы и мазки от ротоглотки, СМЖ) и выявлении в сыворотке или плазме крови АТ IgМ и IgА в течение первых 7 дней после рождения. Проведение исследования в более поздние сроки не позволяет дифференцировать врожденную и приобретенную инфекцию. Выявление ДНК ЦМВ или АГ вируса в крови, моче, соскобах со слизистой ротовой полости через 4–6 недель жизни ребенка при отсутствии вируса в первые 2 недели говорит об интранатальном или раннем постанатальном заражении. Подтверждением манифестной ЦМВИ у детей первых месяцев жизни является наличие ДНК ЦМВ в крови.
При сомнительных результатах дополнительную диагностическую информацию может дать выявление АТ IgМ к отдельным белкам-антигенам вируса методом иммуноблота. Отсутствие АТ-ЦМВ у детей с врожденной ЦМВИ может быть связано с развитием иммунологической толерантности к АГ вируса цитомегалии (инфицирование ЦМВ не сопровождается эффективным синтезом АТ-ЦМВ).
Выявление АТ IgG в сыворотке крови новорожденного без сопоставления с уровнем АТ в крови матери не является диагностически значимым вследствие возможности их трансплацентарного переноса из материнского организма. Только при динамическом (с интервалом в 14–21 день) сравнении уровня АТ IgG новорожденного ребенка с уровнем АТ IgG в крови матери можно судить об их природе. Если титры АТ IgG у ребенка при рождении равны материнским, а при повторном исследовании через 3–4 недели снижаются приблизительно в 1,5–2 раза, то АТ, выявленные у ребенка, являются материнскими.
Скрининг беременных женщин – выявление АТ IgМ и низкоавидных АТ IgG. Для исключения реактивации целесообразно определение АТ IgА и низкоавидных АТ IgG.
Обследование больных с наличием иммунодефицита при подозрении на активную ЦМВИ и манифестную форму заболевания (ЦМВ-болезнь) включает гистологическое исследование биопсийных материалов для выявление цитомегалов (окраска гематоксилином и эозином), обнаружение ДНК ЦМВ в ликворе, плевральной жидкости, БАЛ, биоптатах бронхов, биоптатов внутренних органов при наличии соответствующей органной патологии; выявление АГ ЦМВ в крови, определение концентрации ДНК ЦМВ в крови методом ПЦР. В диагностике ЦМВИ у ВИЧинфицированных наиболее информативно наличие в крови ДНК ЦМВ в высокой концентрации (в плазме крови >10000 копий/мл, в лейкоцитах > 1000 копий/ 105 лейкоцитов).
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 - 2020

! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Читайте также:


