Сердечные от герпеса на
Прием антивирусных препаратов против герпеса в 10 раз снижает заболеваемость синдромом Альцгеймера. 80 процентов людей старше 40 имеют вирус герпеса и большинство не знают об этом.
Ученые уже секвенировали больше 5500 вирусов, которые могут заразить млекопитающих. Возможно в природе существует еще 320 000.
Эта группа вирусов включает вирусы простого герпеса, вирус ветряной оспы (который вызывает ветряную оспу и опоясывающий лишай), цитомегаловирус и вирус Эпштейна-Барра (который вызывает мононуклеоз). До 90 процентов взрослых были инфицированы вирусом Эпштейна-Барра.
CMV обычно лежит в состоянии покоя и безвреден в организме, но может вызвать инфекции, в том числе вирусную сердечную инфекцию. Вирусы распространяются при контакте с жидкостями организма инфицированного человека. Они также могут передаваться от беременной женщины к плоду во время беременности.
Рапамицин вызывает диабет у мышей. Значит причину диабета стоит искать в нашей иммунной системе. В вирусах?
Дальше будут описаны болезни и следующие вирусы, возможно их вызывающие:
Epstein–Barr virus (EBV), также называемый herpesvirus 4 (HHV-4)
Cytomegalovirus (CMV), также называемый herpesvirus 5 (HHV-5)
Varicella zoster virus (VZV), также называемый herpesvirus 3 (HHV-3)
Herpes simplex virus-1 (HSV-1)
Herpes simplex virus-2 (HSV-2)
Синдром Альцгеймера
СА — это сложное нейродегенативное заболевание ведущее к необратимой потери нейронов, интелектуальных способностей, памяти и способности к рассуждению.
Хроническое воспаление считается причиной хронических заболеваний, включая болезнь Альцгеймера
CMV присутствует в очень высокой доле пациентов с сосудистой деменцией в мозгах(Lin et al., 2002)
Наши находки показывают простой и прямой механизм посредством которого инфекции герпеса вызывают осаждение амилоида головного мозга в качестве защитного ответа в мозге, объясняет один из исследователей Рудольф Танзи из MassGeneral Institute for Neurodegenerative Disease (MIND).
Бета-амилоид в мозге специально обертывает частицы герпеса, чтобы предотвратить их распространение!
Основываясь на прошлых исследованиях, ученые выбрали герпес-симплекс 1 (HSV-1) и герпесвирус 6 (HHV-6) в качестве вероятных претендентов на связь с Альцгеймером — HSV-1 — это вирус, который, кстати, вызывает герпес.
Эксперименты не только показали, что вирусные инфекции приводят к большему количеству отложений бета-амилоида, мышам, разведенным с человекоподобным Aβ, лучше удалось отбить повреждение HSV-1, предполагая, что эти белки (амилоид) действительно являются своего рода мерой контратаки.
Также это соответствует с исследованиями, опубликованными всего несколько недель назад, показавшими более высокие уровни вирусов герпеса в мозгах людей, умерших от болезни Альцгеймера.
Сердечно-сосудистые заболевания
Вирус простого герпеса типа 1 (HSV-1) был признан потенциальным возбудителем сердечно-сосудистых заболеваний. Сообщается, что наличие антител к HSV-1 связано с увеличением риска инфаркта миокарда и ишемической болезни сердца
Предыдущие исследования показали, что люди, у которых был положительный результат теста на CMV подвергаются более высокому риску болезни сердца и это не зависит от других факторов риска.
Все больше доказательств того, что хроническая инфекция связана с атеросклерозом . Специфические организмы, включая герпесвирусы, усиливают атеросклероз у мыши с аполипопротеином E (ApoE)
Тридцать семь процентов исследованных (142 из 381) были CMV-сероположительными. У этих людей был более высокий индекс массы тела (1 кг / м2) и систолическое артериальное давление (3 мм рт. Ст.), но более низкий уровень холестерина ЛПНП (0,2 ммоль / л) при измерении по возрасту, полу, и диабету. Не было различий в значениях C-реактивного белка (CRP), уровней гемоглобина A1C (7%).
Пятьдесят восемь процентов исследованных (220 из 379) были HSV-положительными. У этих людей был более высокий индекс массы тела (2 кг / м2) и систолическое артериальное давление (4 мм рт. Ст. Выше), с поправкой на возраст, пол и диабет. В отличие от CMV, у тех, кто был серопозитивным для HSV, были достоверно выше значения C-реактивного белка.
Кальцификации коронарной артерии и CMV/HSV
CMV-положительные индивиды имели 1.5-кратное отношение шансов на наличие кальцификации по сравнению с серонегативной группой. Аналогичное незначительное соотношение наблюдалось между HSV-положительной серологией и кальцификации.
Результаты также показывают, что предыдущая инфекция CMV может быть связана с увеличением атеросклеротической нагрузки, что оценивается путем исследования кальцификации коронарной артерии. Напротив, не было статистически значимого независимого соотношения между HSV, H pylori, C pneumoniae и сосудистой дисфункцией.
Эти результаты дополняют работу с мышами с дефицитом ApoE, в которой мышиный гаммагерпревирус-682 и мышиный цитомегаловирус3 усиливают атерому, но не HSV-1. И согласуется с клиническими признаками того, что CMV, но не HSV-1, связан с атеросклерозом.
Диабет 2-го типа
Сахарный диабет типа 2 является метаболическим расстройством, характеризующимся высоким уровнем глюкозы в крови из-за недостаточности или резистентности к инсулину.
Исследователи рассмотрели более 500 человек в конце 80-х. Из тех, у кого был CMV, у 17% также был диабет типа 2. Среди тех, у кого никогда не было CMV, только у 8% был диабет.
Bот другое исследование
Среди 1 566 субъектов 206 (13,2%) имели диабет типа 2, а 1360 пациентов были недиабетическими. У пациентов в возрасте старше 65 лет артериальная гипертония и болезнь коронарных артерий чаще встречались у пациентов с диабетом, чем у контрольных (все P
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
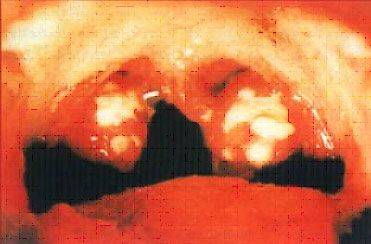
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
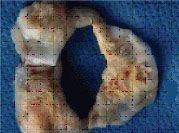
Аортальный клапан
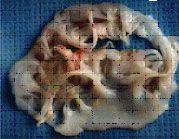
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
Миокардитом во врачебной практике принято называть воспалительный процесс в сердечной мышце, миокарде, вызванный вирусом или бактериальной инфекцией. Вследствие воспаления сократительная способность миокарда постепенно снижается, что приводит, в конце концов, к сердечной недостаточности.

Миокардит не имеет типичных симптомов.
Основанием заподозрить это заболевание становятся нетипичные общие жалобы на фоне недавно перенесенного гриппа или других инфекций, сопровождаемых значительным повышением температуры:
- усталость и снижение выносливости;
- нарушения сердечного ритма;
- одышка;
- боль в груди.
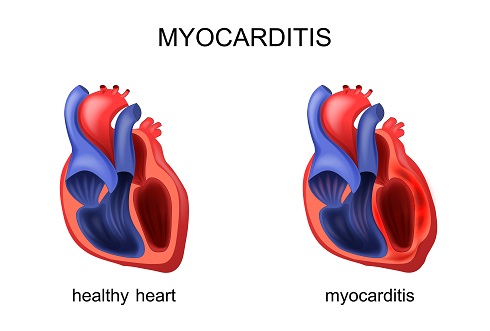
Основной причиной возникновения миокардита считается вирусная инфекция. Её возбудителями могут быть энтеровирус, аденовирус, парвовирус В19, вирус герпеса, цитомегаловирус, реже — вирус гепатита С и ВИЧ. Миокардит также может быть вызван грибками, бактериями, паразитами и простейшими.
Как правило, организм быстро справляется с самим вирусом, но вирусы обладают способностью оставлять в организме образцы своего ДНК в виде нуклеиновых кислот, которые могут провоцировать воспалительную реакцию снова и снова, то есть миокардит может принять хроническую форму.
Гиперчувствительность к некоторым лекарственным препаратам, употребление наркотических веществ, аутоиммунная реакция или курс лучевой терапии тоже могут запустить воспалительный процесс в сердечной мышце.

Из-за отсутствия типичных симптомов миокардит иногда не замечают на фоне гриппа или другой инфекции.
Это может иметь серьёзные последствия:
внезапная остановка сердца у молодых людей во время спортивных нагрузок
в 10% случаев вызвана именно запущенным воспалением миокарда.
Сначала врач собирает информацию о перенесенных заболеваниях и жалобах, а потом проводит физикальное обследование: слушает сердце, измеряет пульс, чтобы выявить аритмию, проверяет лёгкие на шумы. Поскольку у миокардита нет типичных симптомов, без дальнейших исследований не обойтись.
У пациента берут анализ крови, так как повышенное содержание в ней определенных кардиомаркёров — креатинкиназы и тропонина — могут свидетельствовать о воспалении миокарда.
Кроме того, проводят ЭКГ и эхокардиографию, что позволяет оценить сердечный ритм и функцию сердца, особенно его левого желудочка, а также выявить патологию сердечных стенок. Все эти нарушения могут быть признаками вовлечения сердца в инфекционный процесс.
В некоторых случаях назначают компьютерную или магнитно-резонансную томографию сердца, которые позволяют выявить признаки воспалительного процесса и уточнить обширность поражения сердечной мышцы.
Окончательный диагноз ставят на основании результатов биопсии миокарда, а именно гистологического, иммуногистохимического и молекулярно-биологического анализа пробы ткани. Необходимость в проведении биопсии возникает, если функция сердца прогрессивно ухудшается, но при этом исключены другие причины такой патологии.
При надлежащем лечении у большей части пациентов с миокардитом благоприятный прогноз на выздоровление. Исключение составляют, пожалуй, только гигантоклеточный вирусный миокардит и хронический миокардит с расширением полостей сердца (дилатационная кардиомиопатия).
Лёгкая форма миокардита лечится исходя из принципа физического покоя, что подразумевает отказ от тяжелого физического труда, занятий спортом, употребления алкоголя и никотина. Иногда такого режима бывает достаточно для выздоровления.
В случаях хронического миокардита, вызвавшего ослабление сердечной мышцы, проводят медикаментозную коррекцию сердечной недостаточности (в основном ингибиторами АПФ и бета-блокаторами).
При тяжелом течении или в редких случаях для пациента подбирают иммуномоделирующую, иммуносупрессивную, противовирусную и противовоспалительную схему лечения в специализированных центрах.
Аннотация научной статьи по наукам о здоровье, автор научной работы — Кантемирова М. Г., Луценко Я. В., Ибрагимова Г. Ф., Коровина О. А., Абросимова А. А.
Обследовано 45 детей в возрасте от 3 до 15 лет с различными видами аритмий. Выявлена 100% их инфицированность вирусами семейства герпеса, имеющая в 98% характер микстинфек-ции. Преобладает латенция и неактивная персистенция герпесвирусов. Наиболее высоким был уровень инфицированности вирусами EBV и HHV6, а наиболее низким HSV1,2. Выраженность иммунного ответа была максимальной при HSV1.2 и минимальной при HHV6 инфекции. Инфицированность вирусами HSV1,2 была достоверно выше у детей с синдромом слабости синусового узла I, П типов и экстрасистолией по сравнению с детьми с тахиаритмией. Для детей с гетеротопными тахиаритмиями характерна наибольшая выработка IgG AT к HHV6. Высокий уровень смешанной инфицированности герпесвирусами детей с аритмиями может являться одним из факторов развития иммунологически опосредованной дисфункции проводящей системы и электрической нестабильности миокарда.
Похожие темы научных работ по наукам о здоровье , автор научной работы — Кантемирова М. Г., Луценко Я. В., Ибрагимова Г. Ф., Коровина О. А., Абросимова А. А.
Markers of herpes virus infection in children with cardiac arrythmias
Specific herpes virus IgM, IgG antibodies were detected in blood serum of 45 children with cardiac arrhythmias. All children were infected by herpes viruses. Mixtinfection was revealed in 98% with predominance of latent course and non-active persistence of herpes viruses. The most often EBV and HHV6 IgG were found out, more rare HSV1.2 IgG. The level of immune response was maximum in HSV1,2 and minimal in HHV6. HSV1,2 infection was detected significantly often in children with sinus node weakness syndrome (SNWS) and extrasystole (ES) as compared with heterotopic tachycardias (HT). The higher level of HHV6 IgG was more characteristic for patients with HT than with SNWS and ES. Significant level of mixt herpes virus infection in children with arrhythmias can be one of the factors in development of immunological mediated dysfunction of myocardial conduction and electric myocardial instability.
ИНФИЦИРОВАННОСТЬ ВИРУСАМИ СЕМЕЙСТВА ГЕРПЕСА ДЕТЕЙ С НАРУШЕНИЯМИ СЕРДЕЧНОГО РИТМА
М.Г. Кантемирова, Я.В. Луценко,
Г.Ф. Ибрагимова, О.А. Коровина
Кафедра детских болезней РУДН Ул. М. Макпая, д. 8, Москва, 117198,
Окружной проезд д., 30а, Москва, 105187
Морозовская детская городская клиническая больница 4-й Добрынинский пер,, д. 1, Москва, 119049
Обследовано 45 детей в возрасте от 3 до 15 лет с различными видами аритмий. Выявлена 100% их инфицированность вирусами семейства герпеса, имеющая в 98% характер микстинфек-ции. Преобладает латенция и неактивная персистенция герпесвирусов. Наиболее высоким был уровень инфицированное™ вирусами EBV и HHV6, а наиболее низким — HSV1,2. Выраженность иммунного ответа была максимальной при HSV1,2 и минимальной при HHV6 инфекции. Инфицированность вирусами HSV1,2 была достоверно выше у детей с синдромом слабости синусового узла I, П типов и экстрасистолией по сравнению с детьми с тахиаритмией. Для детей с гетеротопными тахиаритмиями характерна наибольшая выработка IgG АТ к HHV6. Высокий уровень смешанной инфицированности герпесвирусами детей с аритмиями может являться одним из факторов развития иммунологически опосредованной дисфункции проводящей системы и электрической нестабильное™ миокарда.
Не вызывает сомнений утверждение, что большинство нарушений сердечного ритма возникает у детей без органического поражения сердца, а изменение электро-физиологических свойств миокарда имеет сочетанный генез [1]. Одним из возможных механизмов развития нарушения функции проводящей системы может быть инициированный вирусами аутоиммунный процесс, затрагивающий как проводящий миокард, так и структуры нервной системы, отвечающие за регуляцию сердечного ритма [2,3,4,].
В литературе имеются указания на существенное влияние герпесвирусов на развитие иммуннопатологических феноменов, в том числе аутоиммунных [5, 6]. Высказывается мнение о значение герпетической инфекции в развитии электрической нестабильности миокарда и нарушении нейрогенной регуляции сердечного ритма у новорожденных [4], в возникновении кораноритов и атеро-
склероза. Известна способность герпесвирусов при миокардиальной инвазии приводить к различным морфологическим изменениям кардиомиоцитов от подавления биосинтеза белков мышечных волокон с развитием перенуклеарного лизиса миофибрилл и атрофии мышечных волокон до развития некротических изменений кардиомиоцитов [7].
Из 8 патогенных для человека вирусов семейства Herpesviridae у детей наиболее часто инфекции вызывают цитомегаловирусы (CMV), вирус Эппггейн-Барр (EBV), вирус простого герпеса (HSV1,2) и вирус герпеса человека 6-готипа (ННВ6). По данным сероэпидемиологических исследований антитела к вирусу простого герпеса выявляются у 70—100% населения, к CMV — у 60%, к EBV — у 95%, к HHV6 типа — у 80% [5, 6]. В основном исследования проведены у взрослых. Сведения о степени и характере инфицированное™ детей различного возраста единичны [8]. Имеются немногочисленные данные об инфи-цированности вирусами семейства герпеса в группах детей с различными заболеваниями [9, 10]. Учитывая распространенность и свойства герпесвирусов, их возможное значение в развитии хронической, в том числе сердечнососудистой патологии и генезе аритмий, интересным представляется изучение степени и спектра инфицированности вирусами HSV1,2, CMV, EBV и HHV6 детей с нарушениями сердечного ритма и проводимости.
Материалы и методы. Для установления степени и характера инфициро-ванности вирусами семейства герпеса обследовано 45 пациентов в возрасте от 3 до 15 лет с различными видами аритмий: I группа — 8 детей в возрасте от 3 до 6 лет, II группа — 15 детей от 7 до 10 лет, Ш группа — 22 ребенка от 11 до 15 лет.
Среди обследованных детей регистрировались следующие нарушения ритма и проводимости (НРСиП): гетеротопные тахиаритмии (хроническая непарак-сизмальная, параксизмальная тахикардия — 12 пациентов (26,6%); экстрасисто-лия (ЭС) — 15 пациентов (33,4%), синдром слабости синусового узла I, II типов (СССУ1,П) — 13 детей (28,9%), полная блокада правой ножки пучка Гиса— 3 ребенка (6,7%), выраженная синусовая тахикардия — 2 ребенка (4,4%).
Все дети находились на стационарном лечении в отделениях Морозовской детской городской клинической больницы, им были проведены общеклинические лабораторные исследования; инструментальное обследование включало электрокардиография в 12 отведениях, эхокардиография, холтеровское монито-рирование ЭКГ; рентгенография черепа, электроэнцефалография, эхоэнцефало-графия выполнялись по показаниям. Ни у одного ребенка на момент обследования не было клинических или лабораторных признаков течения острого инфекционного процесса. Кроме того, отсутствовали анамнестические данные о перенесенной в течение двух недель инфекции.
к HSV 1,2 типов, CMV, IgM и IgG к ядерному антигену EBNA, IgG HHV6. Все исследования были поставлены в дублях. Диагностические значения оптической плотности для HSV 1,2: IgM — 0,3 o.e., IgG — 0,11 o.e., (низкие показатели IgG менее 0,90 o.e., высокие более 0,90 o.e.) для CMV: IgM — 0,45 o.e., IgG — 0,15 o.e. (низкие показатели IgG менее 1,10 o.e., высокие более 1,10 o.e.); для EBV: IgM — 0,25 o.e., IgG — 0,18 o.e. (низкие показатели IgG менее 1,25 o.e., высокие более 1,25 o.e.); IgG для HHV6 — 0,28 o.e. (низкие показатели IgG менее 1,45 o.e., высокие более 1,45 o.e.).
Об инфицированное™ судили на основании выявления специфических IgM, IgG антител.
Результаты и обсуждение. Проведенные исследования показали, что у всех 45 детей с НРСиП в сыворотке крови определялись специфические АТ хотя бы к одному из типов вирусов семейства герпеса. Таким образом выявлена 100% инфицированность герпес-вирусами пациентов с аритмиями. Инфицированность HSV1,2 типов оказалась наименьшей и составила 44,4% (20) обследованных пациентов (табл. 1). Ни у одного ребенка значения IgM не превысили диагностические. У подавляющего большинства детей отмечены высокие значения специфических анти-HSV 1,2 IgG АТ. С возрастом частота инфицирован-ности увеличивалась вдвое.
Характер инфицированное™ герпес-вирусами детей с нарушением ритма сердца и проводимости
Класс Тип вируса
HSV1,2 CMV EBV HHV-6
IgM — 1(1,2%) — не обсл.
IgM IgG — 3 (6,6%) 5(11,1%) не обсл.
IgG низкое 1 (2,2%) 7(15,6%) 6(13,3%) 25 (55,6%)
IgG высокое 19(42,2%) 16(35,6%:) 33 (73,3%) 18(40,0%)
Всего (л = 45) 20(44,4%) 27 (60,0%) 44 (97,8%) 43 (95,6%)
Специфические АТ к СМУ выявлены у 60% обследованных пациентов (табл. 1). Текущая СМУ инфекция в виде острой или активации персиситиру-ющей диагностирована у 4 детей. Маркеры вероятного персисгирования инфекции в виде высоких показателей специфических анти-СМУ антител выявлялись в 2 раза чаще, чем маркеры латенции СМУ — низкие специфические антитела. Отмечено нарастание в 2 раза инфицирования СМУ детей в группах от 3 до 7—10 лет.
Большинство обследованных пациентов с аритмиями инфицированы ЕВУ и ННУ6. Диагностические значения специфических АТ к Эпштейн-Барр-вирусу обнаружены у 97,8% обследованных детей (табл. 1). Первичная инфицированность ЕВУ не была выявлена ни у одного ребенка. У 5 (11,1%) детей старше
7 лет отмечена активация персистирующей инфекции. Низкие показатели спе-
пифических АТ к EBV определены у 6 (13,3%) детей. В 5 раз чаще обнаруживались признаки персистирующей EBV инфекции с высокой продукцией IgG. Уровень инфицированности EBV не зависел от возраста, достигая к 3 годам 90%. Выявлены отличия спектра инфицированное™ герпес-вирусами у пациентов с различными видами аритмий (табл. 1). Чаще регистрировались низкие показатели IgG — у 25 (55.6%) детей. В возрастном аспекте разница в степени инфицированное™ HHV6 не отмечена.
Выраженность иммунного ответа при инфицированное™ HSV1,2 отчетливо нарастала с возрастом, что проявлялось в повышении уровня специфических IgG АТ у детей от 3—6 до 11—15 лет (табл. 2).
Выраженность иммунного ответа в различных возрастных группах детей с НРС и П при инфицированности вирусами семейства герпеса
Вирусы Значения оптической плотности (o.e.)
Диагн. значен. IgG Возраст (лет) Средн. ±т
3-6 (п = 8) 7-10 (п = 15) 11-15 (п = 22)
HSV1.2 0.11 1.8 ±0.52 2.1 ±0.59 2.45 + 0.11 2.3 ±0.32
CMV 0.15 1.45 ± 1.25 1.8 + 0.77 1.67 ±0.76 1.72 ± 0.78
EBV 0.18 1.95 + 0.72 2.0 ±0.71 2.25 ±0.39 2.1 ±0.53
HHV6 0.28 1.35 ±0.86 1.23 ±0.81 1.45 ±0.70 1.31 ±0.75
Напряженность иммунного ответа при инфицированности CMV, EBV и HHV6 с возрастом не менялась. При сопоставлении средних значений оптаче-ской плотности АТ класса IgG к различным типам герпес-вирусов максимальный ответ, с учетом показателей диагностических значений IgG, получен при инфицированности HSV1,2, а минимальный — при HHV6. Низкие показатели АТ класса IgG наиболее часто выявлялись к HHV6 (58%), в два раза реже кСМУ (26%), в четыре раза к EBV (14%), в десять раз реже к HSV 1,2 типов (5%). Такое соотаошение специфических показателей АТ класса IgG и величин их оптической плотности может отражать очередность инфицирования вирусами группы герпеса (более раннее инфицирование HHV6, затем присоединение CMV и EBV, и лишь последним — HSV1,2 тапов). С другой стороны, уровень вырабатываемых АТ может зависеть от свойств самого вируса и от степени скомпрометированное™ иммунного ответа действием предшествующих вирусов [5,6].
Анализ спектра инфицированности детей с НРСи П-вирусами семейства герпеса показал, что 98% детей данной группы инфицированы одновременно двумя и более вирусами герпеса. Лишь у одного ребенка 6 лет выявлена моноинфекция (HHV6). Четверть детей с аритмиями инфицирована двумя вирусами герпеса. У 82% пациентов имеет место сочетание EBV и HHV6. В 2 раза чаще определяется инфицированность детей с НРСиП одновременно тремя вирусами герпеса, причем у 86% пациентов это сочетание представлено EBV, HHV6 и CMV вирусами. Одновременное присутствие в сыворотке АТ к четырем ти-
пам вирусов герпетической группы выявлено у 26.6%. В данной группе значительно преобладают (67%) дети от 11 до 15 лет.
В группе детей с СССУ 1,11 и ЭС инфицированность вирусом простого герпеса составила 66,5% и 46,0% соответственно, в отличие от детей с тахиаритмиями, где инфицированность HSV1,2 была статистически достоверно ниже и составила 16,7% (р Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
[10] Е.Г. Еникеева. Роль герпетической инфекции в развитие аллергических заболеваний // Автореферат. к.м.н. Уфа, 2004. — 25 с.
MARKERS OF HERPES VIRUS INFECTION IN CHILDREN WITH CARDIAC ARRYTHMIAS
M.G. Kantemirova, J.V. Lutsenko,
G.F. Ibragimova, O.A. Korovina
Department of Pediatry RPFU M-Maklaya St., 8, Moscow, 117198, Medical faculty
Okrugnoypassage, 30a, Moscow, 105187
Morozovsky Children’s Municipal Clinical Hospital 4-th Dobrinensky lane, 1, Moscow, 119049
Specific herpes virus IgM, IgG antibodies were detected in blood serum of 45 children with cardiac arrhythmias. All children were infected by herpes viruses. Mixtinfection was revealed in 98% with predominance of latent course and non-active persistence of herpes viruses. The most often EBV and HHV6 IgG were found out, more rare — HSV1,2 IgG. The level of immune response was maximum in HSV1,2 and minimal — inHHV6. HSV1,2 infection was detected significantly often in children with sinus node weakness syndrome (SNWS) and extrasystole (ES) as compared with heterotopic tachycardias (HT). The higher level of HHV6 IgG was more characteristic for patients with HT than with SNWS and ES. Significant level of mixt herpes virus infection in children with arrhythmias can be one of the factors in development of immunological mediated dysfunction of myocardial conduction and electric myocardial instability.
Читайте также:


