Лавомакс при папилломах отзывы
Пятигорский научно-исследовательский институт курортологии
Актуальность. Вирусные инфекции гениталий – одна из актуальных проблем современного акушерства и гинекологии. Нередко именно наличие вирусных инфекций обуславливают развитие многих патологических процессов шейки матки [4,8,12-14]. Так, папилломавирусная инфекция провоцирует формирование йоднегативных очагов, гиперкератозов шейки матки [4,12]. Вирус-индуцированные патологические процессы шейки матки диктуют необходимость коррекции вирусоносительства или остро протекающих вирусных поражений слизистой шейки матки и влагалища, и в то же время не теряет актуальности применение деструктивных методов лечения патологических процессов шейки матки [2,9].
В настоящее время в терапии папилломавирусной инфекции нередко применяют иммуностимулирующий препарат изопринозин. Однако при его длительном применении обращается внимание исследователей на ряд возникающих побочных эффектов, отягощающих состояние больных [6,7,10]. Нередко применяют другие иммуномодуляторы и противовирусные препараты [5,11]. Эти аспекты определяют необходимость поиска других терапевтических подходов к лечению пациенток данной категории.
Цель исследования. Разработать эффективные методы терапии пациенток с выявленной папилломавирусной и другими вирусными инфекциями.
Материалы и методы. Наблюдались 78 пациенток с вирус-индуцированными патологическими процессами шейки матки (ШМ). Больные были разделены в две группы в зависимости от получаемого лечебного комплекса. Лечение проводилось в два этапа. На первом этапе женщины получали противовирусное лечение. Так, в первой группе наблюдения (42 человека) назначался изопринозин курсами по 10 дней в дозировке по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), перерывы между курсами приема препарата составляли 1 мес. Во второй группе (36 пациенток) назначался изоприназин по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), курс лечения - 10 дней; всего – 1 курс лечения, в сочетании с приемом препарата лавомакс (тилорон) по 125 мг 2 дня подряд, затем по 125 мг через день, на курс – 20 табл. Количество курсов приема изопринозина и лавомакса определялось нами при обследовании после каждого проведенного курса терапии. Критерием необходимости прекращения или продолжения приема препаратов были показатели полимеразной цепной реакции (ПЦР) и наличие сохраняющейся вирусной инфекции. На втором этапе лечения всем пациенткам проводилось радиоволновое хирургическое воздействие на ШМ.
Всем женщинам оценивались жалобы, проводилось гинекологическое исследование, микроскопия отделяемого из половых органов. Оценивалось состояние вагинального биоценоза по данным ПЦР-диагностики, проводимого для выявления трансмиссивных инфекций (ТСИ). При ПЦР оценивалось наличие хламидиоза, микоплазмоза, уреаплазмоза, вируса папилломы человека (ВПЧ) высокого риска, вируса Эпштейн-Бара (ВЭБ), герпеса, цитомегалловирусную инфекцию (ЦМВ), гарднерелез, трихомониаз, кандидоз до лечения, после каждого курса медикаментозной терапии и после окончания проводимого лечения [1]. До начала курсовой терапии по поводу выявленных при ПЦР-диагностике бактериальных инфекций всем пациенткам было проведено противовоспалительное лечение. Всем женщинам оценивалось состояние ШМ по данным кольпоскопии [3].
Результаты. Возраст женщин составлял в среднем 34,2±6,7 года. Все женщины предъявляли жалобы на выделения из половых путей, которые имели различные оттенки в отношении цветового диапазона – желтоватые, грязно-серые, молочно-белые, прозрачные или беловато-прозрачные. После проведения первого этапа курсового лечения у всех пациенток практически прекратились желтоватые или грязно-серые выделения из половых путей, отмечалось уменьшение слизисто-белых белей, а у части женщин бели подобного характера исчезли после курсового лечения, причем более заметно – во второй группе.
Боли при менструации, определяемые исходно у трети больных в каждой группе наблюдения, после обоих этапов курсового лечения уменьшались незначительно.
У женщин первой группы первый этап медикаментозного лечения был наиболее длительным. В большинстве случаев при приеме изопринозина у женщин наблюдались побочные эффекты: головные боли, боли в правом подреберье и верхних отделах эпигастрия, приступы тахикардии, выраженные боли в суставах и др. Первый курс приема изопринозина сопровождался подобными побочными эффектами только у части больных (табл. 1).
Таблица 1. Симптомы побочного действия курсового применения изопринозина
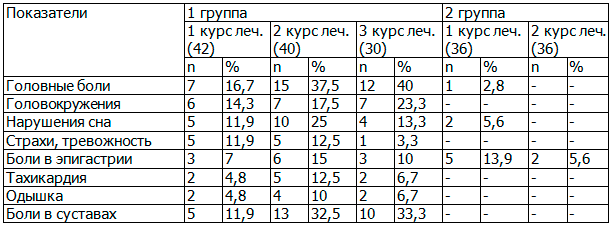
При приеме второго курса изопринозина патологические проявления усугублялись; две пациентки первой группы даже вынуждены были прервать второй курс приема изопринозина из-за нарастающей симптоматики побочных явлений. 10 пациенток первой группы в связи с плохо купируемыми побочными симптомами отказались от третьего курса приема изопринозина.
Во второй группе наблюдения на фоне приема изопринозина назначался лавомакс. При подобном сочетании препаратов у наблюдаемых нами больных побочные эффекты, характерные для приема изопринозина, отсутствовали полностью, что послужило поводом для рассмотрения вопроса о возможном сокращении курсов приема изопринозина.
Всем пациенткам после курсовой терапии проводилось гинекологическое исследование. Ни у одной женщины после первого медикаментозного этапа лечения не определялись воспалительные изменения тканей вульвы и влагалища. В то же время при осмотре ШМ в зеркалах у всех наблюдаемых пациенток во всех группах наблюдения после первого этапа проводимого лечения продолжали определяться патологические процессы ШМ по типу эрозий или белесоватых очагов по поверхности ШМ. После второго этапа лечения с использованием радиохирургического воздействия ни в одном случае наблюдения не было выявлено визуально определяемых признаков эрозий или белесоватых очагов по поверхности ШМ.
При оценке данных бактериоскопического исследования мазков влагалищного секрета IV и III степень чистоты влагалищных мазков после первого же этапа лечения не определялась ни у одной пациентки; II степень была у 9 женщин первой группы (21,5%), 7 – второй (16,7%). У остальных женщин уже после окончания первого этапа лечения определялась I степень чистоты влагалищных мазков. Эти же параметры сохранялись и после второго этапа курсовой терапии.
При ПЦР-диагностике до лечения выявлялся ряд бактериальных инфекций и во всех случаях наблюдения - вирусные инфекции. При обнаружении уреаплазмоза (у 46% женщин), гарднерелеза (у 37%), микоплазмоза (у 2,4% человек), хламидиоза (у 4,8%), кандидоза (у 58%) пациенткам до начала противовирусного лечения назначалось необходимое специфическое лечение. Затем назначалась противовирусная терапия.
После получения медикаментозной терапии и предварительного антибактериального лечения при ПЦР-диагностике случаи хламидиоза и микоплазмоза не были обнаружены. Значительно уменьшилась частота встречаемости уреаплазмоза, кандидоза, гарднерелеза.
После каждого курса медикаментозной терапии на первом этапе лечения оценивались данные ПЦР-диагностики в отношении вирусных инфекций. Обращало на себя внимание, что в первой группе наблюдения после приема первого курса изопринозина значительно уменьшилось содержание герпеса, снизились показатели цитомегалловирусной инфекции, ВПЧ высокого риска; почти не менялись значения данных по вирусу Эпштейн-Бара.
После второго курса приема изоприназина наблюдалось заметное снижение показателей при оценке уровня ВПЧ высокого риска и ЦМВ. После приема третьего курса изопринозина исследуемые вирусные инфекции у пациенток не выявлялись.
Во всех случаях наблюдения значительно снизился уровень показателей вирусных инфекций после всего этапа медикаментозной терапии у женщин первой группы.
Во второй группе наблюдения повторное проведение ПЦР-диагностики было выполнено после первого курса приема изопринозина в сочетании с первым курсом лавомакса. При ПЦР у пациенток второй группы были выявлены единичные случаи сохранившихся повышенных значений ВПЧ высокого риска, ЦМВ и ВЭБ; герпес не определялся ни в одном случае наблюдения (табл.2). В связи с этими изменениями, прием лавомакса был продолжен; все пациентки второй группы дополнительно получили еще 10 табл. лавомакса по 1 табл. через день; при этом повторный курс приема изопринозина не назначался.
Таблица 2. Уровни показателей трансмиссивных инфекций при ПЦР-диагностике
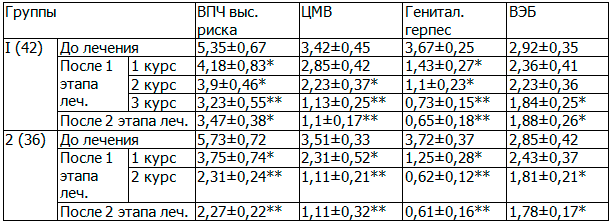
Примечания: показатели в сравнении с данными до лечения * - p
Группа вирусов ВПЧ входит в семейство папилломавирусов, которое включает 5 родов, порядка 43 разновидностей и почти 170 типов, именно ВПЧ является причиной образования бородавок. Существует его прямая взаимосвязь связь с раком шейки матки: в 92% случаев заболевания раком обнаруживается этот вирус.

Основные направления в исследовании — это определение вирусной нагрузки, то есть количественный показатель и определение типа вируса методом ПЦР.
По сути, папиллома — это доброкачественная опухоль, но она таит в себе и опасности. Во-первых, возможно повреждение ее целостности, приводящее к формированию рубцов, редко к заражению крови. Не рекомендуется удалять механически папилломы самостоятельно, это может привести к генерализации процесса и распространению папиллом по всему телу. Самая главная опасность папиллом заключается в том, что они вирусные. Большинство видов ВПЧ не представляют угрозу для здоровья и жизни человека, но ВПЧ 16 и 18 типа могут спровоцировать развитие злокачественных образований. Доброкачественные папилломы, как правило, доставляют много неприятностей человеку. Они могут увеличиваться до больших размеров, могут образовываться в области половых органов. Некоторые виды ВПЧ вызывают предраковые заболевания.
ВПЧ может передаваться различными путями. При контактно-бытовом способе передачи вирус через кожу при рукопожатиях и использовании средств личной гигиены, после примерки чужой одежды и нижнего белья, при посещении общественных бассейнов и саун. Особо опасным считается половой путь передачи вируса, так как при этом существует высокий риск заражения ВПЧ онкогенного типа. Вероятность передачи вируса половым путем намного выше, если у партнера есть остроконечные кондиломы. ВПЧ может передаваться от матери к ребенку во время родов, крайне редко это происходит во время беременности. При этом чаще всего у детей развивается папилломатоз гортани, опасный серьезными нарушениями дыхательной функции. Возможно заражение ребенка от матери при кормлении грудью.

Медикаментозное лечение вируса проводится с помощью лекарственных препаратов, которые воздействуют на причину заболевания, а также восстанавливают функцию иммунной системы. Существуют различные схемы внутривенного введения лекарств, врачи, как правило, назначают лечение индивидуально, стандартных схем нет. Какие препараты обычно назначают? Циклоферон, Интерферон альфа, Панавир, Ингарон. Таблетированные формы противовирусных препаратов: Изопринозин, Ликопид, Лавомакс, Алпизарин. Свечи: Генферон, Бетадин, Виферон. Мази: Оксолиновая мазь, San Fen Zhong мазь, Стефалин, Салициловая мазь. Витамины: Аевит, Алфавит.
Полностью избавиться от ВПЧ при современном уровне фармацевтической промышленности еще невозможно, но можно предупредить заражение инфекцией и для этого проводится вакцинация таким препаратом, как Гардасил. В некоторых странах эти прививки уже являются обязательными, в России сделать вакцинацию можно добровольно. При выборе такого способа профилактики ВПЧ необходимо пройти предварительное обследование на определение наличия вируса в организме. В состав вакцин входят синтетически модифицированные белки, сходные со структурой вируса. Введение в организм этих белков активизирует работу иммунной системы и приводит к выработке антител, защищающих от развития ВПЧ после проникновения возбудителя в организм. Разработчики вакцины советуют ставить препарат девочкам и мальчикам от 10 до 12 лет. Связано это с тем, что в этом возрасте половых контактов в подавляющем большинстве случаев нет, а иммунная система работает в полную силу, что способствует хорошей ответной реакции на препарат.
Самым опасным типом ВПЧ, вызывающий злокачественные образования считаются следующие: ВПЧ-16; ВПЧ-18; ВПЧ-31, 33, 45, 56, 58; ВПЧ-51, 59, 68; ВПЧ-35, 39, 52.
Наиболее часто рак шейки матки вызывается вирусом папилломы человека 16 и 18 типов, они же вызывают рак половых органов. ВПЧ 16 в 50% случае является причиной рака гортани.
ВПЧ передается половым путем, и при этом сами половые контакты становятся основной причиной заражения папиллома вирусом. Расскажем об этом подробнее.
Папилломы, расположенные на половом члене являются признаком папилломавирусной инфекции, следственно заражение половым путем вполне логично. Инкубационный период при ВПЧ длится от 1 до 12 месяцев. При этом сами папилломы могут совсем не вырастать, и только при снижении функции иммунной системы может произойти начало их образования. Поэтому обнаружение ВПЧ в организме на ранних стадиях развития заболевания возможно исключительно с помощью специальных анализов. В настоящее время, ВПЧ является одним из самых распространенных заболеваний и риск заражения партнера при незащищенном половом акте является практически 100%.
Все разновидности ВПЧ по степени риска возникновения злокачественного перерождения можно разделить на следующие: низкой степени риска, средней степени риска и высокой степени онкогенного (канцерогенного) риска.
Остроконечные кондиломы в области гениталий, как правило, не вызываются вирусом с высокой степень онкогенности. Плоскоклеточные папилломы являются злокачественными новообразованиями. Пациенты, у которых диагностируются плоскоклеточные папилломы находятся в группе повышенного риска и требуют незамедлительного лечения.
Если у пациента обнаружен ВПЧ онкогенной группы, для профилактики появления онкологических процессов в организме необходимо уделять внимание иммунной системе, регулярно сдавать анализы и наблюдаться у врача.

Если в организме женщины обнаружен ВПЧ, но при этом нет внешних проявлений в виде образования папиллом, то рожать можно спокойно и не волноваться. Если есть остроконечные кондиломы в области гениталий, то существует очень высокий риск заражения ребенка ВПЧ во время прохождения по родовым путям. Первый самостоятельный вдох ребенка может произойти прямо в родовых путях, вирус попав в горло малыша приводит к разрастанию папиллом на его голосовых складках. Поэтому при наличии генитальных папиллом и активной формы ВПЧ показано кесарево сечение.
По статистическим данным, в 85 % случаев ВПЧ после заражения устраняется организмом самостоятельно, благодаря хорошей работе иммунной системы. Этот процесс может длиться от нескольких месяцев до нескольких лет. Иногда пребывание вируса в организме человека можно не обнаружить даже при медицинском обследовании. Полностью подтвердить наличие ВПЧ можно при наличии образований на коже — папиллом.
- Избегать кожных повреждений и своевременно их лечить, так как даже микроскопические повреждения — это отличные возможности для инфекции попасть в организм.
- Поддерживайте чистоту тела и соблюдайте личную гигиену.
- Поддерживайте свою иммунную систему на должном уровне, регулярно принимайте витамины.
- Все препараты, направленные на повышение функции иммунной системы, необходимо принимать только по назначению врача.
- Если у вас на теле есть папилломы — обратитесь к врачу и удалите их.
Удалить папиллому можно медикаментозно. Но наиболее эффективным методом принято считать хирургическую методику, лазерную хирургию и электрохирургическое удаление. Обычный хирургический метод удаления применяется не часто, после него часто возникают рецидивы возникновения образований. Удаление с помощью лазера считается самым лучшим в мире, при этом удаление безболезненно и безопасно, не оставляет после себя шрамов и рубцов. Радиохирургическое удаление производят под местной анестезией, результат достаточно хороший и стойкий. 
Чаще всего папилломы локализуются в области подмышек и в паху, рядом с половыми органами. Нередко образования встречаются под молочными железами, на шее, веках.
Папилломатоз гортани — весьма тяжёлое заболевание, при котором нарушается голосообразование и дыхательная функция. В детском возрасте распознают симптомы заболевания в возрасте от одного до пяти лет. Если вы отмечаете хриплый голос у ребенка, кашель, затруднение дыхания или ощущение кома в горле, необходимо сразу показать его врачу.
Вирус папилломы человека является причиной развития цервикальной интраэпителиальной неоплазии, рака шейки матки и папилломатоза аногенитальной области. Известно, что наличие иммунодефицита при инфицировании вирусом папилломы человека часто сопровождается развитием бактериального вагиноза. Цель работы состояла в изучении эффективности использования препарата Лавомакс у пациенток с папилломавирусной инфекцией.
Было обследовано 235 женщин репродуктивного возраста, из которых 38 практически здоровых лиц были отнесены к I группе. Во II группе под наблюдением находились 104 пациентки с вирусом папилломы человека, из которых 54 вошли во IIА подгруппу, а 50 – во IIБ. Во IIБ подгруппе обследованные женщины получали Лавомакс. В III группе было 93 пациентки с вирусом папилломы человека и бактериальным вагинозом, из которых IIIА подгруппу составляли 46 женщин. Им назначали влагалищные свечи с метронидазолом 1 раз в сутки в течение недели. В IIIА подгруппе 47 женщинам применяли Лавомакс и Депантол интравагинально по 1 свече 2 раза в сутки также в течение недели. Было установлено, что использование препарата Лавомакс улучшает элиминацию вируса папилломы человека не только у пациенток с нормальным пейзажем влагалища, но и способствует эффективной санации влагалища, восстановлению морфофункциональных свойств вагинального и цервикального эпителия в комбинации с Депантолом у женщин с вирусом папилломы человека и бактериальным вагинозом.
Ключевые слова: папилломавирус человека, иммунотропная терапия, бактериальный вагиноз, Лавомакс, Депантол.
Вирус папилломы человека (ВПЧ) является основным этиологическим фактором возникновения рака шейки матки, а также ряда других онкологических заболеваний аногенитальной и орофарингеальной области. Более 80,0% женщин репродуктивного возраста инфицировано ВПЧ [1, 3]. Хотя большинство случаев папилломавирусной инфекции сопровождается спонтанной элиминацией вируса, доказано, что эта инфекция приводит к цервикальной интраэпителиальной неоплазии (CIN) или к остроконечным кондиломам. Традиционно ВПЧ-инфекцию принято связывать с иммунодефицитом. Достаточно часто наличие ВПЧ сочетается с бактериальным вагинозом (БВ), другими инфекциями, передающимися половым путем [4].
Существует значительное количество штаммов ВПЧ, которые подразделяют на онкогенные и неонкогенные. В организме человека ВПЧ поражает слизистую или кожу половых органов, существуя в интрасомальной или эписомальной форме. Первая является злокачественной и проявляется CIN и раком шейки матки, а вторая – доброкачественной и приводит к остроконечным кондиломам. Иммунная система играет основную роль в процессах борьбы с ВПЧ. При этом угнетено как клеточное, так и гуморальное звено иммунитета. Низкое соотношение эффекторных и регуляторных Т-клеток, инфильтрирующих ткань опухоли, является плохим прогностическим признаком, определяющим быстрое прогрессирование заболевания. У пациенток, инфицированных ВПЧ, под влиянием вирусных антигенов отмечено преобладание регуляторных Т-клеток и низкий уровень интерлейкина (ИЛ)-10. Было также установлено, что активность пула Т-лимфоцитов на фоне ВПЧ снижена [1]. Т-лимфоциты распознают Е6 и Е7 антигены ВПЧ, что обеспечивает иммунологическую толерантность к опухолевым клеткам [3]. Это дает возможность надеяться на поиск путей к преодолению подобных механизмов для создания эффективных препаратов против рака шейки матки. На сегодняшний день разрабатываются подходы к использованию антител к цитотоксическому Т-лимфоцитарному антигену 4 и протеинам, программирующим гибель клетки [12]. Также изучен аутологичный или аллогенный перенос антиген-нагруженных дендритных клеток или антиген-специфических активированных Т-лимфоцитов у больных раком [3]. Известно, что подавление активности В-лимфоцитов может повысить эффективность противоопухолевой вакцины, ингибировать рост солидных опухолей и препятствовать росту регуляторного пула Т-клеток в экспериментальных моделях опухоли мышей [1]. Таким образом, существующие представления позволяют надеяться на активацию процессов киллинга раковых клеток благодаря подавлению механизмов иммунной толерантности и запуска процессов запрограммированной гибели и элиминации клеток.
Тилорон является хорошо известным индуктором синтеза интерферона с противораковой активностью. Его эффективность давно и хорошо изучена не только при банальных острых респрираторных заболеваниях, но и при вирусных гепатитах, лихорадке Эбола [6]. Известны также антипролиферативные свойства тилорона, что обосновывает его использование при папилломатозе гортани, легочном фиброзе [7, 10]. Существуют экспериментальные доказательства эффективности применения тилорона при раке простаты [11]. Также установлено, что тилорон может быть использован как адъювант противораковых вакцин [9]. Можно полагать, что применение тилорона у больных ВПЧ-инфекцией способствует элиминации инфекции и препятствует процессам канцерогенеза. В Украине накоплен обширный опыт применения препарата Лавомакс, который хорошо зарекомендовал себя в профилактике и лечении вирусных инфекционных заболеваний.
Целью работы было изучение эффективности использования препарата Лавомакс у пациенток с ВПЧ-инфекцией.
Средний возраст участниц исследования в I, II и III группах соответственно составил 23,6 ± 2,5 года, 24,1 ± 3,6 и 23,8 ± 2,1 года (p > 0,05). Возрастной состав пациенток, принявших участие в исследовании, был практически однородным. Индекс массы тела также достоверно не отличался у всех женщин: 24,8 ± 3,8 кг/м 2 , 24,9 ± 2,6 и 25,0 ± 2,3 кг/м 2 в I, II и III группах соответственно (p > 0,05). Роды в анамнезе имели 23,7%, 27,9 и 29,0% контингента обследованных в I, II и III группах. Таким образом, выборка представленных в работе пациенток, была достаточно однородной и репрезентативной для когорты женщин репродуктивного возраста г. Харькова.
Статистическая обработка результатов работы была проведена с помощью пакета программ SPSS for Windows Release 19,0 (SPSS Inc. Chicago, Illinois, лицензия № 15G09207000A), адаптированных для медико-биологических исследований, методами параметрической статистики (среднее – M, ошибка – m). Было проведено изучение показателя относительного риска (ОР) с помощью программы MedCalc (MedCalc Software, Mariakerke, Belgium) v.9.6.4.0.
На фоне проведенного лечения было установлено, что элиминация ВПЧ через 1 год произошла у 68 (65,4%) лиц II группы. Отсутствие ВПЧ-инфекции было обнаружено во IIА подгруппе у 25 (46,3%) женщин, а во IIБ подгруппе – у 43 (86,0%). Это подтверждает существующие представления, что инфицирование ВПЧ вызывает иммунные нарушения, а назначение Лавомакса обеспечивает их устранение [7, 9]. В этой группе всем 63 пациенткам с кондиломами была проведена их физическая или химическая деструкция; из них 33 – были во IIА подгруппе и 30 женщин – во IIБ. Рецидивирование кондилом отмечено у 18 (54,5%) и 3 (10,0%) больных в тех же подгруппах соответственно. Можно считать, что использование Лавомакса значительно снижало вероятность рецидива эписомальной формы ВПЧ. По данным кольпоскопии и онкоцитологии, полное выздоровление произошло у 14 (25,9%) пациенток IIА подгруппы и у 41 (82,0%) – IIБ. Иными словами, элиминация ВПЧ-инфекции под влиянием препарата Лавомакс способствовала нормализации морфологических характеристик слизистой влагалища и шейки матки.
Значительные возможности санации пациенток с БВ на фоне ВПЧ-инфекции были обнаружены у лиц IIIБ подгруппы, получавших комплексное лечение с использованием препаратов Лавомакс и Депантол. Отсутствие ВПЧ-инфекции было обнаружено у 14 (30,4%) женщин IIIА подгруппы и у 35 (74,5%) – IIIБ. При этом санация влагалища была эффективной во всех случаях использования свечей Депантол. В IIIА подгруппе лечение не было эффективным у 12 (26,1%) обследованных. Поскольку у большинства пациенток с БВ на фоне ВПЧ (86 [91,5%]) доминирущими симбионтами влагалища были Gardnerella vagina lis и Atopobium vaginae, то можно предположить высокую эффективность Депантола в отношении этих микроорганизмов. Помимо этого, учитывая гидрофильные свойства декспантенола, можно допустить лучшее проникновение хлоргексидина в биопленку у пациенток с БВ [2, 5]. Содружественное электростатическое взаимодействие хлоргексидина и лактобацилл стимулировало восстановление микрофлоры влагалища [8]. Восстановление нормального микробного пейзажа влагалища способствовало улучшению процессов регенерации эпителия влагалища и шейки матки у 17 (36,9%) и 34 (72,3%) обследованных в IIIА и IIIБ подгруппах соответственно. Таким образом, комбинацию Лавомакса и Депантола можно считать эффективным методом лечения БВ и ВПЧ.
ВПЧ является достаточно хорошо изученным вирусом, нарушающим процессы пролиферации эпителия кожи и слизистых. Поскольку эта инфекция сопровождается сниженной реактивностью иммунокомпетентных клеток аногенитальной области, то иммуностимулирующее влияние Лавомакса логично приводило к активации процессов элиминации вирусов и восстановлению морфофункциональных свойств эпителия. БВ также ассоциирован с дефицитом иммунной защиты на поверхности слизистой влагалища и шейки матки. Поэтому санация влагалища также позитивно влияла на способность к борьбе с ВПЧ. Это способствовало исчезновению locus minori resistentiae (место наименьшего сопротивления) и выздоровлению пациенток.
Использование препарата Лавомакс не только способствует элиминации ВПЧ у женщин с нормальным пейзажем влагалища, но и в комбинации с Депантолом содействует эффективной санации влагалища, восстановлению морфофункциональных свойств вагинального и цервикального эпителиев у пациенток с ВПЧ и БВ.
1. Barros M. R. Jr, de Melo C. M.L., Barros M. L. et al. Activities of stromal and immune cells in HPV-related cancers. J Exp Clin Cancer Res. 2018. Vol. 5, No37 (1). P. 137.
2. Björklund S., Pham Q. D., Jensen L. B. et al. The effects of polar excipients transcutol and dexpanthenol on molecular mobility, permeability, and electrical impedance of the skin barrier. J Colloid Interface Sci. 2016. Vol. 479. P. 207-220.
3. Boccardo E., Lepique A. P., Villa L. L. The role of inflammation in HPV carcinogenesis. Carcinogenesis. 2010. Vol. 31. P. 1905-1912.
4. Bradshaw С. S., Tabrizi S. N., Fairley С. К. et al. The association of Atopobium vaginae and Gardnerella vaginalis with bacterial vaginosis and recurrence after oral metronidazole therapy. The Journal of infectious diseases. 2006. Vol. 194, No 6. P. 828-836.
5. Carati D., Zizza A., Guido M. et al. Safety, efficacy, and tolerability of differential treatment to prevent and treat vaginal dryness and vulvovaginitis in diabetic women. Clin Exp Obstet Gynecol. 2016. Vol. 43, No 2. P. 198-202.
6. Ekins S., Lingerfelt M. A., Comer J. E. et al. Efficacy of Tilorone Dihydrochloride against Ebola Virus Infection. Antimicrob Agents Chemother. 2018. Vol. 62, No 2. P. е01711-17.
7. Karimova F. S., Ivanchenko G. F., Grigorian S. S. et al. The treatment of laryngeal papillomatosis with interferon inducers. Vestn Otorinolaringol. 2000. Vol 5. P. 54-57.
8. Molteni B., D’Antuono A., Bandini P. et al. Efficacy and tolerability of a new chlorhexidine-based vaginal gel in vaginal infections. Curr Med Res Opin. 2004. Vol. 20, No 6. P. 849-853.
9. Potebnya G. P., Lisovenko G. S., Trokhimenko N. V. et al. Elevation of efficacy of cancer vaccine combined with interferon and inducer of endogeneous interferon synthesis amixin. Exp Oncol. 2008. Vol. 30, No 4. P. 319-323.
10. Vartiainen V., Raula J., Bimbo L. M. et al. Pulmonary administration of a dry powder formulation of the antifibrotic drug tilorone reduces silica-induced lung fibrosis in mice. Int J Pharm. 2018. Vol. 544, No 1. P. 121-128.
11. Wissing M. D., Dadon T., Kim E. et al. Small-molecule screening of PC3 prostate cancer cells identifies tilorone dihydrochloride to selectively inhibit cell growth based on cyclin-dependent kinase 5 expression. Oncol Rep. 2014. Vol. 32, No 1. P. 419-424.
12. Zhou D., Tuo W., Hu H. et al. Synthesis and activity evaluation of tilorone analogs as potential anticancer agents. Eur J Med Chem. 2013. Vol. 64. P. 432-441.
І. В. Лахно, В. І. Останіна, Е. В. Мілютін
Вірус папіломи людини є причиною розвитку цервікальної інтраепітеліальної неоплазії, раку шийки матки і папіломатоза аногенітальної ділянки. Відомо, що наявність імунодефіциту при інфікуванні вірусом папіломи людини часто супроводжується розвитком бактеріального вагінозу. Метою роботи було вивчення ефективності використання препарату Лавомакс у пацієнток з папіломавірусною інфекцією.
Було обстежено 235 жінок репродуктивного віку, з яких 38 практично здорових осіб було віднесено до I групи. У II групі під спостереженням перебувало 104 пацієнтки з вірусом папіломи людини, з яких 54 становили IIА підгрупу, а 50 – IIБ. У IIБ підгрупі обстежені жінки отримували Лавомакс. До III групи входило 93 пацієнтки з вірусом папіломи людини і бактеріальним вагінозом, з яких IIIА підгрупу становили 46 жінок. Їм призначали вагінальні свічки з метронідазолом 1 раз на добу протягом тижня. У IIIБ підгрупі 47 обстежених отримували Лавомакс і Депантол вагінально по 1 свічці 2 рази на добу також протягом тижня. Було встановлено, що використання препарату Лавомакс покращує елімінацію вірусу папіломи людини не тільки у пацієнток з нормальним пейзажем піхви, але і сприяє ефективній санації піхви, відновленню морфофункціональних властивостей вагінального і цервікального епітелію в комбінації з Депантолом у жінок з вірусом папіломи людини і бактеріальним вагінозом.
Ключові слова: папіломавірус людини, імунотропна терапія, бактеріальний вагіноз, Лавомакс. Депантол.
I. V. Lakhno, V. I. Ostanina, E. V. Milutin
Human papillomavirus is known as a cause of сervical intraepithelial neoplasia, cervical cancer, and papillomatosis in the anogenital area. It is known that the presence of an immune deficiency in papilloma viral infection is often accompanied by the development of bacterial vaginosis. The purpose of the work was to study the efficacy of Lavomax application in patients with Human papillomavirus infection. 235 women of reproductive age were examined and 38 of them were assigned to group I. In the II group 104 women with Human papillomavirus were examined and 54 of them were enrolled in IIA subgroup. 50 patients were included in IIB subgroup. The study population of IIB subgroup received Lavomax. In group III there were 93 patients with Human papillomavirus and bacterial vaginosis. There were 46 women in IIIA subgroup whom were prescribed vaginal suppositoria with metronidazole once per day for a week. Lavomax and Depantol were prescribed to the 47 patients of IIIB subgroup. It was found that the use of Lavomax medication improves the elimination of Human papillomavirus not only in patients with normal vaginal flora but also promotes to effective vaginal sanitation in women with Human papillomavirus and bacterial vaginosis restoring morphofunctional properties of vaginal and cervical epithelium in combination with Depantol.
Key words: human papillomavirus, immunomodulatory therapy, bacterial vaginosis, Lavomax, Depantol.
Читайте также:


