Конизация при генитальном герпесе

Герпес является распространенным заболеванием, передающимся половым путем (ЗППП), которым может заболеть любой человек, ведущий половую жизнь. У большинства людей с вирусом симптомы отсутствуют. Даже без признаков заболевания герпес по-прежнему может распространяться на сексуальных партнеров.
Ротовой герпес обычно вызван HSV-1 и может привести к простуде или герпетической лихорадке в ротовой полости или вокруг рта. Однако у большинства людей симптомы отсутствуют. Большинство людей с ротовым герпесом были инфицированы в детстве или молодом возрасте от несексуального контакта со слюной.
Ротовой герпес, вызванный HSV-1, может распространяться от полости рта до половых органов через оральный секс.(https://www.cdc.gov/std/healthcomm/stdfact-stdriskandoralsex.htm) Именно почему некоторые случаи генитального герпеса вызваны HSV-1.
Генитальный герпес в Соединенных Штатах Америки встречается часто. Более одного из шести человек в возрасте от 14 до 49 лет являются носителем генитального герпеса.
Вы можете заразиться генитальным герпесом во время вагинального, анального или орального полового контакта с кем-либо, кто болен этим заболеванием.
Если у вас нет герпеса, вы можете заразиться, когда вступаете в контакт с вирусом герпеса в/на:
- язве герпеса;
- слюне (если у вашего партнера есть ротовая инфекция герпеса) или генитальных выделениях (если у вашего партнера есть генитальная герпесная инфекция);
- коже в области рта, если у вашего партнера есть ротовая инфекция герпеса, или коже в области гениталий, если у вашего партнера есть генитальная герпесная инфекция.
Вы можете заразиться герпесом от сексуального партнера, у которого нет видимой язвы, или который может не знать, что он или она инфицирован. Также можно получить генитальный герпес, если вы занимаетесь оральным сексом с половым партнером, у которого есть ротовой герпес.
Вы не заразитесь герпесом от контакта с туалетными сидениями, постельными принадлежностями или плавательным бассейном или соприкосновения с окружающими вас предметами, такими как столовые приборы, мыло или полотенца. Если у вас остались вопросы о распространении герпеса, вы можете обсудить их с поставщиком медицинских услуг.
Единственный способ избежать ЗППП — не заниматься вагинальным, анальным или оральным сексом.
Если вы сексуально активны, то для снижения вероятности заражения генитальным герпесом:
- поддерживайте длительные взаимные моногамные отношения с партнером, не инфицированным ЗППП (т. е. тем, который прошел обследование и у которого результаты анализов на ЗППП отрицательные);
- правильно(https://www.cdc.gov/condomeffectiveness/male-condom-use.html) используйте латексные презервативы каждый раз, когда вы занимаетесь сексом.
Имейте в виду, что не все герпесные язвы возникают в областях, покрытых латексным презервативом. Кроме того, вирус герпеса может выделяться (высвобождаться) из областей кожи, на которых нет видимой герпесной язвы. По этим причинам презервативы не могут полностью защитить вас от заражения герпесом.
Если вы находитесь в отношениях с человеком, имеющим генитальный герпес, вы можете снизить риск заражения этим заболеванием, если:
- Ваш партнер принимает лекарство против герпеса каждый день. Это то, что ваш партнер должен обсудить со своим врачом.
- Вы избегаете вагинального, анального или орального секса, когда у вашего партнера наблюдаются симптомы герпеса (то есть, когда у вашего партнера вспышка заболевания).
Если вы беременны и являетесь носителем генитального герпеса, для вас очень важно посещать группы пренатального обследования. Сообщите своему врачу, если у вас когда-либо были симптомы генитального герпеса или был диагностирован генитальный герпес. Также сообщите своему врачу, были ли у вас контакты с лицом, зараженным генитальным герпесом. Существует ряд исследований, которые свидетельствуют о том, что генитальная инфекция герпеса может привести к выкидышу или преждевременным родам.
Инфекция герпеса может передаваться от вас вашему нерожденному ребенку до рождения, но чаще всего — во время родов. Это может привести к смертельно опасной инфекции у вашего ребенка (так называемому неонатальному герпесу). Важно, чтобы во время беременности вы избегали заражения герпесом. Если вы беременны и имеете генитальный герпес, вам может быть предложено лекарство против герпеса в конце вашей беременности. Это лекарство может снизить риск появления признаков или симптомов генитального герпеса во время родов. На момент родов ваш врач должен тщательно обследовать вас на наличие язв герпеса. Если на момент родов у вас присутствуют симптомы герпеса, то обычно делается кесарево сечение.
Большинство людей, страдающих генитальным герпесом, не имеют симптомов вообще или имеют незначительные симптомы. Вы можете не заметить слабо выраженные симптомы или можете принять их за другое кожное заболевание, такое как прыщ или вросший волос. Поэтому большинство людей, которые являются носителями герпеса, не знают об этом.
Люди, которые испытывают первоначальную вспышку герпеса, могут пережить повторные вспышки, особенно, если они инфицированы HSV-2. Рецидивы вспышек, как правило, короче и протекают менее тяжело, чем первая вспышка заболевания. Несмотря на то, что инфекция остается в организме на протяжении всей вашей жизни, количество вспышек в течение последующих лет может снизиться.
Вам следует обратиться к врачу, если вы заметили какой-либо из этих симптомов, или если у вашего партнера есть ЗППП или симптомы ЗППП. Симптомы ЗППП могут включать необычную язву, генитальные выделения с неприятным запахом, жжение при мочеиспускании или кровотечение в периоды между месячными.
Ваш лечащий врач может диагностировать генитальный герпес, просто посмотрев на ваши симптомы. Врачи могут также взять образец из язв(-ы) и провести его анализ. В ряде случаев может быть использован анализ крови для поиска антител к герпесу. Честно и открыто поговорите с вашим лечащим врачом и спросите его, нужно ли вам пройти обследование на герпес или другие ЗППП.
Примечание. Анализ крови на герпес может помочь определить, есть ли у вас инфекция герпеса. Он не покажет, кто заразил вас или как долго вы были инфицированы.
Какого-либо лечения герпеса не существует. Тем не менее, есть лекарственные средства, которые могут предотвратить или сократить вспышки заболевания. Одни из этих лекарственных средств против герпеса можно принимать ежедневно, что сделает менее вероятной передачу инфекции от вас вашему половому партнеру(-ам).
Генитальный герпес может привести к возникновению болезненных язв в области гениталий, а у людей с ослабленной иммунной системой он может быть тяжелым.
Если вы прикоснетесь к язвам или к жидкости из раны, вы можете перенести герпес на другую часть вашего тела, такую как ваши глаза. Чтобы избежать распространения герпеса на другую часть вашего тела, не прикасайтесь к язвам или к жидкости. Если вы прикоснулись к язвам или жидкости, чтобы избежать распространения инфекции немедленно тщательно вымойте руки.
Если вы являетесь носителем герпеса, вам следует поговорить со свои половым партнером(-ами) и сообщить ему или ей об этом, а также о связанных с этим рисках. Помочь снизить этот риск может использование презервативов, но оно не избавит от риска полностью. Наличие язв или других симптомов герпеса может увеличить риск распространения болезни. Даже если у вас нет никаких симптомов, вы все же можете заразить своих половых партнеров.
У вас могут быть сомнения по поводу того, как это повлияет на общее состояние их здоровья, половую жизнь и отношения. Лучше всего для вас — поговорить об этом с лечащим врачом, но также важно осознать, что, хотя герпес и невозможно излечить, ходом заболевания можно управлять с помощью лекарств. Ежедневная супрессивная терапия (т. е. ежедневное использование противовирусных препаратов) для герпеса также может снизить риск распространения генитального герпеса вашему сексуальному партнеру. Обязательно обсудите варианты лечения с вашим поставщиком медицинских услуг. Поскольку диагноз генитального герпеса может повлиять на ваше отношение к настоящим или будущим сексуальным взаимоотношениям, важно понять, как говорить с половыми партнерами о ЗППП.
Инфекция герпеса может привести к образованию язв, либо к повреждению кожи или слизистой оболочки рта, влагалища и прямой кишки. Это повышает риск проникновения ВИЧ в организм. Даже без видимых язв наличие генитального герпеса увеличивает количество CD4-клеток (клеток, которые использует ВИЧ для проникновения в организм), обнаруженных в слизистой оболочке половых органов. Когда человек заражен как ВИЧ, так и генитальным герпесом, вероятность того, что ВИЧ будет распространяться на ВИЧ-неинфицированного сексуального партнера во время полового контакта со своим партнером, влагалищем или прямой кишкой, будет выше.

Раком шейки матки в Эстонии заболевает в среднем каждая 67-я женщина, сказала врач-гинеколог Клиникума Тартуского университета Леэ Падрик.
ФОТО: Силле Аннук
Здоровье. Рак шейки матки поражает даже молодых женщин, и причина этого — раннее начало половой жизни и большое количество половых партнеров.
Как сказала гинеколог Клиникума Тартуского университета и член-учредитель Эстонского общества кольпоскопии Леэ Падрик, с каждым новым сексуальным партнером риск заразиться вирусом папилломы человека (англ. HPV), вызывающем рак шейки матки, повышается в десять раз, что, в свою очередь, увеличивает вероятность заболеть раком.
Чем больше половых партнеров, тем выше вероятность получить различные штаммы вируса. И хотя не все штаммы вируса вызывают рак, некоторые из них вызывают образование только бородавок или кондилом, насчитывается целых 20 типов с высоким онкогенным риском.
Как отметила Падрик, HPV — это вирусная инфекция, передаваемая половым путем, и, как правило, она не является врожденной.
Выросты телесного цвета на коже и слизистых оболочках, похожие на цветную капусту, или остроконечные кондиломы, вызываемые типами вируса 6 и 11, могут при родах с гениталий матери попасть в полость рта, глотку и на голосовые связки ребенка, но, по словам врача, это случается крайне редко.
У ребенка может развиться респираторный папилломатоз, требующий оперативного вмешательства, поскольку папилломы в дыхательных путях мешают нормальному дыханию. По словам Падрик, известны случаи внезапной смерти младенцев по этой причине.
Роль иммунной системы
Именно из-за этого механизма передачи HPV в случае сильно выраженных генитальных кондилом врачи могут принять решение в пользу кесарева сечения вместо естественных родов, но просто при наличии HPV кесарево сечение, по словам врача, не показано.
Чаще всего заражение вирусом папилломы человека происходит все же половым путем, и практически каждый человек, ведущий половую жизнь, хотя бы раз в жизни заражается этим вирусом. Иммунная система человека, как правило, сама справляется с ним, это происходит, как отметила гинеколог, в 90 процентах случаев.
Проблема в том, что, если тип вируса высокого онкогенного риска долго остается организме, может развиться предраковое состояние, и если его вовремя не обнаружить и не вылечить, может развиться рак шейки матки.
Падрик привела пример с молодой женщиной, у которой рак шейки матки обнаружили во время беременности, хотя за 2,5 года до этого ее ПАП-тест, или проба клеток с поверхности слизистой шейки матки, ничего не показала.
У той женщины оказалась агрессивная форма заболевания, которая развивается очень быстро, но которая, по словам врача, встречается крайне редко. Однако настораживает тот факт, что хотя за 1,5 года до постановки онкодиагноза, ПАП-тест показал незначительные изменения на шейке матки, и женщину попросили провериться через год, но она пришла на проверку на полгода позднее.
Обнаружение рака шейки матки во время беременности осложняет ситуацию. Приходится принимать решение: сделать кесарево сечение сразу или подождать, иначе ребенок окажется слишком недоношенным. Кроме того, сразу после кесарева сечения приходится удалять матку. Из-за очень злокачественной формы заболевания вероятность того, что мать доживет до того, как ребенку исполнится пять лет, очень невелика.
Выживаемость при первой стадии рака, когда метастазами не поражены соседние органы, составляет 90 процентов, это означает, что большинство пациентов продолжают жить спустя пять лет. По сказала Падрик, в этом случае считается, что человек излечился от рака, хотя не исключены случаи более позднего рецидива рака.
Если ПАП-тест показывает изменения, то в соответствии с рекомендациями по лечению, установленными в результате исследований, пациента следует осмотреть через год. По обычному сценарию, как сказала Падрик, через год изменения исчезают — организм сам справляется с заболеванием.
Если же ПАП-тест по-прежнему указывает на изменения, проводится обследование на предмет выяснения, в какой стадии находится дисплазия, то есть патологическое развитие клеток, и нуждается ли случай в дальнейшем наблюдении или же необходима конизация, то есть хирургическое удаление конусообразного куска шейки матки.
В случае с первой степенью дисплазии предракового состояния пациента приглашают на проверку уже через шесть месяцев, однако и в этом состоянии организм в состоянии выздороветь самостоятельно.
Лечение рака зависит также от формы и стадии заболевания. Это может быть хирургическое вмешательство, химиотерапия, лучевая терапия или их различные комбинации. Если метастазов нет, то, как сказал гинеколог, обычно хватает хирургического лечения. Однако рак шейки матки может распространиться на лимфатические узлы в области таза, и в таком случае их тоже нужно удалить.
Если женщина еще не рожала и у нее обнаруживают рак шейки матки первой стадии, то, как пояснила врач, можно сделать такую операцию, при которой удаляют только шейку матки, а саму матку сохраняют.
При сохранении матки женщина может рожать после выздоровления от рака, однако любое лечение предопухолевого состояния шейки матки, по словам Падрик, вызывает осложнения во время беременности, увеличивая до трех раз риск преждевременных родов и аборта.
Если шейка матки удалена полностью, то перед зачатием нужно сделать на шейке матки шов, который будет держать матку закрытой — в противном случае беременность просто прервется.
Важна профилактика
По сравнению с другими европейскими странами в Эстонии показатели заболеваемости и смертности от рака шейки матки очень высоки, поэтому, как считает Падрик, очень важно повышать эффективность профилактических мер на уровне государства. Это значит и расширение целевой группы проходящих обследование женщин, и включение вакцинации против вируса HPV в государственную программу иммунизации.
Ежегодно в Эстонии вакцинируются от вируса HPV около 7000 женщин разного возраста, поскольку государство не финансирует это, а вакцина стоит дорого. Самая дешевая доза, по словам Падрик, стоит около 54 евро, а для полной вакцинации нужны три дозы. Однако, как отметила доктор, вакцинация вместе с выборочным обследованием на ПАП-тест стоит примерно столько же, сколько одно только выборочное обследование по выявлению рака груди.
Кроме того, вирус HPV провоцирует некоторые виды рака горла и полости рта, число заболеваемости которыми в последнее время резко возросло. Специалисты считают, что и тут причина заключается в изменении сексуальных привычек, в данном случае — с увлечением оральным сексом, с которым связаны также рак языка и рак слизистой оболочки полости рта.
КОММЕНТАРИЙ
Маргус Цахкна
председатель социальной комиссии Рийгикогу
Вакцинацию против вируса HPV следовало бы ввести в государственную программу, и мы планируем осенью обсудить это в социальной комиссии. Следовало бы ежегодно вакцинировать 12-13-летних девочек. Я вижу проблему в финансировании, поскольку средства должны поступать из государственного бюджета.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье приведена тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и рассмотрена необходимость применения противовирусной терапии
Для цитирования. Зароченцева Н.В., Логутова Л.С., Джиджихия Л.К. Тактика ведения пациенток с цервикальными интраэпителиальными неоплазиями и необходимость применения противовирусной терапии // РМЖ. 2016. No 5. С. 305–311.
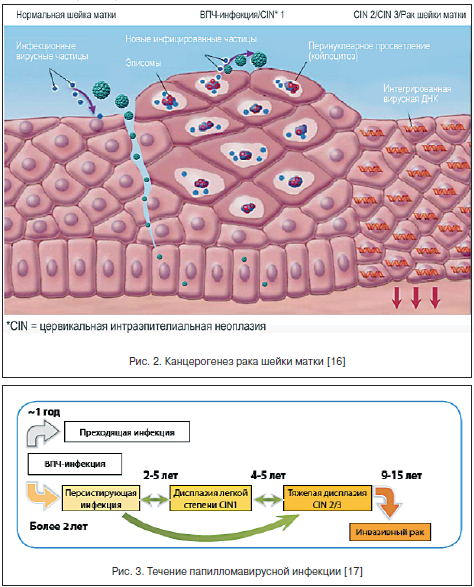
Поздние гены кодируют структурные белки вириона. Гены Е-6 и Е-7 всегда выявляются в опухолевых клетках, зараженных ВПЧ, в то время как другие фрагменты вирусного генома могут быть утеряны в процессе его длительной персистенции в организме.
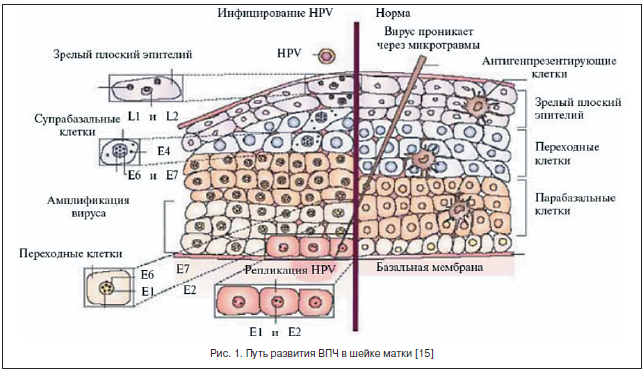
ВПЧ инфицирует пролиферирующие эпителиальные клетки базального слоя эпителия и отличается высоким тропизмом именно к этому типу клеток. Инфицирование многослойного плоского эпителия происходит через микроповреждения (механические, бактериальные и др.), когда глубина их достигает базального слоя, где и обнаруживается эписомальный вирусный геном (рис. 2). При этом репликация ДНК ВПЧ происходит только в клетках базального слоя, эти клетки являются постоянным источником инфицирования эпителиальных клеток, а в клетках других слоев вирусные частицы лишь персистируют.
Папилломатозные разрастания формируются в роговом слое в локусах максимальной репродукции вируса (рис. 3). В зараженных клетках вирусный геном может существовать в 2-х формах: эписомальной (вне хромосом) и интегрированной в клеточный геном [16, 17].
Репликация ДНК вируса и синтез связанных с ней капсидных белков изменяют клеточный цикл и приводят к клеточной атипии, что занимает от 1 до 3-х лет.
Пока вирус находится в эписомальном состоянии, наблюдаются доброкачественные процессы. После инфицирования ВПЧ в эпителиальных клетках нарушается нормальный процесс дифференцировки, особенно в клетках шиповатого слоя, в котором наблюдается клональная экспансия инфицированных ВПЧ-клеток базального слоя, прошедших только первичную стадию дифференцировки. Эта клональная экспансия связана с их трансформацией и последующей малигнизацией. В стадии развитой инфекции наблюдается синтез вирусной ДНК в клетках шиповатого слоя при переходе в зернистый слой. Причем экспрессия поздних генов L1 и L2 на этом этапе отсутствует. Она наступает только на конечной стадии дифференцировки, где и наблюдаются активная сборка зрелых вирусных частиц, их выделение из клеток и почкование прямо на поверхности при формировании кондилом. Именно эти участки инфекционно опасны в отношении контактного заражения.
Однако многие авторы приходят к выводу, что инфицирование эпителиальных клеток ВПЧ – необходимое, но недостаточное событие для ракового перерождения. Для формирования необратимой неоплазии дополнительно необходимы:
– активная экспрессия генов Е-6 и Е-7 вируса;
– индукция метаболических механизмов конверсии эстрадиола в 16,2-гидроксистерон (16,2-ОН);
– индукция множественных повреждений хромосомной ДНК в инфицированной клетке, которая завершает процесс перерождения.
Крайне неблагоприятна сочетанная персистенция ВПЧ с вирусом простого герпеса 2-го типа, цитомегаловирусом, вирусом Эпштейна – Барр, вирусом иммунодефицита человека, хламидиями и микоплазмами.
Развитие РШМ – не молниеносный процесс, он занимает 10–15 лет. Из всех факторов риска РШМ огромное значение имеет возраст сексуального дебюта. По данным D.R. Brown et al. (2005) [18], раннее начало половой жизни в сочетании с ВПЧ-инфекцией увеличивает риск РШМ в 22 раза. По результатам исследований F.X. Bosh et al. (2006) [19], 13% женщин с РШМ начали половую жизнь ранее 14 лет против 3,5% женщин с РШМ, имевших коитархе в возрасте 20 лет.
Несмотря на то что лица 15–19 лет составляют лишь 25% сексуально активного населения, более 50% сексуально-трансмиссивных заболеваний, в т. ч. ВПЧ, возникают именно в этой возрастной группе. ВПЧ-инфекция чаще встречается среди лиц 15–19 лет с кумулятивной частотой заболевания 17% в течение 1 года и 35,7% – в течение 3-х лет с момента коитархе.
По результатам нескольких современных эпидемиологических исследований изучена распространенность ВПЧ-инфекции в подростковой популяции. У лиц в возрастной группе от 13 до 21 года частота инфицирования равна 38,2%, причем пациентки 13–18 лет приблизительно в 2 раза чаще инфицированы ВПЧ, чем в возрасте 19–21 года [20].
Пути передачи и инфицирования ВПЧ
1. Половой путь. Инфицирование ВПЧ происходит при генитально- генитальном половом акте, мануально-генитальном и орально-генитальном контактах.
2. Вертикальный путь. Доказаны повышенная чувствительность эпителия шейки матки к ВПЧ в период беременности, а также возможность внутриутробного инфицирования плода и новорожденного.
3. Бытовой путь. Возможна передача вируса через нижнее белье, хирургические перчатки, хирургический инструментарий для биопсии и другие предметы, обсемененные ВПЧ. Медперсонал может инфицироваться ВПЧ во время лазерной деструкции генитальных бородавок, вдыхая образующийся дым.
Инкубационный период составляет 1–6 мес., максимальное содержание вируса в пораженных тканях обнаруживается на 6-й мес.
Частота передачи ВПЧ от матери к плоду, по данным разных исследователей, различается весьма существенно – от 4 до 87%. При этом ВПЧ в течение многих лет может персистировать в клетках слизистой оболочки рта ребенка и являться причиной участившегося в последнее время рецидивирующего респираторного папилломатоза гортани.
Течение ПВИ
Большинство случаев выявления ПВИ и характерные изменения, наблюдаемые при цитологическом исследовании, нередко разрешаются самостоятельно в течение 1 года (преходящая, или латентная, инфекция), не оставляя повреждений и присутствия ПВИ [16, 21–23].
При наличии ВПЧ в организме более 2-х лет развивается персистирующая инфекция, которая приводит к развитию CIN [24].
По мнению L.G. Koss (1987), патология шейки матки подобна айсбергу: лишь незначительная часть процессов находится на поверхности и может быть замечена глазом [25, 26]. Рутинный осмотр шейки матки в зеркалах далеко не всегда позволяет выявить наличие патологии. Принципы диагностики давно изучены и не представляют сложностей. Основными методами обследования являются цитологический метод (РАР-тест), расширенная кольпоскопия, проведение ВПЧ-тестирования (качественного и количественного), гистологическое исследование биоптата шейки матки и выскабливание цервикального канала шейки матки. Обследование на урогенитальную инфекцию (УГИ): микроскопия мазка, посев на условно-патогенную флору, ПЦР-диагностика ИППП также включены в перечень необходимых исследований при патологии шейки матки.
Тактика ведения женщин с CIN I в биоптате
CIN I характеризуется высоким уровнем спонтанной регрессии и низким уровнем прогрессии этих поражений. Алгоритм ведения пациенток с CIN I четко не определен. Ведение пациенток с CIN I требует активного наблюдения с использованием цитологического исследования и кольпоскопии, однако хирургическое лечение, как правило, можно не проводить в течение 1,5–2 лет ввиду возможной спонтанной регрессии у молодых женщин [36].
Существуют два тактических варианта, выбор одного из них основан на предпочтениях пациентки и врача:
1. Наблюдение CIN I с цитологическим контролем через 6 и 12 мес. или ВПЧ-тестированием через 12 мес. После 2-х последовательных отрицательных цитологических результатов или негативного ВПЧ-теста пациентка подлежит рутинному скринингу, в случае повторного результата цитологического исследования, соответствующего >ASC-US, или положительного ВПЧ-теста – направлению на кольпоскопию.
Проводятся лечение УГИ, бактериального вагиноза, обязательное восстановление микробиоценоза влагалища. Назначается Изопринозин по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней.
Лечение CIN I проводится с использованием методов аблации или эксцизии. Оба метода приемлемы при удовлетворительной кольпоскопии (ЗТ I или II типа).
2. В случае неудовлетворительной кольпоскопии (ЗТ III типа), при наличии поражения в эндоцервикальном образце и у женщин с рецидивом CIN рекомендуется диагностическая эксцизия.
Активное ведение пациенток с CIN I с применением аблации или эксцизии рекомендовано при:
– неудовлетворительных результатах кольпоскопии;
– обширном поражении;
– персистенции CIN I > 18 мес.;
– возрасте пациентки > 35 лет;
– нежелании женщины посещать врача регулярно.
Тактика ведения женщин с CIN II–III в биоптате
Поражения эпителия тяжелой степени (HSIL) сопровождаются значительным риском трансформации в РШМ, поэтому требуют активного лечения.
CIN II–III считаются предраковыми поражениями, они чаще персистируют и прогрессируют, чем регрессируют, и поэтому должны подвергаться лечению (исключение составляют CIN II–III у беременных и CIN II у юных женщин).
Предпочтение, безусловно, следует отдавать эксцизионным методам лечения (петлевая эксцизия или конизация), а не деструктивным, поскольку конизация позволяет, как уже упоминалось, получить биоматериал, пригодный для гистологического исследования, что гарантирует врачу объективные данные о стадии патологического процесса [37].
Эксцизия необходима при:
– большой площади поражения;
– несовпадении цитологического и кольпоскопического заключений;
– рецидиве заболевания;
– неудовлетворительной кольпоскопии (ЗТ III типа, когда поражение локализуется внутри цервикального канала и недоступно визуализации при кольпоскопии); лечение пациенток с CIN III проводят онкогинекологи.
Особенности тактики ведения CIN у девочек-подростков и юных женщин
У юных женщин с CIN I предпочтительна тактика наблюдения, только при наличии CIN III – лечение. Девочки-подростки и юные женщины с CIN I наблюдаются в течение 2-х лет с повторными цитологическими исследованиями через 12 и 24 мес. Кольпоскопическое исследование необходимо, если в мазке через 12 мес. >HSIL или через 24 мес. >ASC-US (атипичные изменения клеток плоского эпителия неясного значения).
Особенности ведения пациенток с CIN в постменопаузе
Наибольший уровень заболеваемости РШМ наблюдается у женщин старше 45 лет. В то же время диагностика заболевания шейки матки в постменопаузе может быть затруднена. Эстрогенная недостаточность приводит к развитию атрофии слизистой цервикса и втягиванию зоны стыка эпителия в эндоцервикс. До наступления менопаузы только 8% CIN находятся эндоцервикально, после менопаузы 48% CIN располагаются в цервикальном канале. Поэтому при кольпоскопическом выявлении ЗТ III и наличии аномального цитологического мазка необходимо проведение кюретажа эндоцервикса (тестирование на ВПЧ) и конизации шейки матки. При подозрении на поражение низкой степени CIN I необходимо проведение санации и гормонального лечения до повторного исследования. При получении аномального мазка высокой степени проводятся санация и кюретаж эндоцервикса, конизация. Рекомендуется применение Изопринозина по 2 таблетки 3 р./сут в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней или без перерыва курсом 30 дней.
Использование эстрогенной терапии – наиболее простой способ улучшить эффективность кольпоскопии. Эстрогены способствуют вывороту эндоцервикальной слизистой оболочки, расширению цервикального канала с образованием слизи, которая благодаря своей прозрачности улучшает визуализацию эндоцервикса. Маленькие дозы эстрогенов достаточны для коррекции атрофии, исчезновения небольших атипий CIN I–II, связанных с атрофией. Предварительная санация влагалища и местная гормональная терапия в течение 15 дней улучшают условия обследования женщин в постменопаузе и облегчают интерпретацию проведенного цитологического исследования мазков и кольпоскопического исследования.
Наблюдение после лечения CIN
Уровень остаточных поражений и рецидивов после лечения CIN составляет 5–15%, большинство из них обнаруживают в течение первых 2-х послеоперационных лет.
В период наблюдения после лечения используют те же методы, что и для диагностики перед лечением: цитологию, кольпоскопию и ВПЧ-тестирование. Чувствительность ВПЧ-теста в идентификации остаточных или рецидивных CIN II–III и прогностическая ценность его негативного результата превосходят аналогичные показатели цитологического исследования.
Отрицательный ВПЧ-тест через 6 мес. после лечения CIN II–III или 3 последовательных негативных цитологических результата, полученных с 6-месячным интервалом, позволяют перевести пациентку на ежегодное цитологическое исследование. При положительном ВПЧ-тесте или цитологии >ASC-US необходимо кольпоскопическое исследование.
Если CIN II–III присутствует в краях иссеченного конуса или в материале, полученном из оставшейся части канала сразу после эксцизии, необходимо цитологическое исследование с получением эндоцервикального образца через 4–6 мес., для женщин старшего возраста предпочтительна повторная процедура эксцизии. У женщин с гистологически верифицированной остаточной или рецидивной CIN II–III допустимы повторная процедура эксцизии или гистерэктомия.
Профилактика – вакцинация
Международная организация по исследованиям в области рака (IARC) определила, что ПВИ – вакциноуправляемая инфекция, а предотвращение заражения и персистенции ВПЧ однозначно можно считать профилактикой РШМ [6, 18, 20, 37, 38].
В настоящее время в мире и, в частности, в России зарегистрировано 2 вакцины против ВПЧ: бивалентная и квадривалентная.
Профилактическая вакцина зарегистрирована в 117 странах мира. Национальные программы ВПЧ-вакцинации рекомендованы в 60 странах, причем в 6 странах рекомендуется и вакцинация мальчиков.
Обе вакцины в установленном порядке зарегистрированы Министерством здравоохранения РФ, в 2007 г. в России вакцинация против РШМ одобрена правительством страны. ВОЗ рекомендует проведение массовой вакцинации от ВПЧ для первичной профилактики ВПЧ- ассоциированных раков.
Читайте также:


