Герпес и сердечная недостаточность
Прием антивирусных препаратов против герпеса в 10 раз снижает заболеваемость синдромом Альцгеймера. 80 процентов людей старше 40 имеют вирус герпеса и большинство не знают об этом.
Ученые уже секвенировали больше 5500 вирусов, которые могут заразить млекопитающих. Возможно в природе существует еще 320 000.
Эта группа вирусов включает вирусы простого герпеса, вирус ветряной оспы (который вызывает ветряную оспу и опоясывающий лишай), цитомегаловирус и вирус Эпштейна-Барра (который вызывает мононуклеоз). До 90 процентов взрослых были инфицированы вирусом Эпштейна-Барра.
CMV обычно лежит в состоянии покоя и безвреден в организме, но может вызвать инфекции, в том числе вирусную сердечную инфекцию. Вирусы распространяются при контакте с жидкостями организма инфицированного человека. Они также могут передаваться от беременной женщины к плоду во время беременности.
Рапамицин вызывает диабет у мышей. Значит причину диабета стоит искать в нашей иммунной системе. В вирусах?
Дальше будут описаны болезни и следующие вирусы, возможно их вызывающие:
Epstein–Barr virus (EBV), также называемый herpesvirus 4 (HHV-4)
Cytomegalovirus (CMV), также называемый herpesvirus 5 (HHV-5)
Varicella zoster virus (VZV), также называемый herpesvirus 3 (HHV-3)
Herpes simplex virus-1 (HSV-1)
Herpes simplex virus-2 (HSV-2)
Синдром Альцгеймера
СА — это сложное нейродегенативное заболевание ведущее к необратимой потери нейронов, интелектуальных способностей, памяти и способности к рассуждению.
Хроническое воспаление считается причиной хронических заболеваний, включая болезнь Альцгеймера
CMV присутствует в очень высокой доле пациентов с сосудистой деменцией в мозгах(Lin et al., 2002)
Наши находки показывают простой и прямой механизм посредством которого инфекции герпеса вызывают осаждение амилоида головного мозга в качестве защитного ответа в мозге, объясняет один из исследователей Рудольф Танзи из MassGeneral Institute for Neurodegenerative Disease (MIND).
Бета-амилоид в мозге специально обертывает частицы герпеса, чтобы предотвратить их распространение!
Основываясь на прошлых исследованиях, ученые выбрали герпес-симплекс 1 (HSV-1) и герпесвирус 6 (HHV-6) в качестве вероятных претендентов на связь с Альцгеймером — HSV-1 — это вирус, который, кстати, вызывает герпес.
Эксперименты не только показали, что вирусные инфекции приводят к большему количеству отложений бета-амилоида, мышам, разведенным с человекоподобным Aβ, лучше удалось отбить повреждение HSV-1, предполагая, что эти белки (амилоид) действительно являются своего рода мерой контратаки.
Также это соответствует с исследованиями, опубликованными всего несколько недель назад, показавшими более высокие уровни вирусов герпеса в мозгах людей, умерших от болезни Альцгеймера.
Сердечно-сосудистые заболевания
Вирус простого герпеса типа 1 (HSV-1) был признан потенциальным возбудителем сердечно-сосудистых заболеваний. Сообщается, что наличие антител к HSV-1 связано с увеличением риска инфаркта миокарда и ишемической болезни сердца
Предыдущие исследования показали, что люди, у которых был положительный результат теста на CMV подвергаются более высокому риску болезни сердца и это не зависит от других факторов риска.
Все больше доказательств того, что хроническая инфекция связана с атеросклерозом . Специфические организмы, включая герпесвирусы, усиливают атеросклероз у мыши с аполипопротеином E (ApoE)
Тридцать семь процентов исследованных (142 из 381) были CMV-сероположительными. У этих людей был более высокий индекс массы тела (1 кг / м2) и систолическое артериальное давление (3 мм рт. Ст.), но более низкий уровень холестерина ЛПНП (0,2 ммоль / л) при измерении по возрасту, полу, и диабету. Не было различий в значениях C-реактивного белка (CRP), уровней гемоглобина A1C (7%).
Пятьдесят восемь процентов исследованных (220 из 379) были HSV-положительными. У этих людей был более высокий индекс массы тела (2 кг / м2) и систолическое артериальное давление (4 мм рт. Ст. Выше), с поправкой на возраст, пол и диабет. В отличие от CMV, у тех, кто был серопозитивным для HSV, были достоверно выше значения C-реактивного белка.
Кальцификации коронарной артерии и CMV/HSV
CMV-положительные индивиды имели 1.5-кратное отношение шансов на наличие кальцификации по сравнению с серонегативной группой. Аналогичное незначительное соотношение наблюдалось между HSV-положительной серологией и кальцификации.
Результаты также показывают, что предыдущая инфекция CMV может быть связана с увеличением атеросклеротической нагрузки, что оценивается путем исследования кальцификации коронарной артерии. Напротив, не было статистически значимого независимого соотношения между HSV, H pylori, C pneumoniae и сосудистой дисфункцией.
Эти результаты дополняют работу с мышами с дефицитом ApoE, в которой мышиный гаммагерпревирус-682 и мышиный цитомегаловирус3 усиливают атерому, но не HSV-1. И согласуется с клиническими признаками того, что CMV, но не HSV-1, связан с атеросклерозом.
Диабет 2-го типа
Сахарный диабет типа 2 является метаболическим расстройством, характеризующимся высоким уровнем глюкозы в крови из-за недостаточности или резистентности к инсулину.
Исследователи рассмотрели более 500 человек в конце 80-х. Из тех, у кого был CMV, у 17% также был диабет типа 2. Среди тех, у кого никогда не было CMV, только у 8% был диабет.
Bот другое исследование
Среди 1 566 субъектов 206 (13,2%) имели диабет типа 2, а 1360 пациентов были недиабетическими. У пациентов в возрасте старше 65 лет артериальная гипертония и болезнь коронарных артерий чаще встречались у пациентов с диабетом, чем у контрольных (все P

Сердечная недостаточность связана со снижением функции сердца. Сердечная мышца не может выработать энергию, необходимую для прокачки необходимого количества крови по всему организму.
Только в России около 7 миллионов человек страдают сердечной недостаточностью. У людей старше 70 лет страдает каждый четвертый человек, причем мужчины, как правило, поражаются в значительно более молодом возрасте, чем женщины. Риск для мужчин примерно в полтора раза выше, чем для женщин. В России болезни системы кровообращения являются самой распространенной причиной смерти.
Что такое сердечная недостаточность?
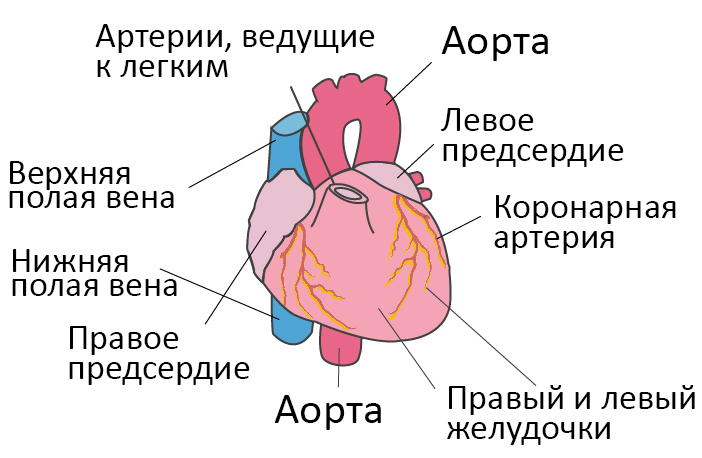
Со здоровым сердцем богатая кислородом кровь из левого желудочка перекачивается через тело к органам, обеспечивая их кислородом и питательными веществами. После снабжения органов кровь с низким содержанием кислорода возвращается из организма в правую часть сердца, откуда она транспортируется в легкие. В легких кровь обогащается кислородом, так что она снова может перекачиваться по всему телу через левый желудочек.
Сердечная недостаточность – это ослабление насосной функции сердца. Как правило, поражается либо правая сторона сердца (правосторонняя сердечная недостаточность), либо левая сторона сердца (левосторонняя сердечная недостаточность). При прогрессирующей сердечной недостаточности могут быть затронуты обе стороны сердца (глобальная сердечная недостаточность). Сердечная недостаточность также может быть хронической или острой по своей природе. Хроническая сердечная недостаточность встречается чаще острой сердечной недостаточности, которая возникает внезапно и неожиданно. Острая сердечная недостаточность может возникнуть внезапно на фоне острой сердечно-сосудистой катастрофы и/или декомпенсации сердечной недостаточности.
![]()
Что вызывает сердечную недостаточность?
Сердечная недостаточность вызвана болезнями, которые затрагивают или повреждают сердечную мышцу. Наиболее распространенной причиной хронической сердечной недостаточности является заболевание коронарной артерии.
Ишемическая болезнь сердца (ИБС) вызывается сужением коронарных сосудов (коронарных артерий), чаще всего из-за атеросклероза. Коронарные артерии – это сосуды, которые обеспечивают сердце кислородом и другими важными питательными веществами. Прогрессирующее сужение (также называемое стенозом) артерий приводит к нарушениям кровообращения сердечной мышцы. ИБС часто диагнастируется, когда присутствует стенокардия (боль и напряжение в груди), но в остальном она остается незамеченной.
Инфаркт происходит из-за уменьшения циркуляции крови, богатой кислородом, к сердечной мышце, что приводит к необратимой гибели ткани. Это повреждение влияет на насосную функцию сердца, приводя к сердечной недостаточности. Большая часть пациентов также страдает от высокого кровяного давления, что дополнительно усугубляет ситуацию.
Высокое кровяное давление (гипертония) является единственной причиной сердечной недостаточности у почти 20% людей, что делает его второй наиболее распространенной причиной этого заболевания. Высокое кровяное давление заставляет сердце постоянно работать сильнее. Сердце не может работать под дополнительной нагрузкой в течение длительного периода времени, и поэтому деградирует.
Подобный эффект может быть вызван проблемой с сердечным клапаном. При суженных или протекающих аортальных клапанах сердце должно работать сильнее или биться чаще, что также ведет к увеличению нагрузки.
Брадикардия – нарушения сердечного ритма при котором снижена частота сердечных сокращений также может быть причиной сердечной недостаточности, поскольку циркулирует слишком мало крови. Слишком быстрое сердцебиение (тахикардия) связано с уменьшением ударного объема и, следовательно, может также привести к сердечной недостаточности.
Наследственные заболевания сердца, беременность, аутоиммунные расстройства, алкоголь, наркотики или злоупотребление медикаментами, гиперактивность щитовидной железы и нарушения обмена веществ (сахарный диабет) могут быть причинами сердечной недостаточности.
Какие виды сердечной недостаточности и каковы их симптомы?
Сердечная недостаточность подразделяется на следующие виды:
Каждый тип сердечной недостаточности имеет разные симптомы, и симптомы могут различаться по интенсивности. Тем не менее, основным симптомом сердечной недостаточности является затруднение дыхания при физической нагрузке или в покое. Предупреждающие признаки могут включать потоотделение при легкой физической нагрузке, неспособность лежать ровно, стеснение в груди или наличие отечности ног.
Это чаще всего вызвано ишемической болезнью сердца (ИБС), высоким кровяным давлением или сердечным приступом и реже – нарушением сердечной мышцы или сердечных клапанов.
Левосторонняя сердечная недостаточность может проявляться остро или развиваться со временем. Обычно впервые замечают по одышке от физической активности. При тяжелом состоянии это может даже привести к гипотонии (низкому кровяному давлению) в состоянии покоя.
Правая сторона сердца отвечает за возврат крови с низким содержанием кислорода обратно в легкие. При правосторонней сердечной недостаточности правый желудочек не работает должным образом. Это вызывает повышенное давление в венах, вытесняя жидкость в окружающие ткани. Это приводит к отекам, особенно в ступнях, пальцах ног, лодыжках и голенях. Это также может привести к острой необходимости мочиться ночью, когда почки получают лучшее кровообращение.
Причиной чаще всего является острое или хроническое увеличение сопротивления легочного кровообращения. Обусловлено легочными заболеваниями, такими как легочная эмболия, астма, выраженная эмфизема, хроническое обструктивное заболевание легких (ХОЗЛ, чаще всего вследствие употребления табака) или левосторонней сердечной недостаточностью. Редкие причины включают проблемы с сердечным клапаном или заболевания сердечной мышцы.
Когда поражены как левая, так и правая стороны сердца, это называется глобальной сердечной недостаточностью. Присутствуют симптомы левой и правой сердечной недостаточности.
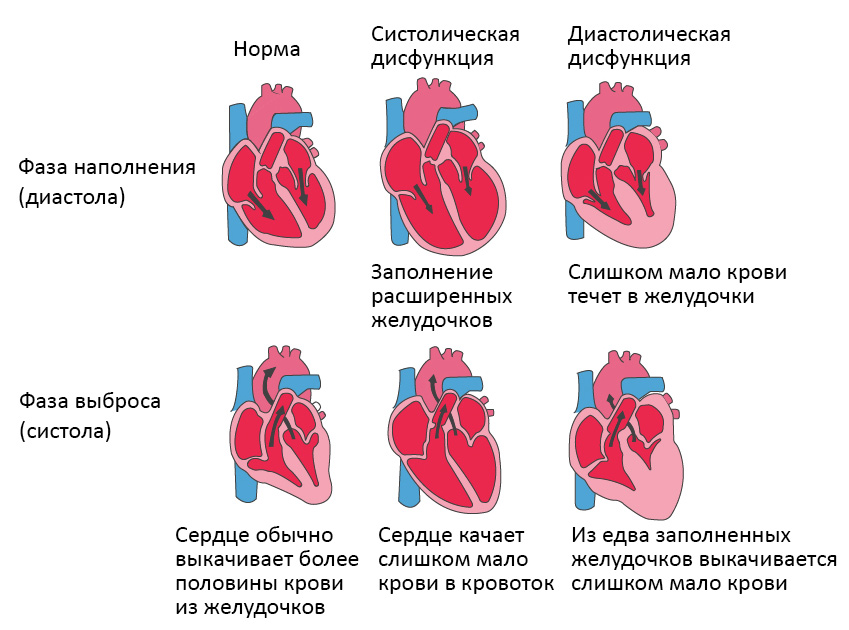
Систолическая сердечная недостаточность связана с потерей нормального функционирования клеток сердечной мышцы или внешних нарушений насосной функции. Кровь попадает в легкие, а органы не получают достаточного количества кислорода.
При диастолической сердечной недостаточности теряется эластичность желудочка, из-за чего он не расслабляется и не наполняется соответствующим образом. Одной из наиболее распространенных причин диастолической дисфункции является высокое кровяное давление. Из-за повышенного сопротивления в артериях сердце должно работать сильнее. Эластичность сердечной мышцы снижается, и между сокращениями из желудочков в организм может перекачиваться меньше крови. Это приводит к тому, что организм не получает достаточного количества крови и питательных веществ.
Болезнь клапана сердца также может привести к утолщению сердечной мышцы. Мускулатура сердца становится более жесткой и менее эластичной из-за накопления белков. Симптомы от кашля до одышки.
Хроническая сердечная недостаточность – это прогрессирующее заболевание, которое развивается месяцами или годами и встречается чаще, чем острая сердечная недостаточность. При хронической сердечной недостаточности симптомы часто не воспринимаются всерьез, поскольку организм способен компенсировать это в течение длительного периода времени или симптомы связывают с увеличением возраста. Симптомы отражают либо левую, либо правостороннюю сердечную недостаточность.
Острая сердечная недостаточность возникает внезапно, через несколько минут или часов, после сердечного приступа, когда организм больше не может это компенсировать. Некоторые симптомы включают в себя:
- Сильные затруднения дыхания и / или кашля;
- Булькающий звук при дыхании;
- Нарушение сердечного ритма;
- Бледность;
- Холодный пот.
На какие классы делится сердечная недостаточность?
Существует несколько классификаций сердечной недостаточности:
- Классификация по В. Х. Василенко, Н. Д. Стражеско, Г. Ф. Ланга;
- Классификация острой сердечной недостаточности по шкале Killip;
- И самая распространенная, классификация Нью-Йоркской кардиологической ассоциации.
Согласно функциональной классификации Нью-Йоркской кардиологической ассоциации (NYHA), сердечная недостаточность подразделяется на классы I-IV в зависимости от выраженности симптомов и ограничения физической активности.
Сердечная недостаточность делится на четыре класса в зависимости от выраженности симптомов:
- NYHA I: болезнь сердца без каких-либо ограничений физической активности. Нормальная активность не вызывает повышенного утомления, сердцебиения или затруднения дыхания.
- NYHA II: болезнь сердца, вызывающая умеренное ограничение в повседневной деятельности. Никаких симптомов в состоянии покоя.
- NYHA III: болезнь сердца, вызывающая заметное ограничение в повседневной деятельности. Простые действия, такие как чистка зубов, прием пищи или разговор, вызывают утомление, сердцебиение или затруднение дыхания. Симптомов в покое нет.
- NYHA IV: сердечные заболевания, вызывающие симптомы в состоянии покоя (и при любой степени легкой физической активности).
Сердечная недостаточность значительно снижает качество жизни. Больные часто испытывают большое разочарование в связи с физическими ограничениями и имеют тенденцию уходить из общественной жизни. По этой причине психологические расстройства, такие как депрессия, часто присутствуют в дополнение к ожидаемым физическим симптомам.
Как диагностируется сердечная недостаточность?
Диагностика начинается с комплексной оценки истории болезни человека, уделяя особое внимание симптомам (начало, продолжительность, проявление). Это помогает классифицировать тяжесть симптома. Сердце и легкие обследуются. Если есть подозрение на сердечный приступ или нарушение ритма, выполняется ЭКГ покоя с 12 отведениями. Кроме того, эхокардиография и общий анализ крови. Необходимость в катетеризации определяется индивидуально.
Как лечится сердечная недостаточность?
При хронической сердечной недостаточности применяются медикаменты (такие как ингибиторы АПФ, бета-блокаторы и диуретики). Лекарства используются для предотвращения осложнений и улучшения качества жизни. Ингибиторы АПФ и бета-блокаторы могут продлевать жизнь, но для достижения положительного эффекта их следует принимать регулярно.
Кроме того, используются ритм-терапии (для лечения нарушений ритма сердца), имплантация трехкамерного кардиостимулятора. Последнее обеспечивает своевременную активацию предсердий и обоих желудочков. Дефибриллятор также часто имплантируется как часть кардиостимулятора для противодействия опасным нарушениям сердечного ритма в условиях тяжелой сердечной недостаточности. Это лечение также известно как ресинхронизационная терапия. Важной частью успешного лечения является физиотерапия.
Каковы шансы на выздоровление от сердечной недостаточности?
Тябут Тамара Дмитриевна, профессор кафедры кардиологии и ревматологии Бел МАПО, доктор медицинских наук
Год здоровья. Прочитай и передай другому
Тонзиллит, вызванный бета-гемолитическим стрептококком.
При наличии хронического тонзиллита в лакунах скапливается большое количество гноя, состоящего из погибших микробов, белых кровяных телец - лейкоцитов, других клеток (гнойно-казеозные пробки). В гнойном содержимом лакун размножаются болезнетворные микробы. Продукты жизнедеятельности микробов из миндалин попадают в кровь и приводят к развитию тонзиллогенной интоксикация, проявляющейся утомляемостью, болями в мышцах и суставах, головными болями, снижением настроения, субфебрилитетом. Миндалины превращаются в хранилище инфекционных агентов, откуда они могут распространяться по организму и быть причиной воспалительных процессов. Частые болезни еще более ослабляют иммунитет, что приводит к дальнейшему развитию тонзиллита. Так формируется порочный круг заболевания.
Хронический тонзиллит опасен осложнениями, связанными с распространением инфекции по организму. К ним относятся паратонзиллярные абсцессы, ·поражение сердца (тонзилогенная миокардиодистрофия, острая ревматическая лихорадка), сосудов, почек.
Тонзиллогенная миокардиодистрофия относится к часто развивающимся, но гораздо реже диагностируемым поражениям сердечной мышцы при хроническим тонзиллите. Она вызывается токсинами бактерий, находящихся в миндалинах, и продуктами местного воспаления и распада тканей.
Клинические признаки тонзиллогенной дистрофии миокарда обусловлены нарушением деятельности вегетативной нервной системы (вегетативной дисфункцией) и нарушением различных видов обмена в сердечной мышце (электролитного, белкового), следствием которых является нарушение образования энергии в сердечной мышце. На ранних этапах развития тонзилогенная миокардиодистрофия проявляется высокой частотой сердечных сокращений - тахикардией, перебоями в работе сердца - экстрасистолией, одышкой при интенсивных физических нагрузках, нарушением общего самочувствия больных. При поздней диагностике появляются признаки сердечной недостаточности, уменьшается объем нагрузки, вызывающей одышку, появляются более тяжелые нарушения ритма и проводимости. При своевременной диагностике и лечении внесердечного фактора - хронического тонзиллита, вызвавшего перечисленные изменения в сердечной мышце, они обратимы и постепенно структура и функции сердечной мышцы
восстанавливаются.
Наибольшую опасность для прогноза и качества жизни пациентов представляет поражение сердца при острой ревматической лихорадке.
Острая ревматическая лихорадка (ОРЛ) - постинфекционное осложнение тонзиллита (ангины) или фарингита, вызванных бета - гемолитическим стрептококком группы А, в виде системного воспалительного заболевания соединительной ткани с преимущественной локализацией патологического процесса в сердечно-сосудистой системе (кардит), суставах (мигрирующий полиартрит), мозге (хорея) и коже (кольцевидная эритема, ревматические узелки), развивающегося у предрасположенных лиц, главным образом молодого возраста (7-15 лет). В Российской Федерации и в РБ заболеваемость ревматической лихорадкой составляет от 0,2 до 0,6 случаев на 1000 детского населения. Первичная заболеваемость ОРЛ в России в начале ХХI века составила 0,027 случая на 1000 населения. Частота впервые выявленной хронической ревматической болезни сердца (ХРБС), которая включает пороки сердца и специфические изменения клапанов (краевой фиброз), выявляемые при ультразвуковом исследовании сердца - 0,097случаев на 1000 населения, в том числе ревматических пороков сердца - 0,076 случаев на 1000 взрослого населения. Имеющиеся статистические различия между частотой первичной заболеваемости острой ревматической лихорадкой и хронической ревматической болезнью сердца свидетельствует о наличии большого количества не диагностированных острых форм болезни.
Временной интервал между перенесенным острым стрептококковым тонзиллитом, фарингитом, обострением хронического тонзиллита и возникновением проявлений острой ревматической лихорадки составляет 3-4 недели. При острой ревматической лихорадке могут поражаться все структуры сердца - эндокард, миокард, перикард. Поражение миокарда (мышцы сердца) встречается всегда. Проявлениями поражения сердца могут быть сердцебиение, одышка, связанная с физической нагрузкой или в покое, боли в области сердца ноющего характера, которые в отличие о стенокардии не имеют четкой связи с физической нагрузкой и могут сохраняться длительный период времени, сердцебиение, перебои в работе сердца, приступообразные нарушения ритма - мерцательная аритмия, трепетание предсердий. Обычно поражение сердца сочетается с суставным синдромом по типу артралгий - болей в крупных суставах (коленных, плечевых, голеностопных, локтевых) или артрита (воспаления) этих же суставов. Для воспаления суставов характерны боль, изменения формы сустава, вызванные отеком, покраснение кожи в области пораженного сустава, местное повышение температуры и нарушение функции сустава в виде ограничения объема движений. Мелкие суставы поражаются гораздо реже. Воспалительный процесс в суставах носит мигрирующий характер и быстро проходит на фоне правильного лечения. Поражение сердца и суставов обычно сопровождается повышением температуры тела, слабостью потливостью, нарушением трудоспособности. У части пациентов встречаются поражения нервной системы, кожные сыпи по типу кольцевидной эритемы и подкожные ревматические узелки.
Для постановки диагноза острой ревматической лихорадки существуют диагностические критерии, которые включают клинические, лабораторные и инструментальные данные, а также информацию о перенесенной инфекции, вызванной бета-гемолитическим стрептококком группы А, его ревматогенными штаммами. Своевременно поставленный диагноз позволяет добиться выздоровления больного при проведении терапии антибиотиками, глюкокортикоидными гормонами, нестероидным противовоспалительными препаратами. Однако, при поздно начатом лечении, несоблюдении пациентами двигательного режима, наличии генетической предрасположенности, не санированной очаговой инфекции (декомпенсированный тонзиллит, кариес) исходом острой ревматической лихорадки может быть хроническая ревматическая болезнь сердца с пороком сердца или без него. Порок сердца возникает как исход воспалительного поражения клапанов сердца. Наличие порока сердца ревматической этиологии требует отнесения пациента к группе высокого риска развития инфекционного эндокардита, наиболее тяжелой формы поражения сердца, связанного с инфекционными агентами.
Острая ревматическая лихорадка относится к заболевания, при которых профилактика имеет важное значение для снижения как первичной заболеваемости, так и повторных эпизодов болезни (повторная острая ревматическая лихорадка).
Первичная профилактика имеет своей целью снижение первичной заболеваемости и включает комплекс медико-санитарных и гигиенических мероприятий, а так же адекватное лечение инфекций, вызванных бета-гемолитическим стрептококком группы А. Первое направление включает мероприятия по закаливанию, знакомство с гигиеническими навыками, санацию хронических очагов инфекции, в первую очередь - хронического тонзиллита и кариеса. Миндалины тщательно санируют повторными полосканиями и промываниями растворами антибактериальных средств, вакуум-аспирацией патологического содержимого лакун. Если это не дает желаемого результата обсуждается вопрос хирургического лечения - удаления миндалин. В каждом конкретном случае выбор тактики лечения определяет врач отоларинголог и терапевт, кардиолог или ревматолог.
Адекватное лечение ангины и фарингита направлено на подавление роста и размножения стрептококка в организме при развитии стрептококкового фарингита, ангины, тонзиллита. Основу лечения составляет антибиотикотерапия в сочетании с противовоспалительными средствами, которые должны проводиться не менее 10 дней с обязательным контролем общего анализа крови, мочи, а по показаниям биохимического анализа крови при возникновении признаков болезни, при окончании лечения и через месяц от появления первых признаков болезни. Лабораторное исследование, проведенное в эти сроки, позволяет правильно поставить диагноз, определить эффективность лечения, и что самое главное, не пропустить начало развития осложнения в виде острой ревматической лихорадки.
Вторичная профилактика имеет своей целью предупреждение развития повторной острой ревматической лихорадки и прогрессирования заболевания у лиц, перенесших ОРЛ. Она проводится у пациентов, не имеющих аллергии к препаратам пенициллинового ряда. Лекарственным средством, используемым для профилактики у взрослых является бензатинбензилпенициллин (экстенциллин, ретарпен) в дозе 2 400 000 ЕД 1 раз в 3 недели внутримышечно. Профилактические режимы зависят от возраста пациента и исхода острой ревматической лихорадки. В соответствии с рекомендациями Ассоциации ревматологов России вторичная профилактика включает следующие режимы:
Наиболее тяжелым и прогностически неблагоприятным заболеванием сердца, связанным с инфекцией считается инфекционный эндокардит - заболевание, характеризующееся развитием воспалительного процесса на клапанном или пристеночном эндокарде, включающее поражение крупных внутригрудных сосудов, отходящих от сердца, возникающее вследствие воздействия микробной инфекции. Наиболее часто это различные бактерии- стрептококки, стафилококки, энтерококки, кишечная палочка, синегнойная палочка и многие другие. Описано 119 различных возбудителей, приводящих к развитию заболевания.
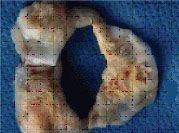
Аортальный клапан
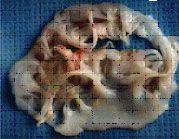
Митральный клапан
Так выглядят клапаны сердца при развитии инфекционного эндокардита.
Наложения из микробов, клеток крови нарушают их функцию,
разрушают клапан и зачастую требуют экстренного хирургического лечения.
Распространенность инфекционного эндокардита в начале 21 века составляла 2- 4 случая на 100 000 населения в год. Отмечается повсеместный рост заболеваемости, наиболее выраженный в старших возрастных группах и составляющий 14, 5 случая на 100 000 населения в возрасте 70-80 лет. Диагностика заболевания сложна. При первом обращении к врачу диагноз ставится только у 19 - 34,2% больных. Средний срок от первичного обращения до постановки диагноза составляет не менее 1,5 - 2 месяцев.
Выделяют группу больных с высоким риском развития инфекционного эндокардита, в которую входят:
- пациенты с ранее перенесенным инфекционным эндокардитом,
- пациенты с протезированными клапанами сердца,
- пациенты с синими врожденными пороками,
- пациенты после хирургических операций на аорте, легочных сосудах
- пациенты с приобретенными пороками сердца, в первую очередь ревматической этиологии (ХРБС).
Кроме этого выделена группа умеренного (промежуточного) риска, объединяющая пациентов со следующими заболеваниями:
- Пролапс митрального клапана, обусловленный миксоматозной дегенерацией или другими причинами с регургитацией 2-3 степени или пролапсы нескольких клапанов
- Нецианотичные врожденные пороки сердца (исключая вторичный ДМПП)
- Бикуспидальный (двухстворчатый)аортальный клапан
- Гипертрофическая кардиомиопатия (идиопатический гипертрофический субаортальный стеноз).
Установлено, что для развития инфекционного эндокардита необходимо попадание возбудителя в кровь. Наиболее частой причиной этого могут быть стоматологические манипуляции, сопровождающиеся повреждением десны и кровоточивостью. При наличии кариеса или заболеваний десен, бактериемия (наличие возбудителя в крови) может возникать достаточно часто.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Воспалительные поражения миокарда представляют собой гетерогенную группу заболеваний, различающихся как этиологией (вирусные, бактериальные, грибковые инфекции, протозойные инвазии игельминтозы, действие токсинов, физических ихимических факторов, аутоиммунные механизмы иреакции гиперчувствительности), так иуникальным для каждой фазы воспалительного процесса сочетанием патогенетических механизмов [1, 2].
Принято считать, что воспаление миокарда лежит в основе около 10% случаев сердечной недостаточности [3]. Истинную заболеваемость миокардитами оценить сложно мало- или бессимптомного течения заболевания в значительном числе случаев, однако минимальная клиническая манифестация острой фазы миокардита не исключает в последующем дилатации полостей сердца с развитием картины хронической сердечной недостаточности [4]. По результатам исследований, частота случаев миокардита колеблется в диапазоне от 0,12 до 12% [5].
В основе воспалительного процесса при миокарде чаще всего лежат вирусная инфекция и иммунные реакции [6, 7]. В качестве этиологического фактора при миокардите обычно указывают энтеровирусы, и прежде всего вирус Коксаки B3, однако в последние годы пристальное внимание стали уделять парвовирусу B19 и вирусам герпеса [8, 9]. Недавно была сформулирована концепция о фазовом течении миокардита, где отмечены три фазы — острая, подострая и хроническая — и выявлены ключевые механизмы патогенеза для каждой из фаз заболевания [4, 8].
Ключевым событием острой фазы вирусного миокардита является внедрение вирусной частицы, обладающей тропизмом к сократительному миокарду, в , что приводит к ее повреждению или гибели. Прямое цитопатогенное действие вируса является ведущим механизмом повреждения миокарда в острой фазе заболевания. Кроме того, включаются неспецифические механизмы противовирусной защиты, направленные на элиминацию инфицированных кардиомиоцитов и представленные естественными киллерными (natural killer — NK) и и макрофагами. Макрофаги служат источником провоспалительных цитокинов, а обеспечивают перфорин и лизис клеток сократительного миокарда. Продолжительность острой фазы вирусного миокардита составляет всего несколько дней, а выраженность клинических проявлений варьирует от бессимптомного до остро протекающего заболевания. Следует отметить, что эффективная элиминация инфекционного патогена благодаря включению механизмов иммунной защиты при остром течении заболевания обеспечивает благоприятный долговременный прогноз: 93% пациентов, переживших острую фазу заболевания, выживали в течение 11 лет, по сравнению с 45% больных с острым миокардитом [10].
Таким образом, острая фаза вирусного миокардита имеет следующие характеристики:
- высокий удельный вес цитопатогенного действия вирусов в повреждении миокарда;
- участие неспецифических механизмов противовирусной защиты, реализуемых макрофагами и ;
- реакция иммунной системы адекватна повреждающему фактору, нет признаков иммунопатологии;
- в основе гибели кардиомиоцитов лежат механизмы некроза.
В тех случаях, когда неспецифические механизмы противовирусной защиты не могут обеспечить элиминацию вирусного генома, заболевание переходит в подострую фазу, основным содержанием которой является включение механизмов специфической иммунной защиты. Активированные макрофаги и другие клетки иммунной системы посредством продукции хемокинов привлекают в очаг воспаления Т- и , которые, в свою очередь, реализуют механизмы цитолиза, а также обеспечивают выработку противовирусных антител. Специфические иммунные механизмы направлены как против вирусных частиц, так и против антигенов собственных клеток, обладающих сходством с вирусными детерминантами, либо ставших доступными для иммунной атаки вследствие попадания во внеклеточное пространство или усиления иммуногенности по причине изменения нативной антигенной структуры.
Массивная продукция провоспалительных цитокинов активированными макрофагами и эффекторными
запускает механизм апоптоза кардиомиоцитов, что усугубляет снижение сократимости миокарда.
Таким образом, подострая фаза вирусного миокардита имеет следующие характеристики:
- подострый вирусный миокардит развивается в том случае, если механизмы неспецифической противовирусной защиты, макрофаги и , не смогли обеспечить элиминацию вирусного генома;
- в основе лежат специфические механизмы клеточного и гуморального иммунитета;
- велик удельный вес иммунного повреждения кардиомиоцитов;
- иммунный ответ носит физиологический характер, в целом адекватен степени выраженности нарушения антигенного гомеостаза;
- как некроз, так и механизмы апоптоза лежат в основе гибели кардиомиоцитов.
Сущностью хронической фазы вирусного миокардита является трансформация заболевания в дилатацию. В основе патологического процесса лежит персистирующее воспаление миокарда вследствие неадекватности иммунного ответа. Неадекватность иммунного ответа заключается в неспособности элиминировать вирусный патоген либо в несостоятельности механизмов самоограничения иммунных процессов [11]. Соответственно, вирус может присутствовать в миокарде, поддерживая воспалительную реакцию, либо повреждение миокарда приобретает аутоиммунный характер и продолжается после элиминации вирусного патогена. Воспаление миокарда опосредовано специфическими иммунными механизмами и присутствует в течение продолжительного времени, приводя к утрате сократительного миокарда, дилатации полостей сердца и увеличению доли соединительнотканного компонента вследствие избыточной продукции профиброгенных цитокинов. Ведущую роль в гибели кардиомиоцитов играют механизмы апоптоза. Изменения в миокарде носят необратимый характер [11, 12].
Важнейшими характеристиками хронической фазы миокардита являются следующие:
- специфические иммунные механизмы лежат в основе прогрессирующего повреждения миокарда;
- иммунный ответ носит патологический характер, что выражается в неспособности иммунной системы к элиминации вируса или в несостоятельности механизмов самоограничения иммунного ответа;
- вирусный геном может присутствовать в клетках сердца, либо заболевание приобретает аутоиммунный характер. Это необходимо учитывать при выборе врачебной тактики — назначении противовирусных препаратов или иммуносупрессивной терапии [13];
- апоптоз кардиомиоцитов становится ведущим механизмом утраты сократительного миокарда;
- ремоделирование миокарда носит, как правило, необратимый характер.
Приведенная выше концепция носит общий характер. В частности, она не учитывает тропность вирусов к различным клеткам миокарда — кардиомиоцитам (энтеровирусы), эндотелию сосудов (парвовирусы, вирусы герпеса) или фибробластам, которая определяет своеобразие клинической картины заболевания, течение и прогноз [14, 15]. Тем не менее, эта концепция хорошо иллюстрирует ведущую роль иммунных механизмов при воспалительных поражениях миокарда [1, 16].
Целью нашего исследования явилось изучение количественных параметров и особенностей функционального состояния основных субпопуляций лимфоцитов периферической крови больных миокардитом с различной степенью выраженности гемодинамических нарушений. В работе приняли участие 30 больных миокардитом, у 13 из которых отмечались выраженные симптомы сердечной недостаточности ( функциональный класс по классификации кардиологической ассоциации — NYHA). У остальных 17 пациентов признаки сердечной недостаточности отсутствовали или были минимальными (I функциональный класс по NYHA). Контрольную группу составили 10 практически здоровых людей. Показатели гемодинамики исследовали методом двухмерной и . Анализ спектра трансмитрального диастолического потока использовали для оценки диастолической функции сердца. Исследование популяционного и субпопуляционного состава и активационных маркеров лимфоцитов периферической крови проводили методом четырехцветной лазерной проточной цитометрии c использованием прибора FACSCalibur и моноклональных антител (Becton Dickinson, США). Статистическую обработку результатов выполняли с помощью программы PASW Statistics 18. Для определения статистической обоснованности различия исследуемых групп применяли непараметрический . Для оценки характера, силы и достоверности связи отдельных показателей использовали коэффициент линейной корреляции Пирсона. В таблицах 1 и 2 представлены средняя величина (M) и ее стандартная ошибка (m) для каждого показателя. На рисунке 1 отражены средние величины изучаемых показателей.
В таблице 1 представлены результаты эхокардиографического обследования. У больных миокардитом с выраженной сердечной недостаточностью были отмечены признаки систолической и диастолической дисфункции левого желудочка и значительная дилатация левых и правых отделов сердца. Напротив, у пациентов с минимальными признаками сердечной недостаточности отсутствовали значимые изменения размеров и полостей сердца и признаки диастолической дисфункции, а величина ФВ хотя и была ниже, чем в контрольной группе, оставалась в пределах нормальных значений.
Количественные характеристики основных субпопуляций у больных миокардитом существенно не отличались от показателей контрольной группы (табл. 2). Следует, однако, отметить наличие корреляционной связи (r=0,43; p Литература
- Палеев Н.Р., Палеев Ф.Н., Санина // Альманах клинической медицины. 2004. № 7. С. 118–126.
- Палеев Н.Р., Палеев заболевания миокарда и их классификация // Рос. кардиол. журнал. 2009. № 3. С. 5–9.
- Yancy C.W., Jessup M., Bozkurt B. et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. 2013. Vol. 62. P. .
- Dennert R., Crijns H. J., Heymans S. Acute viral myocarditis // Eur. Heart. J. 2008. Vol. 29. P. 2073–2082.
- Blauwet L.A., Cooper // Prog. Cardiovasc. Dis. 2010. Vol. 52. P. 274–288.
- Палеев Н.Р., Палеев миокардитов // Креативная кардиология. 2007. № 1–2. С. 46–55.
- Schultheiss H.P., Kühl U., Cooper management of myocarditis // Eur. Heart J. 2011. Vol. 32. P. 2616–2625.
- Kindermann I., Barth C, Mahfoud F. et al. Update on Myocarditis // J. Am. Coll. Cardiol. 2012. Vol. 59. P. 779–792.
- Qian Q., Xiong S., Xu W. Manipulating intestinal immunity and microflora: an alternative solution to viral myocarditis? // Future Microbiol. 2012. Vol. 7. P. 1207–1216.
- McCarthy R.E. 3rd, Boehmer J.P., Hruban R.H. et al. outcome of fulminant myocarditis as compared with acute (nonfulminant) myocarditis // N. Engl. J. Med. 2000. Vol. 342. P. 690–695.
- Huber S.A., Feldman A.M., Sartini D. Coxsackievirus B3 induces T regulatory cells, which inhibit cardiomyopathy in tumor necrosis transgenic mice // Circ. Res. 2006. Vol. 99. P. 1109–1116.
- Макарков А.И., Салмаси Ж.М., Санина и сердечная недостаточность // Сердечная недостаточность. 2003. № 6. С. 312–314.
- Frustaci A., Russo M. A., Chimenti C. Randomized study on the efficacy of immunosuppressive therapy in patients with inflammatory cardiomyopathy: the TIMIC study // Eur. Heart J. 2009. Vol. 30. P. 1995–2002.
- Bultmann B. D., Klingel K., Sotlar K. et al. Fatal parvovirus myocarditis clinically mimicking ischemic heart disease: an endothelial disease // Hum. Pathol. 2003. Vol. 34. P. 92–95.
- Krueger G. R. F., Rojo J., Buja L. M., et al. Human () is a possible cardiac pathogen: an immunihistological and ultrastructural study // Hosp. Gen. 2008. Vol. 71. P. 187–191.
- Салмаси Ж. М., Санина Н. П., Макарков А. И. и др. Роль механизмов иммунорегуляции в патогенезе воспалительных поражений миокарда // Российский иммунологический журнал. 2012. № 3. С. 211–222.
- Mittag A., Lenz D., Gerstner A.O. et al. Polychromatic () cytometry for the phenotyping of leukocyte, NK, and NKT subsets // Cytometry A. 2005. Vol. 65. P. 103–115.
- Никитин В. Ю., Сухина И. А., Цыган В. Н., Гусев характеристика стадий хронического Гепатита С и оценка факторов иммунной системы как прогностических критериев течения заболевания // Журнал инфектологии. 2009. № 1. С. 30–40.
- Simoni Y., Diana J., Ghazarian L. et al. Therapeutic manipulation of natural killer (NK) T cells in autoimmunity: are we close to reality? // Clin. Exp. Immunol. 2013. Vol. 171. P. 8–19.
- Новиков путей распознавания антигенов и развития иммунного ответа, роль CD1 молекул // Иммунопатология, аллергология, инфектология. 2001. № 1. С. 5–12.
- Huber expression on hemopoietic cells promotes CD4+ Th1 response in coxsackievirus B3 induced myocarditis // Virology. 2006. Vol. 352. P. 226–236.
- Ilyinskii P. O., Wang R., Balk S. P., Exley mediates resistance to secondary infection with encephalomyocarditis virus (EMCV) in vitro and immune response to EMCV infection in vivo // J. Virol. 2006. Vol. 80. P. 7146–7158.
- Olson , Bates T. C., Izadi H. et al., Local production of by invariant NKT cells modulates acute Lyme carditis // J. Immunol. 2009. Vol. 182. P. 3728–3734.
- Toda A., Piccirillo and function of naturally occurring CD4+CD25+regulatory T cells // J. Leukoc. Biol. 2006. Vol. 80. P. 458–470.
- Liu W., Huber -talk between nkt cells and γδ cells in t regulatory cell response // Virol. J. 2011. Vol. 8. P. 32.
- Санина Н. П., Хишова Н. Н., Москалец О. В., Макарков CD3+CD16+CD56+ субпопуляции у больных миокардитом // Тезисы докладов III Евразийского конгресса кардиологов. Москва. 2014. С. 112.
- Poryadin G. Sanina N. P., Makarkov A. I. et al. Dynamic Characteristic of Surface Phenotype of Peripheral Blood Lymphocytes in Myocarditis Patients // Russ. J. Immunol. 1999. Vol. 4. P. 165–170.
- Porjadin G. Sanina N. P., Makarkov A. I. et al. Effectiveness of apoptosis of lymphocytes as a prognostic index in patients with myocarditis // Pathophysiology. 1998. Vol. 5(Suppl.). P. 43.
- Randhawa S. R., Chahine B. G., M. et al. Underexpression and overexpression of Fas and Fas ligand: a sword // Ann. Allergy Asthma Immunol. 2010. Vol. 104. P. 286–292.
- Baldeviano G. C., Barin J. G., Talor M. al. Is Dispensable for Myocarditis but Essential for the Progression to Dilated Cardiomyopathy // Circ. Res. 2010. Vol. 106. P. 1646–1655.
- Camporeale A., Marino F., Papageorgiou A. et al. STAT3 activity is necessary and sufficient for the development of myocarditis in mice and promotes progression to dilated cardiomyopathy // EMBO Mol. Med. 2013. Vol. 5. P. 572–590.
- Kong Q., Wu W., Yang F. et al. Increased expressions of and Th22 cells in the coxsackievirus mice acute viral myocarditis // Virol. J. 2012. Vol. 9. P. 232.
Только для зарегистрированных пользователей
Читайте также: