Цикл кори взаимосвязь гликолиза в мышцах и глюконеогенеза в печени
Ткани и органы. Мышцы
Метаболическая регуляция мышечного сокращения
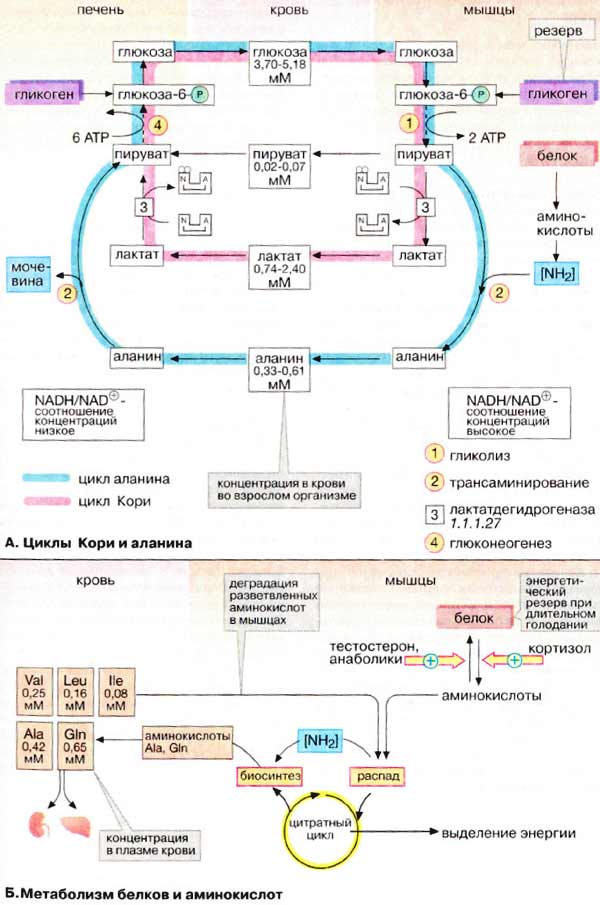
А. Циклы Кори и аланина
В клетках, не содержащих митохондрий (например, в эритроцитах), или в тканях при недостаточном снабжении кислородом (например, в активно работающих мышцах) АТФ (АТР) синтезируется за счет процесса превращений глюкозы в лактат, т. е. за счет процесса брожения (= анаэробного гликолиза , см. рис. 153). Лактат переносится кровью в печень, где в процессе глюконеогенеза с затратой АТФ (см. рис. 157) вновь конвертируется в глюкозу ( цикл Кори ).
При интенсивной работе мышцы максимально активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват) накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных условиях пируват в реакции, катализируемой лактатдегидрогеназой (см. рис. 103) (заключительный этап гликолиза) восстанавливается до лактата. Одновременно НАДН (NADH), кофермент лактатдегидрогеназы, окисляется до НАД + (NAD + ), который вновь используется на окислительном этапе гликолитического пути. Этой реакции способствует относительно высокое отношение НАДН/НАД + в мышечной ткани. Лактат диффундирует в кровь и поступает в печень, где конвертируется в глюкозу. Таким образом, образование лактата временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс из мышц в печень.
Обратная связь, подобная циклу Кори, существует в цикле аланина , в котором также участвует пируват . Цикл аланина берет начало с протеолиза белков. Образующиеся аминокислоты в результате трансаминирования в присутствии ферментов превращаются в α-кетокислоты (на схеме не приведено, см. рис. 181), которые в основном включаются в цикл трикарбоновых кислот (цитратный цикл) (см. рис. 183).Одновременно в реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает в кровь и переносится в печень. Таким образом, цикл аланина служит каналом передачи азота и предшественников глюкозы в печень, которая является местом синтеза конечных продуктов азотистого обмена, например мочевины (см. рис. 185).
Следует напомнить, что при анаэробном гликолизе образуются кислоты, которые, не принимая участие в последующем обмене, существуют в форме анионов. Поэтому при интенсивном анаэробном гликолизе рН мышечной клетки может понизиться настолько, что сокращение станет невозможным. Обычно этого не происходит благодаря быстрому выходу кислых метаболитов (лактата и пирувата) в кровь, которая также может оказаться закисленной (метаболический ацидоз).
Б. Метаболизм белков и аминокислот
Скелетные мышцы активно участвуют в метаболизме аминокислот. Это наиболее важный участок деградации разветвленных аминокислот (Val и Ile, см. с. 402). Ряд других аминокислот также деградируются преимущественно в мышцах. Одновременно идет ресинтез и высвобождение в кровь аланина и глутамина . Эти аминокислоты служат переносчиками азота, образующегося при расщеплении белков, в печень (цикл аланина) и почки (см. рис. 319).
При голодании мышечные белки служат энергетическим резервом организма. Они гидролизуются до аминокислот, которые поступают в печень. Здесь углеродный скелет аминокислот конвертируется в промежуточные продукты цитратного цикла, в том числе в ацетоацетил-КоА и ацетил-КоА (см. рис. 183). Эти амфиболические соединения окисляются в цикле трикарбоновых кислот или включаются в процесс глюконеогенеза.
Синтез и расщепление мышечных белков контролируются гормонами. Тестостерон и синтетические анаболики стимулируют биосинтез белка; напротив, кортизол подавляет образование мышечных белков.
Белки актин и миозин содержат остатки гистидина, метилированного на стадии посттрансляционной модификации. При расщеплении этих белков образуется 3-метилгистидин, который дальше не разрушается. Количество метилгистидина в моче служит мерой деградации мышечных белков.
Название работы: Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори)
Предметная область: Биология и генетика
Описание: Глюконеогенез процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Эти ткани могут обеспечивать синтез 80100 г глюкозы в сутки.
Дата добавления: 2015-02-20
Размер файла: 215.46 KB
Работу скачали: 26 чел.
Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
- Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
- Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
- Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.

- Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.

Пируват-карбоксилаза, катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).

Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
- Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют "глюкозо-лактатным циклом", или "циклом Кори".

Цикл Кори выполняет 2 важнейшие функции: 1 - обеспечивает утилизацию лактата; 2 - предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
- Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.

- Образование глюкозы из глицерола . Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
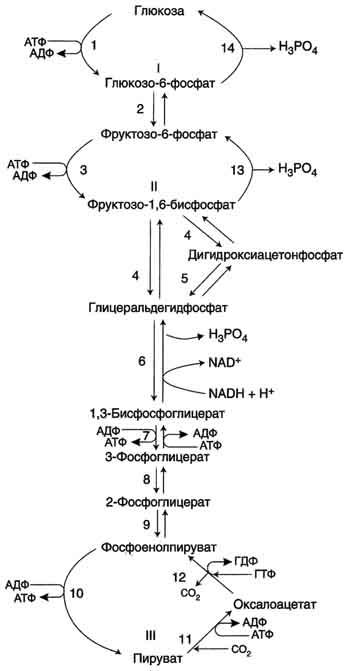
Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.

Пируват-карбоксилаза, катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).
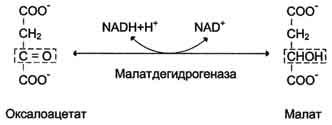
Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD + . Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD + ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют "глюкозо-лактатным циклом", или "циклом Кори".
Цикл Кори выполняет 2 важнейшие функции: 1 - обеспечивает утилизацию лактата; 2 - предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
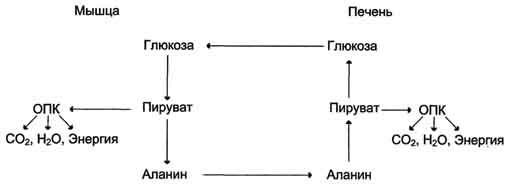
Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
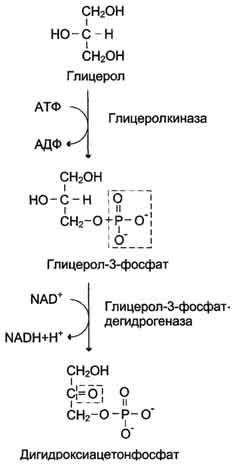
53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распространение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика)
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP + → 3 СО2 + 6 (NADPH + Н + ) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле. Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
В окислительной части пентозофосфатного путиглюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется NАDР + -зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP + приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа пентозофосфатногопути можно представить в виде:
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода.
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительнойфазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом. Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
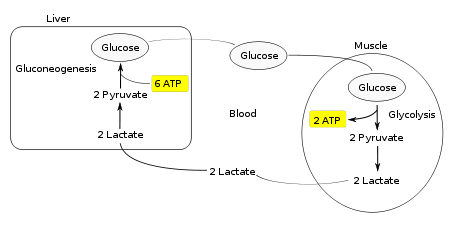
Цикл Кори (также известный как цикл молочной кислоты), названный в честь его открывателей, Carl Ferdinand Cori и Гертите Cori , относится к метаболическому пути , в котором лактат , полученный путь анаэробного гликолиза в мышцах перемещаются в печень и превращается в глюкозу, который затем возвращается к мышцам и метаболизируется обратно в лактат.
содержание

Мышечная деятельность требует АТФ , которая предоставляется пробоем гликогена в скелетных мышцах . Пробой гликоген, процесс , известный как гликогенолиз , высвобождает глюкозу в виде глюкозо-1-фосфата (G-1-P). G-1-Р превращают в G-6-P с помощью фермента фосфоглюкомутазы. G-6-P легко подается в гликолиза , (или может войти в пентозофосфатного пути , если концентрация G-6-P является высоким) процесс , который обеспечивает АТФ в мышечных клетках в качестве источника энергии. Во время мышечной активности, магазин АТФ должен постоянно пополняться. Когда подача кислорода достаточна, эта энергия поступает от кормления пируват , один продукт гликолиза, в цикле Кребса .
Когда подача кислорода недостаточно, как правило , во время интенсивной мышечной активности, энергия должна быть выпущена через анаэробный метаболизм . Брожения Молочная кислота превращает пирувата в лактат посредством лактатдегидрогеназы . Самое главное, что брожение регенерирует NAD + , поддерживая NAD + концентрацию , так что могут возникнуть дополнительные реакции гликолиза. Стадия ферментации окисляет NADH , полученный путем гликолиза обратно в NAD + , передача двух электронов от NADH , чтобы уменьшить пирувата в лактат. (См основных статей по гликолиза и брожения для деталей.)
Вместо того , чтобы накапливать внутри мышечных клеток, лактат получают путем анаэробной ферментации поглощается в печени . Это инициирует вторую половину цикла Кори. В печени глюконеогенез происходит. С точки зрения интуитивной, глюконеогенез меняет как гликолиз и ферментации путем преобразования лактата сначала в пируват, и , наконец , обратно в глюкозу. Глюкозы затем подают к мышцам через кровоток ; она готова подавать в дальнейшие реакции гликолиза. Если мышечная активность прекратилась, глюкоза используется для пополнения запасов гликогена через гликогенез .
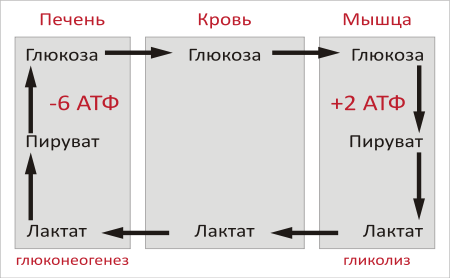
В целом, гликолиз часть цикла производит 2 молекулы АТФ на сумму 6 молекул АТФ , потребляемых в части глюконеогенеза. Каждая итерация цикла должен поддерживаться чистым потреблением 4 молекул АТФ. В результате, цикл не может быть устойчивым на неопределенное время . Интенсивное потребление молекул АТФ указывает на то, что цикл Cori сдвигает метаболическую нагрузку с мышц в печень.
Значимость
Важность цикла основывается на предотвращении молочнокислого ацидоза в мышцах в анаэробных условиях. Однако, как правило , прежде чем это произойдет молочная кислота выводится из мышц и в печени.
Цикл также имеет важное значение в производстве АТФ, источник энергии, во время мышечной активности. Функции Cori цикла более эффективно, когда мышечная активность прекратилась. Это позволяет кислородный долг должен быть погашен таким образом, что цикл Кребса и цепь переноса электронов может вырабатывать энергию с максимальной эффективностью.
Цикл Кори является гораздо более важным источником субстрата для глюконеогенеза , чем пищи. Вклад лактата Cori цикла в общем объеме производства глюкозы возрастает с поста длительностью до плато в . В частности, после того, как 12, 20 и 40 часов голодания по добровольцам, глюконеогенез составляет 41%, 71% и 92% продукции глюкозы, но вклад лактата цикла Cori к глюконеогенезу составляет 18%, 35%, и 36 %, соответственно. Остальные производства глюкозы происходит от распада белка, мышечного гликогена, и глицерина из липолиза .
Препарат метформин может вызвать молочный ацидоз у больных с почечной недостаточностью , потому что метформин ингибирует глюконеогенез в печени цикла Кори, в частности митохондриальной цепи комплекса дыхательной 1. Накопление лактата и его субстраты для производства лактата, пируваты и аланина, приводят к избыточному лактату , Обычно избыток лактата будет очищена через почки, но у пациентов с почечной недостаточностью, почки не могут справиться с избыточной молочной кислоты.
процесса на 480%. В примере, представленном рис. 15.7, такая амплификация достигается путем гидролиза АТР.
Другая потенциальная биологическая роль субстратных циклов состоит в том, чтобы генерировать тепло, продуцируемое при гидролизе АТР. Ярким примером такого феномена служат шмели, которым для полета необходимо поддерживать температуру грудного отдела около 30°С. Шмели способны поддерживать такую высокую температуру грудного отдела и осуществлять поиск пищи даже при температуре всего 10°С, потому что их летательная мышца обладает высокой активностью и фосфофруктокиназы, и фруктозобисфос-фатазы. Поскольку эта фруктозобисфосфа-таза не ингибируется AMP, есть основание думать, что данный фермент специально предназначен для генерирования тепла. В летательной мышце медоносной пчелы в отличие от мышцы шмеля фруктозобис-фосфатазная активность почти отсутствует, и в соответствии с этим пчела не может летать при низкой окружающей температуре. Слишком большая скорость цикла фруктозо-6-фосфат ^ фруктозо-1,6-бисфос-фат может вызывать избыточное образование тепла. Такое состояние, называемое злокачественной гипертермией, вызывается анестетиком галотаном у чувствительной к нему линии свиней.
15.21. Лактат, образованный сокращающейся мышцей, превращается в печени в глюкозу
Основным сырьем для глюконеогенеза является лактат, образованный активной скелетной мышцей. В сокращающейся скелетной мышце при анаэробных условиях скорость образования пирувата в ходе гликолиза превышает скорость его окисления в цикле трикарбоновых кислот. Более того, скорость образования NADH при гликолизе выше, чем скорость его окисления в дыхательной цепи. Продолжение гликолиза зависит от наличия NAD+ для окисления глицеральдегид-3-фосфата, а генерирование NAD+ осуществляется лактат-дегидрогеназой, которая, восстанавливая пируват в лактат, окисляет NADH в NAD+.
Лактат-это тупик в метаболизме. Для дальнейших метаболических превращений он должен быть сначала снова превращен в пируват.
С=0 + NADH + Н+ ==± Н—С—ОН + NAD+
Единственная цель восстановления пирувата в лактат-это регенерирование NAD+, необходимого для осуществления гликолиза в активной скелетной мышце. Образование лактата занимает время и перекладывает часть метаболической нагрузки с мышц на печень.
Плазматические мембраны большинства клеток обладают высокой проницаемостью для лактата и пирувата. Оба соединения диффундируют из активной склетной мышцы в кровь и переносятся в печень. При этом переносится значительно больше лактата, чем пирувата, из-за высокого значения отношения
Рис 15.8. Цикл Кори. Лактат, образованный активной мышией,
[NADH]/[NAD+] в сокращающейся скелетной мышце. Лактат, поступивший в печень, окисляется в пируват, чему благоприятствует низкое отношение [NADH]/[NAD + ] в цитозоле печени. Пируват затем превращается в печени в глюкозу по пути глюконеогенеза. Глюкоза поступает далее в кровь и поглощается скелетными мышцами. Таким образом печень снабжает глюкозой сокращающиеся мышцы, которые получают АТР в результате глитлитического превращения глюкозы в лактат. Затем происходит синтез глюкозы из лактата в печени. Эти превращения составляют цикл Кори (рис. 15.8).
Описанные процессы облегчаются различиями в каталитических свойствах лактат-дегидрогеназ в мышцах и печени. Лактат-дегидрогеназа представляет собою тетра-мер из субъединиц мол. массой 35 кДа. Существуют два вида полипептидных цепей, обозначаемых М и Н, которые могут образовывать пять типов тетрамеров: М4, М3Н, М2Н2, М,Н3 и Н4. Эти формы называются изоферментами (или изозимами). Изофермент М4 обладает значительно большим сродством к пирувату, чем изофермент Н4, остальные изоферменты имеют промежуточную активность. Изоферменты лактат-дегидрогеназы подвергались интенсивному изучению, однако причина существования множественных форм фермента до сих пор является загадкой.
В результате пентозофосфатного пути происходит генерирование NADPH и рибо-зо-5-фосфата в цитозоле. NADPH участвует в восстановительных биосинтезах, а рибозо-5-фосфат используется в синтезе РНК, ДНК и нуклеотидных коферментов. Пентозофосфатный путь начинается с дегидрирования глюкозо-6-фосфата с образованием лактона, который гидролизуется, давая 6-фосфоглюконат, и затем подвергается окислительному декарбоксилирова-нию с образованием рибулозо-5-фосфата. Акцептором электронов в обеих окислительных реакциях служит NA
Читайте также:


