Что лучше амиксин или циклоферон при герпесе на

Противовирусные препараты включены в стандарт оказания специализированной медицинской помощи при гриппе средней степени тяжести.


Противовирусные препараты с иммуномодулирующими свойствами обладают способностью активировать выработку собственных интерферонов и стимулировать ослабленный иммунитет на борьбу с инфекцией.

АМИКСИН ® способствует облегчению общего состояния больного при гриппе и других ОРВИ.
Узнать.

У лиц с ослабленным иммунитетом грипп и другие ОРВИ могут протекать тяжело, в том числе с развитием осложнений. Для борьбы с заболеванием могут применяться препараты с противовирусной и иммуномодулирующей активностью.

Подробнее…


Основа лечения при ОРВИ и гриппе — противовирусные препараты, которые помогают организму справиться с причиной болезни. В этой статье мы постарались собрать подробную информацию о десяти популярных препаратах, которые принимают при простуде, выявить их плюсы и минусы.
Механизм действия противовирусных средств и их классификация
Попадая в организм, вирус проникает в клетку и заставляет ее ядро производить вместо нужных элементов такие же вирусные частицы. Когда концентрация вирусов достигает критического значения, они выходят из клетки и цикл повторяется снова.
Противовирусные препараты могут воздействовать на разные этапы этого цикла. Одни — препятствуют проникновению вируса в здоровые клетки, другие — уничтожают сами вирусные частицы, блокируют их производство или выход из зараженных клеток.
Мы уже выяснили, что средство должно действовать или на сам вирус, или на систему иммунитета.
Идеальный препарат, с точки зрения врача, действует сразу на несколько звеньев развития вирусной инфекции и стимулирует собственную иммунную активность организма.
С точки зрения пациента, препарат, во-первых, должен действовать быстро. Во-вторых, его должно быть удобно принимать: не каждый может выдержать режим строгого приема раз в 3–4 часа. В-третьих, это должен быть препарат, подходящий для всей семьи, который можно применять одновременно и для лечения заболевания, и для его предотвращения. И, наконец, чем меньше противопоказаний у противовирусного препарата, тем лучше.
Практически все препараты, которые мы рассмотрим ниже, соответствуют большей части пожеланий и специалистов, и пациентов.
- безрецептурная форма с дозировкой для детей и взрослых;
- удобная кратность приема;
- короткий курс лечения;
- быстрое начало действия;
- лечебный эффект без привязки к дню начала приема препарата;
- комплексный эффект, направленный на укрепление иммунитета и непосредственно борьбу с вирусом.
- принимать этот противовирусный препарат можно только с 7 лет.
Таблетки нужно класть под язык, они растворяются в ротовой полости. Их можно использовать с трех лет для того чтобы быстрее справиться с респираторными заболеваниями. Курс лечения и профилактики в среднем длится 7–10 дней. Таблетки необходимо принимать 1–3 раза в день по 1–2 таблетки. Средняя стоимость упаковки в 10 таблеток — 700 рублей.
Суппозитории можно применять с 6 лет и их показания болезнями дыхательной системы уже не ограничиваются. Используют по одной свече перед сном. Также выпускают этот противовирусный препарат и для инъекций. На полный курс лечения потребуется около 10 инъекций и 10–20 суппозиториев. Цена суппозиториев (за 10 штук) — около 900 рублей, 5 флаконов лиофилизата — около 650 рублей.
Таблетки содержат молочный сахар, так что при непереносимости лактозы лучше выбрать другую форму выпуска. И при почечной недостаточности препарат либо не применяют вообще, либо согласовывают с врачом.
- возможность применения при различных, не только вирусных инфекциях.
- таблетки можно использовать только для лечения заболеваний дыхательной системы, а вот для других болезней придется применять свечи или делать уколы, что не всегда удобно.
- высокая стоимость.
Для лечения ОРВИ препарат применяют по схеме — 3 раза в первый день и по одной таблетке оставшиеся 6 дней. Профилактика длится до 2 недель.
Из плюсов можно отметить:
Основной минус препарата:
- отсутствие детских форм выпуска;
- Высокая цена. Упаковка в 20 таблеток, которой как раз хватит на курс профилактики, стоит от 420 до 600 рублей.
- найти препарат можно не во всех аптеках.
Капсулы выпускают в двух дозировках, 90 мг для взрослых и 60 мг для детей с 7 лет. Препарат принимают по капсуле 1 раз в день. В упаковке находится 7 капсул, и ее как раз хватает на курс лечения. Для детей такой курс будет стоить от 390 до 430 рублей, а для взрослых — 450–500 рублей.
- достаточно одной капсулы в сутки;
- упаковка, рассчитанная строго на курс лечения.
- ограниченные показания (только респираторные инфекции);
- лечебный эффект только при условии начала приема не позднее 2-го дня болезни;
- высокая стоимость.
- Препарат имеет прямое противовирусное действие.
- высокая кратность приема — во время лечения препарат приходится пить каждые 6 часов.
Некоторые аспекты действия препарата, такие как применение при беременности или распределение в организме, пока не изучены.
Плюс данного препарата:
- возможность приема уже с 6 месяцев.
- необходимость начать прием в первые часы болезни;
- прием 3 раза в день.
Преимущества этого противовирусного препарата:
- долгое начало действия — концентрация препарата в крови становится максимальной только через 48 часов.
Меглюмина акридонацетат, действующее вещество этого лекарства, является индуктором интерферона и подавляет размножение вируса.
Плюсы этого препарата:
- универсальность для всей семьи;
- прием один раз в сутки.
- больше ограничений, чем у других противовирусных средств;
- меньшее количество показаний;
- несколько сложная схема приема, в которой можно запутаться.
Показания к применению — грипп легкой и средней степени тяжести, острая респираторная вирусная инфекция. Среди противопоказаний — непереносимость лактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция, а также повышенная индивидуальная чувствительность к отдельным компонентам препарата. Стоимость упаковки колеблется примерно от 342 до 1349 рублей в зависимости от аптеки.
- можно принимать детям;
- допускает лечение другими лекарственными средствами.
- не вполне удобная форма выпуска для детей;
- спорная эффективность в виду принадлежности препарата к группе гомеопатических средств;
- высокая цена.
Главное достоинство этого препарата:
- возможность применения детьми, в том числе новорожденными, и беременными (в виде свечей — с 14 недель).
- не самая удобная форма приема.
В России зарегистрировано более сотни противовирусных препаратов для лечения ОРВИ [13] . У каждого из них есть свои особенности, начиная от формы выпуска и удобства применения и заканчивая скоростью наступления эффекта и спектром действия. Поэтому перед визитом в аптеку стоит заранее изучить все эти особенности и не забыть перед покупкой еще раз прочесть инструкцию.

У детей младше трех лет и у пожилых — старше 60 лет — людей интерфероны в организме вырабатываются медленнее и меньше, чем у детей после трех лет и у взрослых. Поэтому стоит обращать особое внимание на профилактику ОРВИ у малышей и пожилых членов семьи, в том числе и с использованием иммуномодуляторов.
Изучены клиническая эффективность и безопасность противовирусного иммуностимулирующего препарата тилорон в терапии лабиального герпеса у взрослых. Установлена положительная клиническая динамика рецидивирующего лабиального герпеса на фоне комплексной терап
Clinical effectiveness and safety of viricide immunostimulating preparation tilorone in treatment of labial herpes of adults has been studied. Positive clinical dynamics of recurrent labial herpes with complex therapy has been proved.
Вирусы семейства Herpesviridae относятся к ДНК-содержащим вирусам, пожизненно персистирующими в организме хозяина. Эти патогенные микроорганизмы широко распространены в популяции и вызывают разнообразные заболевания кожи, слизистых, глаз, центральной нервной системы и внутренних органов. В настоящее время известно 8 типов герпесвирусов, из которых особый интерес представляет вирус простого герпеса 1-го типа (ВПГ-1), поскольку является причиной возникновения орофациальных герпетических поражений.
Распространенность носительства ВПГ-1 среди населения РФ малоизучена. Однако в результате многолетних эпидемиологических исследований, проведенных в различных регионах Сибири (Новосибирск, Республика Горный Алтай и Республика Тыва), были установлены закономерности показателей инфицированности населения ВПГ-1. Всего в трех популяциях Сибири обследовано более 1000 человек (47,4% мужчин и 52,6% женщин).
Общая распространенность антител к ВПГ-1 у взрослых не различалась между обследованными популяциями и в целом составила 99,4%. Таким образом, инфицированными этим вирусом были практически все взрослые жители обследованных регионов.
Клиническая эффективность лечения пациентов оценивались по динамике патологического процесса: выраженность субъективных ощущений (зуд, жжение, болезненность), наличие или отсутствие свежих высыпаний, скорость их регресса. Учитывались жалобы, клиническая картина, наличие побочных эффектов, переносимость исследуемого лекарственного средства и мнение пациентов об используемом препарате.
Основные параметры эффективности лечения пациентов оценивались по динамике:
- длительности текущего рецидива;
- длительности и интенсивности местных симптомов рецидива по 3-балльной шкале (зуд, жжение, боль, гиперемия, отечность);
- длительности основных стадий заболевания (везикулярная, эрозивная и стадия эпителизации);
- длительности периода интоксикации (головная боль, слабость);
- оценки пациентом проведенной терапии по 10-балльной шкале;
- в течение периода наблюдения после окончания терапии:
- продолжительности ремиссии;
- продолжительности рецидива;
- лабораторных параметров — динамика иммунологических показателей, интерферонов, антител к вирусу простого герпеса.
Критерии оценки эффективности проведенной терапии:
- Значительное улучшение — сокращение длительности рецидива и/или увеличение длительности ремиссии в 2 и более раза.
- Улучшение — сокращение длительности рецидива и/или увеличение длительности ремиссии менее чем в 2 раза.
- Отсутствие эффекта — отсутствие местных и общих проявлений изменения течения заболевания.
Проведенное лечение будет считаться эффективным при значительном улучшении и улучшении.
Мониторинг безопасности заключался в оценке частоты, характера, выраженности, длительности возникающих побочных эффектов и их связи с приемом препарата.
Количество обязательных визитов пациента к врачу — 3.
Визит № 1. Включение пациента в программу наблюдения, назначение терапии. Лабораторная и клиническая верификация диагноза. Лабораторные методы исследования.
Визит № 2. Окончание курса терапии. Лабораторные методы исследования.
Визит № 3. Окончание периода наблюдения. Получение дневника пациента, завершение программы наблюдения. Лабораторные методы исследования.
Продолжительность исследования (на 1 пациента) составила 108 дней (при курсе лечения 18 дней и периоде наблюдения 90 дней).
Период лечения для групп А, ААЦ составил 18 дней.
Период лечения для группы АЦ — согласно схеме, указанной в инструкции по медицинскому применению препарата Ацикловира.
Период наблюдения для всех групп после окончания терапии составил 90 дней.
Динамика клинических проявлений, показателей идентификации возбудителя, иммунологических показателей и параметров интерферонового статуса у пациентов контрольной и исследуемых групп приведена в табл. 2–4.
Проведенный анализ клинической эффективности включения в лечебные мероприятия Амиксина показал, что уже через 7 дней его совместного применения с Ацикловиром у всех пациентов III группы отмечалось выраженное улучшение в динамике патологического процесса. Субъективно у пациентов исчезли ощущения зуда и жжения в области высыпаний. Через 18 дней клиническое выздоровление зарегистрировано у всех больных этой группы, через 90 дней рецидивов заболевания не наблюдалось.
Во II группе положительная динамика через 10 дней терапии зарегистрирована у 27 пациентов; у 3 больных сохранялось незначительное ощущение зуда и жжения. Клиническое выздоровление от РЛГ развилось у 28 пациентов через 20 дней. Через 90 дней рецидивов заболевания в группе не выявлено.
В I группе только у 24 пациентов ремиссия наблюдалась через 10 дней, у 6 человек сохранялись проявления РЛГ и субъективные ощущения. Через 20 дней у 6 пациентов сохранялись зуд и жжение, у 4 — гиперпигментация в области высыпаний. Через 30 дней у двух пациентов этой группы проявления РЛГ возобновились, был диагностирован рецидив.
В контрольной группе средняя длительность текущего рецидива не отличалась от исходного уровня. В течение всего периода наблюдения (90 дней) рецидив был диагностирован у 18 пациентов.
Таким образом, наиболее значительный клинический эффект наблюдался при использовании Амиксина в комплексной терапии с Ацикловиром.
В результате иммунологического обследования выявлено, что у пациентов с РЛГ установлено достоверное снижение CD 3+ , CD 4+ Т-лимфоцитов по сравнению с нормальными значениями и повышение числа CD 8+ Т-лимфоцитов, CD 16+ NK-клеток, CD 20+ В-лимфоцитов и уровня ЦИК в крови (p 3+ и CD 4+ Т-лимфоцитов у лиц I группы на 31% и 42%, в III — на 42% и 56%, а снижение содержания CD 8+ Т-лимфоцитов на 25% и 23% соответственно по сравнению с исходными величинами (p 3+ Т-лимфоцитов, нормализацией содержания хелперов (CD 4+ ) и супрессоров (CD 8+ ).
Аналогичные данные получены при вирусологическом и иммунологическом обследовании 54 детей от 7 до 17 лет с хронической герпесвирусной инфекцией, в котором показана клиническая и иммунологическая эффективность комплексной противовирусной и иммуномодулирующей терапии наблюдаемых детей с использованием Ацикловира, препаратов рекомбинантного интерферона и отечественного индуктора интерферона Амиксин [5].
Известно, что в ответ на стимуляцию вирусом герпеса максимальный уровень ИНФ-α индуцируется NK-клетками и CD 8+ -лимфоцитами. Это приводит к снижению продукции ими ИНФ-γ, и, кроме того, при хроническом рецидивирующем герпесе установлено значительное снижение активности NK-клеток при повышении их общего количества [6].
Следует также отметить, что ни у одного больного в нашем исследовании не наблюдалось побочных эффектов, связанных с введением препарата Амиксин. Его переносимость нами оценена как очень хорошая в 86% случаях, хорошая — у 14% пациентов.
Таким образом, анализируя полученные результаты, можно предварительно заключить, что дополнительное включение Амиксина в курсовой дозе 1,25 г в комплексную терапию больных, страдающих РЛГ, повышает ее эффективность. Использование данного средства обеспечивает длительный контроль за герпесвирусной инфекцией и участвует в реализации адаптивного иммунного ответа.
- Положительная клиническая динамика рецидивирующего лабиального герпеса на фоне комплексной терапии с включением Амиксина наблюдалась уже через неделю наблюдения, при этом произошло уменьшение выраженности симптомов заболевания, продолжительности и частоты рецидива, увеличение продолжительности безрецидивного периода при монотерапии Амиксином, а также при комбинации Амиксина с местным противовирусным препаратом (Ацикловир).
- Комбинация Амиксина и Ацикловира (крем/мазь для местного применения) превосходит по эффективности монотерапию Ацикловиром.
- Коррекция Амиксином иммунологического состояния организма пациентов с рецидивирующим лабиальным герпесом благоприятно влияет на течение заболеваний, способствует развитию клинического выздоровления и уменьшает вероятность развития их рецидивов, улучшая качество жизни больных и способствуя удлинению ремиссии заболевания.
- Препарат Амиксин является эффективным и безопасным противовирусным и иммуномодулирующим лекарственным средством с широким спектром иммунокоррегирующего действия и может быть рекомендован для применения в комплексной терапии больным с рецидивирующими лабиальным герпесом.
Литература
- Хрянин А. А., Решетников О. В., Кандрушина М. П. Многолетние тенденции в распространенности вируса простого герпеса в популяции Сибири // Вестник дерматологии и венерологии. 2010. № 5. С. 96–101.
- Свиридова В. С., Кологривова Е. Н., Пронина Н. А., Елисеева Л. В., Читалкина А. А. Т-лимфоциты — ключевые иммунорегуляторные клетки // Бюл. сиб. мед. 2007. № 1. С. 83–88.
- Хрянин А. А., Решетников О. В., Сафронов И. Д., Трунов А. Н. Эффективность ферровира в терапии больных с генитальным герпесом // Вестник НГУ (Серия: Биология, клиническая медицина). 2011. Вып. 3. С. 148–152.
- Соколова Т. М., Урываев Л. В., Тазулахова Э. Б., Ершов Ф. И., Малышенкова И. К., Дидковский Н. А. Индивидуальные изменения экспрессии генов системы интерферона в клетках крови человека под влиянием амиксина и циклоферона // Вопросы вирусологии. 2005. Т. 50, № 2. С. 32–36.
- Бабаченко И. В., Левина А. С., Ушакова Г. М., Копылова А. В., Власюк В. В., Осипова З. А., Птичникова Н. Н., Монахова Н. Е. Опыт применения амиксина в комплексной терапии хронических герпесвирусных инфекций у часто болеющих детей // Детские инфекции. 2012. Т. 11. № 2. С. 34–37.
- Nandakumar S., Woolard S. N., Yuan D., Rouse B. T., Kumaraguru U. Natural killer cells as novel helpers in anti-herpes simplex virus immune response // J. Virol. 2008. Vol. 82. Р. 10820–10831.
А. А. Хрянин* , 1 , доктор медицинских наук, профессор
О. В. Решетников**, доктор медицинских наук
* ГБОУ ВПО НГМУ МЗ РФ, Новосибирск
** ФГБУ НИИТПМ СО РАМН, Новосибирск

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
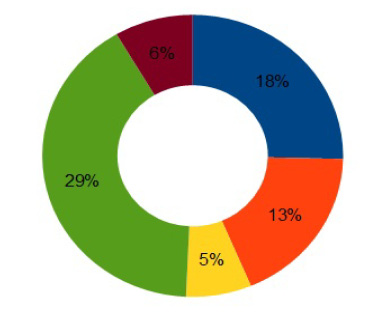

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.

Сегодня постоянно увеличивается арсенал лекарственных средств, используемых при гриппе и ОРВИ, отличающийся разнообразием и охватывающий всевозможные способы влияния на инфекционный процесс. Он включает химиопрепараты этиотропного действия, средства для им-мунокорригирующей, патогенетической и симптоматической терапии (табл. 1.).
Сюда же относятся и антибиотики широкого спектра действия для профилактики постгриппозных бактериальных осложнений [6].
Следует отметить значительный вклад академика АМН СССР А.А. Смородинцева, академиков О.И. Киселева, профессора Н.П. Чижова, а также многих других сотрудников НИИ гриппа СЗО РАМН в разработку противовирусных препаратов и стратегии их применения при ОРВИ и гриппе. Казалось бы, совокупность указанных средств должна существенно снизить заболеваемость ОРВИ и гриппом, но, как считает академик О.И. Киселев, нет оснований быть удовлетворенными результатами клинического применения этих препаратов, поскольку не обеспечивается радикальный эффект, в результате ОРВИ и грипп, продолжают оставаться малоконтролируемыми инфекциями [6].
Основные препараты для лечения и профилактики гриппа и ОРВИ (Киселев О.И. с соавт., 2010)
Группы
лекарственных средств
Блокаторы ионного канала
Специфический шаперон ГА
Ингибиторы NP- белка
Включение синтеза
эндогенных интерферонов
Циклоферон, кагоцел, амиксин
Средства для снятия
Эуфиллин, кленил, аскорил,
беротек, пульмикорт
Адаптогены, витамины С, В, Е, А
Противовирусные препараты - вещества, обладающие антивирусной активностью, представлены этиотропными средствами (химиопрепараты - истинные химические соединения различных классов); патогенетическими лекарственными средствами являются препараты неспецифического действия - интерфероны, их индукторы и частично иммунотропные препараты [4].
Существует несколько способов контроля вирусных инфекций. Неспецифический тип контроля, обеспечиваемый препаратами неспецифического действия (интерфероны, их индукторы и иммунотропные препараты), является наиболее эффективным, его антивирусный спектр очень широкий, но длительность эффекта короткая. Специфический тип контроля обеспечивается вакцинацией против основных заболеваний, согласно национальному календарю прививок, его эффективность и длительность эффекта высокая, но спектр узкий. Химический тип контроля реализуется химиопрепаратами, активность узкая, длительность высокая [6, 17].
Химиопрепараты при лечении заболеваний верхних дыхательных путей
Химиопрепараты являются средством этиотропной терапии заболеваний дыхательных путей, поэтому основным показателем их клинической пригодности служит химиотерапевтический индекс (отношение специфической эффективности к токсичности). К основным недостаткам антивирусных химиопрепаратов относятся узкий спектр действия и формирование резистентных вирусных штаммов, что сводит на нет эффективность терапии. Резистентность обусловлена мутациями в том вирусном белке, который является мишенью действия для препарата. Лекарственная устойчивость является результатом изменений наследственных свойств вирусов и развивается при многократном применении препаратов [5, 14].
Применения только этиотропных средств при повышенной заболеваемости (эпидемии) гриппом и ОРВИ недостаточно, что показал сезон повышенной заболеваемости гриппом 2009/10 гг. (табл. 2).
Максимальный клинический эффект при лечении гриппа и других ОРВИ, не-гриппозной этиологии может быть получен при сочетанном применении химиопрепаратов с препаратами неспецифического действия либо использовании только препаратов патогенетической направленности - интерферонов их индукторов и иммуномодуляторов, обладающих противовирусной активностью.
Эпидемобстановка в России 2009 г.
(по материалам конгресса по инфекционным болезням, 30 марта 2010 г)
Грипп А/H1N1/09 - 35-66,7%
ГриппА/H3N2, H1/N1 - 1% Грипп В - 0,5%; Парагрипп - 0,5%; Аденовирус - 7,2%; РС-вирус - 1,3%
Харитонова В.Ф. (2010)
РС-вирус - 43,1%; Аденовирус - 18,3%; Парагрипп - 31%; РС+парагрипп - 7,9%
Романцов М.Г. (2010),
Вирус гриппа А (H1N1)/09 и H3N2, 14% и 4%; Вирус Парагриппа (11%),
Адено- и РС-вирус (по 4%)
Вопрос о назначении антибиотиков при респираторных инфекциях и гриппе остается спорным. При неосложненных формах респираторных инфекций антибиотики не назначают, поскольку они повышают риск возникновения побочных эффектов и способствуют распространению лекарственной устойчивости. Местное назначение антибактериальных препаратов показано лицам с хроническими заболеваниями (синуситы, риниты, отиты). Респираторные заболевания опасны своими осложнениями, поэтому настороженность врачей при лечении больных гриппом чрезвычайно важна [4, 5, 15].
Роль интерферона и его индукторов при респираторных заболеваниях у детей
Ведущую роль в защите против респираторных вирусов играют интерфероны 1-го и 2-го типа (ИФН-альфа/бета и ИФН - гамма). Неодинаковая способность индуцировать интерферон связана с особенностями иммунопатогенеза детей. Иммунный ответ при ОРВИ реализуется в четырех вариантах, различающихся выраженностью и динамикой неспецифической иммуномодуляции (ответ ФГА в РБТЛ) и уровнем продукции цитокинов (ИФН-альфа/бета и гамма, ИЛ-1 и ТНФ), специфического антителообразования. В периоде выздоровления отмечается прирост ИФН альфа/бета и гамма соответственно на + 3,8 и 6,3 МЕ/мл при снижении исходно повышенного синтеза цитокинов. У детей в возрасте от 1 года до 7 лет синтез главного медиатора клеточной формы иммунного ответа - ИФН-гамма снижен, а период выздоровления сопровождается усиленной его продукцией. Аналогичная тенденция отмечена при индукции ТNF и ИЛ-1, оказывающих цитотоксическое действие на клетки, инфицированные вирусом, ингибируя при этом репродукцию вирусов [5].
В группе часто болеющих детей с атопией предпочтительнее применять индукторы интерферона, поскольку удается избежать дополнительной сенсибилизации, а синтез индуцированного интерферона находится под контролем организма.
У часто болеющих детей, не страдающих бронхиальной астмой, высокая продукция ИЛ-4 сопровождается высокой продукцией ИФН-гамма. В приступном периоде бронхиальной астмы выявлена низкая продукция ИФН-альфа и -гамма, а уже через 3 недели отмечалась выраженная стимуляция продукции интерферона. У часто болеющих детей после очередного ОРВИ наблюдали сочетание высокой продукции ИЛ-4 и интерферона-гамма, уровень последнего был повышен и в периоде ремиссии, а у больных группы сравнения указанные показатели значимо не менялись [11].
В исследованиях Н.В. Минаевой (2006) изучен цитокиновый профиль (ИЛ-1, ИФН-гамма, ИЛ-4) 392 детей дошкольного возраста с аллергической патологией. Отмечено повышение уровня ИЛ-1 в 20 раз выше нормы, отражая сочетание аллергического и инфекционного воспаления. Уровень интерферона гамма составил 58,8 (при колебаниях от 47,5 до 131,4 при норме до 25 пг/мл). Установлена корреляционная связь средней силы между ИЛ-1 и ИФН-гамма (r=0,48). После проведения иммунореабилитационных мероприятий (циклоферон, ацикловир) уровень ИФН-гамма снизился в 1,5 раза, составив 38,3 при норме до 25 пг/мл [12, 13].
Увеличение уровня интерферон-гамма при одновременном снижении уровня ИЛ-4, под влиянием проводимой терапии (циклоферон+гриппозная инактивированная вакцина) с целью профилактики ОРВИ и гриппа указывает на активацию Th1 ответа, являясь благоприятным фактором для прогноза заболевания.
Е.А. Лыкова, с соавт. (2001) показала, что у детей с осложненным течением ОРВИ наблюдается значительное снижение способности к индукции альфа- и гамма-ИФН. Способность к индукции альфа- и гамма-ИФН при положительной динамике инфекционного процесса заметно увеличивается, а сывороточный интерферон превышает допустимые значения. Улучшение параметров интерферонового ответа в процессе терапии свидетельствует о восстановлении адаптивного иммунного ответа макроорганизма. Способность к индукции интерферонов у реконвалесцентов ОРВИ ниже, чем у детей с вегето-сосудистой дистонией, что объясняет возникновение реинфекции и бактериальных осложнений при текущей вирусной инфекции [10].
Таким образом, отмечается индукция уровня альфа-интерферонов у детей в возрасте до 4-х лет под воздействием как антигенного раздражителя (вирус), так и под воздействием лекарственных средств, включая и индукторы эндогенного интерферона. Представляется закономерным включение индукторов интерферона 1-и 2-го типа (к которым относится циклоферон) в комплексное лечение неосложненных и осложненных ОРВИ.
Возможности применения индукторов интерферона в детской практике с учетом иммунного ответа
Индукторы интерферона обладают универсально широким диапазоном антивирусной активности (этиотропное действие) и выраженным иммуномодулирующим эффектом, не обладают антигенностью, синтез эндогенного интерферона сбалансирован, контролируется организмом, предотвращая побочные эффекты, характерные для экзогенно вводимых интерферонов. Однократное введение индуктора приводит к длительной циркуляции эндогенного интерферона (при введении циклоферона - до 72 часов, а при введении амиксина - 48 часов, кагоцела - до 5 суток) [4,6-17].
В детской практике применяется амиксин - низкомолекулярный индуктор интерферона, относится к классу флуоренонов. Обладает противовирусным и иммуномодулирующим действием, ингибирует трансляцию вирусспецифических белков в инфицированных клетках, вследствие чего подавляется репликация вируса. Сегодня на фармацевтическом рынке имеется дженерик амиксина - лавомакс. Применяется в детской практике у детей старше 7 лет. Побочные явления - аллергические реакции, диспептические явления, кратковременный озноб. На фармацевтическом рынке России появился КагОцел, полимер на основе целлюлозы. КагОцел - поздний индуктор интерферона, вызывает синтез эндогенных ИНФ-α/β и ИФН-γ с пиком активности через 24-48 часов с последующей циркуляцией до 4-5 дней. Умеренный эффект препарата на индукцию альфа-интерферона (+8 МЕ/мл) и несколько ниже эффект на синтез гамма-инферферона (+4,8 МЕ/мл) 17.
Одним из важных направлений формирования полноценного иммунного ответа является регуляция синтеза ИФН-g. Продукция ИФН-g Th1 осуществляется благодаря стимуляции ИФН-g-индуци-рующими цитокинами - ИЛ-12, ИЛ-2 и ФНО-a. ИЛ-18, являясь потенциальным индуктором синтеза ИФН-g, выступает в роли синергиста ИЛ-12, и оба цитокина лидируют в быстрой активации моноцит/макрофа-гальной системы посредством стимуляции выработки ИФН-g, который стимулируется циклофероном. В ряде случаев размножение вирусов подавляется дефектными частицами - дефект-интерферирующие частицы (ДИ-частицы), препятствующие нормальной репродукции вируса, подавляя цитоцидное действие вируса. Накопление достаточного количества ДИ-частиц в инфицированном организме приводит к самоограничению инфекции. Дефектные частицы сохраняют цитокин- и интерферон (ИФН)-индуцирующие свойства, стимулируя неспецифический иммунитет [17].
Показана [17] нормализация показателей клеточного иммунитета и концентрации иммуноглобулина А (при комбинированном применении циклоферона и биовестин-лакто); показано увеличение числа детей, не болевших ОРВИ в течение 3-6 месяцев после приема препаратов, обеспечив снижение повторных ОРВИ и осложнений, снижение кратности (в 2,2 раза) и длительности острых эпизодов (на 2,7дня) ОРВИ, уменьшение проявлений синдрома лимфоаденопатии, астенического синдрома, осложненного течения заболевания, восстановление нормальной флоры слизистых оболочек носа и зева. И.В. Сарвилиной [20] отмечено снижение ОРВИ в 4,1 раза и уменьшение длительности обострения ОРЗ в 1,7 раз, а также частоты развития аллергии в 4,6 раза. В исследованиях [18, 21] показана эпидемиологическая эффективность циклоферона (индекс эффективности 2,9 при колебаниях от 2,4 до 3,4, при показателе защиты от 58,5 до 67,1%), отмечено снижение уровня заболеваемости в 2,9 раза. Число заболевших, получавших циклоферон, составило 6%, наблюдалось легкое течение ОРВИ, число пропущенных дней по болезни в пересчете на 1 ребенка составило 4,8 дня. Среди детей, не получавших средств неспецифической профилактики, уровень заболеваемости составил 58%, при заболеваемости в 19% у детей, получавших гриппол. Показано снижение заболеваемости ОРВИ и гриппом (в 2,4 - 4,4 раза) в организованных коллективах, как у детей, так и у подростков. При проведении курса циклоферона наблюдается смена структуры ОРВИ среди заболевших, увеличиваются легкие (в 4,3 и более раза), уменьшаются тяжелые и осложненные формы заболеваний. У детей с бронхиальной астмой выявлено снижение в 1,4 раза обострений заболевания и в 1,9 раза частоты ОРВИ у больных детей.
Применяя циклоферон для профилактики ОРЗ и гриппа, Е.И.Кондратьева [7] показала, что препарат, обладая цитопротективным действием на слизистую оболочку полости носа, снижает степень деструкции плоского и цилиндрического эпителия, повышает содержание лизоцима, увеличивает уровень s- IgA в слюне.
Микоплазменная инфекция актуальна в связи с формированием рецидивирующих и хронических заболеваний органов дыхания, оказывает цитопатическое действие на клетки эпителия респираторного тракта, изменяя их метаболическую активность, нарушая эвакуаторную функцию. Возбудитель способствует формированию затяжного и/или рецидивирующему течению воспалительного процесса. При включении циклоферона в терапию микоплазменной инфекции сокращается лихорадочный период, интоксикация, уменьшается длительность катарального симптома, бронхиальной обструкции (в среднем на 3-1,6 дней). Улучшение клинической симптоматики происходит на фоне усиления макрофагальной активности, активации синтеза интерферона (в 1,5-1,9 раза), снижения уровня TNF, нарастания концентрации иммуноглобулина А, включая и секреторный его компонент, у 67-87 % пациентов [8].
Н.В. Минаевой [12,13] изучены особенности аллергопатологии у детей с синдромом нарушения противоинфекционной защиты, и разработана схема лечебно-реабилитационных мероприятий, основанная на этиоиммунопатогенетических принципах, с применением циклоферона. Применение циклоферона в комплексе с ацикловиром у детей с аллергической патологией и синдромом нарушения противоинфекционной защиты снижает в 1,7 раза уровень острой заболеваемости, уменьшает в 1,9-2,6 раза рецидивирование хронической герпесвирусной инфекции, долю детей с ЛОР-патологией, нормализуя показатели иммунитета. Детям с манифестацией герпесвирусной инфекции, риском активации или высокой активностью противовирусного иммунитета рекомендуется терапия ацикловиром и циклофероном. При отсутствии манифестных форм ВПГ-инфекции или высоких титров антител к ВПГ рекомендуется лечение только циклофероном.
У детей раннего возраста на отягощенном преморбитном фоне нарушения иммунного реагирования обусловлены инфицированием вирусами простого герпеса (1 и 2 типы), цитомегаловирусом. Частота выявления антител к герпесвирусам составила 77,4%. Циклоферон обеспечивает гладкое течение постинфекционного периода, предотвращая развитие осложненных форм инфекции, способствует укорочению длительности периода интоксикации и лихорадки. Циклоферон нормализует Т-клеточный иммунный ответ и купирует общеинфекционный синдром. При бронхолегочных осложнениях ОРВИ циклоферон нормализует уровень АКТГ и кортизола и поддерживает на нижней границе нормы концентрации ТТГ и Т3, повышая активность АКТГ, снижая повышенный уровень соматотропного гормона (СТГ). Наблюдается легкое течение заболевания без развития осложнений, быстрое купирование лихорадки и интоксикации [1, 14].
Нами проведена вакцинация часто болеющих детей с рецидивирующими заболеваниями верхних и нижних дыхательных путей, дивакциной против кори и паротита (в возрасте 1,76±0,35 лет) с применением циклоферона. В поствакцинальном периоде у 2 (7,1 %) детей отмечена пневмония, остальные 26 (92,8 %) детей переносили вакцинацию бессимптомно, а течение поствакцинального процесса у них было гладким. При первичном введении вакцины происходил прирост антител к кори и паротиту с 14 дня от начала вакцинации, а выработка антител продолжалась в период от 45 до 60 дня после вакцинации. Без применения препарата прироста антител на этих же сроках у часто болеющих детей не происходило. При ревакцинации отмечен прирост (в 3-4 раза) титров антител к 45 дню. По данным предыдущих исследований, проводимых нами, до 15 % часто болеющих детей после ревакцинации остаются с низкими титрами антител, а наслоение интеркуррентных заболеваний отмечалось более чем у 30 % детей [17].
В период повышенного подъема заболеваемости гриппом A/H1N1(sw)/09/04 осенью 2009 года проведена оценка эффективности циклоферона как лечебного (150 человек) и профилактического средства для экстренной профилактики (86 человек). Циклоферон при своевременно начатом лечении обеспечивал минимизацию синдрома интоксикации, ликвидацию катарального синдрома (к 5 дню). Снижение температурной реакции отмечено на 2-е сутки, а ее нормализация наступала к 4-м суткам приема препарата, без использования антибактериальных средств. Защита от гриппа и ОРВИ наблюдалась у 76,5% у медицинских работников, контактирующих с больными гриппом и ОРВИ в осенний период 2009 года [19].
Из иммунотропных препаратов, обладающих интерферониндуцирующей активностью, остановимся на иммунофане, бронхомунале, рибомуниле, ИРС-19 и иммунориксе (пидотимоде). Мишенью для препаратов являются фагоцитарные клетки. Препараты повышают функциональную активность фагоцитов, синтез провоспалительных цитокинов, а имунорикс усиливает активность естественных (натуральных) киллеров. Препараты рекомендуются для коррекции иммунного дисбаланса, профилактики и лечения инфекционно-воспалительных заболеваний ЛОР-органов у детей 16.
Таким образом, список противовирусных лекарственных препаратов, разрешенных для применения в детской практике, постоянно расширяется, эти препараты занимают достойное место, обеспечивая улучшение качества оказания медицинской помощи детям.
Список литературы
Читайте также:


