Ацикловир как профилактика от рецидивов генитального герпеса
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Анализ медицинской литературы последних лет показывает неослабевающий интерес акушеров-гинекологов к проблеме вирусной инфекции вообще и герпетической инфекции в частности. По данным различных авторов, вирус простого герпеса (ВПГ) является одной из основных причин осложненного течения беременности, внутриутробной и перинатальной инфекции [2, 8, 13]. Несмотря на неоднозначное мнение различных исследователей относительно роли этого вируса в частоте перинатальных осложнений, бесспорным является тот факт, что в современных условиях ВПГ представляет весьма многогранную медико-социальную проблему [1, 3, 6].
По-прежнему у практикующих врачей часто возникают определенные сложности при ведении беременности и родов у женщин с герпетической инфекцией [4, 12]. Одним из решающих этапов в комплексе профилактических мероприятий у данного контингента пациенток является их адекватная прегравидарная подготовка с правильным подбором всех современных методов медикаментозной коррекции.
Возбудителем герпетических заболеваний половых органов является ВПГ – облигатный внутриклеточный паразит, принадлежащий к подсемейству α-вирусов в семействе герпес-вирусов. Идентифицировано два серотипа данного вируса: первый тип (ВПГ-1) поражает преимущественно кожу и слизистую оболочку губ, глаз, носа и др.; второй тип (ВПГ-2) является возбудителем генитального герпеса. Развитие последнего возможно также и при возникновении смешанной инфекции ВПГ первого и второго типов [2, 3, 23].
Единственным резервуаром ВПГ являются зараженные им люди, которые распространяют его среди населения. Генитальный герпес относится к заболеваниям, в 99,9% случаев передаваемых половым путем. Это так называемый горизонтальный путь передачи инфекции от носителей вируса к здоровым людям. Вертикальный путь передачи возможен в случае трансплацентарного инфицирования плода [3, 9].
По данным литературы, частота встречаемости генитального герпеса варьирует от 7 до 40%. Причиной большинства случаев генитального и, соответственно, неонатального герпеса является ВПГ-2 (70–80%), однако в 20–30% случаев эта инфекция может быть вызвана ВПГ-1 [2, 19].
Попав в организм человека, ВПГ сохраняется в нем на протяжении всей жизни, периодически вызывая рецидивы заболевания различной степени тяжести. Прослеживается определенная тенденция к фиксированности очагов высыпания, что объясняется поражением только нескольких ганглиев, которые иннервируют ограниченную зону кожи и слизистых. Первичное заражение сопровождается репликацией (размножением) вируса в месте инвазии с последующим его перемещением либо по нервному стволу, либо гематогенным путем. При гематогенном пути распространения инфекции вирусемия является обязательным этапом как первичного, так и рецидивирующего генитального герпеса. Установлено, что ВПГ оседает в виде элементарных телец в строме эритроцитов, он также обнаруживается в лейкоцитах, тромбоцитах и лимфоцитах [2, 7, 11]. Вирус герпеса может находиться и в лимфатической системе, в свободном состоянии или связанном с лимфоцитами, при определенных условиях размножается в Т- и В-лимфоцитах. При персистенции инфекции данный вирус может длительно находиться в коже, слизистых и половых секретах.
К особенностям герпетической инфекции следует относить:
• высокий уровень инфицированности населения;
• пожизненную персистенцию возбудителя в организме человека;
• системность процесса, а также полиморфизм клинических проявлений;
• трудности лабораторной диагностики атипичных и стертых форм заболевания;
• торпидность к имеющимся методам терапии (ни один из противогерпетических препаратов не приводит к полной элиминации вируса из организма, а только подавляет его репликацию).
При определении формы генитального герпеса выделяют первичную инфекцию или первичный эпизод инфекции и рецидивирующее ее течение. Первично инфицированными считаются пациентки с серонегативными результатами, которые ранее не сталкивались с ВПГ и не имеют к нему антител. Инкубационный период колеблется в широких пределах и составляет в среднем 3–9 дней, в течение которых экспрессия вируса минимальна. В 50–80% случаев появлению типичных повреждений предшествуют локальные продромальные симптомы в виде парестезии, зуда или боли, локального лимфаденита, невралгии в ягодичной, паховой, бедренной областях, дизурии, а также нарушения общего состояния пациенток. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением. Как правило, первичный эпизод заболевания характеризуется обширными высыпаниями, тяжелой общей симптоматикой и длительной экспрессией вируса [1, 3].
Существует несколько подходов к диагностике герпетической инфекции. Алгоритмы обследования основаны на клинических симптомах и лабораторных тестах. Наиболее распространенным в клинической практике является метод быстрой диагностики герпетической инфекции – полимеразная цепная реакция [2, 21]. Также для постановки диагноза герпетической инфекции часто используется иммуноферментный анализ.
Анализ литературных данных показал, что беременность, как правило, не влияет на частоту возникновения и тяжесть герпетической инфекции. В то же время имеется и противоположное мнение, указывающее на изменение клиники генитального герпеса на фоне физиологического иммунодефицита, имеющего место при беременности [1, 6].
Следует отметить, что пути проникновения вируса к эмбриону и плоду могут быть различными. Первый путь – трансплацентарный, возникает при наличии вирусемии у беременной, когда вирус из межворсинчатого пространства плаценты проникает в сосудистую систему плода с дальнейшей диссеминацией в его органах [3, 9, 13].
Резко увеличивает потенциальную опасность трансплацентарной передачи ВПГ плоду первичное инфицирование женщины во время беременности. Риск увеличивается и при активации латентной герпетической инфекции, однако он значительно ниже, чем при первой встрече организма с вирусом. Возможность трансплацентарной передачи инфекции значительно возрастает на фоне снижения иммунологической реактивности организма и при всех сопутствующих состояниях, увеличивающих проницаемость плаценты. Однако, по мнению ряда авторов [1, 13], вирусы могут проникать в организм плода даже через неповрежденную плаценту.
При восходящем инфицировании основными факторами, повышающими риск заражения плода, являются патологические изменения шейки матки, снижение защитных свойств цервикальной слизи, а также акушерские вмешательства и манипуляции, возможность проникновения вируса в околоплодные воды через плодные оболочки [3].
Бесспорно, как отечественными [1, 6], так и зарубежными авторами [9, 13] лидирующее место (до 90% случаев) отводится контактному механизму заражения плода, возникающему при прохождении ребенка через инфицированные родовые пути матери. При этом передача инфекции возможна как при наличии очагов повреждения в области шейки матки и вульвы, так и при бессимптомном выделении вируса.
В I триместре гестации риск инфицирования плода ВПГ резко возрастает при наличии первичного эпизода инфекции или стадии обострения хронической рецидивирующей формы заболевания, что может явиться причиной возникновения пороков развития плода, неразвивающейся беременности, спонтанных абортов и др. [2, 23]. Эмбриональные ткани с их высоким уровнем метаболизма и энергетики являются идеальной средой для репликации вирусов. При этом вирусная нуклеиновая кислота может включаться в состав клеточного генома, передающего генетическую информацию в аппарат, воспроизводящий клеточный белок, что в конечном итоге приводит к гибели зародыша или нарушению процессов органогенеза и возникновению пороков развития [3].
По данным литературы, при инфицировании беременной после 20 нед. гестации возрастает частота поздних самопроизвольных выкидышей, преждевременных родов, внутриутробного инфицирования плода. В этот период у плода могут развиться воспалительные заболевания головного мозга, глаз, легких, анемия, гепатоспленомегалия и т. д. Генитальная герпетическая инфекция, ввиду частых воспалительных изменений последа, может явиться причиной преждевременного или раннего излития околоплодных вод (с высоким риском восходящего инфицирования плода), нарушений сократительной активности матки с развитием первичной и/или вторичной слабости родовой деятельности, аномалий прикрепления и отделения плаценты с кровотечением в последовом и раннем послеродовом периодах [2, 3, 13].
Внедрение в практику противовирусной терапии привело к значительному снижению заболеваемости и смертности, однако до настоящего времени проблема герпетической инфекции во время беременности и ее влияние на организм ребенка являются одной из наиболее острых проблем в перинатологии [5, 14, 16, 17].
В работах зарубежных авторов было показано, что среди женщин с рецидивирующим генитальным герпесом примерно в 75% случаев следует ожидать по крайней мере один рецидив ВПГ во время беременности и в 14% – клинические проявления на момент родоразрешения [22, 25]. Данные систематического обзора 7 рандомизированных контролируемых испытаний с 1249 участниками выявили, что женщины с первичным эпизодом или рецидивом ВПГ-инфекции, которые получали антивирусную профилактику ацикловиром (400 мг 3 р./сут) или валацикловиром (500 мг 2 р./сут) начиная с 36 нед. беременности, значительно реже имели рецидивы инфекции к моменту родоразрешения (OR=0,28; CI=0,18–0,43), а проведение супрессивной терапии данными препаратами привело к снижению частоты выполнения кесарева сечения в связи с обострением ВПГ-инфекции (OR=0,30; CI=0,20–0,45) [15].
Как известно, во время родоразрешения при рецидивирующей генитальной ВПГ-инфекции происходит заражение плода. В крупном проспективном исследовании (58 362 беременные женщины), проведенном с целью оценки влияния метода родоразрешения на частоту передачи ВПГ-инфекции новорожденным, было показано, что инфицирование новорожденных практически в 6 раз ниже при операции кесарева сечения, чем при самопроизвольных родах (1,2% по сравнению 7,7% соответственно; ОR=0,14; CI=0,02–1,08) [10].
Также в исследованиях было показано, что у беременных с рецидивирующим генитальным герпесом проведение антивирусной профилактики ацикловиром после 36 нед. гестации для снижения риска передачи инфекции новорожденному является более экономически выгодной мерой, чем проведение кесарева сечения в связи с активацией ВПГ-инфекции на момент родоразрешения. Однако в настоящий момент недостаточно исследований, оценивающих экономическую эффективность противовирусной профилактики валацикловиром [18].
С учетом полученных данных, Американский колледж акушеров и гинекологов (AGOG) и общество акушеров и гинекологов Канады (SOGC) рекомендуют женщинам с рецидивирующей генитальной ВПГ-инфекцией проводить супрессивную терапию ацикловиром или валацикловиром после 36 нед. гестации, а также осуществлять родоразрешение путем операции кесарева сечения пациенткам с наличием активных герпетических высыпаний на половых органах и продромальных симптомов инфекции к моменту родов. SOGC предлагает пациенткам с первичной генитальной ВПГ-инфекцией в третьем триместре проводить кесарево сечение вне зависимости от наличия или отсутствия поражения кожных покровов половых органов в связи с высоким риском (до 60%) вертикальной передачи [8, 20].
Осложненное течение гестационного периода у женщин с герпетической инфекцией, тяжесть неонатального герпеса и неблагоприятный прогноз для новорожденного делают весьма актуальной разработку рациональных подходов к диагностике, профилактике и лечению этого заболевания. В профилактике неонатального герпеса большое значение приобретает правильная тактика ведения беременности и родов, однако реальным малоиспользуемым до настоящего времени резервом в решении проблемы рождения здорового ребенка является правильная прегравидарная подготовка пациенток с герпетической инфекцией, которая включает ее лечение с последующей профилактикой рецидивов. При генитальной герпетической инфекции, независимо от уровня поражения репродуктивной системы, показано проведение как базисной (противовирусной) терапии, так и лечение сопутствующих заболеваний.
К базисным видам лечения относится:
• Блокада репродукции ВПГ в режиме эпизодической или супрессивной терапии. Применяют ацикловир по 0,2 г 5 р./сут в течение 5 дней при легком течении инфекции (обострения 1 раз в 6–8 мес.) и по 0,2 г 4 р./сут в непрерывном режиме в течение 3–6 мес. и более – при ее частых рецидивах (обострения 1 раз в 30–90 дней).
• Проведение стимуляции неспецифической резистентности организма в зависимости от показателей иммунного и интерферонового статуса больных (препараты иммуноглобулина, индукторы интерферона, энзимотерапия и др.).
• Местное применение специфических мазей.
В настоящее время наиболее широко используемыми для купирования обострения различных форм герпеса являются препараты из группы ациклических нуклеотидов. Многочисленными наблюдениями показано, что применение ацикловира в дозе 200 мг 5 р./сут или валацикловира – 500 мг 2 р./сут в течение 5 дней значительно уменьшает клинические проявления заболевания, сокращает время рецидива и период вирусовыделения. Были отмечены абсолютная безопасность, хорошая переносимость препаратов и отсутствие значимых побочных эффектов [6, 14, 16].
Как показывает клиническая практика, эффективность ациклических нуклеозидов зависит от биодоступности препарата, чувствительности герпес-вируса к конкретному препарату, адекватности применяемой дозы, продолжительности и кратности лечения, сроков начала лечения. Назначение валацикловира в дозе 500 мг 2 р./сут в течение 5 дней в продромальном периоде или сразу после появления симптомов рецидива заболевания способствует быстрому купированию проявлений вирусной инфекции. Препарат для системного лечения герпетической инфекции Валцикон сочетает в себе эффективность и безопасность ацикловира при отсутствии его недостатков – таких как ограниченная биодоступность, связанная с недостаточно эффективным всасыванием препарата при пероральном применении. Применение Валцикона дает возможность снизить количество приемов лекарства до 2 р./сут в отличие от 5 р./сут – при назначении ацикловира и повысить приверженность пациентов к проводимой терапии.
В ряде случаев среди пациентов, получавших хотя бы короткие курсы валацикловира в момент рецидива, тенденция к нарастанию частоты клинических проявлений ВПГ-инфекции ниже, чем среди пациентов, получавших только местное лечение, что во многом зависит от исходного состояния противовирусной защиты и продолжительности вторичного иммунодефицита у больных с ВПГ-инфекцией. Супрессивную терапию рекомендуют людям с частыми рецидивами. Для пациентов с сохраненным иммунитетом назначают препарат в дозе 500 мг 1 р./сут, с иммунодефицитом – 500 мг 2 р./сут. Прием препаратов ежедневно в течение 12 и более месяцев в 80% случаев предотвращает рецидивы герпеса и обеспечивает психологическое преимущество над лечением, проводимым во время обострений; при такой терапии рецидивы заболевания становятся достаточно редкими, а у некоторых пациентов возможна ремиссия в течение нескольких лет. Анализ рандомизированного исследования [26] подтвердил высокую клиническую эффективность применения валацикловира в профилактике рецидивирующей ВПГ-инфекции. Супрессивная терапия в прегравидарном периоде и перед родоразрешением может снизить частоту рецидивов ВПГ, риск бессимптомного выделения вируса и частоту кесарева сечения вследствие активации герпетической инфекции. Валцикон с фармакоэкономической точки зрения наиболее оптимально подходит для супрессивной терапии. Учитывая наличие большой упаковки (42 капсулы), доступную стоимость и 2–кратное применение в сутки, препарат Валцикон позволяет достичь очень высокой комплаентности лечения.
Таким образом, следует подчеркнуть, что проведение ранней диагностики, профилактики и лечения ВПГ-инфекции у женщин до наступления беременности, прегравидарная подготовка и планирование беременности позволяют снизить частоту осложнений гестационного периода, тяжесть течения (частоту и длительность рецидивов) инфекционного процесса при беременности, предупредить тяжелые формы неонатальной инфекции, уменьшить перинатальную заболеваемость и смертность.




Мы хорошо знаем о таких венерических заболеваниях как СПИД, сифилис, гонорея. Что же касается, генитального герпеса, то ему, как правило, отводится второстепенная роль, но, на самом деле, он не менее опасен. Так же как и СПИД, герпес не поддается окончательному излечению и, один раз заразившись этим вирусом, человек становится его носителем на всю оставшуюся жизнь. Хотя, в отличие от ВИЧ-инфекции сам по себе вирус герпеса не может стать причиной смерти, тем не менее, запущенный генитальный герпес может привести к иммунодефицитному состоянию, стать причиной раковых поражений половых органов.

По своей распространенности данная болезнь занимает второе место среди всех инфекций, передающихся половым путем. По расчетам специалистов, примерно каждый десятый россиянин заражен генитальным герпесом.
Передача генитального герпеса происходит при половых контактах во влагалище, в рот и прямую кишку. Заразить партнера наиболее возможно во время обострения болезни, однако даже в период отсутствия высыпаний риск передачи герпеса остается. К тому же, примерно у 80% больных генитальный герпес протекает без видимых проявлений. Эти люди и не знают, что заражены, являясь при этом источником инфекции.
Типичная картина болезни выглядит так: в области половых органов появляются пузырьки, которые затем разрастаются, друг с другом объединяются и, лопаясь, образуют болезненные язвочки. У женщин чаще всего поражается само влагалище и его преддверие, половые губы и шейка матки. Реже высыпания располагаются на лобке, бедрах, ягодицах и в области промежности.
К физическим страданиям часто добавляются психологические переживания: раздражительность, страх перед новыми высыпаниями, мысли о невозможности иметь здоровых детей, боязнь заразить близкого человека, чувство ненужности, одиночества… Могут даже возникнуть суицидальные мысли.
Генитальный герпес не только причиняет физическую и моральную боль, но также является причиной ослабления иммунитета, вызывает хронические заболевания внутренних половых органов и способен в конечном итоге стать причиной как женского, так и мужского бесплодия. Особенно опасен генитальный герпес для беременных женщин, у которых может развиться патология беременности, произойти инфицирование плода и новорожденного.
Классические препараты для лечения генитального герпеса — ациклические нуклеозиды (ацикловир, валацикловир, фамцикловир). Однако в последнее время появляется все большее количество устойчивых к ацикловиру (и подобным ему препаратам) вирусов. Поэтому ациклические нуклеозиды рекомендуется чередовать друг с другом (например, ацикловир с валацикловиром) или использовать их совместно с препаратами интерферона. Интерферон — это один из самых сильных противовирусных белков организма. Он распознает проникший в клетку возбудитель инфекции и препятствует его размножению. Считается, что именно недостаток интерферона в организме является причиной рецидивов герпеса.
Лучше использовать препараты, содержащие одновременно интерферон с ацикловиром. Единственным в мире средством, содержащим одновременно ацикловир и интерферон является мазь герпферон. Учитывая болезненность генитального герпеса, в состав мази был также включен лидокаин, который обеспечивает обезболивающее действие.
По данным клинических исследований, применение герпферона при генитальном герпесе у 85% больных привело к полному выздоровлению на 5-ые сутки. Этот показатель оказался в 3,5 раза выше, чем у группы, получавшей классическое лечение ацикловиром. У пациентов, применявших герпферон, значительно раньше прекращались общее недомогание, головная боль, быстрее проходили зуд, боль и жар в месте высыпаний.
Повторные эпизоды генитального герпеса появляются под действием неблагоприятных для иммунной системы факторов. К ним относятся: болезни, длительное пребывание на солнце, переохлаждение, приход менструации, беременность, прием гормональных препаратов. Также герпес может обостриться и на фоне стресса.
Поэтому не следует пренебрегать здоровым образом жизни, полноценным питанием и приемом витаминов. Имеющиеся заболевания следует вовремя выявлять и пролечивать под контролем врача. Нужно избегать длительного пребывания на солнце и переохлаждения, беречь себя от стресса. И, конечно, соблюдать интимную гигиену и своевременно выявлять и лечить сопутствующие венерические заболевания.
В любом случае, если у Вас появились характерные для генитального герпеса высыпания, не стоит откладывать визит к специалисту.
Как оградить себя от генитального герпеса? Прежде всего, надо помнить, что абсолютно безопасного секса не существует. Даже презерватив, колоссально снижая опасность заражения, не дает полной, стопроцентной гарантии защиты от генитального герпеса.
Также нельзя забывать и о правилах гигиены. Недаром у каждого есть свое личное полотенце. Ведь, например, если пользоваться полотенцем после больного генитальным герпесом человека — можно легко заразиться самому.
Надо иметь в виду, что при оральных контактах герпес с губ легко попадает на гениталии. Поэтому заниматься оральным сексом нужно с использованием специальных латексных салфеток. А во время появления высыпаний на лице и губах — и вовсе от этого удовольствия следует воздержаться.
Возможны случаи самозаражения генитальным герпесом, когда вирус с губ переносится грязными руками на половые органы. И здесь нам на выручку опять приходят до банальности простые правила личной гигиены. Тщательное мытье рук (особенно во время появления лихорадки на губах), наличие отдельных полотенец для лица, рук и тела уберегут Вас от подобной неприятности.
Применение барьерных контрацептивов, особенно во время обострения генитального герпеса, не исключает возможности заражения. Поэтому после подозрительных сексуальных контактов или контакта с носителем вируса герпеса в дополнение к презервативу следует использовать специальные средства для экстренной профилактики заболевания. Одним из таких средств является препарат герпферон. Если в течение 1−2 часов после близости использовать мазь герпферон, вероятность избежать инфицирования генитальным герпесом значительно увеличится.
Перламутров Ю.Н., Чернова Н.И, Московский Государственный Медико-Стоматологический Университет
Поскольку простой герпес является пожизненной инфекцией и элиминации возбудителя в настоящее время достичь невозможно, в тактике лечения выделяют следующие задачи: ослабление выраженности клинических симптомов инфекции (зуд, жжение, боль, лихорадка); сокращение срока полной эпителизации поражений; уменьшение частоты и тяжести рецидивов; предупреждение передачи инфекции половому партнеру.
В последнее время синтезированы и широко используются новые противовирусные препараты этой группы валтрекс и фамвир, в которых преодолен основной недостаток ацикловира – низкая биодоступность при пероральном применении.
В настоящее время существует два варианта терапии рецидивирующего герпеса с использованием аналогов нуклеозидов эпизодическая, чтобы сократить длительность и выраженность клинических проявлений, и супрессивная, чтобы уменьшить частоту рецидивов. Эпизодическая терапия подразумевает пероральный прием препаратов в момент обострения инфекции. Такой режим оптимален у пациентов с редкими клиническими проявлениями. Терапия наиболее эффективна в период продромы или впервые дни высыпаний.
Супрессивная терапия (назначение препарата ежедневно) в 80% случаев предотвращает рецидивы герпеса у пациентов с тяжелым течением процесса.
Противовирусная химиотерапия способствует клиническому улучшению у большинства пациентов с проявлениями заболевания. Однако химические аналоги нуклеозидов не влияют на риск, частоту или тяжесть рецидивов после прекращения лечения. Значительной проблемой является прогрессивное увеличение ацикловир устойчивых штаммов вирусов. Применяемые в современной клинической практике методы иммунотерапии не дают гарантированный клинико-лабораторный эффект при профилактике и лечении герпес-вирусных заболеваний, а кроме того не являются безопасными и плохо контролируются. Становится очевидным необходимость поиска безопасных, высокоэффективных противовирусных средств, также обладающих иммуномодулирующим действием.
Подобным требованиям отвечает Панавир препарат растительного происхождения - очищенный экстракт побегов растения Solanum tuberosum - биологически активный полисахарид.
Целью работы являлось определение клинической эффективности применения ректальных суппозиториев Панавир в терапии пациентов с рецидивирующим генитальным герпесом.
Материалы и методы
Под наблюдением находились 30 больных с рецидивирующей герпетической инфекцией гениталий в возрасте от 20 до 40 лет и давностью заболевания от 12 до 36 месяцев.
Диагностику генитального герпеса проводили при помощи исследования соскобов из уретры, вагины и цервикального канала с выявлением ДНК ВПГ12 типа методом ампфликации нуклеиновых кислот полимеразной цепной реакцией (ПЦР).
Кратность обследования
Осмотр кожи и слизистых гениталий проводили 1раз в 5 дней в течение трех недель, далее 1 раз в месяц 3 месяца.
Забор материала для лабораторных исследований проводился до и через месяц после окончания лечения.
Изучение эффективности, переносимости и безопасности препарата проводилось на основании:
динамики субъективных и объективных симптомов,
отсутствия ДНК ВПГ1/2 в соскобах из урогенитального тракта после лечения при типировании методом ПЦР,
По степени тяжести генитального герпеса больные распределились следующим образом: легкое течение с рецидивами 3-4 раза в год имели 12 человек и средней тяжести с проявлениями 5-6 раз в год 18 пациентов. Методика лечения заключалась в назначении Панавира по 1 суппозиторию ректально на ночь. Процедура повторялась через день 5 свечей на курс. Лечение начинали в период продромы или в 1 -3 день рецидива.
Результаты исследования
До лечения у всех 30 больных в соскобах из урогенитального тракта выделена ДНК ВПГ1/2 типа.
В период продромы обратились 10 человек из них 7 со средней тяжестью процесса и 3 с легким течением. При применении суппозиториев Панавир в продромальный период абортирование рецидива отмечено у 8 (80%) больных: (2 легкое течение и 4 средней тяжести).
В 1-3 день рецидива герпеса начали лечение суппозиториями Панавир 20 больных, 9 человек с легким течением заболевания и 11 пациентов с процессом средней тяжести. Высокая эффективность терапии наблюдалась у 6 человек, все больные начали лечение в 1 день высыпаний, рецидив купировался за 2 дня. Лечение было эффективным у 10 больных. Продолжительность рецидивов уменьшилась в 1,5-2 раза по сравнению с данными до лечения (6,02 ± 0,4 дней) и составила в среднем 3,8 ± 0,51 дня. Применение суппозиториев панавир не повлияла на длительность рецидива у 2 пациентов.
На основании полученных данных можно констатировать, что положительный клинический эффект при лечении генитального герпеса суппозиториями панавир наблюдался у 96 % исследуемых. Необходимо отметить, что все пациенты лечение переносили хорошо: побочных явлений и аллергических реакций не отмечалось. После курса терапии суппозиториями панавир при исследовании соскобов из урогенитального тракта при помощи ПЦР через 21-28 дней ДНК ВПГ1/2 типа не определялась у 28 пациентов.
При наблюдении за больными в период 90 дней после проведенного лечения длительная ремиссия наблюдалась у 29 пациентов.
Выводы:
1.Использование ректальных суппозиториев Панавир в период продромальных явлений способствовало абортированию рецидива у пациентов с легкой и средней тяжестью течения генитального герпеса.
2. Применение Панавира увеличило период ремиссии у 90,6% больных.
3. При наблюдении за больными в течение 3 месяцев после лечения суппозиториями панавир ремиссия отмечалась у 96% человек.
4. Ни в одном случае в процессе применения суппозиториев Панавир не зарегистрировано нежелательных побочных явлений или аллергических реакций.
5. Высокая клиническая эффективность и безопасность, хорошая переносимость суппозиториев Панавир, отмеченные у абсолютного числа пролеченных пациентов, позволяет рекомендовать препарат к широкому применению в терапии генитального герпеса.
6. Панавир можно применять у пациентов с непереносимостью синтетических нуклеозидов, и в тех случаях, когда наблюдается резистентность к ацикловиру.
Литература
1. Аковбян В.А., Масюкова С.А. и др. Генитальный герпес: современные проблемы и пути их решения. Клинич. микробиол. и антимикроб. химиотер. 2003; 1 (5): 4–18.
2. Гранитов В.М. Герпесвирусная инфекция. М.: Медицинская книга, 2001.
3. Молочков В.А., Семенова Т.Б. Генитальный герпес: клиника, диагностика, лечение и профилактика. М., 2005.
4. Ramaswamy M, McDonald C et al. The epidemiology of genital infection with Herpes simplex virus types 1 and 2 in genitourinary medicine attendees in inner London. Sex Transm Infect 2005; 81 (4): 306.
5. Sanchez-Aleman MA, Conde-Glez CJ et al. Sexual behavior and Herpes simplex virus 2 infection in college students. Arch Med Res 2005; 36 (5): 74–80.

В своей практической деятельности врачи многих специальностей встречаются с заболеваниями, вызванными вирусами семейства Herpesviridae, которые широко распространены в человеческой популяции. Они способны поражать практически все органы и системы организма хозяина, вызывая латентную, острую и хроническую формы инфекции при этом, спектр клинических проявлений, развитие которых они обусловливают, чрезвычайно широк [7]. Особого внимания заслуживает рецидивирующая форма герпетической инфекции (ГИ), относящаяся к числу наиболее распространенных психосоматических кожных заболеваний. Хроническое течение, зуд, частая локализация и характер высыпаний на лице или интимно значимых участках кожного покрова сопровождаются изменениями эмоциональной сферы. В свою очередь, состояния стресса, восприятие самим пациентом проявлений болезни оказывает влияние на интенсивность и частоту рецидивов простого герпеса (ПГ) [24].
Многочисленные исследования в области проблемы ГИ, особенно вызванные вирусами простого герпеса (ВПГ) 1 и 2 типов, не теряют своей актуальности в настоящее время [21, 16].
Серьёзной проблемой является высокая инфицированность здорового населения, преимущественно молодого, трудоспособного возраста. В мире ежегодно заражаются от 16 до 800, а в России – от 40 до 80 человек на 100 тыс. населения. В настоящее время заболеваемость ПГ крайне высока, по статистике ВОЗ, она занимает второе место среди вирусных поражений, уступая лишь гриппу. ВПГ-1 инфицировано около 90 % взрослого населения планеты, распространенность ВПГ-2 колеблется от 7 до 40 %. В США ежегодно регистрируется до 98 млн случаев лабиального герпеса и 20 млн случаев рецидивирующего герпеса гениталий, 500 тыс. случаев офтальмогерпеса и более 5 тыс. случаев герпетического энцефалита, около 1 тыс. случаев герпеса новорожденных. По мнению ведущих специалистов, в нашей стране ежегодная заболеваемость герпесом губ составляет 10 млн, герпесом кожи – 1 млн, офтальмогерпесом – 250 тыс. случаев. Рецидивирующими формами герпеса страдают от 10 до 20 % населения, а ежегодный прирост увеличивается на 15–17 % [3, 13, 23].
Литературные данные свидетельствуют, что большинство населения Земли инфицировано ВПГ-1, ВПГ-2 или тем и другим вирусом одновременно. Первичная инфекция, ассоциированная с ВПГ-1 или ВПГ-2, может протекать в клинически выраженной форме в очаге инфицирования (например, в орофациальной или генитальной области) либо как бессимптомная или нераспознанная инфекция. Генитальная форма простого герпеса может быть связана с ВПГ-1, так же как и лабиальная форма – с ВПГ-2. После первичного инфицирования у 50–75 % больных отмечается рецидивирующее течение простого герпеса. В течение первых 12 месяцев после инфицирования ВПГ-2 рецидив возникает у 80 % пациентов, ВПГ-1 – у 55 % [15, 26].
Современная медицина не располагает методами лечения, позволяющими элиминировать ВПГ из организма человека. Целью лечения герпеса является: 1) подавление репродукции ВПГ в период обострения (купирование рецидива); 2) снижение частоты и длительности рецидивов заболевания, тяжести их течения; 3) формирование адекватного иммунного ответа и его длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Всё разнообразие методов терапии и профилактики обострения герпесвирусных инфекций можно сгруппировать в направления этиотропного, патогенетического и симптоматического лечения с применением химиотерапии, иммунотерапии и комплексного лечения [1, 7, 11].
Большое внимание уделяется антигерпетическим соединениям растительного происхождения, природным антиоксидантам, адаптогенам из лекарственного растительного сырья и витаминно-минеральным комплексам, ввиду изменения иммунного статуса пациентов [14, 19].
Патогенетическая терапия направлена на нормализацию функции иммунной системы организма, в том числе на активацию системы интерфероновой защиты, как правило, связанная с применением интерферонов (ИФН), индукторов ИФН и иммуномодуляторов. Специфическая иммунотерапия состоит в применении герпетической вакцины, хотя ряд исследователей считает, что надежды, возлагаемые на специфическую вакцинопрофилактику, не оправдали себя [11, 19]. Иммунотропные препараты, обладающие активностью против вируса герпеса, разнообразны и представлены в таблице.
Иммунотропные препараты, обладающие активностью против вируса герпеса
Использование противовирусной химиотерапии велико при лечении рецидивирующих форм простого герпеса с поражением кожи и слизистых оболочек. В лечении простого герпеса с применением противогерпетических химиопрепаратов можно выделить два принципиально отличающихся друг от друга подхода: 1) эпизодическое лечение – прием ациклических нуклеозидов (АН) в момент рецидива в терапевтических дозах при соблюдении кратности и длительности лечения; 2) супрессивная терапия – длительный, иногда многолетний, постоянный прием препаратов АН вне рецидива в более низких дозах [9, 25].
Согласно проведенным исследованиям, биодоступность (per os) противогерпетических препаратов из группы ациклических нуклеозидов возрастает следующим образом: ацикловир – 20 %, валацикловир – 54 % и фамцикловир – 77 % [24]. Тем не менее применение ацикловира по-прежнему остаётся востребованным среди врачей и пациентов в настоящее время, и одновременно ведутся исследования по увеличению растворимости ацикловира [5] и синтезу его производных [8].
В разные годы предпринимались многочисленные попытки повысить эффективность лечения ПГ путем комбинированной терапии. С этой целью использовались различные сочетания средств иммунного влияния, а также препаратов, отличающихся по этиопатогенетическому механизму действия [20].
Возможно сочетанное использование противовирусной терапии и глюкокортикостероидов. Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир + преднизолон значительно быстрее купирует острую боль и возвращает пациента к обычной жизнедеятельности в случае постгерпетической невралгии [2].
Наружные средства дополняют системную противовирусную терапию. Многочисленные наблюдения подтверждают, что в случае назначения таблетированных форм ациклических нуклеозидов на стадии предвестников в сочетании с наружной противовирусной терапией значительно чаще удается полностью прервать дальнейшее развитие рецидива или наблюдать его абортивное течение [20].
Местная терапия противовирусных лекарственных средств при герпесе кожи и слизистых оболочек требуется для уменьшения отёка, экссудации, боли и зуда, ускорения заживления язвочек и эрозий и сокращения длительности выделения вируса на участках поражения [22]. Применение данных лекарственных форм начинают при появлении первых признаков активации инфекции (чувство жжения, зуд и т.д.) и продолжают вплоть до эпителизации эрозий. Рано начатое местное лечение может предотвратить развитие везикул.
В комплексную терапию пациентов с простым герпесом необходимо включать местные противовирусные средства, способствующие стабилизации и разрешению процесса [12].
При анализе ассортимента противовирусных средств на российском рынке установлено, что большинство противовирусных препаратов выпускается в виде твёрдых лекарственных форм – 66 %, в виде мягких лекарственных форм – 22 %, а в форме жидких – 12 % [22], лидером же является ацикловир [6].
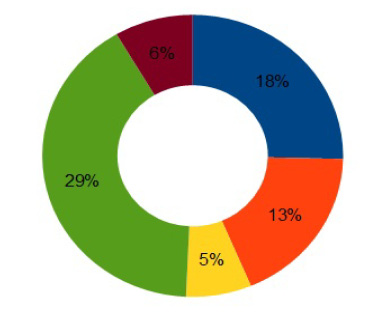

Ассортимент лекарственных форм, содержащих ацикловир
Следует отметить, что современная фармакотерапия герпеса эффективно уменьшает его клинические проявления, положительно влияет на психическое состояние пациентов и приобретает комплексный подход. Несмотря на различные достижения в лечении герпеса, ацикловир по-прежнему играет значительную роль в данном направлении и привлекает внимание исследователей по созданию комбинированных препаратов. В связи с чем актуальными являются исследования по разработке лекарственной формы комбинированного состава, обладающей противогерпесным эффектом – медицинские карандаши.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Хаджиева З.Д., д.фарм.н., профессор, профессор кафедры технологии лекарств ПМФИ – филиала ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Читайте также:


