Золотистый стафилококка и алкоголь
Золотистый стафилококк (Staphylococcus aureus) – грамположительная условно-патогенная бактерия, распространенная повсеместно. В норме золотистый стафилококк могжет находиться у человека на слизистой оболочке носа, в брюшной полости и на коже.
Попав в организм человека, золотистый стафилококк вырабатывает токсины и может стать источником сепсиса при снижении иммунитета, вызывая генерализованные инфекции с очагами воспаления во внутренних органах, коже и костно-мышечной системе.
Основные источники инфекции: здоровые (носители) и больные люди, домашние и сельскохозяйственные животные, а также пища, содержащая золотистый стафилококк и его мощные токсины (чаще всего это сахаросодержащие молочные продукты, мороженное, кондитерские изделия без термообработки, салаты и т.п.).
Дети могут инфицироваться от взрослых стафолококконосителей. У детей грудного возраста возможно выделение стафилококка в посевах фекалий.
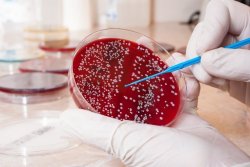
В эпидемиологических целях анализ на выявление патогенного стафилококка обязательно проводят во время ежегодных профилактических осмотров и при предварительных осмотрах для приема на работу в сферы обслуживания населения: медицины, образования, питания и торговли. В данном случае посев выполняется из носа и зева.
При наличии патогенного стафилококка в пробе обследуемого, через 18-24 часа наблюдается рост колоний золотистого цвета. В этом случае обязательно определяется количество стафилококка. Это необходимо врачу для решения вопроса о том, нужно ли проводить лечение.
Наличие золотистого стафилококка не обязательно означает инфекцию, это может быть бессимптомное носительство, например, при посеве мазков из носа и зева носительством считается количество бактерий до 10 3 КОЕ. Однако более высокие показатели говорят о том, что это уже не бессимптомное носительство, а то, что выявленный золотистый стафилококк может являться причиной заболевания.
- Для выяснения бактерионосительства или опасного инфицирования.
- Для подтверждения, что стафилококк является причиной возникшего заболевания (об этом свидетельствуют высокие показатели посева).
- Для определения целесообразности лечения.
- Для контроля за состоянием пациента после проведенного лечения.
Исследование можно пройти по направлению от лечащего врача вашей поликлиники, если есть клинические показания или на платной основе.
Лаборатория клинической микробиологии (бактериологии) Мурманской областной больницы предлагает следующие услуги по обнаружению патогенного стафилококка:
Микробиологическое (культуральное) исследование отделяемого зева на патогенный стафилококк
Микробиологическое (культуральное) исследование отделяемого носа на патогенный стафилококк
Микробиологическое (культуральное) исследование испражнений на стафилококк
Срок выполнения анализа: от 2 до 5 рабочих дней.
Подготовка к исследованию:
- Сбор материала проводится до начала лечения антибактериальными, иммунобиологическими препаратами (общего и местного значения).
- При контроле эффективности лечения (после окончания курса лечения) исследование проводится через 14 дней.
- Мазок из зева собирают натощак или через 3–4 часа после приема пищи.
- Перед взятием мазка из носа нельзя промывать носовые ходы.
- Желательно за 2–3 дня до взятия пробы находиться на диете, исключающей приём продуктов, усиливающих процессы брожения в кишечнике и молочнокислые продукты, а также алкоголь.
- За 3–4 дня до исследования необходимо отменить приём слабительных препаратов, касторового и вазелинового масла и прекратить введение ректальных свечей.
- Фекалии собираются ложечкой в стерильный одноразовый контейнер с завинчивающейся крышкой в количестве не более 1/3 объёма.
- Для получения достоверного результата - пробы фекалий храните в темном месте при температуре не выше 20—25 °С, во избежание чрезмерного размножения кишечной микрофлоры.
- Пробы фекалий не замораживайте.
Возможная соматическая патология у больных с неотложными состояниями, связанными с употреблением алкоголя, представлена поражением практически всех органов и систем организма.
Нарушения дыхательной системы при длительном алкогольном воздействии обусловлены повреждением отофарингеальной микрофлоры, нарушением механического и целлюлярного удаления микроорганизмов из легких, снижением гуморального и клеточного иммунитета. Практически всегда у больного с хронической алкогольной интоксикацией развивается хронический бронхит, а при достаточном стаже заболевания — пневмосклероз.
Характерной особенностью пневмоний у больных алкоголизмом является длительное ее течение без четкой клинической картины. Часто отсутствует лихорадка, воспалительные изменения лейкоцитарной формулы. У таких больных пневмонии имеют склонность к абсцедированию.
В случае острой алкогольной интоксикации (ОАИ) чаще всего имеет место аспирационная пневмония.
При алкогольном делирии также высока вероятность аспирационной пневмонии. Кроме того, очень вероятна нозокомиальная пневмония, развитию которой способствует длительная фиксация, седативная и антипсихотическая терапия, приводящая к выраженному нарушению дренажной функция трахеобронхеального дерева.
Особенности лечения пневмонии следующие:
Внебольничные пневмонии чаще всего вызвают Streptococcus pneumoniae и Haemophilus influenzae, Klebsiella pneumoniae, различные энтеробактерии и легионеллы, Chlamydia pneumoniae, Staphylococcus aureus, Mycoplasma spp.Для них характерны постепенное развитие, медленное нарастание клинической картины. Как уже упоминалось, у больных алкоголизмом велика вероятность абсцедирования и эмпиемы плевры.
Антибиотики резерва представлены комбинацией: триметоприм/сульфаметоксазол + макролид.
В случае, когда возбудителем является золотистый стафилококк, назначают пенициллиназоустойчивые пенициллины или ванкомицин.
Аспирационную пневмонию чаще всего вызывают бактероиды, пептострептококки, фузобактерии, энтеробактерии, пневмококки.
Антибиотики резерва представлены комбинацией: клиндамицин + активные в отношении синегнойной палочки аминогликозиды.
Возбудителями госпитальной пневмонии чаще всего являются энтеробактерии (Enterobacter spp, Citrobacter spp.), актинобактерии, синегнойная палочка, легионелла, золотистый стафилококк.
Для злоупотребляющих алкоголем больных рекомендуются следующие препараты: фуразолидон, метронидазол, хлорпропамид, левомицетин, цефалоспорины, сульфаниламиды, обладающие тетурамоподобным действием.
Следует помнить, что изониазид и тетрациклины ускоряют поражение печени [8].
Артериальная гипертензия является наиболее распространенной патологией сердечно-сосудистой системы у злоупотребляющих алкоголем больных.
Прием большого количества алкоголя или алкогольный абстинентный синдром (ААС) часто сопровождаются повышением артериального давления, что способно привести к поражению органов-мишений (гипертоническая энцефалопатия, острое нарушение мозгового кровообращения, острый коронарный синдром, острая сердечная недостаточность, расслаивающая аневризма аорты).
В низких дозах (12–15 г чистого этанола в сутки) этанол улучшает липидный профиль снижения агрегационной способности тромбоцитов. В наибольшей степени это благоприятное влияние выражено у мужчин 50–60 лет при употреблении в вышеприведенных умеренных дозах красного сухого вина.
Одновременно не подлежит сомнению тот факт, что продолжение приема алкоголя на фоне уже имеющейся ИБС ухудшает прогноз заболевания.
У таких больных алкоголь в сочетании с физической нагрузкой может приводить к безболевым инфарктам миокарда, во-первых, вследствие того, что алкоголь сам по себе является анестетиком, а во-вторых, из-за алкогольной невропатии, при которой первыми поражаются чувствительные нервные волокна [9].
Алкогольная кардиомиопатия обычно развивается при злоупотреблении алкоголем в течение более 10 лет (в последнее время прослеживается четкая тенденция к снижению этого срока).
В патогенезе поражения сердца участвуют два механизма: инфильтрация миокарда жировой тканью с дегенерацией кардиомиоцитов и тиаминзависимое поражение вегетативной нервной системы.
Морфологическая картина алкогольной кардиомиопатии складывается из группы патологических проявлений, в число которых входят:

Рисунок 1. Стромальный липоматоз миокарда

Рисунок 2. Дилатированные камеры сердца

Рисунок 3. Гиперэластоз эндокарда левого желудочка. Истончение стенок и дилатация сердца
Поражение слизистой желудка в виде алкогольного гастрита или язвы обусловлено прямым токсическим воздействием не только алкоголя, но и ацетальдегида, образующегося при участии алкогольдегидрогеназы IV типа. Этот фермент находится в слизистой желудка и метаболизирует 19% поступающего этанола, окисляя его до ацетальдегида [9].
Таким образом, злоупотребление алкоголем является независимым фактором риска развития язвенной болезни желудка и двенадцатиперстной кишки, осложняет течение Helicobacter pylory-ассоциированного поражения слизистой, препятствует рубцеванию язвы, способствует ее рецидивированию.
Другие более редкие причины желудочно-кишечного кровотечения у больных с хронической алкогольной интоксикацией — синдром Меллори–Вейса (надрыв слизистой кардиального отдела пищевода в результате упорной рвоты), синдром Берхава (разрыв всех слоев пищевода) и кровотечение из варикозно-расширенных вен пищевода. Синдром Меллори–Вейса и синдром Берхава нередко развиваются на фоне ААС, для которого характерна повторная рвота. Если у больного с клиникой ААС вместо гипертонии регистрируется гипотония, в первую очередь необходимо исключить желудочно-кишечное кровотечение.
Печень. Гепатоцит — основное место, где происходит окисление этанола с образованием ацетальдегида, поэтому основной удар приходится именно на печень. Наибольшие изменения наблюдаются в центролобулярной зоне, в этой же зоне происходит некроз гепатоцитов.
Жировая дистрофия печени — потенциально обратимое состояние, развивается при употреблении 50–60 г чистого этанола ежедневно.

Рисунок 4. Алкогольный жировой гепатоз

Рисунок 5. Алкогольный гепатит

Рисунок 6. Варикозные вены пищевода

Рисунок 7. Цирроз печени. Спленомегалия
Морфологически отмечается накопление жира в гепатоцитах вследствие остановки окисления жирных кислот, вызываемой алкоголем (рис. 4). Наряду с крупнокапельным ожирением гепатоцитов, имеют место перицеллюлярный фиброз вокруг центральных вен, нейтрофильная инфильтрация междольковых, а иногда и внутридольковых (вокруг гепатоцитов) отделов печени, набухание гепатоцитов, отложение в них гиалиновых телец Мэллори [9].
Клиническое течение самого жирового гепатоза обычно бессимптомное. Отмечается увеличение содержания в сыворотке крови g-глутамилтранспептидазы, умеренное повышение активности сывороточных трансаминаз и щелочной фосфатазы. Прекращения приема алкоголя обычно достаточно для полной регрессии заболевания.
Острый алкогольный гепатит (рис. 5) обычно развивается в случае, когда печень не способна метаболизировать индивидуально токсическую дозу этанола. Чаще всего развивается вместе с ААС. Возможно фульминантное (молниеносное) течение заболевания с крайне неблагоприятным прогнозом. При фульминантном гепатите быстро развивается печеночная энцефалопатия, вероятно развитие портальной гипертензии по синусоидальному типу, геморрагического и гепаторенального синдромов.
Лечение острого алкогольного гепатита проводится параллельно с терапией ААС, так как отказ от алкоголя является непременным условием эффективности лечения.
Алкогольный цирроз печени развивается при потреблении 80–100 г этанола в сутки в течение 10–15 лет.
У больных с хронической алкогольной интоксикацией цирроз печени может формироваться на фоне фиброза без промежуточного этапа в виде алкогольного гепатита.
Фиброз развивается в результате трансформации жировых клеток Ито (липоцитов печени) в фибробласты и миофибробласты. Синтез коллагена стимулируется гипоксией и некрозом клеток, а также продуктами перекисного окисления липидов [9].
Так как цирроз печени — необратимое состояние, терапия должна быть направлена на предупреждение и коррекцию осложнений, от которых больные и погибают. Осложнения включают ряд синдромов.
Синдром портальной гипертензии, проявляющийся варикозным расширением вен пищевода (рис. 6), желудка, геморроидального сплетения, кровотечениями из расширенных вен, спленомегалией (рис. 7, 8). Характерно развитие венозных коллатералей передней брюшной стенки.
Лечение предполагает применение:
Желтуха свидетельствует о превалировании процесса разрушения гепатоцитов над процессами регенерации и потому является плохим прогностическим признаком.
Отечно-асцитический синдром проявляется скоплением жидкости в брюшной полости и периферическими отеками.
Синдром печеночной энцефалопатии проявляется нарушением циклов сна и бодрствования, конструктивной апраксией, хлопающим тремором. При прогрессировании нарастают нарушения сознания вплоть до печеночной комы.
Синдром нарушения белково-синтетической функции печени проявляется гипоальбуминемией, гипопротеинемией, кровоточивостью (рис. 9).
Гепаториенальный синдром проявляется прогрессирующей почечной недостаточностью.
Лечение предполагает экстракорпоральную детоксикацию.
Поджелудочная железа. В настоящее время принято считать дебют алкогольного панкреатита потенциально обратимым острым панкреатитом, который, однако, при продолжении алкоголизации ведет к необратимому изменению поджелудочной железы.

Рисунок 8. Мелкоузловой цирроз печени

Рисунок 9. Кровотечение из острых эрозий желудка

Рисунок 10. Индуративный панкреатит с очагами стеатонекроза
Алкоголь и его метаболиты (ацетальдегид) влияют на сфинктер Одди, протоки железы, ацинарные клетки железы, вызывая внутрипротоковую гипертензию. Обычно злоупотребление алкоголем в течение нескольких лет приводит к осаждению белков внутри протоков поджелудочной железы. Со временем отложения белков становятся более распространенными, что вызывает гистологические изменения. Через 3–5 лет развивается первый клинический приступ панкреатита, обусловленный преждевременной активацией ферментов поджелудочной железы. При этом трипсин и фосфолипаза А2 обусловливают некроз тканей, эластаза — разрушение стенок кровеносных сосудов и геморрагический синдром [9].
После первой недели заболевания прежде всего опасны осложнения некроза поджелудочной железы: вторичное инфицирование нежизнеспособных тканей (обычно, грамотрицательная флора), кистоид поджелудочной железы — скопление панкреатической жидкости и тканевого детрита, отграниченное капсулой из фиброзной стенки и сосудов, опасный инфицированием, кровотечением и перфорацией.
Характер течения алкогольного панкреатита непостоянен, в первые годы часто отмечается его рецидивирующее течение, а по мере прогрессирования панкреатита, гибели паренхимы поджелудочной железы заболевание приобретает безрецидивное течение с постоянными болями и функциональными расстройствами: внешнесекреторной панкреатической недостаточностью; скрытым или явным сахарным диабетом, реже — гипогликемическим синдромом; симптомами холестаза; нарушениями дуоденальной проходимости; сегментарной портальной гипертензией; воспалительными и гнойными осложнениями.
Лечение острого алкогольного панкреатита и обострения хронического панкреатита часто приходится проводить одновременно с лечением ААС (часто осложненного алкогольным делирием, что значительно утяжеляет состояние больного и ухудшает прогноз). В таких случаях к терапии по возможности присоединяют транквилизаторы, антипсихотические препараты, β-адреноблокаторы, восполняют дефицит витаминов, прежде всего группы В.
Базовая терапия предусматривает:
Комплекс интенсивной терапии при панкреонекрозе с органной недостаточностью включает современные методы детоксикации, продленной искусственной вентиляции легких, возмещение дефицита жидкости, электролитов, белкового состава крови, устранение анемии, парентеральное и энтеральное зондовое питание, инсулинотерапию.
Показаниями к операции при остром панкреатите являются:
Возможности консервативного лечения в хронической фазе панкреатита ограничены. Поэтому основные усилия должны быть направлены на смягчение болей, рациональную диетотерапию, коррекцию внешне- и внутрисекреторной недостаточности поджелудочной железы (ферментные и сахароснижающие препараты), а также на устранение этиологических факторов панкреатита — воздержание от приема алкоголя.
Проявлениями миоренального синдрома являются рабдомиолиз и острая почечная недостаточность.
Клинически характерны быстро нарастающий деревянистый отек поврежденной конечности, нарушение чувствительности, появление грязно-бурой мочи.
В олигоанурической стадии (до 3 нед) на первый план выступают симптомы уремии. Часто на этой стадии развивается алкогольный делирий. При благоприятном исходе наступает фаза ранней полиурии и восстановления функции почек.
Лечение осуществляется в отделении интенсивной терапии, где имеется возможность проведения экстракорпоральной детоксикации [9].
В. Г. Москвичев, кандидат медицинских наук
Р. Ю. Волохова
А. Л. Верткин, доктор медицинских наук, профессор
МГМСУ, ННПОСМП, Москва
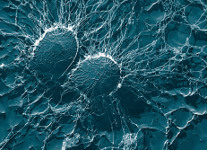
Недавно американские биохимики смогли разгадать одну из самых сложных загадок, которые загадывает людям золотистый стафилококк, пренеприятнейший и опаснейший для человечества микроорганизм. Ученые выяснили, каким образом он может нейтрализовать действия иммунных клеток. Оказалось, что бактерия использует для этого их же собственное оружие.

Одной из самых опасных для человечества болезнетворных бактерий является золотистый стафилококк (Staphylococcus aureus), постоянными носителями которого являются около 20 процентов населения Земного шара — он может достаточно долго сохраняться на кожных покровах и слизистых оболочках верхних дыхательных путей человека. Этот микроорганизм вызывает целый ряд заболеваний, начиная от кожных раздражений и фурункулов, и заканчивая такими опасными болезнями как пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и сепсис. Однако самое опасное в нем то, что стафилококк не только весьма устойчив к действию антибиотиков (что происходит от способности бактерии быстро мутировать в "нужном направлении"), но и нечуствителен к "атакам" со стороны иммунных клеток человека.
Вообще, когда наблюдали за поведением этой бактерии в живом организме, то создавалось впечатление, что наши клетки-защитники смертельно боятся стафилококка. Обычно вокруг патогенного микроорганизма после попадания его в тело человека сразу же собираются стройные ряды тех, кто защищает наше здоровье. Причем первыми подходят клетки, известные как нейтрофилы — в их задачу входит задержать "нарушителя" до тех пор, пока не появится "тяжелая артиллерия" в виде макрофагов-моноцитов. Именно они-то и уничтожают носителя инфекции.
Однако, в случае со стафилококком, заключительного этапа данной "операции" почему-то не происходит — макрофаги совсем не стремятся приблизится к зловредному микроорганизму, словно он чем-то отпугивает их. Но что это может быть? Недавно группе ученых из медицинского центра Чикагского университета (США), которой руководил профессор Олаф Шнеевинд, удалось выяснить, каким именно образом стафилококку удается успешно отражать атаки иммунных клеток. И самым интересным оказалось то, что микроорганизм побеждает своих противников, используя их собственное оружие.
Сначала исследователи выяснили, что среди всех штаммов S. aureus имеется один, содержащий мутацию генов, кодирующих ферменты под названием стафилококковая нуклеаза и аденозинсинтетаза. Оба этих белка нужны для того, чтобы разрушать нуклеиновые кислоты (например, наследственное вещество вирусов-бактериофагов, что проникают в бактериальную клетку). После ряда экспериментов выяснилось, что именно особи этого мутантного штамма наиболее эффективно "отбивают" атаки макрофагов. Ученых заинтересовал один вопрос — не могут ли быть связаны данные мутации со способностью бактерий противостоять действиям клеток-защитников?
Оказалось, что связь между двумя этими явлениями действительно имеется. Как было сказано выше, сначала на пути инфекционного агента всегда встают клетки-нейтрофилы, которые, обнаружив "нарушителя", начинают выбрасывать из своих ядер собственное ДНК во внешнюю среду (сами они при этом погибают). Эта ДНК собирается в структуру, напоминающую сложную сеть, в которой и запутывается бактерия. Таким образом нейтрофилам ценой собственной жизни уудается задержать патогенный микроорганизм до того момента, когда к нему приблизятся макрофаги и убьют его.
Так вот, проведенные группой Шнеевинда эксперименты с нормальными и мутантными штаммами стафилококков показали, что когда макрофаги подходили к запутавшимся в ДНК-овой сети бактериям, то, в том случае, если это был мутант, они просто… погибали. Более подробное изучение ситуации показало, что микроорганизмы убивали их каким-то токсином — у погибших макрофагов были все признаки клеточного "отравления". Но откуда стафилококки брали этот яд? Оказывается, они с помощью модифицированных ферментов стафилококковой нуклеазы и аденозинсинтетазы превращали компоненты нитей нейтрофильной ловушки в вещество под названием 2'-дезоксиаденозин, который смертельно опасен для макрофагов.
Таким образом, стафилококк научился бороться с защитными клетками, используя их же собственное оружие. Именно поэтому в последнее время этот микроорганизм стал практически неуязвимым для человеческого иммунитета. И сразу же стало ясно, что прежняя стратегия борьбы с этим вредителем была совершенно не рациональной — она как раз подразумевала то, что если больной стафилококковой инфекцией будет принимать лекарства, стимулирующие иммунитет, то он сможет справится со стафилококком (эта стратегия была избрана после появления у стафилококка штаммов вроде MRSA, которые не чувствительны к действию антибиотиков). Но после открытия ученых из группы профессора Шнеевинда стало ясно, что этим микроорганизм не остановить — сколько не стимулируй иммунитет, он все равно взломает "линию обороны" клеток защитников.
Впрочем, авторы работы уверены в том, что отчаиваться не следует — нужно просто пересмотреть саму стратегию. Хотя с их точки зрения, справиться с вышеописанной особенностью бактерии, которая позволяет ей избавляться от макрофагов, будет непросто: если начать создавать препараты, блокирующие действия "мутантных" бактериальных ферментов и дезоксиаденозина, то есть риск того, что эти лекарства смогут повредить и человеческому организму. Однако все-таки, по мнению биохимиков, разработать такое вещество, которое смогло бы и бактерию ее оружия лишить, и больному хуже не сделать, все-таки возможно…
Читайте самое интересное в рубрике "Наука и техника"
Знаете ли вы, что простуда или постоянные воспаления на коже могут оказаться следствием активности золотистого стафилококка — опасной и очень распространенной бактерии, которой можно заразиться где угодно? Чем грозит заражение стафилококком и как понять, что вам необходимо сдать пробу на этот микроорганизм? В статье мы расскажем о вариантах инфицирования и проведения анализа, а также дадим несколько советов по выбору клиники для исследования.
Типы анализов на выявление стафилококков
Стафилококковые бактерии имеют шарообразную форму, относятся к грамположительным, и насчитывается их около 30-ти видов. Некоторые представители рода присутствуют в организме, на слизистых и коже человека, не нанося вреда. Но золотистый, сапрофитный и эпидермальный стафилококки могут нанести серьезный удар по здоровью. В некоторых случаях бактерии вызывают воспалительные процессы. Действие опасных представителей стафилококков заключается в поражении организма токсинами, которые они вырабатывают в процессе жизнедеятельности, а также в снижении барьерной функции иммунитета.
Сапрофитный стафилококк локализуется в основном в мочевыводящих и половых органах, чаще у женщин, чем у мужчин, и может вызвать цистит. Эпидермальный стафилококк всегда живет на поверхности нашей кожи, но если при повреждении покровов он попадает в кровь, то при ослабленном иммунитете может вызвать ее заражение.
Самый опасный — золотистый стафилококк — может навредить абсолютно любым органам. Он одинаково легко поражает женщин и мужчин, пожилых и детей. В основном вызывает гнойные процессы на коже или во внутренних органах (мозг, сердце и др.), а также может стать причиной пищевого отравления, воспаления легких, менингита и других заболеваний. И самое страшное — золотистый стафилококк очень трудно победить, он не боится ни высоких температур, ни чистого спирта, резистентен ко многим антибиотикам и антисептикам. Несмотря на то, что бактерия давно и довольно подробно изучена, стопроцентно эффективного лечения пока не существует.
Заразиться золотистым стафилококком можно воздушно-капельным путем, через внешний контакт (пыль, поверхности вещей, одежда), через кровь, нестерильные медицинские инструменты. Спровоцировать патологическую активность стафилококков можно сильным переохлаждением организма, постоянным употреблением никотина и алкоголя, перманентными стрессами и недосыпом.
Поскольку стафилококк может локализоваться практически в любом отделе организма, только квалифицированный врач способен решить, какой именно биоматериал нужно сдать, чтобы подтвердить или опровергнуть наличие бактерии. Для анализа на стафилококк чаще всего берут мазок из носа, глотки или с других слизистых оболочек. Также сдают кровь, мочу или кал, грудное молоко.
Появление патологической активности стафилококков не бывает бессимптомным. Существует ряд признаков, которые могут указывать на наличие заражения. Если вы их заметили, необходимо срочно обратиться к врачу.
Есть группы людей, которых вышеперечисленные симптомы обязывают пройти обследование на стафилококк. Дело в том, что они легче заражаются этими бактериями и им труднее от них избавиться. В группе риска люди, страдающие онкологическими заболеваниями, сахарным диабетом или ВИЧ, пациенты на гемодиализе. Здесь же те, кто часто получает травмы кожи (порезы, ожоги), работает в медицинских учреждениях или в сельском хозяйстве. Пожилые и новорожденные, кормящие матери и люди с ослабленным иммунитетом также входят в число тех, для кого повышен риск заражения стафилококком.
Анализ на стафилококк сдают не только носители симптомов. Его обязательно назначают беременным, чтобы исключить возможность внутриутробного заражения, госпитализированным пациентам в целях профилактики, сотрудникам общепита и медицинскому персоналу. Направление на анализ может дать терапевт или педиатр, ЛОР, инфекционист, уролог, маммолог, дерматолог и даже гастроэнтеролог. Если человек получил такое направление, то необходимо выполнить ряд предписаний, влияющих на степень достоверности результата.
Перед сдачей анализа на золотистый стафилококк нельзя принимать антибиотики в течение двух месяцев. Если же пациент проходил курс лечения антибактериальными препаратами, нужно обязательно сообщить об этом врачу. То же касается и противовирусных лекарственных средств, если проводится анализ крови. Забор материала производится натощак, обычно утром. Перед посещением лаборатории лучше воздержаться от курения в течение нескольких часов.
Пациенту, сдающему на анализ мокроту из носа или зева, нужно выпить побольше жидкости за 10–12 часов до пробы. Так выделения станут менее густыми, и врачу легче будет взять материал. За восемь часов до анализа нельзя пить и есть, чистить зубы, поэтому обычно исследование назначают на утро.
За двое суток перед сдачей мочи пациенту нужно прекратить прием мочегонных средств, а за трое суток перед сдачей кала — отказаться от слабительных или иных препаратов, влияющих на работу кишечника (в том числе свечей и мазей). Если сдается мазок из половых органов, то мужчинам рекомендуется не посещать туалет за три часа до процедуры, а женщинам приходить на анализ перед менструацией или через два дня после ее окончания.
Если пациент собирает биоматериал самостоятельно, на нем лежит ответственность за правильность процедуры. Необходимо помнить, что кал или мочу нужно собирать в стерильную емкость, которую можно купить в любой аптеке. Не стоит стерилизовать тару в домашних условиях, это не дает стопроцентной гарантии чистоты.
Сбор материала в медицинском учреждении происходит следующим образом. Мазок со слизистой носа и ротоглотки берут небольшим ватным тампоном, процедура абсолютно безболезненная. Затем врач помещает пробу в специальную питательную среду, где бактерии, если они есть, будут стремительно размножаться. А вот забор крови может доставить несколько неприятные ощущения, потому что ее берут из вены.
Забор выделений из раны или какой-либо другой пораженной области производится тоже с помощью ватного тампона. Будет ли это болезненным, зависит от характера повреждения, но, как правило, врачу достаточно очень маленького количества биоматериала, поэтому боль терпимая.
Получить результат анализа крови или мазка можно уже по прошествии суток, кала или мочи — чуть позже. В последнем случае сроки зависят от особенностей работы медицинского учреждения (от полутора до трех дней).
Если результат отрицательный, значит, в организме человека нет бактерий золотистого стафилококка. Если же результат положительный, это значит, что человек либо болен, либо является носителем инфекции. И в том, и в другом случае необходимо пройти курс лечения, так как бактерия обязательно проявит агрессию и даст о себе знать неприятными проявлениями.
Не обладающий медицинскими знаниями человек не может самостоятельно определить факт заражения стафилококковой инфекцией. Никакие симптомы не могут однозначно указать на наличие бактерии в организме. Поэтому при частом возникновении заболеваний дыхательных путей, воспалений, в случае периодических отравлений лучше обратиться к специалистам и сдать анализ на золотистый стафилококк. Оперативное получение результата и своевременное лечение может избавить пациента от многих осложнений, некоторые из которых перетекают в хронические заболевания и почти не лечатся.
Болезнь лучше предупредить, чем лечить. Меры профилактики поражения золотистым стафилококком просты. Тщательно мойте продукты и руки перед едой, обязательно обрабатывайте ранки при получении даже небольших повреждений (особенно это касается детей), поддерживайте чистоту в доме и регулярно проводите глубинную чистку мягкой мебели и постельных принадлежностей.
Читайте также:


