Золотистый стафилококк на чашке петри
Строим дом для бактерий

Знаете ли вы, сколько бактерий обитает на ваших ладонях? А на крышке телефона? А на каком-нибудь предмете, которым вы пользуетесь каждый день и, как вам кажется, содержите в чистоте? Нет? Хотите посмотреть? Предлагаем доступный способ увидеть мир, обитающий на кончиках пальцев.
- жирное мясо (50 г);
- вода (0,5 л);
- пакетик агара (это вещество выделяется из красных и бурых водорослей, продаётся в некоторых продуктовых магазинах в виде порошка).
Это такая стеклянная или пластиковая лабораторная посуда, состоящая из двух плоских чашек, которые входят друг в друга. Такое строение служит для защиты от внешних загрязнений или газов, выделяемых самими колониями бактерий. Чашки Петри продаются в большинстве аптек, стоят дёшево.
Строим дом
1. Подготовьте среду для роста и размножения будущих бактерий: сварите мясной бульон. Лучше поварить мясо подольше, чтобы получилось наваристее.
2. Добавьте в сваренный бульон агар из расчёта 1/2 чайной ложки (1,2 г) на каждые 1/4 стакана (60 мл жидкости). Это количество подходит для одной чашки Петри.
3. Разогрейте вашу свесь в микроволновке, доведите до кипения, и дождитесь, пока весь порошок агара не растворится. После этого остудите.

4. Возьмите чашки Петри. Обратите внимание: они должны быть стерильными внутри! Если не уверены, окуните в кипяток, только аккуратнее, чтоб не ошпариться. Чтобы не занести бактерии из воздуха, лучше проделывать все операции возле горящей газовой горелки.

5. Залейте питательную смесь в нижнюю половинку тонким слоем, лишь слегка покрывающим дно, и как можно быстрее закройте ёмкость верхней чашкой. Дайте остыть.

6. Поставьте закрытые чашки Петри в холодильник. Лучше, чтобы нижняя половинка оказалась сверху. Это нужно, чтобы предотвратить разрушение среды каплями конденсата. Дождитесь, пока среда станет похожей на твёрдое желе. Готовые чашки Петри могут храниться в холодильнике около двух месяцев.
Новоселье
1. Достаньте чашки Петри из холодильника и разогрейте их до комнатной температуры. Теперь можно приступать к заселению! Тут есть множество вариантов — всё зависит от вашей фантазии. Мы решили посмотреть, какие бактерии живут на кончиках пальцев.

2. Прикоснитесь к желе поочерёдно пятью пальцами в разных местах. Делать это надо аккуратно, не повреждая поверхность. Накройте ёмкость со следами пальцев верхней чашкой (это надо делать очень быстро) и запечатайте, например, клейкой лентой. На нижней поверхности чашки маркером обведите отпечатки пальцев и подпишите.



5. Попробуйте идентифицировать микроорганизмы, колонии которых вырослив чашках. Для этого у микробиологов есть множество способов типа выделения чистой культуры, окраски по Граму, биохимических проб. Мы сможем использовать лишь некоторые — определить цвет и форму колонии.

Знакомство
- после поездки в общественном транспорте;
- после долгой работы за компьютером;
- после того как руки помыты с мылом / без мыла;
- после возвращения с работы / из школы / из университета;
- после рукопожатий с соседями справа, слева и снизу, а также поездки в лифте с хозяином трёх американских бульдогов.
Для сравнения оставьте в одной из чашек отпечатки максимально чистых рук (помыть антибактериальным мылом, протереть дезинфицирующим раствором).
На ваших пальцах обитают самые разные виды микроорганизмов, и определить, что в каком месте выросло, очень сложно. Можно лишь делать предположения, например:
- разные виды стафилококков могут образовывать красящие вещества (пигменты) золотистого, белого и лимонно-жёлтого цветов;
- колонии Serratia marcescens имеют красный цвет;
- розовый микрококк — розовый;
- Pseudomonas aeruginosa — синий;
- хромобактер фиолетовый — фиолетовый;
- микобактерии туберкулёза — жёлтый или ярко-оранжевый;
- некоторые виды плесени (на всякий случай напоминаем, что плесень — это разновидность грибов, а не бактерий) образуют чёрные мохнатые колонии.
Разумеется, точно определить микробов можно только в лаборатории.
Выселение
Рано или поздно колония полностью удовлетворит ваше любопытство и по закону роста микроорганизмов начнёт погибать. А это значит, что пришла пора от неё избавиться — жёстко и беспощадно, чтобы освободить дом для новых жильцов. Ну, или решить, что быть микробиологом не ваше призвание, и избавиться от чашек Петри. На самом деле колонии, выросшие по мановению вашей руки, вряд ли опасны, однако это не освобождает вас от обязанности похоронить их по всем правилам микробиологии со всеми ритуалами и почестями.

1. Обеспечьте себя защитой: наденьте фартук, маску и резиновые перчатки.

2. Залейте чашки Петри небольшим количеством хлорного раствора и оставьте на несколько минут.

3. Вылейте содержимое, ополосните чашки, положите их в пакеты, а после — в мусорное ведро.
Предупреждение: если вы захотите самостоятельно продолжить эксперименты по выращиванию микробов, не используйте какие-либо биологические жидкости (например, слюну), иначе можно вырастить колонии, опасные для здоровья. Соблюдайте меры предосторожности и будьте аккуратны!

Рубрика: 11. Прочие отрасли медицины и здравоохранения
Дата публикации: 02.05.2018
Статья просмотрена: 806 раз
Целью работы является продемонстрировать, что бактерии класса стафилококков не поддаются воздействию антибиотиков.
Задачи работы.
1. Определить необходимость антибиотиков.
2. Проанализировать пользу антибиотиков для человека.
3. Проанализировать эффективность использования антибиотиков.
4. Провести эксперимент, который доказывает, что стафилококк не поддаются воздействию антибиотиков.
Для исследования использовалось: наблюдения, фотографирование, сравнительный анализ, работа с источниками информации, проведение экспериментов и анкетирований. Были изучены свойства часто спрашиваемых антибиотиков в аптеках. А так же был проведен эксперимент, который доказывал, что стафилококки не поддаются воздействию антибиотиков широкого спектра пенициллинового ряда.
Анкетирование провизоров
Нужно было выяснить, какие антибиотики чаще всего спрашивают. И выяснилось, это с помощью анкетирования провизоров.Был проведен опрос 23 аптек. Провизорам были заданы следующие вопросы:
1) Часто ли покупатели просят продать антибиотики пенициллинового ряда без рецепта?
2) Можно ли купить антибиотики пенициллинового ряда без рецепта, и в каких случаях?
3) Какие антибиотики пенициллинового ряда чаще всего спрашивали покупатели?
Все аптеки ответили по-разному, поэтому записала только самые спрашиваемые, это амоксиклав и флемоксин.
Народное анкетирование
Был проведен опрос возле аптек города Новосибирска. Чтобы сгруппировать опрошенных людей между собой, воспользовалась теорией психосоциального развития Эрика Эриксона. Юность (18–19 лет), молодость (19–35 лет), взрослость (35–60 лет), старость (от 60 лет).
Всего было опрошено 73 человека. Из опроса стало ясно, что большинство жителей 18–19 лет употребляют антибиотики по назначению врача, 19–35 лет чаще всего самостоятельно назначают себе курс лечения антибиотиками т. к. эта группа людей постоянно спешит. У них нет времени болеть, поэтому они пьют антибиотики чаще всего. 60 и более лет жители пьют курс антибиотиков если им назначил врач.
Подготовка питательной среды для эксперимента
Для проведения опытов с бактериями необходимо подготовиться. Для начала, должны подготовить питательную среду. Именно получение нужных питательных сред и создание оптимальных условий, обеспечивающих рост микроорганизмов в искусственных условиях. Для успешной постановки эксперимента исследователю необходимо выделить чистую культуру и подобрать оптимальную питательную среду для бактерий.
Для приготовления питательной среды, взяла нарезанное мясо говядины предварительно очищенного от костей, жира, сухожилий, пропустила через мясорубку. 500 г полученного фарша заливаю 1 л водопроводной воды, оставляю при комнатной температуре на 12 часов. Затем отжимаю мясо через марлю, и полученный настой кипячу 30 мин, остывший бульон фильтрую через ватный фильтр, довожу бульон до кипения добавляю 2 % агар-агара и кипячу 5 минут, добавляю 0,5 % хлорида натрия. Никаких других солей добавлять не требуется, т. к. они в достаточном количестве уже есть в бульоне. Предварительно перед заливанием питательной среды в чашки, они проходят термическую обработку в духовом шкафу. Заливаю нашу питательную среду в чашки Петри на ¾. Полученный бульон необходимо автоклавировать. У меня нет автоклава, поэтому, я использовала духовой шкаф при 210 градусов.

Рис. 1. Автоклавирование
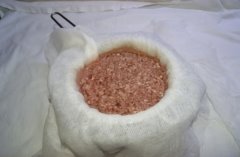
Рис. 2. Отжимание мяса через марлю

Рис. 3. Фильтрация через ватный фильтр

Рис. 4. Варка питательной среды

Рис. 5. Повторное автоклавирование
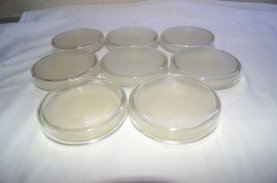
Рис. 6. Готовые чашки Петри с питательной средой
Подсадка бактерий вчашки Петри
Один из самых распространенных методов проведения подсадки — это прикосновение пальцев рук к поверхности питательной среды до или после мытья. Было принято решение выращивать колонии с двух образцов:
— с пальцев рук, предварительно санитарно не обработанных(ввиду большего количества бактерий).
—с человеческой слюны, ввиду того, что там находится порядка трех сотен разных видов бактерий.
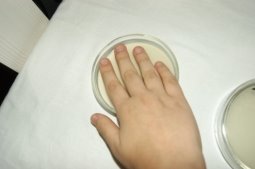
Рис. 7. Подсадка бактерий с рук

Рис. 8. Подсадка бактерий со слюны
Определение культур бактерий
Культуральные признаки бактерий характеризуются особенностью роста бактерий на плотных и жидких питательных средах. На плотных питательных средах изучаются признаки изолированно от других выросших в чашке Петри колоний бактерий. В зависимости от их положения в среде различают поверхностные и глубинные колонии. Наиболее типично видовые признаки выражены у поверхностных колоний.
а) форма колоний — округлая, неправильная, амебовидная, ризоидная, мицелиальная.
б) размер колонии — точечные (диаметр 1мм), мелкие (диаметр 1–2мм), средние (диаметр 3–4мм), крупные (диаметр более 4мм).
в) край колонии — ровный, волнистый, лопастной, бахромчатый.
г) структура колонии — однородная, мелкозернистая, крупнозернистая, струйчатая, волнистая.
д) профиль колонии — плоский, выпуклый, кратерообразный, конусовидный.
е) консистенция колонии — мягкая, слизистая, тягучая, хрупкая.
При этом форму, профиль, цвет, блеск определяют невооруженным глазом; край и структуру — при малом увеличении микроскопа; консистенцию — прикосновением к ее поверхности петлей; размеры — обычной линейкой.

Рис.9. Форма, профиль, край, структура колоний бактерийформа: а — округлая, б — неправильная, в — амебовидная, г — ризоидная, д — мицелиальная. Профиль: а — плоский, б — выпуклый, в — кратерообразный, г — бахромчатый. Край: а — ровный, б — волнистый, в — лопастной, г — бахромчатый. Структура: а — однородная, б — мелкозернистая, в — крупнозернистая, г — струйчатая, д — волнистая.
По данному алгоритму я определила, что в моих чашках Петри находится золотистый стафилококк, метициллинрезистентный золотистый стафилококк, плесень, стрептококки.
Выделение чистой культуры
Для выделения чистой культуры с чашки Петри нам понадобится: чашки Петри с чистой питательной средой для бактерий, три пробирки, самодельная микробиологическая петля из проволоки, дистиллированной вода, газовая горелка, пипетка или ватная палочка, маска и перчатки для защиты дыхательных путей и кожи рук от бактерий.
Берем микробиологическую петлю, нагреваем ее на газовой горелке до покраснения для дезинфекции, в момент, когда она остывает, ломаем колбу с дистиллированной водой, выливаем ее в пробирку примерно 2–3 мл, взяв микробиологическую петлю, соскабливаем колонию бактерий и помещаем ее в пробирку, тщательно перемешиваем до однородного раствора. Полученный однородный раствор собираем пипеткой и капаем в чашку Петри. Повторяем данный алгоритм до тех пор, пока не пересадим нужные колонии в новые чашки Петри.

Рис. 10. Дезинфекция микробиологической петли
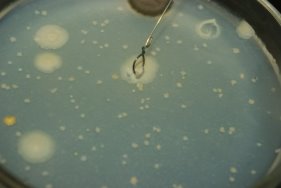
Рис. 11. Сбор колоний в чашку Петри
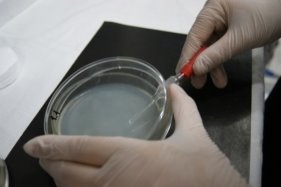
Рис. 12. Пересадка бактерий в чашку Петри
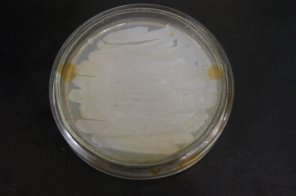
Рис. 13. Конечный результат
Проведение эксперимента сантибиотиками
Для проведения эксперимента с антибиотиками, была необходима информация, о количественном содержании антибиотика в одной таблетке. Затем провести расчеты, чтобы сделать растворы разной концентрации. Благодаря этому мы выясним, при какой концентрации антибиотика бактерии начинают погибать. Антибиотики начинают действовать в крови человека при 1,5–3мг/мл, я буду отталкиваться от этих данных.
Расчеты концентраций антибиотика флемоксин:
Необходимо было приготовить растворы с концентрацией в 10, 30 и 60 % содержания антибиотика, для этого использовали метод разбавления: исходный раствор был получен путем растворения таблетки в 100 мл воды, его концентрация составила 500мг/100мл=5мг/мл. От данного раствора была взята аликвота 1 мл, путем разбавления которой были получены растворы нужной концентрации из расчета: Раствор 1:
50мкг/100мл=0.5мкг/мл (разбавление от исходного раствора до 10 %)
50мкг/29мл=1.6мкг/мл (раствор 30 %)
50мкг/14мл=3.3мкг/мл (раствор 60 %)
50мкг/9 мл=3.3мкг/мл (самый сильный раствор 100 %)

Расчеты концентраций антибиотика амоксиклав квиктаб
Необходимо приготовить растворы с концентрацией в 10, 30 и 60 % содержания антибиотика, для этого использовали метод разбавления: исходный раствор был получен путем растворения таблетки в 200 мл воды, его концентрация составила 1000мг/200мл=5мг/мл. От данного раствора была взята аликвота 1 мл, путем разбавления которой были получены растворы нужны концентраций из расчета:
1000мг/200=5 мг/мл (берем от данного раствора 1 мл, продолжаем расчеты)
50мкг/100мл=0.5мкг/мл (разбавление от исходного раствора до 10 %)
50мкг/29мл=1.6мкг/мл (раствор 30%)
50мкг/14мл=3.3мкг/мл (раствор 60%)
50мкг/9 мл=3.3мкг/мл (самый сильный раствор 100%)

Рис. 15. Стаканы с разной концентрацией антибиотика
Проведение основного эксперимента
После проделанных расчетов, основываясь на минимальной бактерицидной концентрации в крови (1,5–3мкг/мл). Я решила проводить основной эксперимент. Надеваем медицинские резиновые перчатки и маску, чтобы защитить себя от бактерий. Чтобы начать мой основной эксперимент, потребовалось взять чашки Петри, в которых уже находилась пересаженная колония бактерий. Далее разводим антибиотики, как написано в расчетах. Берем пипетки для всех концентраций разные, чтобы растворы не смешивались, и получился чистый эксперимент. Делим чашки Петри на ровные доли маркером по поверхности крышки чашки. Осторожно приоткрываем чашки Петри и капаем разными концентрациями на поверхность питательной среды. В середине у меня условный 100 % раствор, к краям концентрация растворов меняется, далее идет 60 %,30 %,10 %. Ведем наблюдение до того, как появится первый результат. Для выявления точности полученных данных опыт был проведен четыре раза.
Результаты опыта занесены в таблицы:
Наименование
Результат
Время эксперимента
Примечание
Чашка Петри с золотистым стафилококком 1
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 2
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 3
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается
Чашка Петри с золотистым стафилококком 4
ничего не наблюдается
Никаких изменений не замечено
ничего не наблюдается
ничего не наблюдается
ничего не наблюдается

Рис. 16. До добавления антибиотиков

Рис. 17. После добавления антибиотиков
Результаты экспериментов. Выводы
По результатам проведенных исследований можно сделать вывод, что стафилококк не поддаются воздействию антибиотиков пенициллинового ряда, а конкретно флемоксином и амоксиклавом. Занимаясь самолечением, люди усугубляют болезнь, параллельно нанося вред собственному организму. Из-за того, что они не могут разобраться в том, было ли заболевание вызвано вирусами или бактериями. Проще говоря, антибиотики теряют свою эффективность. Стафилококки, пневмококки, и даже палочка Коха, возбудитель туберкулёза, имеют резистентность к повсеместно применяемым антибиотикам широкого спектра, что и было доказано в моей работе. Что делает их почти неуязвимыми к лечению. От этого некоторые заболевания плохо поддаются лечению, развиваются тяжёлые септические состояния.
Рекомендации
Бактерии, обладающие резистентностью к антибиотикам, предшествуют медицинскому применению антибиотиков людьми; тем не менее, широкое применение антибиотиков сделало бактерии более резистентными в процессе давления эволюционного отбора.
Причины широкого применения антибиотиков включают: повышение глобальной доступности в течение долгого времени, начиная с 1950-х годов неконтролируемые продажи антибиотиков во многих странах с низким или средним уровнем дохода, где их можно получить без рецепта, что потенциально приводит к применению антибиотиков без предписания врача. Это может привести к возникновению резистентности у любых оставшихся бактерий.
Применение антибиотиков в животноводстве в качестве добавки в корм для скота в малых дозах для стимулирования роста является общепринятой практикой во многих промышленно развитых странах, и, как известно, приводит к повышению уровня резистентности. Выброс большого количества антибиотиков в окружающую среду во время фармацевтического производства за счет ненадлежащей очистки сточных вод повышает риск того, что устойчивые к антибиотикам штаммы будут развиваться и распространяться. Точно неизвестно, способствуют ли бактерицидные вещества в мыле и других продуктах развитию устойчивости к антибиотикам, но они не рекомендуются к применению по другим причинам
Поэтому, я хочу порекомендовать принимать антибиотики только по назначению дипломированного медицинского работника, но также не стесняйтесь спрашивать, действительно ли они вам необходимы. Если вы принимаете антибиотики, всегда заканчивайте полный курс, даже если вы почувствовали себя лучше, так как прекращение приема содействует росту лекарственно устойчивых бактерий
Похожие статьи
3. При приготовлении второго образца (с бактериями, испытавшими влияние антибиотика) в ампуле с водой сначала мы растворяли антибиотик (амоксициллина тригидрат — препарат флемоксин солютаб), затем несколько капель раствора подмешали ко второй части.
Библиографическое описание: Зонтиков Д. Н., Марамохин Э. В. Проблемы стерильности сред и растительных эксплантов культуры in vitro
Наиболее часто в настоящее время используются антибиотики широкого спектра действия: пенициллинового и цефалоспоринового ряда.
Рабочий раствор готовили разведением бактериальной культуры с концентрацией 5 млн. микробных
Селезенку помещали в заранее приготовленную полную питательную среду 199 с добавлением
После застывания геля агарозы чашки инкубировали при 37оС в течение 1 часа.
Приблизительно 20 % от исходного количества антибиотиков разрушается в результате проварки [4,8].
Так, наиболее сильными аллергенами из применяемых в животноводстве антибиотиков являются пенициллин и тилозин.
Определение чувствительности микрофлоры к наиболее часто применяемым антибиотикам и антисептическим веществам производили
Кишечная палочка в монокультуре высеяна у 106 (50,7 %) больных, золотистый стафилококк — у 30 (14,4 %) больных, стрептококк — у 21 (10,0.
11. Практика использования электроактивированных водных растворов в
Основные термины (генерируются автоматически): питательная среда, среда, культивирование бактерий рода
В чашки Петри разливали универсальную питательную среду СПА (сухой питательный агар).
Антибиотикорезистентность: знания, отношения и практики применения антибиотиков пациентами с респираторной патологией.
Знаете ли Вы, что антибиотики убивают бактерии, которые в норме живут на поверхности кожи и в кишечнике.
Чистые культуры для хранения пересевались в пробирки на скошенную агаровую
Удешевление питательной среды для культивирования бактерий.
Среди аэробных микроорганизмов преобладали S. aureus (36 %), коагулазонегативные стафилококки (19,8.
. с введением 3–5 мл физиологического раствора.
на поверхность дифференциально-диагностических питательных сред: агар для анаэробов, среда эндо
часто применяемым антибиотикам и антисептическим веществам производили диско-диффузионным методом.

Основными источниками обсеменения стафилококками пищевых продуктов являются люди и животные с гнойно-воспалительными процессами (абсцессы, фурункулы, гнойные раны и др.), а также носители этих микроорганизмов. Перенос стафилококков от людей на пищевые продукты может происходить воздушно-капельным путем, при непосредственном контакте людей с продуктами, оборудованием, в процессе убоя скота и разделки туш.
Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются [2].
Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%. Некоторые микроорганизмы (В. сеreus, дрожжи из рода Саndidа и др.) оказывают на стафилококки стимулирующий эффект (они усиливают образование энтеротоксина).
Энтеротоксин стафилококков обладает высокой термоустойчивостью. Инактивирование (разрушение) токсина происходит только через 2,5–3 часа кипячения. При автоклавировании (120°С) токсин разрушается через 20 мин. При благоприятных температурных условиях энтеропатогенные стафилококки быстро размножаются в продуктах и продуцируют токсин. Пищевые токсикозы, вызванные энтеропатогенными стафилококками, протекают в форме острого гастроэнтерита, сопровождающегося рвотой, реже диареей, головной болью. Инкубационный период очень короткий – от 30 мин до 6 ч. Длится заболевание один, реже – два, три дня [1].
Выявление и определение количества этих микроорганизмов в пищевых продуктах проводят в соответствии с ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus.
Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды [4].
Метод определения наиболее вероятного числа (НВЧ) коагулазоположительных стафилококков и S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см 
жидкого продукта менее 15 колониеобразующих единиц (КОЕ) коагулазоположительных стафилококков и S. aureus.
Метод определения количества коагулазоположительных стафилококков и S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см 
жидкого продукта более 150 КОЕ коагулазоположительных стафилококков и S. aureus [4].
Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus.
При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам.
Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду [6].
Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях.
Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды [3].
Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого, яично-желточно-азидного, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок после 24 ч и все оставшееся пробирки после 48 ч.
Чашки Петри с посевами инкубируют при температуре 37°С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности) [7].
На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма).
Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы.
Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены"[5].
Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus. Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670.
Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus [4].
Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри. Аналогично проводят посев десятикратных разведений испытуемого продукта. Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч.
Количество коагулазоположительных стафилококков в 1 см 
или 1 г продукта определяют по числу типичных и/или атипичных колоний, выросших на чашках Петри, принадлежность которых к коагулазоположительным стафилококкам подтверждена путем определения отношения микроорганизмов из этих колоний к окраске по Граму, наличия у них каталазы и коагулазы [3,4].
При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам.
Количество S. aureus в 1 см 
или 1 г продукта определяют исходя из количества коагулазоположительных стафилококков, принадлежность которых к S. aureus подтверждена по образованию ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности.
При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред [6,7].
Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия.
В 10 см модифицированного Жиолитти-Кантони бульона нормальной концентрации или сред вносят 1 см
жидкого продукта или 1 см исходной суспензии (т.е. 0,1 г или 0,1 см продукта). После посева навески продукта и (или) его разведений на поверхность Жиолитти-Кантони бульона осторожно наслаивают слой стерильного голодного агара или слой стерильного парафина и охлажденных до температуры 44 °С - 47 °С, дают полученному слою агара или парафина застыть и герметично закрывают.
Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1 [3].
Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева.
Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч [2].
Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Пересевы проводят также из пробирок, в которых нет видимых признаков роста.
Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч. После 24 ч инкубирования чашек Петри по отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний [1].
На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию.
Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях [5].
Определение образования ацетоина (реакция Фогес-Проскауера). Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. После инкубирования посевов к 1 см 
отобранной культуральной жидкости прибавляют 0,6 см 
раствора - нафтола и 0,2 см 
раствора гидроокиси калия. Появление розового окрашивания через 15-60 мин указывает на положительную реакцию. S. aureus образует ацетоин.
Определение ферментации мальтозы в аэробных условиях. Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus. Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется. S. aureus ферментирует мальтозу в аэробных условиях [4].
Оценка результатов подтверждения принадлежности коагулазоположительных стафилококков к S. aureus. Если коагулазоположительные стафилококки образуют ацетоин и сбраживают мальтозу в аэробных условиях, то считают, что выявленные коагулазоположительные стафилококки относятся к S. aureus. Для биохимической идентификации допускается использование тест-систем промышленного производства, зарегистрированных на территории государства, принявшего стандарт.
Оценка результатов посевов в жидкие среды. При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus [6].
Результаты выявления коагулазоположительных стафилококков или S. aureus записывают: обнаружены (не обнаружены) в 1 г (см3) продукта; масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus.
Читайте также:


