Возбудитель листериоза животных диагностика

На МПА образует мелкие колонии в виде росинок,МПБ в первые сутки роста мутнеет. Листерии обладают изменчивостью: изменение темп-ры культивирования ведёт [ведет] к изменению формы микробных клеток и числа жгутиков; под влиянием факторов (пенициллин и др.) образуются L-формы; под действием ультрафиолетовых лучей возникают радиорезистентные,а под влиянием стрептомицина — стрептомицинорезистентные мутанты; при выращивании на твёрдых [твердых] средах происходит превращение колоний S-формы в R-форму. У возбудителей отмечено 14 соматич. (I—XIV) и 4 жгутиковых антигена (А, В, С, D). Различают 2 серологич. группы, объединяющие различных в антигенном отношении листерий. Они способны продуцировать особые антибиотич. вещества — моноцины. Обнаружены также листериозные бактериофаги. Листерии устойчивы во внешней среде, длительно сохраняются в почве, воде, на растениях. Общеупотребительные дезинфицирующие вещества их быстро инактивируют. Возбудители патогенны для белых мышей, кроликов, морских свинок и степных пеструшек.
Иммунитет при Л. изучен недостаточно.
В процессе переболевания и иммунизации живыми культурами в организме животных накапливаются антитела,относящиеся к 19S- и 7S-антителам,при иммунизации убитыми культурами — только к 19S-антителам. В СССР в неблагополучных по Л. х-вах применяется живая вакцина из ослабленного штамма листерий (АУФ).
Течение и симптомы. Инкубационный период 7—30 сут. Течение острое, подострое и хроническое. Л. проявляется в неск. формах: нервной, септической, смешанной, бессимптомной, а также с преимущественным поражением половых органов и вымени. У кр. рог. скота чаще поражается нервная система. Болезнь начинается угнетением, вялостью, снижением аппетита. Через 3—7 сут у животных отмечают некоординируемые движения, судороги, приступы буйства, парезы нижней челюсти и отдельных групп мышц, потерю зрения, конъюнктивит. Темп-ра тела повышается или остаётся [остается] в пределах нормы. Длительность болезни до 10 сут. Поражение половой системы проявляется абортами, задержанием последа, метритами. Иногда возникает мастит, У телят Л. чаще всего протекает в виде септицемии. У овец и коз также поражается нервная система (рис. 5). Вначале отмечают необычное поведение животного, снижение аппетита, сонливость, конъюнктивит и ринит. Темп-ра тела повышается до 40,5—41°C или остаётся [остается] в пределах нормы. Через 1—2 сут появляются признаки поражения нервной системы: круговые движения, потеря равновесия, оглумоподобное состояние, судороги, искривление шеи, расширение зрачков, потеря зрения. Болезнь длится от неск. часов до 10 сут. У ягнят чаще наблюдают септицемич. форму (поносы, лихорадка). У беременных овец и коз возникают аборты и маститы. У взрослых свиней отмечают исхудание, анемию, кашель, нарушение координации движений, абсцессы в различных органах и тканях, аборты и рождение мёртвых [мертвых] поросят. У поросят чаще наблюдают поражение нервной системы: расстройство координации движений, своеобразную “ходульную” походку, манежные движения, мышечную дрожь, судороги, возбуждение. Темп-ра тела повышена, затем снижается и падает ниже нормы. При септич. форме у поросят отмечают угнетение, отказ от корма, слабость, затруднённое [затрудненное] дыхание, посинение кожи в области ушей и живота, реже — понос. Темп-ра тела повышена. Длительность болезни до 3 сут. У птиц характерны потеря аппетита, угнетение, малоподвижность, конъюнктивит, слабость, судороги, параличи.
Патологоанатомические изменения. При нервной форме обнаруживают инъекцию сосудов и отёк [отек] головного мозга, кровоизлияния в мозговую ткань и внутр. органы; при гистол. исследовании устанавливают менингоэнцефалит. При септич. форме регистрируют гиперемию или отёк [отек] лёгких [легких] , катаральный гастроэнтерит, кровоизлияния во внутр. органах, увеличение селезёнки [селезенки] и лимфатич. узлов, дистрофич. изменения и некротич. очажки в печени, селезёнке [селезенке] , почках, миокарде; при поражении половых органов у самок — эндометрит или метрит.
Диагноз ставят на основании эпнзоотол., клинич. и патологоанатомич. данных, а также бактериол., серологич. исследований и биол. пробы. Решающее значение принадлежит бактериол. исследованию. Разработан метод люминесцирующих антител (рис. 6). Серологич. методы могут быть применены для выяснения эпизоотич. ситуации в х-вах, где диагноз на Л. поставлен комплексным методом с выделением культуры. Л. у кр. рог. скота дифференцируют от злокачеств. катаральной горячки, бруцеллёза [бруцеллеза] , вибриоза, трихомоноза; у свиней — от болезни Ауески, отёчной [отечной] болезни; у овец — от ценуроза, сальмонеллёза [сальмонеллеза] , кетонурии; у птиц — от пастереллёза [пастереллеза] , ньюкаслской болезни, гриппа, тифа, спирохетоза; у всех видов животных — от бешенства, кормовых отравлений.
Лечение более успешно в начальный период болезни. Эффективна также предохранительная (превентивная) терапия животных, подозреваемых в заражении. Чаще применяют антибиотики тетрациклинового ряда, ампициллин, сульфаниламиды (сульфантрол, сульфадимезин). Проводят симптоматич. лечение (сердечные, дезинфицирующие, вяжущие средства).
Профилактика и меры борьбы. Для предупреждения Л. фермы комплектуют животными из благополучных по Л. х-в; допускают животных в общее стадо только после предварительного карантинирования в течение 30 сут, во время к-рого проводят клинич. обследование животных, а при необходимости (при выявлении признаков поражения нервной системы, абортов, лихорадки) — бактериол. и серологич. (РА) исследования на Л.; уничтожают грызунов, кровососущих членистоногих; отлавливают и проводят лабораторные исследования на Л. пойманных грызунов; контролируют качество кормов; ведут учёт [учет] абортов и падежа животных; исследуют бактериологически патол. материал на Л.; исследуют на Л. племенных животных перед их продажей. При обнаружении Л. х-ва объявляют неблагополучными по Л.; в них запрещают ввод и вывод животных (за исключением вывода на убой). Проводят клинич. осмотр животных с измерением темп-ры тела. Животных с поражением нервной системы отправляют на убой, подозрительных по заболеванию изолируют и лечат. За остальными устанавливают вет. наблюдение; животных вакцинируют (в соответствии с наставлением по применению вакцины) или дают им антибиотики с профилактич. целью. Для выявления листерионосителей и скрытобольных применяют РА. Положительно реагирующих изолируют, лечат антибиотиками или направляют на убой. Проводят дезинфекцию, дезинсекцию и дератизацию. Х-во объявляют благополучным через 2 мес после последнего случая выделения клинически больных животных, получения отрицат. результатов по РА и заключительной дезинфекции.
Листериоз человека . Люди заражаются Л. при использовании в пищу животноводч. продуктов от больных животных, а также при употреблении ранних плохо промытых овощей (как правило, без термич. обработки), выращенных на полях, удобряемых фекалиями и навозом. Наблюдают сверхострое, острое, подострое, хронич. и абортивное течение болезни. По клинич. признакам различают ангинозно-септич., нервную, септико-гранулематозную (у новорождённых [новорожденных] ), глазо-железистую, септико-тифозную формы и Л. беременных. Описана кожная форма Л. у вет. работников после гинекологич. исследований животных. Для предохранения от заражения людей необходимо строго соблюдать меры личной профилактики при уходе за больными животными, а также при работе в лабораториях с культурами листерий; обязательно обезвреживать продукты жив-ва, поступающие из неблагополучных по Л. пунктов, тщательно промывать и обрабатывать термически сырые овощи перед употреблением.
Лит.: Бакулов И. А., Листериоз с.-х. животных, М., 1967; Гребенюк Р.В., Чиров П. А., Кадышева А. М., Роль диких животных и кровососущих членистоногих в эпизоотологии листсриоза, Фр., 1972.
Хурай Р.Я., Марченко Т.В., Глотова Е.В.
ФГБУ "Краснодарская МВЛ"
Листериоз - инфекционная болезнь людей и животных, вызывается листериями, характеризуется множеством источников возбудителя инфекции, разнообразием путей и факторов его передачи, полиморфизмом клинических проявлений, высокой летальностью.
Листериоз не является широко распространенной инфекцией. По количеству выявленных случаев это заболевание значительно уступает сальмонеллезам и кампилобактериозам, но превосходит их по тяжести клинического течения и проценту летальных исходов.
В настоящее время листериоз рассматривается как одна из важнейших пищевых инфекций. В связи с этим эпидемическая ситуация во всем мире продолжает ухудшаться; и обусловлено это рядом причин, в том числе некоторыми биологическими особенностями лис-терий.
Возбудитель болезни. Listeria monocytogenes - подвижная неспорообразующая полиморфная грамположительная палочка.
Листериям свойственна изменчивость: температура культивирования ниже оптимальной ведет к изменению формы микробных клеток и числа жгутиков. При выращивании на твердых средах колонии S-формы превращаются в R-форму; под влиянием ряда факторов образуются L-формы; под влиянием ультрафиолетовых лучей - радиорезистентные мутанты.
Листерии длительно сохраняются во внешней среде, способны размножаться в мертвых тканях и в силосе при низкой температуре. Они остаются жизнеспособными в отрубях и овсе до 105 дней, в сене и мясо-костной муке - до 134 дней; долгое время не погибают при низкой температуре в соленом мясе. Листерии погибают при воздействии раствора хлорной извести при содержании 100 мг активного хлора в 1л - через 1ч. Нагревание до 100°С убивает листерий за 5-10 минут, а до 75-90°С - за 20 минут.
Эпизоотология. Листерии широко распространены во внешней среде, в том числе в почве, воде, растениях. Их выделяют в различных климатических регионах планеты, даже за Северным полярным кругом. Возбудитель листериоза изолирован от 103 видов животных, в том числе рыб (пресноводных), рептилий, 15 видов птиц и более чем 90 видов млекопитающих. Последние представлены насекомоядными, грызунами, жвачными, приматами, а также водными животными.
Источник возбудителя листериоза - больные и переболевшие животные, которые выделяют возбудителя во внешнюю среду с мочой, калом, молоком, истечениями из носовой полости, глаз, половых органов, а также животные-листерионосители, играющие определенную роль в поддержании стационарных очагов болезни (дикие мелкие млекопитающие и птицы). Установлено листерионосительство у человека. Переносчиком инфекции листериоза могут быть кровососущие членистоногие (иксодовые и гамазовые клещи), а также различные виды блох и вшей.
Листерии могут размножаться при низких (+4°С) температурах. Некачественный силос (рН свыше 5,5) является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотическом и эпидемиологическом отношении.
Листериозу свойственны природная очаговость и стационарность.
В естественных условиях заражение листериозом происходит через пищеварительный тракт, дыхательные пути, а также поврежденную кожу и слизистые оболочки половых органов.
Животные заражаются через корма и воду, загрязненные листе-риями, от грызунов, а также больных и переболевших животных.
Человек заражается в основном алиметарным путем через инфицированные овощи, некипяченое молоко, сыры и другие молочные продукты, недостаточно термически обработанное мясо, а также через зараженную воду, не подвергшихся термической обработке ранних овощей, собранных с участков, где использовали для полива необеззараженные сточные воды и навоз. Повышенную опасность представляют мягкие сыры, а также продукты быстрого приготовления ("фаст фуд").
Особое значение имеет возможность передачи листерий от беременной женщины плоду. Возможно профессиональное заражение людей: ветеринарных специалистов, работников боен, мясокомбинатов и животноводческих ферм.
Патогенез и клинические признаки. Распространение лис-терий по организму происходит нейрогенным (по периневральным путям), лимфогенным и гематогенным путями. Листерий попадают в различные органы, в том числе, преодолевая защитный барьер, проникают в головной мозг. По современным представлениям, листерий в организме в основном размножаются внутри макрофагов. Длительное листерионосительство обусловлено неспособностью макрофагов полностью фагоцитировать возбудителя, чему также способствует продолжительный (до года) срок жизни макрофагов.
Инкубационный период 7 — 30 дней. Течение болезни острое, подострое, хроническое. Болезнь проявляется несколькими клиническими формами: нервной, септической, смешанной, стертой, бессимптомной, а также с преимущественным поражением половых органов и молочной железы.
При поражении нервной системы отмечают некоординированные, нередко круговые движения, потерю равновесия, судороги, иногда приступы буйства, парезы отдельных групп мышц, искривление шеи, потерю зрения, конъюнктивит, стоматиты, оглумоподобное состояние. Поражение половой системы проявляется абортами, задержанием последа и воспалительными процессами в матке. На почве листериоза может возникнуть мастит, сопровождающийся длительным выделением возбудителя с молоком. При септической форме болезни отмечают угнетение, отказ от корма, слабость, затрудненное дыхание, иногда — признаки катарального энтерита. Температура тела повышена.
Бактериологическая диагностика. Для исследования в лабораторию направляют свежие трупы мелких животных (не позднее 24 часов после их смерти) или голову (головной мозг), паренхиматозные органы абортированный плод или его оболочки.
Следует обратить внимание на ряд технических деталей, соблюдать которые необходимо при лабораторном исследовании. При изучении морфологии листерий нужно помнить, что они могут выглядеть в виде палочек и кокков. Нередко случается, что в мазках из органов обнаруживали типичные палочковидные формы, а при посеве на питательные среды наблюдали кокковые формы. Это приводит к тому, что культуры листерий оцениваются как банальная микрофлора и дальнейшее их исследование не проводится. Чтобы избежать этого, надо сделать несколько последовательных пересевов культуры на свежие питательные среды и вырастить её при комнатной температуре - листерии при этом приобретают типичную палочковидную форму.
Нелегко уловить первичный рост листерий на жидких и, в особенности, на твердых средах. Колонии листерий на агаре в первые сутки роста настолько мелки и прозрачны, что их бывает трудно обнаружить.
Иногда случается, что при наличии в мазках-отпечатках грам-положительных палочек, напоминающих листерии, посевы остаются стерильными. Особенно часто это бывает, если животное обрабатывали с лечебной целью антибиотиками. Объясняют это также внутриклеточным расположением листерий. Опыты показали, что посевы из суспензии (в особенности приготовленные с помощью стерильного песка) более результативны.
Общепринятым является мнение, что листерии лучше растут на обогащенных питательных средах. Однако, следует помнить, что на этих средах они растут более пышно и это может дезориентировать исследователя.
Особенностью листерий является широкий температурный диапазон роста - от 45 до 4°С (оптимальная 36—38°С), оставаться жизнеспособными и при более низких температурах. Диапазон рН от 5 до 11. Способность листерий расти как в присутствии кислорода, так и без него, обусловила их довольно широкое распространение и значительную устойчивость во внешней среде, а, следовательно, и возможное многообразие путей проникновения возбудителя листериоза в организм животных и человека.
В микроанаэростате в условиях вакуума на кровяном или простом мясо-пептонном агаре через 24 ч после выращивания в термостате хорошо заметен рост листерий в виде росинчатых колоний. Хорошо растут листерии на печеночных средах с добавлением глюкозы (1 %) и глицерина (2—3 %) и на триптозном агаре.
На МПА образуются круглые, выпуклые прозрачные колонии, размером от 0,2—0,4 до 2 мм в диаметре, приобретающие голубоватый оттенок в проходящем свете. Наиболее характерными для лис-терий и чаще всего встречающимися следует считать колонии S-фор-мы. Однако, при длительном хранении на искусственных питательных средах культуры листерий подвергаются диссоциации. Изменения от гладких S-форм колоний к шероховатым R-формам идут через промежуточные SR и RS-стадии.
В качестве элективных сред используют мясо-пептонный печеночный бульон (МППБ) с 0,05 % теллурита калия или 0,01—0,02 % теллурита калия в водном растворе глицерина и растворе флорими-цина или полимиксина (500 тыс. ЕД в 10 мл изотонического раствора натрия хлорида).
В обычном мясо-пептонном бульоне рост происходит медленно, только через 1—2 дня появляется явное помутнение и улавливается кисломолочный запах. При посеве единичных микробов рост вообще не наблюдается. Поэтому из патологического материала необходимо делать обильные посевы. Культивирование возбудителя удается не всегда, однако предварительное выдерживание исследуемого материала в холодильнике при 4°С в течение 4—8 недель, по данным некоторых исследователей, способствует получению положительного результата. При выращивании листерий в холодильнике их легче можно выделить из смешанных культур.
Через 5—7 дней роста листерий в МПБ на дне пробирки образуется слизистый осадок, который при встряхивании с трудом поднимается вверх в виде характерной спиралевидной косички.
На полужидком 0,3 %-ном МПА листерии растут в виде хлопка, распространяющегося в дальнейшем по всей среде. При посеве на мясо-пептонную желатину уколом наблюдается рост микробов в виде штыка с боковыми отростками ближе к верхней части укола.
В настоящее время производятся различные среды, созданные специально для выделения, накопления и культивирования листерий. Они являются высокоселективными, обеспечивая оптимальные условия для роста листерий.
Листерии имеют ограниченную биохимическую активность, постоянным их признаком является способность выделять фермент каталазу. Культуры листерий редуцируют метиленовую синьку, не образуют индола. Через 24 ч при 37°С листерии постоянно сбраживают левулезу, трегалозу и салицин с образованием кислоты. Листерии не изменяют среды с раффинозой, инулином, инозитом, дульцитом, адонитом и маннитом.
На МПА с содержанием 5% крови крупного рогатого скота вокруг колоний образуется более отчетливо выраженная зона гемолиза, чем на МПА с содержанием 10% крови.
Листерии при выращивании в обычных условиях не образуют сероводорода. Однако, диссоциированные культуры листерий могут его продуцировать.
К другим культуральным свойствам, которые следует отметить, относятся способность листерий расти в МПБ с добавлением 10 % поваренной соли, а также выделение бактериоциноподобных веществ некоторыми нелизогенными штаммами листерии после, воздействия на них ультрафиолетовых лучей.
Патогенность выделенной культуры Listeria monocytogenes исследуют на белых мышах, которые должны погибнуть в течение 2-6 суток. При этом из внутренних органов погибших животных необходимо делать мазки-отпечатки и высевы на питательные среды. Срок наблюдения за подопытными животными 14 дней.
Дифференциальный диагноз. Следует исключить болезни, имеющие некоторые сходные симптомы с листериозом: бруцеллез, бешенство, болезнь Ауески, отечную болезнь, злокачественную катаральную горячку, кампилобактериоз, паратиф овец, ценуроз, А-ави-таминоз, отравления, а у птиц пастереллез, болезнь Ньюкасла, чуму, тиф, спирохетоз.
Профилактика листериоза животных . Исключительная важность профилактики листериоза подчеркивается зоонозным характером данной болезни и большой опасностью, которую она предстваля-ет для людей.
Листериоз чаще всего возникает в хозяйствах с плохими санитарно-гигиеническими условиями и плохо организованным кормлением. В связи с этим, чтобы не допустить возникновения данной болезни, особое внимание необходимо уделять организации правильного и полноценного питания (особенно в минеральном и витаминном отношениях), а также соблюдение всех санитарно-гигиенических правил содержания животных.
Профилактика листериоза людей включает контроль за продуктами питания, предусмотренный соответствующими нормативными документами; санитарно-просветительную работу среди населения, особенно групп риска.
- Бакулов И.А. Листериоз сельскохозяйственных животных. М.: Колос, 1967г. 296 с.
- Гильмутдинов Р.Я., Иванов А.В., Панин А.Н. Инфекционные болезни экзотических и диких животных. М.: Колос, 2010. 668с.
- Калишин Н.М. Листериоз крупного рогатого скота. Л.: Колос. Ле-нингр. отделение, 1987г. 96 с.
- Методические рекомендации по лабораторной диагностике листе-риоза животных и людей. Москва, 1987г.
- Поздеев О.К. Медицинская микробиология. Учебное пособие. М.: ГЭОТАР-Медиа, 2010г. 768 с.
Листериоз по частоте проявления значительно уступает другим инфекциям, но тяжесть течения и летальность делают это заболеванием актуальным. Особые опасения вызывает влияние инфекции на частоту недонашивания и состояние плода как у животных, так и у людей. В настоящее время листериоз рассматривается как одна из важнейших пищевых инфекций. Диагноз на лис-териоз ставится комплексно. Пока "золотым стандартом" диагностики является бактериологическое исследование с выделением культуры возбудителя - Listeria monocytogenes. При лабораторном исследовании специалисты сталкиваются с трудностями, связанные с морфологическими особенностями возбудителя и его культивированием. При проведении исследования следует обращать внимание на ряд технических деталей, которых необходимо придерживаться. Для профилактики листериоза необходимо строгое соблюдение санитарно-гигиенических правил содержания животных, а для людей, в первую очередь, контроль за продуктами питания.
Ключевые слова: листериоз, клинические признаки, возбудитель болезни, бактериологическое исследование, аборт, менингит, поражения центральной нервной системы, меры профилактики, питательные среды.
Сведения об авторах
Хурай Рамазан Якубович, кандидат ветеринарных наук, заслуженный ветеринарный врач Российской Федерации, заведующий бактериологическим отделом, ФГБУ "Краснодарская МВЛ"; г. Краснодар, ул. Калинина, 15, 8(861)2216162.
Марченко Татьяна Витальевна, кандидат ветеринарных наук, заведующая отделом ветеринарно-санитарной экспертизы ФГБУ "Краснодарская МВЛ", г. Краснодар, ул. Калинина, 15, 8(861)2216162.
Ответственный за переписку с редакцией: Глотова Елена Васильевна, ветеринарный врач бактериологического отдела ФГБУ "Краснодарская МВЛ", г. Краснодар, ул. Калинина, 15, 8(861)2216162, elglotova@yandex.ru
LISTERIOSE OF ANIMALS
Khuray R. Ya., Marchenko T.V., Glotova E.V.
Listeriosе is not a widespread infection. By quantity of revealed cases it considerably concedes to salmonellose and campylobacteriose, but surpasses them in weight of a clinical current and mortality. It is dangerous both to animals, and for the humans. The causative agent is bacterium Listeria monocytogenes, which is fairly stable in the environment and food products. Infection occurs in different ways, but most important is infection by eating infected food. In connection with variety of clinical displays of illness major importance in diagnostics is given to results of laboratory researches the main of which is allocation of culture by bacteriological method. At allocation of Listeria it is necessary to pay attention on their morphological and cultural characteristics. For the prevention of listerioses it is necessary to follow the full feeding and observance of sanitary-and-hygienic rules of of animals content. For people control of foodstuff is obligatory.
Key words: listerioses, clinical signs, infecting agent, bacteriological research, abortion, meningitis, defeat of the central nervous system, preventive maintenance measure, nutrient mediums.
Листериоз (listeriosis) – природно-очаговая инфекционная болезнь многих видов животных и птиц, характеризующаяся поражением нервной системы, сепсисом и маститами. Восприимчив к листериозу и человек.
Заболевание регистрируется во многих странах мира, в том числе и в Республике Беларусь.
Экономический ущерб слагается из большой летальности животных (до 55%), снижения продуктивности, абортов, а также затрат на лечебно-профилактические мероприятия.
Этиология. Возбудитель Listeria monocytoqenes – грамположительная палочка (0,3-2 мкм), подвижная, спор и капсул не образует. Возбудитель имеет сложную антигенную структуру, которая представлена 15 соматическими и 5 жгутиковыми антигенами. Растет на обычных питательных средах. В почве и навозе возбудитель сохраняется до 11 мес., в силосе – до 20 мес.
Листерии чувствительны к антибиотикам и сульфаниламидным препаратам. Малоустойчивы к дезинфицирующим средствам.
Эпизоотологические данные. Восприимчивы домашние (чаще овцы) и дикие животные, а также птица. Источником возбудителя инфекции являются больные и переболевшие животные, выделяющие возбудителя из носа, половых органов, калом, мочой и молоком.
Листериозоносительство имеет место среди здоровых животных и продолжается до 250 дней. Заражение происходит алиментарным путем, а также – поврежденную кожу, слизистые оболочки и даже внутриутробно. Фактором передачи являются контаминированные возбудителем вода, почва, корма (особенно силос) и т.д. для листериоза характерна зимне-весенняя сезонность и стационарность, которая обусловлена широким носительством возбудителя среди грызунов. Листериоз может протекать в виде энзоотий и спорадий, летальность 35-55%.
Патогенез. В организм возбудитель попадает через поврежденные слизистые оболочки пищеварительного тракта и дыхательных путей, кожу и конъюнктиву. Из мест первичной локализации листерии лимфогенным и гематогенным путем проникает в ЦНС, а беременных животных – в матку, что приводит к развитию соответственно гнойного энцефаломиелита и аборта.
Течение и симптомы болезни. Инкубационный период от 7 до 30 дней. Течение болезни бывает острое, подострое и хроническое, а формы – нервная, септическая, генитальная, атипичная и бессимптомная.
При нервной форме отмечается угнетение, слезотечение, потеря аппетита. Через 3-7 дней у взрослого крупного рогатого скота появляются признаки поражения ЦНС (некоординированные движения, ''ходульная походка'', судороги, приступы буйства, парез нижней челюсти, ушей и губ, потеря зрения, стоматит и конъюнктивит). Температура тела повышена или нормальная. Длительность болезни до 4 суток. У овец наблюдается неестественное искривление (боковое) шеи, у свиней – нарушение координации движения, кашель, рвоту, поносы, экзантемы. Болезнь в 60-100% случаев заканчивается летально. Септическая форма регистрируется у молодняка животных, сопровождается повышением температуры тела, угнетением, потерей аппетита, поносами. У телят часты судороги, коматозное состояние; у поросят – затрудненное дыхание, кашель, синюшность ушей, живота. В большинстве случаев молодняк погибает. Генитальная форма у коров проявляется абортами во второй половине беременности, задержанием последа, эндометритами, маститами. Атипичная форма регистрируется редко и характеризуется лихорадкой пневмонией и гастроэнтеритами. У лошадей болезнь протекает в виде поражения ЦНС.
Патологоанатомические изменения. При вскрытии трупов обнаруживают: кровоизлияния под – эпи и эндокардом, в плевре, слизистой оболочке трахеи и бронхов; увеличение селезенки с милиарными некрозами в ней; серозное воспаление брыжеечных лимфоузлов; зернистую дистрофию печени; острый катаральный гастроэнтерит; катарально-геморрагический ринит (у овец), трахеит и бронхит (у свиней); гнойный конъюнктивит и кератит (у овец). При гистоисследовании – гнойный энцефаломиелит.
Диагностика. Диагностику осуществляют комплексно с учетом эпизоотологических данных, клинических признаков и результатов патологоанатомического вскрытия. Окончательную диагностику осуществляют путем бактериологического исследования. РА и РСК используют для выяснения эпизоотической ситуации по этому заболеванию.
Дифференциальная диагностика. У крупного рогатого скота листериоз дифференцируют от бешенства, губкообразной энцефалопатии, болезни Ауески, бруцеллеза, кампилобактериоза, ЗКГ.
У свиней – кчс, болезни Ауески и Тешена, отечной болезни. У овец сальмонеллеза, скрепи, болезни Ауески, авитаминозов и отравлений.
Лечение. Средств специфического лечение при листериозе нет. До появления клинических признаков болезни применяют антибиотики тетрациклинового ряда: биомицин и террамицин вводят внутримышечно в дозе 10-30 мг, стрептомицин 10-20 тыс. ЕД на 1 кг массы животного. При появлении клинических признаков прогноз неблагоприятный.
Иммунитет. Для специфической профилактики болезни используется живая вакцина из штамма АУФ.
Профилактика и меры борьбы. При возникновении заболевания животных листериозом, хозяйство объявляют неблагополучным и вводят ограничения. Больных животных изолируют и лечат, остальных прививают сухой живой вакциной.
В случае вынужденного убоя животного тушу и внутренние органы при отсутствии патизменений направляют на промпереработку (вареные колбасы). При истощении и дегенеративных изменениях в мышцах тушу отправляют на техническую утилизацию. Проводят текущую дезинфекцию.
Хозяйство объявляют благополучным через 2 мес. после последнего случая выявления клинически больных животных и получения двукратных, с интервалом 14-20 дней, результатов исследований сыворотки крови.

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
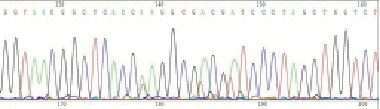
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
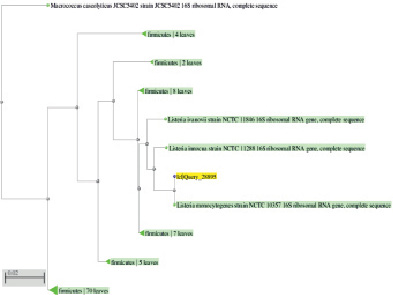
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
Читайте также:


