Стафилококковый бактериофаг может вызвать аллергию
Наша страна была пионером фаготерапии, ставшей сегодня актуальным биомедицинским направлением. Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров
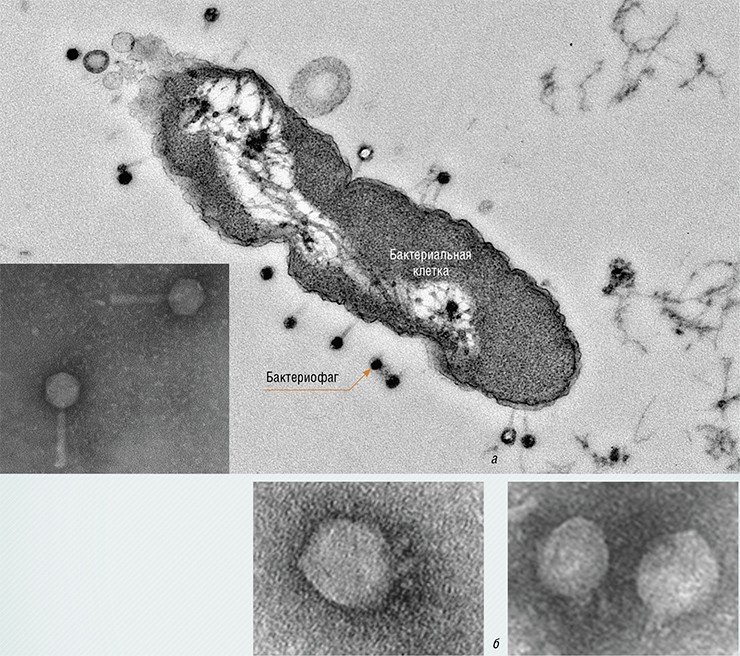
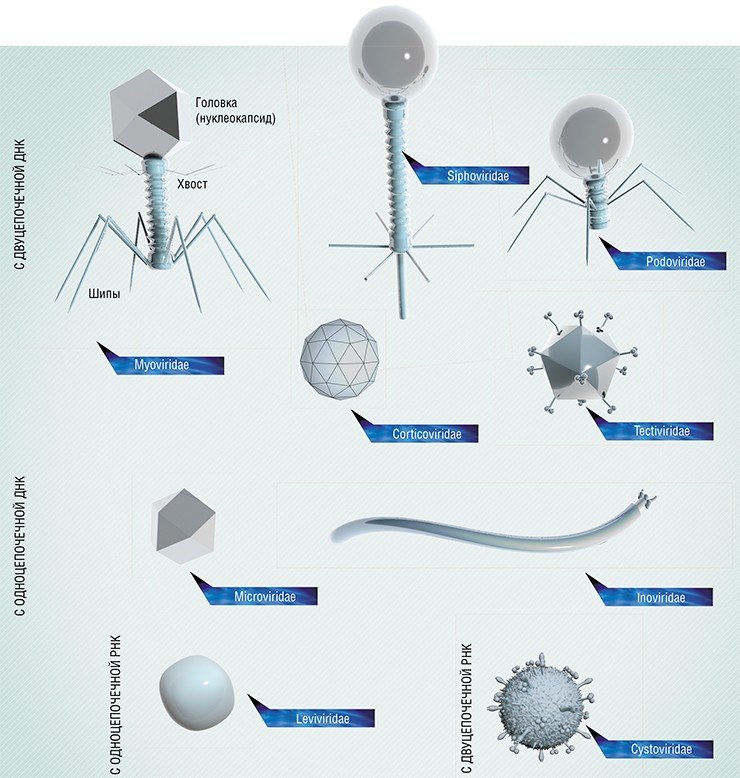
Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс. пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
Гонка вооружений
По оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней.
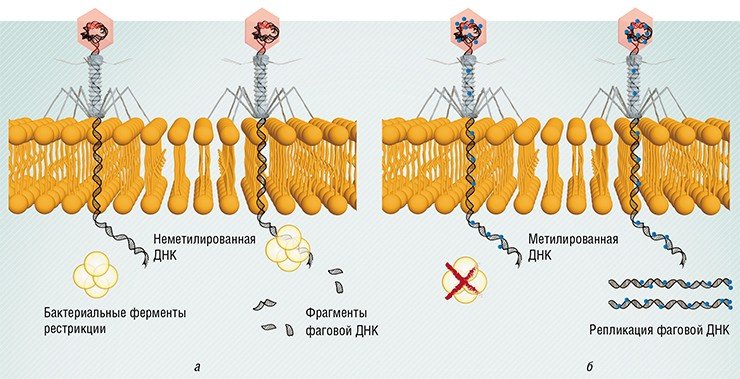
Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.
К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками.
Фаготерапия: сквозь тернии
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
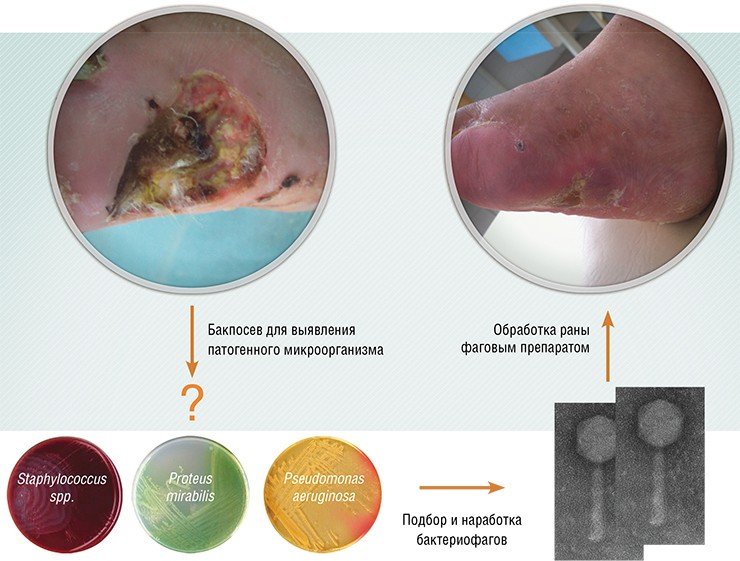
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Выбираем фаги
Почему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам.
Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР.
Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании. Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами.
Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными. Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
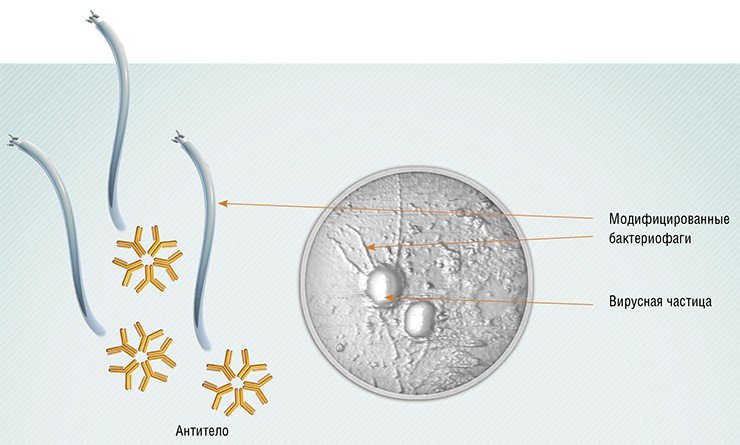
Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов.
АНТИБИОТИКИ Достоинства:
широкий спектр действия;
простота патентования
Недостатки:
разрушают собственную микрофлору организма,
что создает угрозу вторичных инфекций;
не способны концентрироваться в области
инфекционного поражения;
вызывают побочные эффекты: аллергии, кишечные
расстройства и т. д.;
приводят к возникновению бактериальных штаммов с лекарственной устойчивостью;
создание новых антибиотиков – длительный
и дорогостоящий процесс БАКТЕРИОФАГИ Достоинства:
специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг;
поиск нового фага занимает несколько дней или недель;
производство недорогое и экологически чистое;
не вызывают дисбактериоза;
не токсичны и не вызывают побочных эффектов;
после уничтожения патогенного агента элиминируются из организма
Недостатки:
слишком высокая избирательность – для гарантии
успеха лечения нужно идентифицировать патоген;
патентование затруднено из-за многообразия агентов
Уже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа. Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15.
Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215.
Miedzybrodzki R., Borysowski J., Weber-Dabrowska B. et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451.
Препараты, созданные на основе бактериофагов, не вызывают формирования развития резистентности патогенной микрофлоры.
Фаговая терапия применима для лиц с аллергией к антибиотикам, не вызывает тератогенного действия, и ее можно использовать во время беременности.
Кроме этого, подобные препараты положительно влияют на состояние местного иммунитета. При местном использовании фаги имеют особое преимущество в том, что они продолжают размножаться и проникать глубже до тех пор, пока присутствует инфекция. Одна из основных причин низкой эффективности или полного отсутствия лечебного эффекта заключается в неумелом подборе фагов для лечебных целей. Одна и та же болезнь, например, дизентерия, может вызываться различными видами дизентерийных бактерий. Фаги, активные против одних дизентерийных бактерий, совершенно не влияют на другие. Это не всегда учитывалось в должной мере при приготовлении фаговых препаратов для лечения определенных заболеваний. Фагопрофилактика бактериальных инфекционных болезней в эпидемических очагах заключается в применении бактериофагов лицам с высоким риском заражения. Убедительно показано, что при появлении в детских садах, яслях, школах дизентерийной инфекции использование препаратов фага предотвращает заболевание детей, имевших контакт с заболевшими. В настоящее время готовят сухие препараты фагов в виде драже. Есть специальные коллекции типовых фагов, активных против патогенных микроорганизмов. Фаги помогли выяснить источники многих заболеваний. При помощи специфических фагов можно установить наличие определенных патогенных и непатогенных форм микробов в различных средах.
Сегодня в России производятся:
- моновалентные бактериофаги — стрептококковый, стафилококковый, синегнойный, дизентерийный, колифаг, протейный, холерный, брюшнотифозный, псевдотуберкулезный, сальмонеллезный, клебсифаг и др.;
- комбинированные препараты поливалентных бактериофагов — колипротейный, пиобактериофаг комплекс жидкий, пиополифаг, секстафаг, интести–бактериофаг и др.;
- косметические гели с бактериофагами: фагодент, отофаг, фагодерм, фагогин и др.
Бактериофаг стрептококковый выпускается в виде раствора (бутылочка 20 мл). В растворе не допускаются никакие примеси или осадок. Для консервации препарата используется хинозол в количестве 0,01 мг на мл раствора. Стрептофаг обладает способностью лизировать стрептококковые бактерии, выделенные при гнойных инфекциях.
Назначается стрептококковый бактериофаг для терапии и предупреждения гнойных поражений, спровоцированных стрептококками. Препарат используют при карбункулезе и др. поражениях кожи, а также в терапии эндометрита, остеомиелита, уретрита, цистита, пиелонефрита, кольпита, лор–заболеваний и мн. др. (см. инструкцию)
Можно использовать его и для предупредительной обработки свежих ран, особенно хирургических разрезов при оперативном вмешательстве. Препарат рекомендуется использовать только после проведения анализа на микрофлору раны. Чем быстрее начинается лечение бактериофагом, тем оно эффективнее. Причем желательно обрабатывать бактериофагом именно то место, которое является центром распространения инфекции.
Препарат используют для обработки ран или слизистых оболочек, можно ввести подкожно вокруг пораженного участка кожи. Такие уколы делаются один раз в 1–2 суток по рекомендации врача–специалиста.
Противостафилоккоковый бактериофаг выпускается в форме раствора, суппозиторий, мази и таблеток. Стафилофаг обладает способностью лизировать стафилококковые бактерии, выделенные при гнойных инфекциях. Применяют местно в виде мази, примочек, орошения или тампонирования пораженных участков.
Бактериофаг стафилококковый рекомендуется назначать для лечения и профилактики гнойных инфекций кожи, слизистых оболочек, заболеваний, вызванных стафилококковыми бактериями, а также при дисбактериозе кишечника.
БАКТЕРИОФАГ ПСЕВДОМНАС АЕРУГИНОЗА (синегнойный)
Бактериофаг синегнойный представляет собой раствор (бутылочка 20, 50 и 100 мл). Бактериофаг обладает способностью специфически лизировать бактерии Pseudomonas aeruginosa и обладает иммуностимулирующим действием. Назначается при воспалительных процессах, проходящих с образованием гноя и локализующихся в самых разных местах, при заболеваниях органов дыхательной системы, в отоларингологии, хирургических, урогенитальных, энтеральных, септических заболеваниях, гнойно–воспалительных заболеваниях новорожденных.
Препарат используют для нормализации микрофлоры внутренних сред организма и с профилактической целью для обработки послеоперационных и свежеинфицированных ран, для профилактики внутрибольничных инфекций. Эффективно используется практически при любых заболеваниях, спровоцированных синегнойной палочкой. Наиболее эффективным является комбинирование орального местного применения препарата (делать примочки на больные места, полоскать горло, закапывать в уши и т.п.).
Для лечения заболеваний органов мочевыделительной системы препарат вливают непосредственно в пораженный орган — в мочевой пузырь, в почечную лоханку. Процедуру проводят один или два раза в день. Если необходимо лечить заболевания женских половых органов, то препарат вливают в матку один раз в день по 5–10 мл.
Бактериофаг клебсиеллезный, выпускаемый в виде раствора (амп. 5 и 10 мл, фл. 20 мл), эффективен против клебсиелл озены, пневмонии и риносклеромы. Назначается этот препарат для лечения недугов, спровоцированных клебсиеллами, таких как риносклерома, воспалительные процессы в области носовых пазух или среднего уха, воспалительные процессы в мягких тканях и внутренних органах, в т.ч. пищеварительной системе, генерализованных септических заболеваний, гнойно–септических заболеваний новорожденных. Препарат используют в виде ингаляций, клизм, аппликаций, а также орально. Применяют лекарство от 1 до 3 раз в сутки, в зависимости от заболевания. Курс лечения от 10 до 40 дней.
Для лечения риносклеромы и озены назначают орошение полости носа, ингаляции; по окончании процедуры необходимо закрыть носовые ходы ватными шариками, намоченными лекарством, вытащить которые следует только через час. Такое лечение нужно проводить дважды в сутки в течение 3–4 недель. Если инфекция распространена на область горла, кроме орошения полости носа нужно еще проводить ингаляции.
Для ингаляции лучше всего использовать небулайзер, т.к. нежелательно подогревать раствор выше 40°С. Противопоказаний к использованию препарата не существует, возможно в сочетании с ЛС, в т.ч. с антибиотиками и БАД.
Колифаг — бактериофаг коли жидкий (фл. 20, 100 мл, амп. 2, 10 мл; уп. – 10 шт.) для приема внутрь, местного и наружного применения. Колифаг обладает способностью специфически лизировать энтеропатогенные кишечные палочки (Escherichia coli), наиболее значимые в этиологии гнойно–воспалительных заболеваний. Препарат применяют для лечения и профилактики инфекций кожи и внутренних органов, вызванных кишечной палочкой, включая гнойно-септические заболевания, гнойно–осложненные раны, ожоги, абсцессы, флегмоны, фурункулы, карбункулы, холецистит, проктит, цистит и др. (см. инструкцию).
Применяется колифаг в профилактике колиинфекций и для профилактической обработки послеоперационных, свежеинфицированных ран, а также внутрибольничных инфекций по эпидемическим показаниям.
При энтероколите и дисбактериозе кишечника вводят 3 раза в день за 1 час до еды. При терапии гнойно–воспалительных заболеваний с локализованными поражениями применяют местно в течение 7–20 дней. Гнойные раны обрабатывают в виде орошения, аппликаций, повязок, введения через дренаж не менее 1 раза в день.
При абсцессах после вскрытия и удаления гнойного содержимого препарат вводят в количестве, меньшем, чем объем удаленного гноя. В дренированные полости ежедневно 1 раз в день 20–200 мл.
Для профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей колифаг применяется в виде клизм 2 раза в день в течение 5–7 дней.
Важно! Бактериофаг коли жидкий не пригоден для использования при помутнении раствора и наличии хлопьев.
Протейный бактериофаг, выпускаемый в виде раствора, используется для предупреждения и лечения недугов, спровоцированных протеем различных разновидностей. Используется этот препарат для лечения недугов лор-органов, бронхов и легких. Назначается лекарство также и для лечения ран, гнойных процессов кожи и мягких тканей самого разного характера и локализации. Кроме этого, используется он для лечения гнойных процессов, локализующихся в костной ткани, в суставах. Эффективен при лечении инфекций мочевыводящих органов, органов желудочно–кишечного тракта, при лечении заражения крови, воспалительных процессах слизистых оболочек глаз. Широко применяется и для лечения заболеваний маленьких детей.
Протейный бактериофаг можно использовать в лечении пациентов всех возрастов и с любыми сопутствующими заболеваниями. У препарата практически нет побочных эффектов и противопоказаний. Его используют для компрессов, полосканий, и ставят ватные шарики, пропитанные препаратом. Единичная доза препарата может варьировать от 5 до 200 мл. При лечении абсцесса используется введение в полость ватного шарика, пропитанного препаратом.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В осенне-зимний период возрастает частота обращений пациентов к врачу-оториноларингологу или врачу общей практики с острыми гнойно-воспалительными заболеваниями ЛОР-органов или с обострениями хронических заболеваний ЛОР-органов.
Острый бактериальный риносинусит (ОБРС) является достаточно распространенным заболеванием с постоянной тенденцией к росту. Так, например, в США за последние годы по поводу ОБРС было зарегистрировано приблизительно 25 млн обращений за медицинской помощью в год [17, 18].
В России данная проблема осложняется еще и тем, что из года в год все большему количеству больных требуется стационарное лечение, причем удельный вес больных, госпитализированных по поводу заболеваний околоносовых пазух, ежегодно увеличивается на 1,5–2%. Так, в структуре оториноларингологических стационаров больные с патологией синусов составляют от 15 до 36%. Чаще встречается верхнечелюстной синусит и этмоидит [1, 5, 9, 12].
Классификация ОБРС основывается на длительности и повторяемости симптомов. Наиболее удачной, по нашему мнению, является классификация, предложенная специальной комиссией Американской академии отоларингологов (American Academy of Otolaryngology Head and Neck Surgery) (табл. 1) [14].
По тяжести течения выделяют:
• легкое течение: заложенность носа, слизистые или слизисто-гнойные выделения из носа и/или в ротоглотку, повышение температуры тела до 37,5˚С, головная боль, слабость, гипосмия; на рентгенограмме околоносовых синусов – толщина слизистой оболочки менее 6 мм;
• среднетяжелое: заложенность носа, гнойные выделения из носа и/или в ротоглотку, температура тела выше 37,5˚С, боль и болезненность при пальпации в проекции синуса, головная боль, гипосмия, недомогание, могут быть иррадиирущие боли в зубы, уши; на рентгенограмме околоносовых пазух синусов – утолщение слизистой оболочки более 6 мм, полное затемнение или уровень жидкости в одном или двух синусах;
• тяжелое: заложенность носа, часто обильные гнойные выделения из носа и/или в ротоглотку (но может быть полное отсутствие), температура тела выше 38˚С, сильная болезненность при пальпации в проекции синуса, головная боль, аносмия, выраженная слабость; на рентгенограмме околоносовых пазух синусов – полное затемнение или уровень жидкости более чем в двух синусах; анализ крови: лейкоцитоз, сдвиг формулы влево, увеличение СОЭ, орбитальные, внутричерепные осложнения или подозрения на них. Серьезным осложнением является тромбоз кавернозного синуса, летальность при котором достигает 30% и не зависит от адекватности антибактериальной терапии [14].
Чаще всего острый риносинусит развивается на фоне ОРВИ. Считается, что при вирусных инфекциях околоносовые пазухи вовлечены в воспалительный процесс в той или иной мере. А вот формирование ОБРС происходит лишь в 1 или 2% случаев. Тем не менее, 1–2% – это достаточно большой процент заболеваемости. Одной из причин роста числа больных острым бактериальным гнойным риносинуситом признаны изменения в характере иммунного ответа слизистых носа и глотки. В частности, синуситы относят к проявлениям инфекционного синдрома, обусловленного иммунной недостаточностью как на местном, так и на системном уровне [2, 5, 9].
По мнению А.С. Лопатина, ОБРС практически всегда вызывается застоем секрета и нарушением вентиляции в околоносовых пазухах. А при нарушении мукоцилиарного транспорта и продленный контакт патогенных бактерий с клетками слизистой оболочки дает возможность формирования бактериального воспаления.
Как правило, наиболее существенную роль в развитии бактериальных инфекций верхних дыхательных путей играют Streptococcus pneumoniae, Haemophilus influenzae, а также Streptococcus pyogenes, Moraxella catarrhalis, Staphylococcus aureus, Pseudomonas aeruginosa, Proteus spp, Esherichia coli и ряд других патогенных и условно-патогенных штаммов бактерий [1, 2, 5, 6, 14].
Основными медикаментозными средствами в лечении ОБРС служат антибактериальные препараты, применение которых направлено на эрадикацию возбудителей. Считается, что оптимальным является применение антибиотиков, к которым наиболее чувствительны микроорганизмы (табл. 2).
Критерием рациональности назначенной антибиотикотерапии является оценка состояния больного через 72 ч (3-е сут) после начала лечения. Положительная динамика состояния пациента предполагает продолжение стартовой антибиотикотерапии. При отсутствии положительной клинической динамики через 72 ч следует сменить антибиотик. В лечении синуситов в большинстве случаев приоритет остается за антибактериальной монотерапией. Назначение двух и более антибиотиков оправданно при тяжелом течении синусита или наличии осложнений [5].
Продолжительность лечения зависит от выбранного препарата и степени тяжести синусита. Курс лечения может составлять от 7 до 14 дней. Важно полностью купировать воспалительный процесс в околоносовых пазухах, поэтому, имея целью полную эрадикацию возбудителя, следует ориентироваться на срок лечения в 7–10 дней. Учитывая значительную роль отека слизистой оболочки полости носа и обструкции соустий естественных отверстий околоносовых пазух в патогенезе ОРС, большое значение придается сосудосуживающим препаратам: ксилометазолину, оксиметазолину, фенилэфрину и др. Топические глюкокортикостероиды сравнительно недавно вошли в арсенал лекарственных средств для лечения острого риносинусита. Цель назначения – уменьшение секреции желез слизистой оболочки, уменьшение тканевого отека и, как следствие, улучшение носового дыхания (мометазона фуроат спрей для носа по100 мкг 2 р./сут) [5, 6].
К сожалению, ввиду бесконтрольного использования лекарственных препаратов, особенно антибактериальных, происходит постоянная эволюция бактериальных клеток, которые приобретают новые свойства, становятся более устойчивыми. За последнее десятилетие значительно выросла резистентность этих бактерий к макролидам и пенициллинам, традиционно широко использующимся в отоларингологии. Кроме того, в последние годы отмечается резкий рост числа бактерий, продуцирующих β-лактамазы расширенного спектра действия, что связано с широким использованием в стационарной и амбулаторной практике цефалоспоринов первого, второго и третьего поколений [10].
Антибиотикорезистентность – достаточно серьезная проблема в лечении синуситов. По данным литературы, особенно большой ее процент отмечается в странах Западной Европы, что затрудняет лечебную тактику синуситов [5]. Распространение антибиотикоустойчивости среди возбудителей заболеваний ЛОР-органов, наряду с токсическими, иммуносупрессивными и аллергическими реакциями на введение антибиотиков, является ведущей причиной снижения эффективности антибактериальной терапии. Однако в последние годы появилось большое количество штаммов микроорганизмов, не чувствительных к антибиотикам, широко используемым в практике [9]. Так, метициллинрезистентность отмечается у 30–40% Staphylococcus aureus. Отмечена тенденция к нарастанию резистентности к пенициллинам, макролидам, а также к аминопенициллинам и антибиотикам цефалоспоринового ряда первого и второго поколений [5, 9].
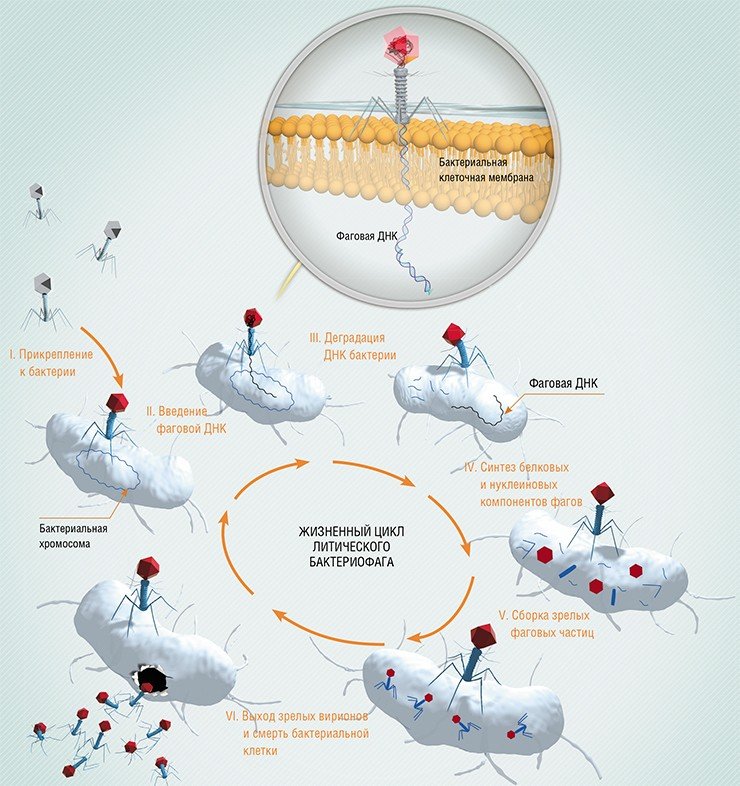
Каков механизм действия бактериофагов? Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки. Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги. Очень важным свойством бактериофагов является их специфичность. По признаку специфичности выделяют поливалентные бактериофаги, лизирующие культуры одного семейства или рода бактерий, моновалентные (монофаги) – лизирующие культуры только одного вида бактерий, а также отличающиеся наиболее высокой специфичностью – типовые бактериофаги, способные вызывать лизис только определенных типов (вариантов) бактериальной культуры внутри вида бактерий [7, 12, 13].
Препараты бактериофагов используются для лечения гнойно-септических и энтеральных заболеваний, вызванных условно-патогенными бактериями родов Escherichiae, Proteus, Pseudomonas, Enterobacter, Staphylococcus, Streptococcus, Klebsiellae. Именно эти бактерии являются возбудителем тяжелых синуситов на фоне иммунодефицитных состояний, о чем было сказано ранее.
Бактериофаги обладают рядом преимуществ: специфичность действия, отсутствие угнетения нормальной микрофлоры и аллергической реакции, стимуляция факторов специфического и неспецифического иммунитета [3, 4, 7, 12, 16].
Применение специфических бактериофагов позволяет оптимальным образом осуществить прицельный лизис патогенной флоры с целью антимикробного эффекта, а также для восстановления нормального микробиоценоза. Бактериофаги не имеют токсичного эффекта и не подавляют нормальную микрофлору. Опосредованно обладают стимулирующим иммунологическим эффектом, влияя на клеточный и гуморальный иммунитет [19].
Различные препараты бактериофагов, применяемые в соответствии с видом возбудителя, высокоэффективны при лечении паратонзиллярных абсцессов, воспалений пазух носа, гнойно-септических заболеваний больных в отделениях реанимации, хирургических инфекций, пиелонефритов, холециститов, гастроэнтероколитов, дисбактериоза кишечника, воспалительных заболеваний и сепсиса новорожденных [3, 7, 11].
Отсутствие побочных патологических реакций на применение препаратов бактериофагов позволяет эффективно использовать их у новорожденных и детей первого года жизни [Ворошилова Н.Н. и др., 2000].
Лечебно-профилактические бактериофаги изготавливаются с соблюдением всех требований к асептике и представляют собой препараты на основе натуральных природных компонентов, содержащихся в воде, почве, поэтому их можно назначать детям и взрослым. По составу бактериофаги делятся на монопрепараты, содержащие вирулентные фаги бактерий одного рода или вида, – стафилококковый, стрептококковый (в т. ч. энтерококковый), протейный, псевдомонас аэругиноза (синегнойный), клебсиелл пневмонии, коли, дизентерийный поливалентный, брюшнотифозный, сальмонеллезный (гр. АВСДЕ), и комбинированные фаги, в составе которых несколько монопрепаратов. К комбинированным относятся: коли-протейный, клебсиелл поливалентный, пиобактериофаги поливалентные (очищенный, комплексный и Секстафаг®) – содержащие бактериофаги стафилококковый, стрептококковый, протейный, псевдомонас аэругиноза (синегнойный), клебсиелл, коли, а также Интести-бактериофаг, содержащий бактериофаги против шигелл, сальмонелл, стафилококков, энтерококков, протея, синегнойной палочки и энтеропатогенной кишечной палочки.
Пиобактериофаг поливалентный (Секстафаг®) обладает способностью специфически лизировать соответствующие фагу микроорганизмы. Препарат хорошо себя зарекомендовал при гнойно-воспалительных заболеваниях верхних и нижних дыхательных путей, в т. ч. и при лечении ОБРС. Препарат принимают перорально. Возможно применение совместно с антибактериальными средствами по традиционной схеме антибактериальной терапии, о которых речь шла выше. Секстафаг®, как правило, назначается натощак в жидком виде по 20 мл 2–3 р./сут. Препарат применяется в монотерапии, также возможна комбинированная терапия с антибиотиками. Продолжительность курса составляет, как правило, не более 7–10 дней.
Препарат разрешен к применению у новорожденных с 0 мес.
Таким образом, терапия ОБРС, особенно вызванного возбудителями внутрибольничных штаммов, на фоне иммунодефицитных состояний, оправданна препаратами бактериофагов и является перспективным направлением. Может рассматриваться как альтернатива антибиотикотерапии и как вспомогательное лечение при классической терапии антибактериальными препаратами. Появление новых препаратов бактериофагов служит посылом для изучения антибактериальных свойств этих препаратов в отношении основных возбудителей воспалительных заболеваний ЛОР-органов, а также изучения влияния препаратов бактериофагов на иммунный статус пациентов.
Читайте также:


