Стафилококковая инфекция микробиологическая диагностика
Стафилококки - бактерии округлой формы, способные образовывать скопления, напоминающие гроздья (staphyle - виноградная гроздь) . Грамположительные, факультативные анаэробы, хорошо размножаются на простых питательных средах и растут на средах с высокой концентрацией NaCI.
Это обширная группа бактерий, насчитывающая 27 видов, 14 из которых обнаруживаются на коже и слизистых человека. При этом лишь 3 вида способны вызывать болезни, поэтому относятся к условно-патогенной микрофлоре:
- эпидермальный стафилококк (S. epidermidis). Селится на любых слизистых и участках кожи. Наибольшую опасность представляет при операциях, например, может заноситься в организм с зараженным протезом – клапаном, шунтом и прочим. Наиболее частая причина нагноения катетеров. В большинстве случаев этот стафилококк лечения не требует, а вызванная им инфекция проходит сама после удаления протеза или замены катетера, а также очищения раны.
- сапрофитный стафилококк (S. s aprophyticus). Наименее опасен из всех условно-патогенных видов, чаще всего обитает в области мочеиспускательного канала и гениталий. Может вызывать цистит и уретрит.
- золотистый стафилококк (S. aureus ). Наиболее патогенный вид из всех существующих. Подавляющее большинство болезней, вызванных бактериями стафилококка, связаны именно с этим видом. При этом может также присутствовать в микрофлоре здорового человека.
Факторы вирулентности стафилококков, особенно S. aureus, связаны с их адгезией на рецепторах чувствительных клеток, колонизацией и агрессивными свойствами, проявляющимися в подавлении фагоцитоза. Из экзоферментов, продуцируемых главным образом S. aureus, существенную роль в патогенезе заболеваний играют плазмокоагулаза, гиалуронидаза, лецитиназа, фибринолизин, ДНК-аза. Стафилококки секретируют ряд токсинов, отличающихся друг от друга по механизму действия. К ним относятся мембраноповреждающие токсины. Золотистые стафилококки могут образовывать гистотоксины, к которым относятся энтеротоксины, вызывающие пищевую интоксикацию.
Преимущественное значение в патологии человека имеет S. aureus. В организм человека он может проникать различными путями. Их патогенность выражается в способности вызывать гнойно-воспалительные процессы в коже, подкожной клетчатке, лимфоузлах (фурункулы, карбункулы, маститы, абсцессы и др.), респираторном тракте (бронхиты, пневмонии, плевриты), ЛОР-органах (отиты, ангины, гаймориты, тонзиллиты и др.), органах зрения (конъюнктивиты, язвы роговицы), желчевыводящих путях (холециститы, холангиты и др.), мочеполовых органах (гломерулонефриты, уретриты, простатиты и др.), опорнодвигательном аппарате (остеомиелиты, артриты, миозиты), а также пищевые отравления. Генерализация любой формы местного процесса может привести к сепсису или септикопиемии.
Основной метод лабораторной диагностики - бактериологический, так же разработаны и внедрены серологические реакции. В случае необходимости (при интоксикациях) прибегают к биологической пробе.
Материалом для бактериологического исследования служат кровь, гной, слизь из зева, носа, отделяемое ран, мокрота (при стафилококковой пневмонии), испражнения (при стафилококковом колите), в случае пищевых интоксикаций - рвотные массы, испражнения, промывные воды желудка, подозрительные продукты.
Материал засевают на кровяной агар (гемолиз), на молочно-солевой (молочно-желточно-солевой) агар (угнетается рост посторонних бактерий за счет NaCl, лучше выявляются пигмент и лецитиназа). Выделенную культуру идентифицируют по видовым признакам, определяют у нее наличие основных признаков и факторов патогенности (золотистый пигмент, сбраживание маннита, гемолиз, плазмокоагулаза), обязательно проверяют чувствительность к антибиотикам, в случае необходимости проводят фаготипирование.
Из числа серологических реакций для диагностики гнойно-септических заболеваний применяют РПГА и ИФМ, в частности для определения антител к тейхоевой кислоте или к видоспецифическим антигенам.
Для определения энтеротоксигенности стафилококков используют три метода:
1) серологический - с помощью специфических антитоксических сывороток в реакции преципитации в геле обнаруживают энтеротоксин и устанавливают его тип;
2) биологический - внутривенное введение фильтрата бульонной культуры стафилококка кошкам в дозе 2-3 мл на 1 кг веса. Токсины вызывают у кошек рвоту и понос;
3) непрямой бактериологический метод - выделение из подозрительного продукта чистой культуры стафилококка и определение у него факторов патогенности.
Методы микробиологической диагностики стафилококковых заболеваний отражены в схеме 1. Выполняется следующий комплекс методов исследования.
Бактериоскопический метод – микроскопия мазков из материала от больного, окрашенных по Граму. Выявление в мазках кокков, располагающихся небольшими группами по 2-3 бактерии; типичное расположение в виде гроздьев винограда характерно для чистых культур стафилококка (рис. 1 – цветная вкладка).
Бактериологический метод.Исследуемыйматериал засевают на чашки с желточно-солевым (ЖСА) и кровяным МПА, инкубируют при 37 0 С сутки. На 2 день учитывают характер
роста колоний на обеих средах. На желточно-солевом агаре колонии стафилококка имеют ровные края, гладкую поверхность, вокруг колонии образуется радужный венчик в результате расщепления лецитина яичного желтка ферментом лецитовителлазой; цвет пигмента колоний варьирует от золотистого до белого. На кровяном МПА вокруг колоний образуются зоны
гемолиза. Из типичных для стафилококка колоний делают мазок, окрашивают его по Граму, микроскопируют. Оставшуюся часть колонии пересевают на скошенный МПА для получения чистой культуры. На 3 день проводят идентификацию выделенной культуры стафилококка с дифференциацией основных видов в соответствии с таблицей 2, определяют чувствительность к антибиотикам методом бумажных дисков и фаговар (набор для фаготипирования состоит из фагов 21 типа, разделенных на 4 группы; при внутрибольничных инфекциях наиболее часто встречаются фаговары 77 и 80).
Таблица 1.Этиология бактериальных раневых и гнойно-воспалительных инфекций
| Аэробы | Анаэробы |
| Грамположительные бактерии Enterococcus faecalis, Staphylococcus aureus, Staphylococcus hyicus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus haemolyticus, Staphylococcus hominis, Streptococcus pyogenes, Streptococcus agalactiae, Erysipelotrix rhusiopathiae Грамотрицательные бактерии Burkholderia cepacia, Citrobacter koseri, Edwardsiella tarda, Eikenella corrodens, Enterobacter spp, Escherichia coli, Haemophylus influence, Klebsiella spp, Listeria monocytogenes, Moraxella catarrhalis, Proteus spp, Pseudomonas spp, Salmonella enterica, Serratia spp, Spirillum minus, Streptobacillus moniliformis, Vibrio vulnificus | Неспорообразующие грамположительные бактерии Bacteroides spp, Prevotella spp, Porphiromonas spp, Fusobacterium spp, Veilonella spp Неспорообразующие грамотрицательные бактерии Peptostreptococcus spp, Propionibacterium spp Cпорообразующие грамположительные бактерии Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum, Clostridium sporogenes, Clostridium ramosum |
| Схема 1. Микробиологическая диагностика стафилококковых инфекций | |
| Материал: гной, раневое отделяемое, пунктаты из полостей и абсцессов, кровь, мокрота, моча, ликвор, рвотные массы, испражнения, остатки пищи. | |
| Микроскопический метод Выявление грамположительных кокков (группами по 2-3 клетки) в мазках из материала от больного, окрашенных по Граму Серологический метод РНГА или РН для определения α-антитоксина в сыворотке крови больных хроническими стафилококковыми инфекциями. ИФА для определения антител к стафилококку. Имеет вспомогательное значение Бактериологический метод 1 день. Посев материала на чашки с желточно-солевым (ЖСА), кровяным МПА, сахарным МПБ. 2 день -учет характера роста колоний. На ЖСА колонии стафилококка с ровными краями, гладкой поверхностью, радужным венчиком вокруг, цвет - от золотистого до белого. | На кровяном МПА - зоны гемолиза, в МПБ –равномерное помутнение. В мазке из колоний в окраске по Граму – кокки в виде гроздьев винограда. Пересев оставшейся части колонии на скошенный МПА для получения чистой культуры, а с сахарного МПБ на кровяной МПА и ЖСА для получения изолированных колоний. 3 день - идентификация выделенной культуры стафилококка, дифференциация видов по биохимическим свойствам, определение чувствительности к антибиотикам и фаговара. Выделение чистой культуры с ЖСА и кровяного МПА. 4 день.Заключение о виде стафилококка. Идентификация культуры, выделенной из сахарного МПБ 5 день.Заключение о виде стафилококка, выделенного из сахарного МПБ. |
Таблица 2. Дифференциация основных видов стафилококка
| Признаки | Виды стафилококков | ||
| S. aureus | S. epidermidis | S. saprophyticus | |
| Плазмокоагулаза | + | - | - |
| Лецитиназа | + | - | - |
| Альфа-токсин | + | - | - |
| Анаэробная ферментация глюкозы | + | + | - |
| Анаэробная ферментация маннита | + | - | - |
| Чувствительность к новобиоцину | S | S | R |
Обозначения: (+) – наличие признака; (-) – отсутствие признака; S - чувствительный; R – резистентный.
Для выявления плазмокоагулазы цитратную плазму крови кролика разводят в 2 раза, разливают по 0,4 мл в пробирки, куда вносят петлей культуру стафилококков. Результаты регистрируют через 2, 4, 24 часа. При наличии плазмокоагулазы образуется сгусток.
В некоторых случаях у выделенных чистых культур стафилококка определяют наличие ДНК-азы, каталазы, лизоцимной активности, фибринолизина, гиалуронидазы.
Лизоцимную активность выявляют по зонам просветления вокруг колоний стафилококка при его посеве на МПА в чашках Петри с культурой Micrococcus luteus.
Определение ДНК-азы. Суточную агаровую культуру стафилококка засевают на МПА в чашке Петри, содержащий ДНК. После инкубации посевов при температуре 37 0 С в течение 18-24 часов поверхность МПА заливают 1 N раствором соляной кислоты. Наличие ДНК-азы характеризуется появлением зоны просветления вокруг колоний.
Каталазный тест. Чистую культуру стафилококка вносят в каплю 3%-10%-го раствора перекиси водорода на стекле и растирают круговыми движениями. При наличии каталазы перекись водорода разлагается с образованием пузырьков кислорода.
Cерологический методв диагностике стафилококковых инфекций имеет вспомогательное значение, используясь, в основном, для диагностики хронических процессов (остеомиелит, септикопиемия и др.). Для определения антител к токсину стафилококка применяют РНГА с эритроцитарным диагностикумом, нагруженным α-токсином стафилококка или РН (реакция нейтрализации гемолитической активности стафилококкового токсина антитоксинами сыворотки крови больного в присутствии эритроцитов кролика). У здоровых лиц титр стафилококкового антитоксина составляет 0,5-4 АЕ. Разработан также ИФА.
| Клинически значимые виды стафилококка Коагулазоположительные: S. aureus, S. hyicus Коагулазоотрицательные: S. epidermidis, S. saprophyticus, S. haemolyticus, S.hominis |
Не нашли то, что искали? Воспользуйтесь поиском:
Относятся к семейству Micrococcoceae. Род Staphylococcus включает 19 видов, из которых патогенны для человека только некоторые: S.aureus, S.epidermidis и S.saprophyticus. Заболевания вызывают золотистые, реже – эпидермальные и еще реже – сапрофитные стафилококки.
Морфология, физиология. Отдельные клетки имеют форму правильного шара, при размножении образуют скопления в виде гроздьев винограда (slaphyle – виноградная гроздь). Размер от 0,5 до 1,5 мкм. В препаратах из патологического материала (из гноя) располагаются поодиночке, парами или небольшими скоплениями. Золотистые стафилококки имеют способность образовывать нежную капсулу.
Стафилококки – факультативные анаэробы, но лучше развиваются в аэробных условиях, Гр+. На поверхности плотных питательных сред образуют круглые, выпуклые, пигментированные (золотистые, палевые, лимонно-желтые, белые) колонии с ровными краями; в жидких – равномерное помутнение. В лабораториях используют способность стафилококков размножаться в средах с большим количеством (6-10 %) NaCl (ЖСА). Такую концентрацию соли другие бактерии не переносят Þ солевые среды являются элективными для стафилококков. Штаммы золотистых стафилококков, продуцирующие гемолизины, дают на кровяном агаре колонии, окруженные зоной гемолиза.
Стафилококки имеют ряд ферментов, расщепляющих многие углеводы, белки. Дифференциально-диагностическое значение имеет тест на сбраживание глюкозы в анаэробных условиях. Из ферментов, участвующих в патогенезе стафилококковых инфекций, только плазмокоагулаза и частично ДНКаза характерны для S.aureus. Другие ферменты (гиалуронидаза, протеиназа, фосфатаза, муромидаза) непостоянны (но чаще продуцируются S.aureus). Стафилококки ситезируют бактериоцины. Устойчивы к пенициллину (пенициллиназа).
Антигены. Вещества клеточной стенки: пептидогликан, тейхоевые кислоты, белок А, типоспецифические агглютиногены, а также капсула, имеющая полисахаридную природу. Пептидогликан имеет общие АГ с пептидогликанами микрококков и стрептококков. Антигенность тейхоевых кислот связана с аминосахарами. Белок А золотистого стафилококка способен к неспецифическому соединению с Fc-фрагментом IgG, в связи с чем он агглютинируется нормальной человеческой сывороткой. У стафилококков есть 30 белковых типоспецифических антигенов. Но внутривидовая дифференциация по Аг структуре в практике не используется.
Патогенность. Повреждающее действие на клетки и ткани организма человека оказывают токсины и ферменты. Также к факторам патогенности можно отнести капсулу, препятствующую фагоцитозу и связывающую комплемент, а также белок А, инактивирующий комплемент и тормозящий опсонизацию при взаимодействии с Fc-фрагментом IgG.
S.aureus способен выделять ряд токсинов, в частности лейкоцидин, который оказывает губительное действие на фагоцитирующие клетки, главным образом на макрофаги. Гемолизины (α, β, дельта, γ) оказывают лизирующее действие на эритроциты человека и животных (кролика, лошади, барана). Основным из них является α-токсин, продуцируемый S.aureus. Помимо гемолитического, этот яд обладает кардиотоксическим действием, вызывает спазм коронарных сосудов и остановку сердца в систоле, он поражает нервные клетки и нейроны, лизирует мембраны и лизосомы клеток, что приводит к освобождению лизосомальных ферментов.
Возникновение пищевых отравлений стафилококковой природы связано с действием энтеротоксинов, продуцируемых золотистыми стафилококками. Известно 6 антигенов различных энтеротоксинов (АВСDЕF).
Эксфолиативные токсины вызывают у новорожденных пузырчатку, локальное буллезное импетиго, генерализованную скарлатиноподобную сыпь. Заболевания сопровождаются внутриэпидермальной отслойкой эпителия кожи, образованием сливающихся пузырей, жидкость в которых стерильна. Фокус стафилококковой инфекции находится чаще всего при этом в пупочной ранке.
Экзоверменты: плазмокоагулаза осуществляет свертывание плазмы (белки как бы одеваются в фиброзный чехол, защищающий их от фагоцитоза). Большие концентрации коагулазы, в организме больного, приводят к уменьшению свертываемости периферической крови, нарушению гемодинамики, прогрессирующему кислородному голоданию тканей.
Гиалуронидаза способствует распространению стафилококков в тканях. Лецитиназа разрушает лецитин, входящий в состав оболочек клеток, вызывает лейкопению. Фибринолизин растворяет фибрин, отграничивающий местный воспалительный очаг, чем способствует генерализации патологического процесса. Патогенетические свойства других экзоферментов стафилококков (ДНКаза, мурамидаза, протеиназа, фосфатаза), часто сопровождающих коагулазную активность, еще не определены.
Экология и распространение. В первые дни жизни человека стафилококки поселяются на слизистых оболочках рта, носа, в кишечнике, а также на коже, входят в состав формирующейся нормальной микрофлоры тела человека.
Стафилококки постоянно поступают в окружающую среду от человека. Они присутствуют на предметах обихода, в воздухе, в воде, в почве, на растениях. Но их болезнетворная активность различна, особое внимание уделяется золотистым стафилококкам как потенциально патогенным для человека. При контакте с источником инфекции носителями S.aureus становятся не все люди. Формированию бактерионосительства способствуют низкое содержание SIgA в носовом секрете и другие проявления функциональной недостаточности иммунной системы. У таких лиц формируется резидентное носительство, т.е. постоянным местом обитания стафилококков становится слизистая оболочка носа, на которой микроорганизмы интенсивно размножаются и выделяются в окружающую среду массивными дозами. В лечебных учреждениях их источником являются больные с открытыми гнойно-воспалительными процессами (инфекция передается контактным путем). Этому способствует длительность выживания стафилококков на окружающих предметах.
Хорошо переносят высушивание, пигмент защищает их от губительного действия солнечного света (прямые солнечные лучи убивают их только через несколько часов). При комнатной температуре они остаются жизнеспособными на предметах ухода за больным в течение 35–50 дней, на предметах твердого инвентаря – десятки дней. При кипячении гибнут мгновенно, чувствительны к дезинфектантам, к бриллиантовой зелени, что позволяет широко применять её для лечения поверхностных воспалительных заболеваний кожи.
Патогенез заболеваний человека. Способны поражать любую ткань человеческого организма. Это местные гнойно-воспалительные процессы (фурункулы, карбункулы, нагноения ран, бронхиты, пневмонии, отит, ангина, конъюнктивит, менингит, эндокардит, энтероколит, пищевые отравления, остеомиелит). Генерадизация любой формы местного процесса завершается сепсисом или септикопиемией. У лиц с иммунодефицитными состояниями стафилококковые инфекции развиваются чаще.
Иммунитет. Взрослые устойчивы, т.к. имеют естественные защитные механизмы и специфические антитела, которые приобретаются в течение жизни при контакте с больными и носителями. В процессе стафилококковой инфекции возникает сенсибилизация организма.
В формировании иммунитета имеют значение как антимикробные, так антитоксические и антиферментные антитела. Степень защиты определяется их титром и местом действия. Большую роль играют секреторные IgA, обеспечивающие местный иммунитет слизистых оболочек. Антитела к тейхоевым кислотам определяются в сыворотках крови взрослых и детей с тяжелыми стафилококковыми инфекциями: эндокардитом, остеомиелитом, сепсисом.
Лабораторная диагностика. Материал (гной) подвергают бактериоскопии и высевают на питательные среды. Кровь, мокроту, фекалии исследуют бактериологическим методом. После выделения чистой культуры по ряду признаков определяют видовую принадлежность. В случае выделения S.aureus определяют плазмокоагулазу, гемолизин, А-протеин.
Серодиагностика: РП (альфа-токсин), РНГА, ИФА.
Для установления источника и путей распространения инфекции, выделенные культуры фаготипируют. Лабораторный анализ непременно включает определение чувствительности выделенной культуры или культур к антибиотикам.
Профилактика и лечение. Профилактика направлена на выявление носителей S.aureus, главным образом среди персонала медицинских учреждений, с целью их санации. Особое внимание уделяется профилактике стафилококковых инфекций у новорожденных.
Для лечения острых стафилококковых заболеваний назначаются антибиотики, выбор которых определяется чувствительностью выделенной культуры к набору препаратов. При септических процессах вводят противостафилококковый иммуноглобулин или антистафилококковую плазму. Для лечения хронических стафилококковых инфекций (хрониосепсис, фурункулез и др.) применяют стафилококковый анатоксин, аутовакцину, которые стимулируют синтез антитоксических и антимикробных антител.
Методы микробиологической диагностики стафилококковых заболеваний отражены в схеме 1. Выполняется следующий комплекс методов исследования.
Бактериоскопический метод – микроскопия мазков из материала от больного, окрашенных по Граму. Выявление в мазках кокков, располагающихся небольшими группами по 2-3 бактерии; типичное расположение в виде гроздьев винограда характерно для чистых культур стафилококка (рис. 1 – цветная вкладка).
Бактериологический метод. Исследуемый материал засевают на чашки с желточно-солевым (ЖСА) и кровяным МПА, инкубируют при 37 0 С сутки. На 2 день учитывают характер
роста колоний на обеих средах. На желточно-солевом агаре колонии стафилококка имеют ровные края, гладкую поверхность, вокруг колонии образуется радужный венчик в результате расщепления лецитина яичного желтка ферментом лецитовителлазой; цвет пигмента колоний варьирует от золотистого до белого. На кровяном МПА вокруг колоний образуются зоны
гемолиза. Из типичных для стафилококка колоний делают мазок, окрашивают его по Граму, микроскопируют. Оставшуюся часть колонии пересевают на скошенный МПА для получения чистой культуры. На 3 день проводят идентификацию выделенной культуры стафилококка с дифференциацией основных видов в соответствии с таблицей 2, определяют чувствительность к антибиотикам методом бумажных дисков и фаговар (набор для фаготипирования состоит из фагов 21 типа, разделенных на 4 группы; при внутрибольничных инфекциях наиболее часто встречаются фаговары 77 и 80).
Таблица 1. Этиология бактериальных раневых и гнойно-воспалительных инфекций
Enterococcus faecalis, Staphylococcus aureus, Staphylococcus hyicus, Staphylococcus epidermidis, Staphylococcus saprophyticus, Staphylococcus haemolyticus, Staphylococcus hominis, Streptococcus pyogenes, Streptococcus agalactiae, Erysipelotrix rhusiopathiae
Неспорообразующие грамположительные бактерии
Неспорообразующие грамотрицательные бактерии
Peptostreptococcus spp, Propionibacterium spp
Cпорообразующие грамположительные бактерии
Clostridium perfringens, Clostridium novy, Clostridium oedematiens, Clostridium septicum, Clostridium sordelli, Clostridium histolyticum, Clostridium sporogenes, Clostridium ramosum
Схема 1. Микробиологическая диагностика стафилококковых инфекций
Материал: гной, раневое отделяемое, пунктаты из полостей и абсцессов, кровь, мокрота, моча, ликвор, рвотные массы, испражнения, остатки пищи.
Выявление грамположительных кокков (группами по 2-3 клетки) в мазках из материала от больного, окрашенных по Граму
РНГА или РН для определения α-антитоксина в сыворотке крови больных хроническими стафилококковыми инфекциями. ИФА для определения антител к стафилококку. Имеет вспомогательное значение
1 день. Посев материала на чашки с желточно-солевым (ЖСА), кровяным МПА, сахарным МПБ.
2 день - учет характера роста колоний. На ЖСА колонии стафилококка с ровными краями, гладкой поверхностью, радужным венчиком вокруг, цвет - от золотистого до белого.
На кровяном МПА - зоны гемолиза, в МПБ –равномерное помутнение. В мазке из колоний в окраске по Граму – кокки в виде гроздьев винограда. Пересев оставшейся части колонии на скошенный МПА для получения чистой культуры, а с сахарного МПБ на кровяной МПА и ЖСА для получения изолированных колоний.
3 день - идентификация выделенной культуры стафилококка, дифференциация видов по биохимическим свойствам, определение чувствительности к антибиотикам и фаговара. Выделение чистой культуры с ЖСА и кровяного МПА.
4 день. Заключение о виде стафилококка. Идентификация культуры, выделенной из сахарного МПБ
5 день. Заключение о виде стафилококка, выделенного из сахарного МПБ.
Таблица 2. Дифференциация основных видов стафилококка
Анаэробная ферментация глюкозы
Анаэробная ферментация маннита
Чувствительность к новобиоцину
Обозначения: (+) – наличие признака; (-) – отсутствие признака; S - чувствительный; R – резистентный.
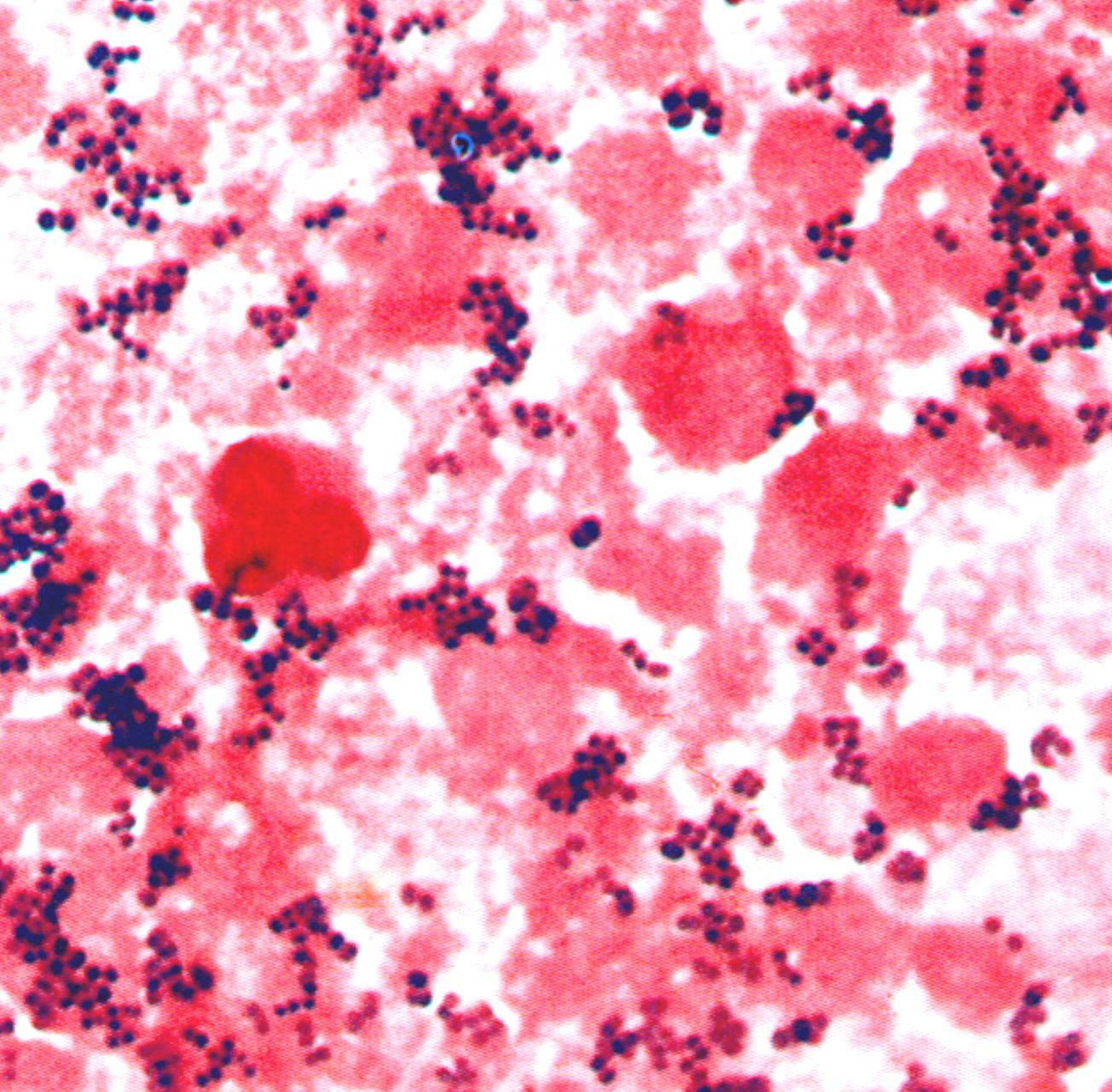
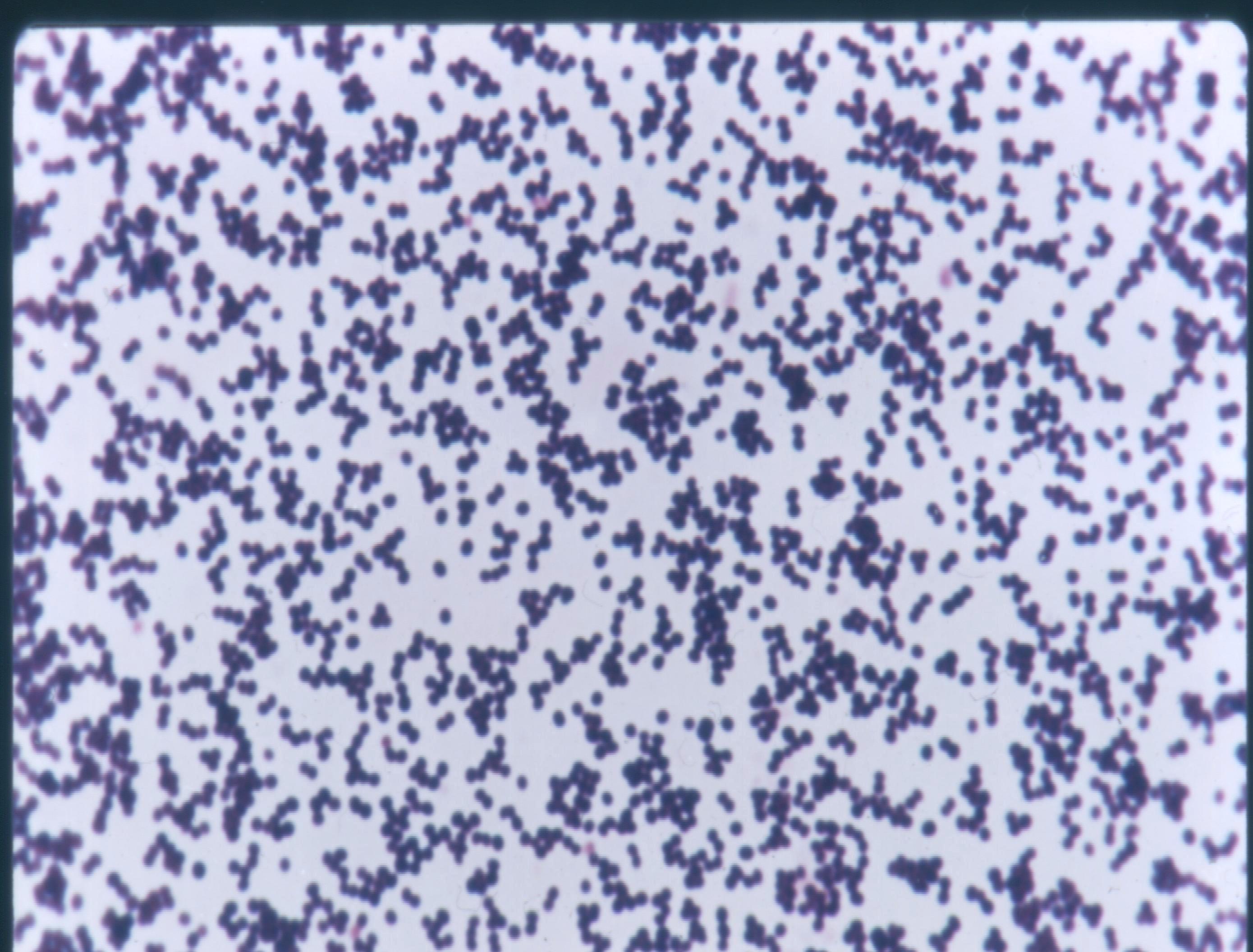
Рис. 1. Стафилококк - Staphylococcus aureus. а – мазок из исследуемого материала, б - мазок из чистой культуры. Окраска по Граму. Скопления кокков в виде гроздьев винограда. х900
Для выявления плазмокоагулазы цитратную плазму крови кролика разводят в 2 раза, разливают по 0,4 мл в пробирки, куда вносят петлей культуру стафилококков. Результаты регистрируют через 2, 4, 24 часа. При наличии плазмокоагулазы образуется сгусток.
В некоторых случаях у выделенных чистых культур стафилококка определяют наличие ДНК-азы, каталазы, лизоцимной активности, фибринолизина, гиалуронидазы.
Лизоцимную активность выявляют по зонам просветления вокруг колоний стафилококка при его посеве на МПА в чашках Петри с культурой Micrococcus luteus.
Определение ДНК-азы. Суточную агаровую культуру стафилококка засевают на МПА в чашке Петри, содержащий ДНК. После инкубации посевов при температуре 37 0 С в течение 18-24 часов поверхность МПА заливают 1 N раствором соляной кислоты. Наличие ДНК-азы характеризуется появлением зоны просветления вокруг колоний.
Каталазный тест. Чистую культуру стафилококка вносят в каплю 3%-10%-го раствора перекиси водорода на стекле и растирают круговыми движениями. При наличии каталазы перекись водорода разлагается с образованием пузырьков кислорода.
Cерологический метод в диагностике стафилококковых инфекций имеет вспомогательное значение, используясь, в основном, для диагностики хронических процессов (остеомиелит, септикопиемия и др.). Для определения антител к токсину стафилококка применяют РНГА с эритроцитарным диагностикумом, нагруженным α-токсином стафилококка или РН (реакция нейтрализации гемолитической активности стафилококкового токсина антитоксинами сыворотки крови больного в присутствии эритроцитов кролика). У здоровых лиц титр стафилококкового антитоксина составляет 0,5-4 АЕ. Разработан также ИФА.
Волков Игорь Иванович
СОВЕРШЕНСТВОВАНИЕ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ И ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ ИХ ВОЗБУДИТЕЛЕЙ
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Материал предоставлен сайтом "Вестник инфектологии"
Материалы и методы исследования
Обследован медицинский персонал 8 хирургических клиник Военно-медицинской академии (694 человек) на носительство стафилококков на слизистой носа и зева, на носительство МРС и видовой состав стафилококков - 510 человек (медицинский персонал - 175, больные - 159, курсанты - 176 человек).
Проанализирована частота выделения стафилококков из 3162 проб клинического материала хирургических клиник (раневое отделяемое - 485, кровь - 1620, моча - 798, мокрота - 139, желчь - 20, секционныей материал - 100 проб). Пробы раневого отделяемого исследовались на активность инфекционного процесса (определение концентрации возбудителя), а выделенные стафилококки идентифицировались до вида.
У 109 больных клиники сердечно-сосудистой хирургии определена этиологическая структура септических эндокардитов (40 штаммов стафилококков). Критерием этиологической значимости считали повторное выделение из крови одного и того же вида стафилококка у конкретного пациента. Для изучения особенностей экологии стафилококковых инфекций провели санитарно-бактериологические исследования 64 проб воздуха палат хирургических отделений и учебных классов. Всего выделено и проведена видовая идентификация 240 S.aureus и 910 КОС.
Взятие материала и количественное определение микрофлоры ран проводили в соответствии с "Методическими рекомендациями по микробиологической диагностике раневых инфекций в лечебно-диагностических учреждениях армии и флота" (1996 г.). Первичный посев крови от больных кардиохирургического стационара осуществляли в усовершенствованную транспортную среду Л.Е. Журавлевой (1997 г.). Выделение и идентификацию стафилококков проводили в соответствии с приказом МЗ СССР N 535 от 22.04.85 г., приказом N 8 МЗ РФ от 1995 г. и методическими рекомендациями по выделению и идентификации бактерий рода Staphylococcus 1990 г., с учётом новых данных W.E. Kloos и K.H. Schleifer 1982-1997 гг.
Бактериологическое обследование на выявление носителей золотистого стафилококка проводили в соответствии с Приказом МЗ СССР N 720 от 31.07.78 г. Санитарно-бактериологическое обследование хирургических стационаров проводили в соответствии с "Инструкцией по санитарно-противоэпидемическому режиму и проведению санитарного надзора в лечебных учреждениях Советской Армии и Военно-Морского Флота 1980 г. Исследование микробной обсеменённости воздушной среды изучали аспирационным методом с помощью приборов Кротова и пробоотборника аэрозольного бактериального (ПАБ-1).
При разработке тестов микрообъемной идентификации, для сравнения, использовали данные классического метода. Сравнение идентифицирующей способности разработанного микрометода проводили с коммерческими тест-системами STAPHYtest ("Lachema", Чехия) и ПБДС (НПО Нижний Новгород). Постановку реакций осуществляли согласно инструкциям фирм изготовителей. Идентификацию видов стафилококков производили по прилагаемым "ключам". Собственные "ключи" идентификации разработаны на основе методики А.М. Полового (1982 г.).
Чувствительность выделенных стафилококков к антибиотикам осуществляли в соответствии с "Методическими рекомендациями по определению чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков" (1985 г.) с учетом методических рекомендаций профессора М.С. Поляка (1998 г.). Изучалась чувствительность к 23 препаратам из различных групп антибиотиков. В работе были использованы диски для определения чувствительности к противомикробным препаратам Научно-исследо-вательского центра фармакотерапии (НИЦФ) при НИИ антибиотиков г. Санкт-Петербург. При определении чувствительности к антибиотикам исследовали чувствительность эталонных штаммов S.aureus: АТСС 29253, 5a и 209Р, E.coli АТСС 25922 и P.aeruginosa АТСС 27853 (НИЦФ).
Чувствительность к метициллину определяли на специальной среде набора для определения "метициллинрезистентности" (НИЦФ) при 30оС в течении 48 ч в соответствии с инструкцией к набору. К метициллинрезистентным относили штаммы, у которых отсутствовала зона задержки роста.
Материалы исследований обрабатывали с помощью методов вариационной статистики с вычислением средней арифметической и её ошибки. Оценку достоверности различий определяли по Т-критерию Стьюдента. При проведении расчётов использовали пакет прикладных программ для ПЭВМ.
Читайте также:


