Серологическое исследование на листериоз

С 2009 по 2015 гг. в хозяйствах Алматинской области РК проводили исследования по обнаружению возбудителя листериоза у 1 % животных. Ежегодно в стационарно неблагополучных хозяйствах области проводили бактериологические исследования биоматериала от больных и патматериала от павших животных по обнаружению возбудителя листериоза. Диагностические исследования проводились с использованием бактериологических, биохимических, серологических и генетических методов, постановкой биопробы.
Листериоз – инфекционная болезнь человека и многих видов животных, которая чаще всего встречается у овец и свиней, реже у крупного рогатого скота и коз, промысловых животных, пушных зверей, кроликов, домашних и диких птиц, лошадей, лисиц, хорьков, кур. Листериоз протекает либо в септической форме (кролики, морские свинки, мыши, поросята), либо с явлениями нервного синдрома и значительным расстройством центральной нервной системы (свиньи, крупный рогатый скот, овцы, лисы). Листериоз может сопровождаться абортами у крупного рогатого скота, овец и коз. Листериозу свойственны природная очаговость и стационарность.
В естественных условиях листериозом поражаются все виды домашних и диких животных. Основным резервуаром возбудителя в природе являются некоторые виды диких животных, но особенно грызуны. Листерии длительное время могут не только сохраняться во внешней среде – почве, навозе, воде, на растениях, но и размножаться, даже при низких (+ 4 °С) температурах. Некачественный силос является благоприятной средой для размножения листерий, особенно в его поверхностных слоях. Загрязненные листериями водоемы опасны в эпизоотологическом и эпидемиологическом отношении. Человек листериозом заражается в результате контакта с инфицированными грызунами, либо с сельскохозяйственными животными, особенно со свиньями, через поврежденную кожу; через пищеварительный тракт – при употреблении в пищу не подвергавшихся термической обработке ранних овощей, собранных с участков, где использованы для полива необеззараженные сточные воды и навоз. В результате инфицирования поражается нервная система и головной мозг человека. Внедрение листерий в организм человека может привести к развитию сепсиса, поражению отдельных органов и систем, а также к бессимптомному заболеванию. У женщин при поражении листериозом отмечаются аборты листериозной этиологии. Заболевание человека возможно также после употребления инфицированной пищи, в частности молока и мяса больных животных. Распространение листерий в организме происходит нейрогенным, лимфогенным, гематогенными путями. Листерии, распространяясь различными путями, преодолевая защитный барьер, проникают в головной мозг. У человека листериоз протекает в форме моноцитарной ангины и листериозного менингита, который во многих случаях заканчивается смертельно. Поражается центральная нервная система, отмечаются приступы судорог, возбуждение. Температура тела в начальный период заболевания повышена, а затем снижается. При листериозе у различных видов животных, а также у человека отмечается значительное повышение числа моноцитов в крови (отсюда и название Listeria monocytogenes). Гистологическое исследование мозга указывает на моноцитарную инфильтрацию.
В хозяйствах Алматинской области листериоз сельскохозяйственных животных встречается. По нашим данным, в стационарно неблагополучных хозяйствах, имеющих крупный и мелкий рогатый скот, листериоз обнаруживается у 10–30 % исследованных животных. В Казахском научно-исследовательском ветеринарном институте из 10 проб, предоставленных из хозяйств Алматинской области РК в 2009 год выделен возбудитель листериоза в двух случаях (от 7 месячного теленка, 2-летней коровы), в 2011 году – в двух случаях (от 3-летней коровы, годовалой овцы); в 2014 году – в трех случаях (от 6 месячного теленка, овцы, 8 месячного ягненка); а в 2015 году – в двух случаях (от коровы и быка-производителя).
Диагноз на листериоз ставят на основании комплекса эпизоотологических данных и результатов лабораторного исследования. Решающее значение принадлежит бактериологическому исследованию – выделению культуры листерий. Бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурально-морфологическим, биохимическим, молекулярно-биологическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Материалы и методы исследования
Для бактериологического исследования на листериоз отбирается: головной мозг, доля печени, почка.
В патологическом материале с подозрением на листериоз – в паренхиматозных органах павших животных характерные патологоанатоми- ческие изменения: изменен цвет паренхимы печени, мягкой консистенции, бывает разложившаяся; селезенка кровенаполнена, темного цвета; паренхима почки мягкой консистенции, цвет изменен. Предоставленные патматериалы были отобраны от трупов животных. Заболевание протекало в острой форме и закончилось гибелью животных.
Бактериологические исследования проводили путем посева суспензии из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1:5 на питательные среды МПБ (мясо-пептонный бульон), МПА (мясо-пептонный агар). При приготовлении сред для лучшего роста листерий добавляли 3 % сыворотки крови КРС, 3 % глюкозы и 2 % глицерина. Посевы культур выращивали в термостате при 25 °С. Из головного мозга и печени готовили мазки-отпечатки. Мазки из суточных колоний листерий и мазки-отпечатки окрашивали по Граму.
Биохимические свойства выделенной культуры листерий, каталазную и лецининазную активность определяли общепринятыми методами, биопробу ставили на белых мышах и морских свинках. Для окончательной идентификации выделенных культур, выполняли генетические исследования по секвенированию 16S rRNA гена бактерии.
Предназначенные для идентификации 24 – часовые бульонные культуры, выращенные при 25 °С, бактериологической петлей засевали частым штрихом на 2 пробирки МПА, так, чтобы получить рост по всей поверхности агара, выращивали при комнатной температуре 24 – 30 часов. Затем агаровую культуру смывали небольшим количеством физраствора, чтобы получить густую взвесь (1–1,5 млрд м.к. (микробных клеток) в 1 мл) для постановки РА – реакция агглютинации, пластинчатая реакция для серологической диагностики листериоза.
Для серологической идентификации выделенной культуры листерий использовали поливалентную листериозную агглютинирующую сыворотку, которая представляет собой смесь кроличьих листериозных агглю- тинирующих сывороток и содержит антитела Н-АВ и О-II, V, VI, VII, IX. Для проведения РА на чистое обезжиренное предметное стекло наносили две капли: каплю поливалентной сыворотки и каплю физиологического раствора (физраствора). К обеим каплям на стекле добавляли по одной капле смыва суточной культуры, смесь тщательно перемешивали бактериологической петлей, после чего стекла плавно покачивали круговыми движениями. Одновременно для контроля исследовали на стекле каплю сыворотки с добавлением капли физраствора.
Результаты исследования и их обсуждение
Через 24 ч культивирования посевов в термостате при 25 °С в МПБ наблюдалось легкое равномерное помутнение бульона, на МПА выросли колонии мелкие, росинчатые, блестящие, вязкой консистенции, в проходящем свете наблюдали нежный рост колоний – мелкие выпуклые беловатые колоний как беловатый налет на агаре.
Для выделения листерий из патматериала использовали МПБ, МПА с добавками. Через 24 ч при появлении сплошного роста колоний бактериоло- гической петлей производили пересев на селективную диагностическую среду Palkam. Через 24 часа инкубирования на селективной среде Pаlcam отмечался обильный рост мелких, серовато-зелёных или оливково-зелёных колоний с чёрным ореолом, диаметром 0,5–1,0 мм. Через 48 часов колонии диаметром 1,0–2,0 мм приобретали зеленую окраску с углубленными центрами, окруженными чёрным ореолом. При появлении сплошного роста колоний листерий производили пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2–3 чашки Петри с селективной дифференциально-диагностической средой для получения изолированных колоний. Бактериальную массу из выросших изолированных колоний использовали для окрашивания по Граму, проведения молекулярно-генетических исследований.
В окрашенных по Граму препаратах бактерии рода листерия установлены в виде коротких палочек, располагающихся одиночно и попарно. Возбудитель листериоза представляет собой грамположительные с закругленными концами палочки, которые могут быть полиморфными. Характерной особенностью листерий является то, что некоторые 2 бактерий располагаются по отношению друг к другу в виде римской цифры V или летящей чайки (важный дифференцирующий признак). Суточная культура листерий, выделенная от теленка, представлена на рис. 1.

Рис. 1. Культура листерий в мазке, окрашенном по Граму
На рис. 1 видны мелкие грамположительные палочки с закругленными концами, которые являются полиморфными, располагаются по одиночке, попарно или группой клеток. Видны бактерий листерий, располагающихся в виде римской цифры V и летящей чайки.
Дальнейшую идентификацию возбудителя листериоза проводили путем определения подвижности методом висячей капли 12-часовой бульонной культуры, выращенной при комнатной температуре. Для установления подвижности листерий культуры выращивали на ПЖА при комнатной температуре, так как при культивировании при 37 °С термолабильные жгутики у листерий разрушаются и подвижность их прекращается. На ПЖА отмечался характерный рост по линии укола в виде зонтика, в культуре листерий были подвижны.
При хранении патологического материала в холодильнике при + 4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного диагностического метода использовали исследуемый материал в течение 30 дней для проведения повторных исследований через каждые 10 дней путем посева на МПБ и МПА. В трех повторностях посевов изолята выросли культуры листерий с характерными культурально-морфологическими признаками.
Изучением биохимических свойств установлено, что при посеве суточных культур на среды Гисса листерии ферментировали с образованием кислоты без газа глюкозу, рамнозу, салицин, левулезу, несколько медленнее -сахарозу, растворимый крахмал и глицерин; не ферментировали арабинозу, дульцит, инулин, сорбит; не образовывали индола и сероводорода, не разжижали желатин, не восстанавливали нитраты в нитриты. Определение каталазной активности листерий: к 1 мл суточной бульонной культуры и агаровой культуре добавляли 1 мл свежеприготовленной 5 %-ной перекиси водорода. Вследствие присутствия фермента каталазы у выращиваемой культуры перекись водорода разлагается с образованием кислорода (пузырьков газа). В наших опытах в пробирочной и пластинчатой реакциях агглютинации наблюдалось газообразование (бурлило), поэтому выделенная культура предварительно идентифицирована как Listeria.
Видовую идентификацию проводили методом определения лецитиназной активности листерий. К среде ГРМ № 1, содержащей 5 % вытяжки желтка куриного яйца в 50 % содержании питательного агара, добавляли порошкообразный активированный уголь до концентрации 0,5 %. Для определения лецитиназной активности исследуемую культуру и контрольный штамм листерий пересевали штрихами в 2 чашки среды ГРМ № 1 (без активированного угля) и 2 чашки с добавлением активированного угля. Инкубировали 48 ч при температуре 25 °С, после чего чашки просматривали в проходящем свете и определяли наличие активности в присутствии активированного угля. Эталонный штамм Listeria ivanovii давала плотную зону помутнения независимо от присутствия активированного угля, Listeria monocytogenes образовывала аналогичную зону помутнения в присутствии активированного угля и не образовывала в отсутствие угля. Это биохимическое свойство отличает Listeria monocytogenes от других видов рода Listeria.
Способом усовершенствования идентификации и таксономической классификации бактериальных разновидностей является получение нуклеотидной последовательности 16S rRNA гена путем секвенирования ДНК бактерий. Данный метод позволит провести генетическую идентификацию рода Listeria путем генотипирования.
Методом ПЦР был амплифицирован фрагмент ДНК протяженностью около 1100 п.н.. ПЦР была выполнена универсальными праймерами 16SrRNA-190F 5’– ATTAGCTAGTAGGTGGGGTAA-3 и 16SrRNA-1100R- 5’ TTACTAGCGATTCCGACTTCA в общем объеме 25 мкл. ПЦР смесь содержала 15 нг ДНК, 2.5х смеси, 5 пмоль каждого праймера и деионизированную воду 10 мкл. Программа амплификации ПЦР включала начальную денатурацию 94 °С в течение 3 минут; 27 циклов: 94 °С – 30 секунд, 60 °С – 30 секунд, 72 °С – 30 секунд; заключительную элонгацию 7 минут при 72 °С. ПЦР программа была выполнена с применением амплификатора Mastercycler Gradient, (Eppendorf).
Перед проведением реакции секвенирования для полученных фрагментов ДНК применяли ферментативный метод очистки. При ферментативном методе ПЦР продукты очищали от остатков олигонуклеотидов методом дефосфорилирования с помощью щелочной фосфатазы (SAP – Shrimp Alkaline Phosphatase, SibEnzyme) и эндонуклеазы Exonuclease I (Fermentas).
После ферментативной очистки ПЦР продукты были использованы для выполнения реакции секвенирования, очистки и разделения на автоматическом генетическом анализаторе ABI 3500.
Нуклеотидные последовательности 16S rRNA гена идентифицируемого штамма Listeria monocytogenes от 6 месячного теленка были проанализированы в программном обеспечении SeqScape 2.6.0 (Applide Biosystems).
С учетом полученных результатов, были проведены дальнейшие исследования по проверке чистоты представленного штамма, которые были осуществлены на основе анализа ферограммы нуклеотидной последовательности 16S rRNA гена. Было установлено, что у анализируемого штамма отсутствует смешение сигналов, что свидетельствует об отсутствии в предоставленной культуре посторонних видов бактерий. На рис. 2 в представлена ферограмма фрагмента нуклеотидной последовательности анализируемого гена Listeria monocytogenes.
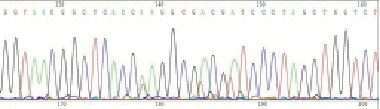
Рис. 2. Ферограмма фрагмента нуклеотидной последовательности гена 16S r RNA
Из рис. 2 видно, что проведенный анализ позволяет сделать выводы об отсутствии перекрестной контаминации культуры Listeria monocytogenes посторонними бактериями.
Последовательности нуклеотидов, полученные с применением прямого и обратного праймеров были объединены в общую последовательность, используя программное обеспечение SeqMan. Последовательности праймеров и плохо разделенные концевые участки были удалены из анализа. В результате проведенного анализа была получена нуклеотидная последовательность протяженностью около 700 п.н. Полученная нуклеотидная последовательность была проанализирована с применением базы данных NCBI утилиты BLAST. Нуклеотидная последовательность и результаты идентификации представлены в таблице и на рис. 3.
Результат идентификации гена 16S rRNA Listeria monocytogenes
Последовательность фрагмента 16S r RNA гена
Идентификация нуклеотидных последовательностей в международной базе данных (http://www.ncbi.nlm.nih.gov/) алгоритм BLAST
Инвентар-ный номер GeneBank (Accesion number) или коллекционный номер штамма
TAAAGAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAACGAACGGAGGAAGAGCTTGCTCTTCCAAAGTTAGTGGCGGACGGGTGAGTAACACGTGGGCAACCTGCCTGTAAGTTGGGGATAACTCCGGGAAACCGGGGCTAATACCGAATGATAAAGTGTGGCGCATGCCACGCTTTTGAAAGATGGTTTCGCTATCGCTTACAGATGGGCCCGCGGTGCATTAGCTAGTTGGTAGGGTAATGGCCTACCAAGGCAACGATGCATAGCCGACCTGAGAGGGTGATCGGCCACACTGGGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTAGGGAATCTTCCGCAATGGACGAAAGTCTGACGGAGCAACGCCGCGTGTATGAAGAAGGTTTTCGGATCGTAAAGTACTGTTGTTAGAGAAGAACAAGGATAAGAGTAACTGCTNGTCCCTTGACGGTATCTAACCAGAAAGCCACGGCTAACTACGTGCCAGCAGCCGCGGTAATACGTAGGTGGCNAGCGTNGTCCGGATGGATTGGGCGTNAAGCGCGCGCAGGCGGTCTTTTAAGTCTNATGTGAAAGCCCCCGGCTGAACCGGGNNGGGTCATTGGAAACTGGAAGACTNGAGTGCNGAAGAGGAGAGTGGAATTCCACGTGTAGCGGTGAAATGCGTAGATATGTGGAGGAACACCAGTGGCGAAGGCGACTCTCTGGTCTGTNACTGACG CTGAGGCGCG AAAGCGTGGG
Listeria monocytogenes 07PF0776 strain 07PF0776
Listeria monocytogenes strain NCTC 10357
Listeria innocua strain ATCC 33090
Из таблицы следует, что данные Международного банка GeneBank [6] показывают высокую степень однородности нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (99 %).
Как видно из рис. 3, анализируемый штамм находится на одной филогенетической ветви с разновидностями рода Listeria.
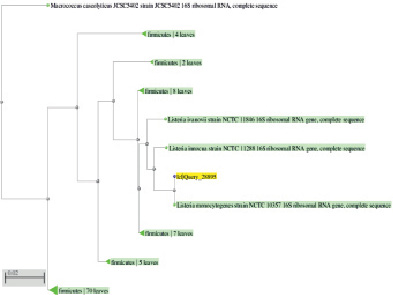
Рис. 3. Филогенетическое древо, построенное на основании фрагмента гена 16S rRNA
Определение патогенности листерий. Биопробу ставили на 3 белых мышах массой 16-18 г, которым подкожно вводили по 0,2 мл суточной бульонной культуры Listeria monocytogenes. На 3 сутки опытные животные пали. При бактериологическом исследовании патматериала от павших белых мышей чистая культура листерий высевалась из печени, сердца.
На 2 морских свинках ставили конъюнктивальную пробу введением в конъюнктивальный мешок по 0,05 мл суточной бульонной культуры Listeria monocytogenes. У морских свинок на 3 сутки развился кератоконъюнктивит и светобоязнь.
В результате проведенных исследований установлено, что эпизоотическая культура Listeria monocytogenes, полученая из патматериала от теленка, коровы, быка-производителя, обладала типичными культурально-морфологическими, биохимическими и антигенными свойствами и по результатам серологических исследований отнесена к 1-му серотипу. По биологическим свойствам эпизоотический изолят был идентичен эталонному музейному штамму. Методом генотипирования была установлена однородность нуклеотидной последовательности 16S rRNA изучаемого штамма с разновидностями рода Listeria (совпадение 99 %).
Таким образом, диагноз на листериоз был поставлен на основании клинико-эпизоотологических данных, характерных культуральных и морфологических свойств, тинкториальных свойств, биохимических свойств (отношение к белкам, углеводам, каталазной, лецитиназной активности и т.д.), молекулярно – генетических свойств (проведения генотипирования методом ПЦР), положительной реакции агглютинации с поливалентной и типовой листериозными сыворотками и отсутствием агглютинации в контроле с физраствором, а также в результате изучения биологических свойств с постановкой биопробы на лабораторных животных.
Во время изолированного содержания, при формировании новых групп в хозяйствующих субъектах или населенных пунктах необходимо проводить клиническое обследование животных и при необходимости (при выявлении признаков поражения нервной системы, абортов, повышенной температуры тела) бактериологические и серологические исследования на листериоз. Систематически проводить уничтожение грызунов, кровососущих насекомых и клещей. Вести строгий учет случаев абортов, мертворождения и падежа животных и направлять патологический материал на исследование в ветеринарную лабораторию.
Полный текст:
В обзоре представлены данные об антигенной структуре листерий и современной классификации эпидемически значимых серовариантов листерий. Приведены сведения о характерных видоспецифических свойствах серовариантов листерий, которые могут быть общими для двух или нескольких видов, а также имеют общие антигены со стафилококками, тифо-паратифозными бактериями. Показано, что для медицинской микробиологии представляет практический интерес только антигенная схема Listeria monocytogenes – единственного вида листерий, патогенного для человека. Определено важное значение серотипирования при проведении эпидемиологического анализа с целью выявления источника инфекций и путей её распространения. Изложены сведения об открытии возбудителя листериоза. Приведены данные, касающиеся различий в обозначении серовариантов при диагностике листериоза в отечественной и зарубежной медицинской практике. Отображена неразрывная связь серотипов листерий с определённым хозяином, определённым типом заболевания и географическим происхождением, что подтверждается выделением изолятов из продуктов питания. Так, наиболее часто выделяемыми серотипами являются 1 и 4. Показано, что высокий уровень адаптационных свойств листерий, их способность к размножению в абиотической среде, в том числе в продуктах питания, увеличение лиц с различными иммунодефицитами, а также преобладание пищевого пути заражения представляют значительный риск повышения заболеваемости листериозом. В обзоре дана информация о таких рекомендуемых в качестве экспрессдиагностики методах иммунохимических исследований, как реакция иммунофлюоресценции, иммуноферментный анализ, а также полимеразная цепная реакция. В обзоре рассматривается современное состояние проблемы серологической диагностики и перспективные направления серотипирования патогенных листерий. Серологическая диагностика листерий детально не разработана, а существующие серологические методы направлены на выявление специфических антител к листериям. К преимуществам серологического метода можно отнести: быстрый результат; возможность исследования любого биологического материала. Доступные в настоящее время серологические методы имеют ряд недостатков, такие как малая достоверность результатов, низкая специфичность исследования.
1. Фризе К., Кахель В. Инфекционные заболевания беременных и новорожденных. М.: Медицина; 2003.
2. Эпидемиология и профилактика листериоза: Методические указания. М.: Федеральный центр Госсанэпиднадзора Минздрава России; 2002.
3. Swaminathan B, Gerner-Smidt P. The epidemiology of human listeriosis. Microbes Infect. 2007; 9(10): 1236-1243. doi: 10.1016/j.micinf.2007.05.011
4. Собянин К.А., Сысолятина Е.В., Чаленко Я.М., Ермолаева С.А. Влияние природных вариантов фактора инвазии InLB на вирулентность листерий. Вестник КрасГАУ. 2016; (6): 57-63.
5. Bueno VF, Banerjee P, Banada PP, Mesquita AJ, LemesMarques EG, Bhunia AK. Characterization of Listeria monocytogenes isolates of food and human origins from Brazil using molecular typing procedures and in vitro cell culture assays. Int J Environ Health Res. 2010; 20(1): 43-59. doi: 10.1080/09603120903281283.
6. McLauchlin J. The pathogenicity of Listeria monocytogenes: a public health perspective. Rev Med Microbiol. 1997; (8): 1-14.
7. NicAogáin K, O’Byrne CP. The role of stress and stress adaptations in determining the fate of the bacterial pathogen Listeria monocytogenes in the food Chain. Frontiers Microbiology. 2016; 7(1865): 1-16. doi: 10.3389/fmicb.2016.01865
9. Гальцева Г.В., Федоренко Л.М., Инжеватова В.Б., Буланова Е.Е. Лабораторная диагностика листериоза. Успехи современного естествознания. 2006; (1): 52-53.
10. Джейн Д.М., Лёсснер М.Д., Гольден Д.А. Современная пищевая микробиология. М.: БИНОМ. Лаборатория изданий; 2011.
11. Зайцева Е.А., Ермолаева С.А. Дифференциация штаммов Listeria monocytogenes методом мультиплексной полимеразной цепной реакции. Тихоокеанский медицинский журнал. 2014; (3): 40-42.
12. Почицкая И.М., Козельцева Е.И., Лобазова И.Е. Выявление и идентификация Listeria monocytogenes с помощью тест-систем Singlepath® L.‘mono. Пищевая промышленность: наука и технологии. 2017; 1(35): 98-102.
13. Стародумова С.М., Зайцева Е.А. Способ быстрой идентификации бактерий рода Listeria и патогенного вида Listeria monocytogenes с помощью мультиплексной ПЦР. Тихоокеанский медицинский журнал. 2014; (1): 95-97.
14. Тартаковский И.С. Листерии: роль в инфекционной патологии человека и лабораторная диагностика. Клиническая микробиология антимикробная химиотерапия. 2000; 2(2): 20-30.
15. Doumith M, Buchrieser C, Glaser P, Jacquet C, Martin P. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR. J Clin Microbiol. 2004; (42): 3819-3822. doi: 10.1128/ JCM.42.8.3819-3822.2004
16. Fentahun T, Fresebehat A. Listeriosis in small ruminants: a review. Adv Biol Res. 2012; 6(6): 202-209. doi: 10.5829/idosi. abr.2012.6.6.66159
17. Gasanov U, Hughes D, Hansbro PM. Methods for the isolation and identification of Listeria spp. and Listeria monocytogenes: a review. FEMS Microbiology Reviews. 2005; 29(5): 851-875. doi: 10.1016/j.femsre.2004.12.002
18. Janzten MM, Navas J, Corujo A, Moreno R, López V, Martínez-Suárez JV. Review. Specific detection of Listeria monocytogenes in foods using commercial methods: from chromogenic media to real-time PCR. Span J Agric Res. 2006; 4(3): 235-247. doi: 10.5424/sjar/2006043-198
19. Jordan K, Fox EM, Wagner M. Listeria monocytogenes: methods and protocols, methods in molecular biology. NY: Springer Science; 2014.
20. Vallim DC, Hofer CB, Rodrigo de Castro L, Victor BA, Alves RL, Moura FC, et al. Twenty years of listeria in Brazil: occurrence of Listeria species and Listeria monocytogenes serovars in food samples in Brazil between 1990 and 2012. BioMed Research International. 2015; 2015: 540204. doi: 10.1155/2015/540204
21. Зайцева Е.А. Особенности биологических свойств бактерий вида Listeria innocua, выделенных на территории Приморского края. Альманах клинической медицины. 2017; 45(2): 147-153. doi: 10.18786/2072-0505-2017-45-2-147-153
22. Тартаковский И.С., Малеев В.В., Ермолаева С.А. Листерии: роль в инфекционной патологии человека и лабораторная диагностика. М.: Медицина для всех; 2002.
23. Gholizadeh Y, Poayrt C, Livin M, Bertti JL, Croize J, Berche P, et al. Serodiagnosis of listeriosis based upon detection of antibodies against recombinant truncated forms of listeriolysin O. J Clin Microbiol. 1996; 34(6): 1391-1395.
24. McLauchlin J, Audurier A, Taylor AG. Aspects of the epidemiology of human Listeria monocytogenes infections in Britain 1967-1984; The use of serotyping and phage typing. J Med Microbiol. 1986; 22(4): 367-377. doi: 10.1099/00222615-22-4-367
25. Junttila JR, Niemela SI, Hirn J. Minimum growth temperatures of Listeria monocytogenes and non-haemolytic listeria. J Appl Bacteriol. 1988; 65(4): 321-327.
26. Murray EGD, Webb RA, Swann MBR. A disease of rabbits characterized by large mononuclear leucocytosis caused by a hitherto und escribed bacillus Bacterium monocytogenes (n.sp.). J Pathol Bacteriol. 1926; 29: 407-439.
27. Лабинская А.С., Костюкова Н.Н., Иванова С.М. Руководство по медицинской микробиологии. Частная медицинская микробиология и этиологическая диагностика инфекций. М.: БИНОМ; 2012.
28. Ющук Н.Д., Венгеров Ю.Я. Инфекционные болезни: национальное руководство. М.: ГЭОТАР-Медиа; 2015.
29. Годова Г.В., Пушкарева В.И., Калашникова Е.А., Овод А.А., Диденко Л.В., Князев А.Н., и др. Формирование биопленок Listeria monocytogenes при взаимодействии с клетками овощных культур. Известия ТСХА. 2013; (5): 50-59.
30. Жаринова Н.В., Брюханова Г.Д., Малецкая О.В., Царева Н.С., Лунева Т.М. Взаимоотношение возбудителей чумы и листериоза при одновременном пребывании их в организме блохи Citellophilus tesquorum при разных температурных условиях внешней среды. Медицинская паразитология и паразитарные болезни. 2008; (1): 41-43.
31. Orsi RH, Wiedmann M. Characteristics and distribution of Listeria spp., including Listeria species newly described since 2009. Appl Microbiol Biotechnol. 2016; 100(12): 5273-5287. doi: 10.1007/ s00253-016-7552-2
32. Зайцева Е.А., Пуховская Н.М., Мусатов Ю.С., Иванов Л.И., Ермолаева С.А., Сомов Г.П. Молекулярно-генетические особенности и эпидемическая значимость штаммов Listeria monocytogenes, выделенных от беременных женщин и из абортного материала в дальневосточном регионе России. Клиническая микробиология и антимикробная химиотерапия. 2007; 9(1): 81-89.
33. Montero D, Bodero M, Riveros G, Lapierre L, Gaggero A, Vidal RM, et al. Molecular epidemiology and genetic diversity of Listeria monocytogenes isolates from a wide variety of ready-toeat foods and their relationship to clinical strains from listeriosis outbreaks in Chile. Front Microbiol. 2015; (6): 384. doi: 10.3389/ fmicb.2015.00384
34. Lee S, Ward TJ, Graves LM, Wolf LA, Sperry K, Siletzky RM, et al. Atypical Listeria monocytogenes serotype 4b strains harboring a lineage II-specific gene cassette. Appl Environ Microbiol, 2012; 78(3): 660-7. doi: 10.1128/AEM.06378-11
35. Ибрагимова М.А. Современные аспекты листериозной инфекции (обзор литературы). Вестник АГИУВ. 2016; (1): 84-91.
36. Burall LS, Grim C, Gopinath G, Laksanalamai P, Datta AR. Whole-genome sequencing identifies an atypical Listeria monocytogenes strain isolated from pet foods. Genome Announc. 2014; 2(6): e01243-14. doi: 10.1128/genomeA.01243-14
37. Chiara M, Caruso M, D’Erchia AM, Manzari C, Fraccalvieri R, Goffredo E, et al. Comparative genomics of Listeria sensu lato: genus-wide differences in evolutionary dynamics and the progressive gain of complex, potentially pathogenicityrelated traits through lateral gene transfer. Genome Biol Evol. 2015; 7(8): 2154-2172. doi: 10.1093/gbe/evv131
38. Lomonaco S, Nucera D, Filipello V. The evolution and epidemiology of Listeria monocytogenes in Europe and the United States. Infect Genet Evol. 2015; 35: 172-183. doi: 10.1016/j. meegid.2015.08.008.
39. Butman BT, Plank MC, Durham RJ, Mattingly JA. Monoclonal antibodies which identify a genus-specific Listeria antigen. Appl Environ Microbiol. 1988; 54(6): 1564-1569.
40. Мукантаев К.Н., Бегалиева А., Інірбай Б., Райымбек Г., Казыкен Д., Сегизбаева Г.Ж., и др. Получение рекомбинантного антигена р60 Listeria monocytogenes. Биотехнология. Теория и практика. 2015; (1): 17-25. doi: 10.11134/btp.1.2015.2
41. Grenningloh R, Darji A, Wehland J, Chakaraborty T, Weiss S. Listeriolysin and IrpA are major protein targets of the human humoral response against Listeria monocytogenes. Infect Immun. 1997; 65(9): 3976-3980.
42. Lorber B. Listeriosis. Clin Infect Dis. 1997; 24: 1-11.
43. Егорова И.Ю., Цыбанова В.А. Дикие животные как источник пищевых токсикоинфекций человека. Ветеринарная патология. 2014; (4): 45-49.
44. Farber JM, Peterkin PI. Listeria monocytogenes, a foodborn pathogen. Microbiol Rev. 1991; 55(3): 476-511.
45. Curiale MS, Lepper W, Robison B. Enzyme-linked immunoassay for detection of Listeria monocytogenes in dairy products, seafoods, and meats: collaborative study. J AOAC Int. 1994; 77(6): 1472-1489.
46. Ryser ET, Marth EH. Listeria, listeriosis and food safety. 2nd ed. New York: Marcel Dekker Inc; 1999.
47. Покровский В.И., Пак С.Г., Брико Н.И., Данилкин Б.К. Инфекционные болезни и эпидемиология: учебник. М.: ГЭОТАРМедиа; 2009.
48. Buchrieser C, Rusniok C, Kunst F, Cossart P, Glaser P. Comparison of the genome sequences of Listeria monocytogenes and Listeria innocua: clues for evolution and pathogenicity. FEMS Immunol Med Microbiol. 2003; 35(3): 207-213. doi: 10.1016/S0928- 8244(02)00448-0
49. Georgiev VSt. Opportunistic Infections: Treatment and Prophylaxis. New Jersey, Totowa: Humana Press; 2003.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


