Пиогенный стафилококк что это такое
Среди 18 видов и 8 родственных групп бактерий, причисленных к важнейшим патогенам человека, особую роль играют стрептококки. По медицинской значимости они занимают второе место после стафилококков. Из числа стрептококков, патогенных для человека, с середины 80-х гг. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной β-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
β-гемолитический стрептококк группы А (пиогенный стрептококк, БГСА S.pyogenes) - грамположительный, неспорообразующий, неподвижный микроорганизм. Растёт на кровяном агаре, обладает выраженной гемолитической активностью, каталазанегативный, чувствителен к бацитрацину. Встречается повсеместно, часто колонизирует кожные покровы и слизистые оболочки человека. Главными путями передачи являются воздушно-капельный, контактный и пищевой. Патогенез заболеваний связан с продукцией токсинов: гемолизин, стрептолизин, стрептокиназы А и В, дезоксирибонуклеаза, гиалуронидаза. Основные нозоформы представлены поверхностными (ангины, фарингит, импетиго, рожа), инвазивными (некротизирующий фасциит, миозит, менингит, эндокардит, пневмония, послеродовой сепсис) и токсин-опосредованными инфекциями (скарлатина, синдром токсического шока). Со стрептококковой инфекцией связано также возникновение неврологических расстройств у детей, проявляющихся обсессивно-компульсивными расстройствами (PANDAS-синдром).
Streptococcus pyogenes сохраняет 100% чувствительность к β-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность. Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%. Многоцентровое исследование резистентности клинических штаммов S.pyogenes, проведённое в 2000-2001 гг., позволило изучить распространенность устойчивости, прежде всего к макролидам, в различных регионах России. Частота резистентности к эритромицину варьировала и достигала 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину, представителю нового класса антибиотиков - кетолидов. Почти в 90% случаев резистентность к макролидам была обусловлена метилированием рибосом, в остальных случаях она была связана с активным выведением (эффлюксом) антибиотика из клетки.
Стрептококковый тонзиллофарингит
Стрептококковый тонзиллофарингит (ангина) - острое общее инфекционное заболевание с преимущественным поражением лимфоидного аппарата и слизистой оболочки глотки, вызванное БГСА. Под рецидивирующим стрептококковым тонзиллофарингитом следует понимать множественные эпизоды заболевания в течение нескольких месяцев с положительными результатами бактериологических и/или экспресс-методов диагностики БГСА, отрицательными результатами исследований между эпизодами заболевания, повышением титров противострептококковых антител после каждого случая болезни.
Этиология: среди бактериальных возбудителей острого тонзиллофарингита наибольшее значение имеет БГСА.
Эпидемиология. В США ежегодно диагностируется 1-1,4 млн. случаев тонзиллофарингита БГСА-этиологии. Передача осуществляется воздушно-капельным, контактным и пищевым путями. Источниками инфекции являются больные, реже - бессимптомные носители. Вероятность заражения увеличивается при высокой обсемененности и тесном контакте. БГСА может вызывать крупные вспышки тонзиллофарингита в организованных коллективах. Чаще болеют дети в возрасте 5-15 лет. Наибольшая заболеваемость - в зимне-весенний период.
Клиническая картина: Инкубационный период составляет от нескольких часов до 2-4 дней. Характерно острое начало с повышения температуры тела до 37,5-39°С, выражена общая интоксикация. Боль в горле бывает так сильно выражена, что у больного нарушается глотание. При осмотре выявляется покраснение нёбных дужек, язычка и задней стенки глотки. Миндалины гиперемированы, отёчны, часто с гнойным налётом желтовато-белого цвета. Налёт рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечается регионарный лимфаденит.
Кровь: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ, появление С-реактивного белка.
Длительность периода разгара (без лечения) составляет 5-7 дней. В дальнейшем, при отсутствии осложнений, основные клинические проявления болезни быстро исчезают.
Осложнения. Особую опасность представляют осложнения стрептококкового тонзиллофарингита, которые делятся на:
- ранние (гнойные), развивающиеся на 4-6-й день от начала заболевания,- отит, синусит, мастоидит, паратонзиллярный абсцесс, шейный лимфаденит, менингит, бактериемия, эндокардит, пневмония;
- поздние (негнойные): постстрептококковый гломерулонефрит, токсический шок, развивающиеся в стадии реконвалесценции (на 8-10-й день от начала болезни) и острая ревматическая лихорадка, развивающаяся через 2-3 нед после купирования симптомов заболевания - опасные, часто приводящие к инвалидизации заболевания.
Диагностика. Чрезвычайно важно своевременно установить этиологию тонзиллофарингита, поскольку, за редким исключением, только ангина стрептококковой этиологии требует антибактериальной терапии. Диагностика включает микробиологическое исследование мазка с поверхности миндалин и/или задней стенки глотки. За рубежом широкое распространение получили методы экспресс-диагностики, основанные на прямом выявлении стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки. Современные тестовые системы позволяют получать результат через 15-20 мин с высокой специфичностью (95-100%), но меньшей, чем при культуральном исследовании, чувствительностью (60-95%), в связи с чем отрицательный результат экспресс-теста всегда должен подтверждаться культуральным исследованием.
Целью антибиотикотерапии острых стрептококковых ангин является эрадикация БГСА, что ведёт не только к ликвидации симптомов инфекции, но и предупреждает ранние и поздние осложнения, а также предотвращает распространение инфекции.
Выбор антибиотиков. Препаратами I ряда для лечения острого стрептококкового тонзиллита являются пенициллин (феноксиметилпенициллин), аминопенициллины и оральные цефалоспорины. У пациентов с доказанной аллергией на β-лактамные антибиотики следует применять макролиды, а при непереносимости последних - линкозамиды.
Носительство БГСА. В среднем около 20% детей школьного возраста являются носителями БГСА в весенне-зимнее время. Учитывая низкий риск развития гнойных и негнойных осложнений, а также незначительную роль в распространении БГСА, хронические носители, как правило, не нуждаются в антибактериальной терапии.
Острая ревматическая лихорадка
Острая ревматическая лихорадка (ОРЛ) может возникать как после тонзиллофарингита с типичной клинической картиной, так и после перенесённой бессимптомной или малосимптомной инфекции. ОРЛ возникает только после инфекций глотки, и никогда после инфекций кожи и мягких тканей. Предположительное объяснение этого феномена состоит в различии иммунного ответа на кожную и глоточную инфекцию и в отсутствии ревматогенного потенциала у штаммов, вызывающих кожные инфекции. Риск развития ОРЛ после нелеченного тонзиллофарингита составляет 1%. К ревматогенным М-серотипам стрептококка относятся 1, 3, 5, 6, 18, 19, 24.
В настоящее время в развитых странах острая ревматическая лихорадка встречается с частотой 0,5 на 100000 детей школьного возраста. В развивающихся странах заболеваемость составляет от 100 до 200 на 100000 детей школьного возраста, ежегодно регистрируется от 10 до 15 млн. новых случаев ОРЛ, которая является основной причиной смерти от сердечно-сосудистой патологии.
Следует отметить, что немотивированная задержка восстановления трудоспособности, слабость, нестойкий субфебрилитет, артралгии, сердцебиение и нерезко повышенная СОЭ, сохраняющиеся после перенесенной ангины, в сочетании с ростом титров противострептококковых антител (антистрептолизин О, антистрептокиназа, антистрептогиалуронидаза, анти-ДНКаза В) могут свидетельствовать о дебюте острой ревматической лихорадки.
В соответствии с рекомендациями ВОЗ для диагностики острой ревматической лихорадки в качестве международных применяются критерии Джонса, пересмотренные Американской кардиологической ассоциацией в 1992 г. (см. табл.). Наличие двух больших критериев или одного большого и двух малых в сочетании с данными, документированно подтверждающими предшествующую БГСА-инфекцию, свидетельствует о высокой вероятности ОРЛ. Однако ни один диагностический критерий не является строго специфичным для ОРЛ, поэтому трудности в раннем распознавании заболевания и дифференциальной диагностике с другими нозологиями сохраняются по-прежнему.
Критерии Джонса, применяемые для диагностики первой атаки ревматической лихорадки (по состоянию на 1992 г.)
Исследование для выявления возбудителя стрептококковой инфекции (Streptococcus pyogenes), в ходе которого с помощью метода полимеразной цепной реакции в реальном времени определяется генетический материал (ДНК) стрептококка в образце биоматериала.
Пиогенный стрептококк, бета-гемолитический стрептококк группы А, БГСА, β-гемолитический стрептококк группы А, β-ГСА [полимеразная цепная реакция в реальном времени, ПЦР в реальном времени].
S. pyogenes, Group A streptococcus, GAS, β-hemolytic streptococcus group A, β-hemolytic streptococcus group A.
Полимеразная цепная реакция в режиме реального времени.
Какой биоматериал можно использовать для исследования?
Мазок из зева (ротоглотки), мазок из носоглотки, соскоб урогенитальный.
Общая информация об исследовании
S. pyogenes – это грамположительная бактерия шаровидной формы, являющаяся возбудителем острого фарингита и импетиго, а также спектра более тяжелых деструктивных заболеваний, таких как пневмония, сепсис и септический артрит, синдром токсического шока, целлюлит и некротизирующий фасциит.
Традиционно для подтверждения диагноза "стрептококковая инфекция" применяют бактериологический посев биоматериала на специальные среды. В качестве биоматериала может выступать отделяемое миндалин или носоглотки (при подозрении на острый фарингит), мокрота (при пневмонии). Как правило, результат может быть получен лишь через несколько суток, что связано с промедлением в постановке точного диагноза и назначении специфического лечения. Однако выявлено, что своевременная диагностика и специфическое лечение не только уменьшают продолжительность болезни и интенсивность симптомов, но также снижают риск развития таких осложнений, как паратонзиллярный абсцесс, средний отит, острая ревматическая лихорадка и постстрептококковый гломерулонефрит (при остром фарингите), стрептококковый сепсис (при пневмонии), деструкция сустава и инвалидизация (при септическом артрите). Эмпирическая терапия антибиотиками пенициллинового ряда основана на предпосылке, что S. pyogenes является основным бактериальным возбудителем острого фарингита (5-15 % случаев у взрослых и 20-30 % у детей). Следует отметить, что острый фарингит может быть вызван другими бактериальными или вирусными агентами, при которых назначение такой эмпирической терапии не только не оправдано, но и опасно развитием резистентных штаммов микроорганизмов. Подобные диагностические трудности могут быть преодолены с помощью РТ-ПЦР – полимеразной цепной реакции – этот метод позволяет получить точный результат в более короткие сроки.
В реакции РТ-ПЦР применяются специфические праймеры к фрагменту ДНК S. pyogenes. Такая особенность позволяет выявлять только пиогенный стрептококк, а не родственные ему другие стрептококки – представители нормальной микрофлоры зева (Streptococcus mutans, Streptococcus viridians). По специфичности РТ-ПЦР не уступает бактериологическому посеву и значительно превосходит другие методы идентификации возбудителя (например, экспресс-тест для определения антигена).
Достаточно часто биоматериал на исследование берется уже на фоне лечения заболевания. В результате чувствительность методов диагностики снижается и вероятность получить ложноотрицательный результат выше. В такой ситуации метод РТ-ПЦР обладает некоторым преимуществом перед другими видами диагностики. Это объясняется тем, что для идентификации возбудителя в реакции используется генетический материал возбудителя – как геномная ДНК живого микроорганизма, так и фрагменты ДНК бактерии, подвергшейся лизису. При этом становится возможным выявление не только живых, активно размножающихся микроорганизмов, но и убитых в результате лечения бактерий. В отличие от РТ-ПЦР, обязательным условием для осуществления других методов диагностики (иммуноферментного анализа или бактериологического посева) является наличие живых микроорганизмов. Поэтому, если биоматериал сдается уже на фоне лечения, метод РТ-ПЦР следует предпочесть другим методам диагностики.
Высокая чувствительность РТ-ПЦР позволяет использовать этот метод при диагностике осложнений острого фарингита: острой ревматической лихорадки и постстрептококкового гломерулонефрита. Осложнения острого фарингита – это аутоиммунные заболевания, при которых S. pyogenes – ассоциированный фарингит является причинным фактором патологического иммунного ответа, но на момент диагностики этих осложнений он уже проходит (самостоятельно или в результате лечения). Поэтому выявить возбудитель при бактериологическом посеве отделяемого миндалин и носоглотки у пациентов с осложнениями острого фарингита удается лишь в небольшом проценте случаев. С другой стороны, доказательство перенесенной S. pyogenes – инфекции является необходимым критерием постановки диагноза, а также значительно облегчает проведение дифференциальной диагностики заболеваний. Метод РТ-ПЦР характеризуется высокой чувствительностью и поэтому может быть использован при диагностике осложнений острого фарингита.
Выявление S. pyogenes в так называемых стерильных средах – это всегда патологический признак. С другой стороны, обнаружение этого микроорганизма в нестерильных средах (мокрота, отделяемое носоглотки) не всегда указывает на наличие заболевания. Выявлено, что около 12-20 % детей школьного возраста и 2,4-3,7 % взрослых людей являются бессимптомными носителями S. pyogenes. В таких случаях трактовку положительного результата исследования следует расценивать с учетом бактериальной нагрузки и в сочетании с некоторыми другими клиническими и лабораторными признаками. Как правило, бессимптомное носительство характеризуется меньшим количеством бактерий по сравнению с активной инфекцией. Поэтому обнаружение высокой бактериальной нагрузки S. pyogenes в мазке из зева у пациента с лихорадкой, болью в горле и болезненным регионарным лимфаденитом подтверждает диагноз "острый стрептококковый фарингит". И, наоборот, обнаружение низкой бактериальной нагрузки этого микроорганизма в мазке из зева при отсутствии жалоб и клинической картины следует расценить как бессимптомное носительство. РТ-ПЦР – это полуколичественный метод, позволяющий косвенно оценить бактериальную нагрузку. Поэтому он оказывается особенно полезным при обследовании "здоровых носителей" стрептококка. Бессимптомное носительство S. pyogenes следует заподозрить у пациента при выявлении стрептококка после адекватного курса антибиотикотерапии, а также у членов семьи пациента с частыми обострениями стрептококкового фарингита.
Для чего используется исследование?
- острого фарингита;
- острой ревматической лихорадки и постстрептококкового фарингита у пациентов с указанием на перенесенный эпизод острого фарингита в анамнезе или без него;
- бессимптомного носительства S. pyogenes у пациента с частыми рецидивами фарингита;
- бессимптомного носительства S. pyogenes у членов семьи пациента с частыми рецидивами стрептококкового фарингита;
- внебольничной пневмонии;
- септического артрита.
Когда назначается исследование?
- При симптомах острого фарингита: боль при глотании, отек и эритема слизистой зева, гнойное отделяемое с поверхности миндалин, болезненный регионарный лимфаденит;
- при симптомах острой ревматической лихорадки: мигрирующий полиартрит или артралгия, чувство перебоев в работе сердца, боль в области сердца, немотивированная слабость, кольцевидная эритема и подкожные узелки, а также неврологическая симптоматика в виде хореического гиперкинеза;
- при симптомах постстрептококкового гломерулонефрита: отек (периорбитальной области или генерализованный), макрогематурия, немотивированная слабость, протеинурия менее 3,5 г/сут., артериальная гипертензия;
- при обследовании пациента с рецидивирующим фарингитом;
- при обследовании членов семьи пациента с рецидивирующим фарингитом;
- при обследовании членов семьи пациента с частыми рецидивами острого стрептококкового фарингита;
- при наличии такого фактора риска S . pyogenes (ассоциированной пневмонии), как вирус гриппа H 1 N 1;
- при симптомах внебольничной пневмонии: внезапное начало болезни, лихорадка, одышка, боль в грудной клетке, кашель с отхождением гнойной мокроты;
- при наличии факторов риска септического артрита: младенческий и старческий возраст, иммуносупрессивная терапия, соматические заболевания, гемодиализ;
- при симптомах септического артрита: боли в суставе в покое и при движении, эритема кожных покровов над областью сустава, нарушение подвижности в суставе, повышение температуры тела и немотивированная слабость.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата
В отделяемом носоглотки и миндалин:
- острый фарингит;
- острая ревматическая лихорадка;
- постстрептококковый гломерулонефрит.
- пневмония;
- острый бронхит, бронхит курильщика.
Что может влиять на результат?
- Применение антибактериальных препаратов пенициллинового ряда (амоксиклав, ампициллин), цефалоспоринов (цефиксим, цефтибутен) и макролидов (азитромицин, кларитромицин) до взятия материала на анализ может привести к получению отрицательного результата.
- Около 12-20 % детей школьного возраста и 2,4-3,7 % взрослых людей являются бессимптомными носителями S. pyogenes.
- Результат исследования следует оценивать вместе с некоторыми другими лабораторными анализами.
Кто назначает исследование?
Врач общей практики, ЛОР, инфекционист, пульмонолог, эпидемиолог, травматолог.
Литература
- Lee JH, Uhl JR, Cockerill FR 3rd, Weaver AL, Orvidas LJ. Real-time PCR vs standard culture detection of group A beta-hemolytic streptococci at various anatomic sites in tonsillectomy patients. Arch Otolaryngol Head Neck Surg. 2008 Nov;134(11):1177-81.
- Uhl JR et al. Comparison of LightCycler PCR, rapid antigen immunoassay, and culture for detection of group Astreptococci from throat swabs. J Clin Microbiol. 2003 Jan;41(1):242-9.
- Chiappini E, Regoli M, Bonsignori F, Sollai S, Parretti A, Galli L, de Martino M. Analysis of different recommendations from international guidelines for the management of acute pharyngitis in adults and children. Clin Ther. 2011 Jan;33(1):48-58.
- Hill HR. Group A streptococcal carrier versus acute infection: the continuing dilemma. Clin Infect Dis. 2010 Feb 15;50(4):491-2.
- García-Arias M, Balsa A, Mola EM. Best Pract Res Clin Rheumatol. Septic arthritis. 2011 Jun;25(3):407-21.
Стрептококк (лат. Streptococcus) - это род шаровидных или овальных бактерий, они могут располагаться отдельно либо цепочками разной длины (от греч. streptos – цепочка).
Заболевания, вызываемые гемолитическими стрептококками, известны и описаны очень давно, но сами гемолитические стрептококки открыты и описаны относительно недавно. Впервые это сделал в 1874 году немецкий хирург Теодор Бильрот, выделив гемолитический стрептококк из раневых поверхностей, а также исследовав больных с рожистым воспалением.
Из числа стрептококков, патогенных для человека, с середины 80-х г.г. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной бета-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
Бета-гемолитический стрептококк группы А (пиогенный стрептококк, БГСА, S.pyogenes) - грамположительный, неспорообразующий, неподвижный микроорганизм. Встречается повсеместно, часто колонизирует кожные покровы и слизистые оболочки человека.
Главными путями передачи являются воздушно-капельный, контактный и пищевой.
Основные формы заболевания представлены:
- поверхностными (ангины, фарингит, импетиго, рожа);
- инвазивными (некротизирующий фасциит, миозит, менингит, эндокардит, пневмония, послеродовой сепсис);
- токсин-опосредованными инфекциями (скарлатина, синдром токсического шока).
С тех пор о стрептококках стало известно практически всё, однако пристальное внимание учёных и врачей к стрептококку не ослабевает, этому находится несколько причин:
- бета-гемолитический стрептококк группы А – один из наиболее распространенных возбудителей бактериальных инфекций человека;
- в последнее десятилетия во всём мире отмечено изменение распространения стрептококковых инфекций с преобладанием тяжёлых проявлений (развитием сепсиса, синдрома инфекционно–токсического шока), это очень тяжёлые состояния, угрожающие жизни пациента;
- по данным Министерства Здравоохранения Республики Беларусь основной экономический ущерб, вызванный инфекцией бета-гемолитического стрептококка группы А, в 10 раз выше, чем ущерб от вирусных гепатитов, вместе взятых, и обеспечивается, в основном, стрептококковой ангиной (57,6%) и другими стрептококковыми ОРЗ (30,3%).
Что необходимо знать о бета-гемолитическом стрептококке?
- Гемолитические стрептококки группы А отличаются повышенной стойкостью к различным физическим и химическим воздействиям. При нагревании во влажной среде до +70 °С некоторые виды сохраняют жизнеспособность до 1 часа, а при +65 °С - до 2 часов.
- Стрептококки хорошо переносят замораживание, в высохшем гное или крови сохраняются неделями и месяцами, но быстро погибают под действием дезинфицирующих средств.
- Стрептококки не образуют спор, неподвижны, хорошо растут на мясо-пептонных питательных средах. В холодильнике практически каждой семьи есть кастрюля со вчерашним супом – это и есть мясо-пептонный бульон, на котором очень любят размножаться бета-гемолитические стрептококки группы А. Поэтому нельзя оставлять кастрюлю с супом открытой, и нужно обязательно доводить её содержимое до кипения перед употреблением.
- Стрептококки сбраживают сахара и спирты, но использовать их для приготовления домашних настоек не советуем – можно попасть в больницу с пищевой токсической инфекцией.
Некоторые виды гемолитических стрептококков имеют практическое значение:
- streptococcus lactis сбраживает лактозу с образованием молочной кислоты, которая применяется для получения кисломолочных продуктов (кефира, простокваши, ряженки);
- известны виды, образующие полисахарид декстран, из которого готовят кровезаменитель.
Стрептококки очень опасны, прежде всего, за счёт выделяемых токсинов, которые ответственны за внутреннее поражение органов заболевшего. Однако это ещё половина неприятностей. Токсины стрептококка могут спровоцировать неадекватный иммунный ответ пациента и запустить аутоиммунные реакции, вызывающие такие тяжёлые заболевания, как ревматизм и гломерулонефрит, которые без правильного лечения часто заканчиваются плачевно.
Пути передачи заболевания
Стрептококки передаются воздушно-капельным, контактным, алиментарным (через еду) путём через слюну, при кашле, чихании, поцелуях, а также через бытовые предметы.
Инфекция распространяется очень быстро в закрытых коллективах (детских садах, яслях, школах, в армейских коллективах и т.д.).
Самым опасным для человека считается бета-гемолитический стрептококк группы А. Вы можете встретить его разные названия: пиогенный стрептококк или сокращённо БГСА, или на латинском языке Streptococcus pyogenes, или просто S.рyogenes.
Основные заболевания, вызываемые бета-гемолитическим стрептококком
Количество заболеваний, которые вызывает БГСА, очень большое: ангина, фарингит, скарлатина, рожистое воспаление, паратонзиллярный абсцесс, флегмона шеи, сепсис, отиты, менингит, фасциты и миозиты, стрептодермия, ревматизм, гломерулонефрит.
Каждое из этих заболеваний очень серьёзное и несёт в себе угрозу. При выявлении БГСА необходимо как можно раньше назначить адекватную антибиотикотерапию.
Streptococcus pyogenes сохраняет 100%-ную чувствительность к бета-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность.
Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%.
Частота резистентности к эритромицину достигает 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину - представителю нового класса антибиотиков-кетолидов.
Диагностика стрептококковых инфекций
До сих пор диагностика инфекций, вызванных БГСА, представляет значительную сложность. В Республике Беларусь в качестве быстрого определения БГСА в ротовой полости зарегистрирован и применяется экспресс-анализ методом иммунохроматографии.
Врач бактериологического отдела
ЦДЛ городской больницы
Мясникова Н.М.
Приемная главного врача
(+375 214) 50-62-70
(+375 214) 50-62-11 (факс)
Канцелярия
(+375 214) 50-15-39 (факс)
Значение других стафилококков за редким исключением ограничено проблемой госпитальных (внутрибольничных) инфекций. Реализация их весьма условной патогенности связана с инвазивностью современных диагностических и лечебных процедур, которые способствуют внедрению бактерий, широко представленных в микрофлоре человека и окружающей среде.
Золотистый стафилококк (S. aureus)
Отличить S. aureus от других стафилококков нетрудно, тем более что его культуральные особенноcти легко усилить при помощи дифференциально-диагностических сред, выявляющих активность ферментов (липаза, дезоксирибонуклеаза, стафилокиназа) или токсинов (гемолизины) (рис. 2). Изучение культуральных признаков, мазок из колонии, окрашенный по Граму, и тест на свертывание плазмы (из стафилококков человека только S. aureus обладает коагулазной активностью) фактически исчерпывают рутинный микробиологический анализ. Впрочем, иногда приходится решать еще две задачи: определение чувствительности к антибиотикам и внутривидовое типирование для выяснения закономерностей распространения инфекции (источник заражения, пути передачи).
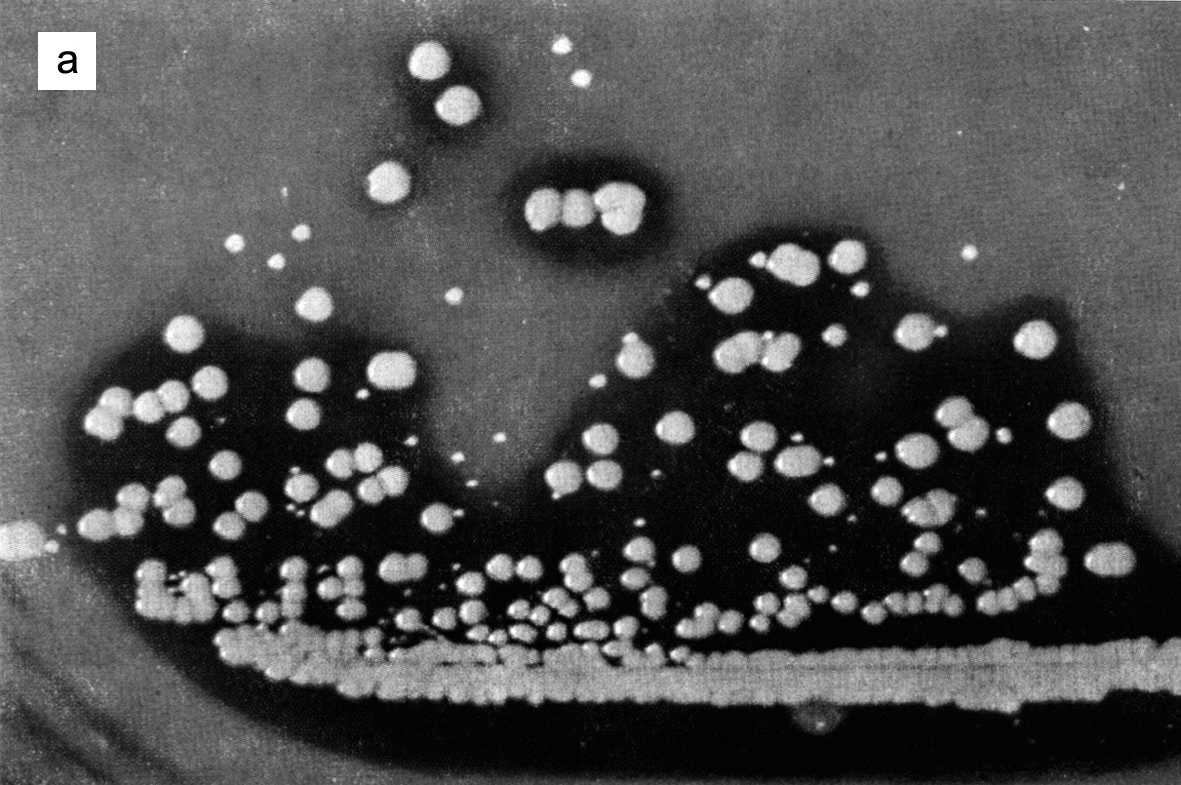
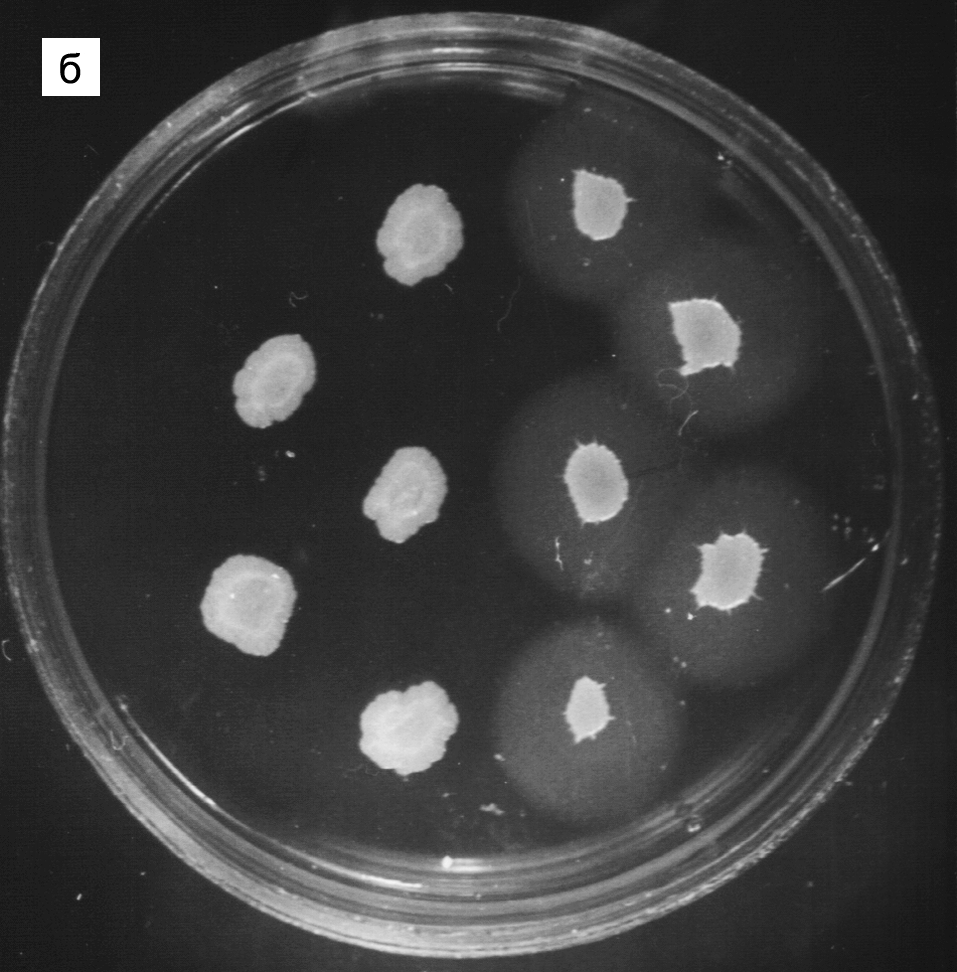
Рис. 2. Колонии стафилококков на дифференциально-диагностических средах. На кровяном агаре (а) колонии S.aureus окружены зоной гемолиза; колонии S.epidermidis — мелкие, негемолитические. На желточно-солевом агаре (б) колонии S. aureus окружены мутным орелом расщепленных липидов (результат высокой липазной активности)
Серологическая дифференцировка штаммов не является общепризнанной. Стафилококки обладают сложным и непостоянным набором поверхностных антигенов и использовать их для типирования бактерий не удалось. По капсульному полисахариду золотистый стафилококк может быть разделен на 11 серотипов, однако этого явно недостаточно для эпидемиологической практики. Штаммы S. aureus можно различить по генотипу или по спектру секретируемых белков, но чаще применяется фаготипирование c помощью международного набора бактериофагов (табл. 1).
Т а б л и ц а 1
Фаготипирование золотистого стафилококка
| Фагогруппа | Фаги (фаготип, или фаговар) |
| I | 29, 52, 52A, 79, 80 |
| II | 3A, 3C, 55, 71 |
| III | 6, 42E, 47, 53, 54, 75, 77 |
| IV | 42D |
| Вне групп | 81, 94, 95, 96 |
Одна и та же культура может лизироваться разными фагами, из чего складывается профиль фагочувствительности (фагомозаика) штаммов. Так как число подобных спектров велико и на практике их трудно учитывать, фаги объединены в группы. Каждый штамм относится к одной из фагогрупп и соответствующему фаготипу; предпочтение отдают фагам с наибольшей литической активностью. Совпадение фагомозаики у штаммов, изолированных от разных больных, говорит об общем источнике инфекции.
Экология
Золотистый стафилококк принадлежит к числу широкораспространенных бактерий. Он часто выделяется от здоровых людей и с этой точки зрения может рассматриваться как факультативный компонент нормальной микрофлоры. Контакт с ним неизбежен, и уже в первые дни жизни (в родильном доме) практически все новорожденные подвергаются контаминации. Повышенный уровень инфицирования наблюдается и в обычных медицинских стационарах, причем как среди больных, так и у обслуживающего персонала. Чаще всего золотистый стафилококк локализуется на слизистой оболочке носа и носоглотки. Примерно 20% людей не поддерживают носительства. Для большинства людей (около 60%) носительство транзиторно: они освобождаются от стафилококка через несколько дней или недель и, если заражаются вновь, то уже другим штаммом. Но встречаются и упорные носители (их около 20%), у которых тот же штамм выделяется месяцы и даже годы. Это наиболее вероятный источник инфицирования окружающих, особенно при высокой обсемененности носителя (эпидемически опасным считается присутствие более 10 млн. бактерий в 1 мл назального секрета).
Борьбе с носительством золотистого стафилококка отдано немало сил. Этот вопрос особенно важен для медицинских учреждений, где угрозе заражения подвергаются ослабленные больные и дети. Однако реальных успехов и общепризнанных рекомендаций добиться не удалось. Борьба со здоровым носительством — это по сути борьба с нормальной микрофлорой, что не всегда проходит бесследно для природных микробиоценозов, провоцируя развитие дисбиотических состояний. Об этом следует помнить и санировать лишь злостных носителей, т.е. лиц, упорно выделяющих большие дозы бактерий. Появились надежды, связанные с местными аппликациями антибиотика мупироцина (природного продукта Pseudomonas fluorescens), который неплохо справляется с интраназальным носительством золотистого стафилококка. Он быстро метаболизируется сывороточными ферментами, а потому должен применяться местно. Это первый препарат, действующий на тРНК-синтетазы (в том числе на метациллинрезистентные клоны золотистого стафилококка), и есть надежда, что будут получены аналоги мупироцина для внутреннего использования.
Вторая по значимости экологическая ниша для S. aureus — кожа, особенно участки с повышенной влажностью (у 10—20% людей золотистый стафилококк выделяется из промежности). Колонизация кожи создает основу для ее пиогенных инвазий — самой распространенной стафилококковой инфекции. В небольших количествах золотистый стафилококк присутствует в толстом кишечнике и влагалище. Изредка это служит причиной местных поражений или системных интоксикаций.
В основе клинического разнообразия стафилококковой патологии лежит способность S. aureus 1) вызывать пиогенную инвазию кожи и ее придатков, 2) проникать в кровь и индуцировать пиогенные (гнойно-деструктивные) поражения внутренних органов, 3) вызывать неспецифическую (септическую) и 4) специфические интоксикации.
Чаще всего S. aureus поражает кожу с развитием пиодермий — не только самой распространенной формы стафилококковой инфекции, но и пиогенных инвазий вообще. Слизистые оболочки поражаются редко, и в этом отношении стафилококк отличается от стрептококка (Str. pyogenes), который чаще инфицирует слизистые оболочки. Отсюда сравнительно небольшое значение золотистого стафилококка при ангинах, отитах, гайморитах и первичных поражениях бронхолегочного аппарата. Стафилококковая инфекция выступает здесь как фактор, осложняющий течение основного патологического процесса.
Читайте также:


