Носительство стафилококка энтерококка и стрептококка
Клиническое значение грибково-микробных ассоциаций и антибактериальная терапия при хронических воспалительных заболеваниях органов дыхания у детей: tabone
Эффективность ломефлоксацина и офлоксацина в комплексном лечении инфекций у обожженных: tabone
Тиенам в лечении новорожденных с гнойной хирургической патологией: tabthree
Тиенам в лечении новорожденных с гнойной хирургической патологией: Схемы антибактериальной терапии
Макролидный антибиотик кларитромицин (Клабакс) при лечении внегоспитальных бронхолегочных заболеваний: Материал и методы
Опыт применения аугментина (амоксициллин/клавуланата) в хирургической клинике: абдоминальная хирургия, послеоперационные гнойные осложнения, антибиотикопрофилактика, амоксициллин/клавуланат (аугментин), цефалоспорины II-III поколения, ципрофлоксацин, метронидазол.
Возбудители внебольничных пневмоний на пороге нового тысячелетия: (1)
Структура и чувствительность к антибиотикам возбудителей внебольничных инфекционных заболеваний бактериальной природы у детей: tabtwo
Этиология внебольничных бронхитов и пневмоний у детей раннего возраста как основа выбора антибактериальной терапии: Введение
Реабилитация больных хроническим гнойным средним отитом: хронический гнойный средний отит, обострение, консервативное лечение, хирургическое лечение
Опыт клинического применения цифрана при лечении инфекций ожоговых ран и инфекционных осложнений ожоговой болезни: tabone
Этиотропная антибиотико- и иммунотерапия больных с гнойно-воспалительными процессами: (1)
Результаты многоцентрового исследования антибиотикочувствительности энтерококков: энтерококки, антибиотикочувствительность, ампициллин, гентамицин, стрептомицин, ципрофлоксацин.
Особенности диагностики и терапии воспалительных урогенитальных заболеваний у женщин, ассоциированных с Ureaplasma urealyticum: Материал и методы
Исследование аэробного микробного фона и антибиотикочувствительности выделенных штаммов в оториноларингологическом отделении: Заключение
Клиническая эффективность аугментина (амоксициллин/клавуланата) при лечении воспалительных заболеваний мочеполовых органов: инфекции мочевыводящих путей, микрофлора, амоксициллин/клавуланат (аугментин).
Антибактериальная терапия тяжелой пневмонии: tabone
Антибактериальная терапия тяжелой пневмонии: (1)
Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
В женских половых органах встречаются гемолитические и негемолитические стрептококки. В определенных условиях эти микроорганизмы могут стать возбудителями инфекционных процессов. Наибольшее значение имеют стрептококки групп А, В, Д.
S. haemolyticus (группа А) может быть выделен из влагалища здоровых женщин при отсутствии признаков инфекции. Встречается носительство этих бактерий на коже перианальной области(источник развития вагинитов у детей и взрослых). Гемолитические стрептококки гр. А могут быть возбудителями ряда послеродовых и послеабортных инфекций, а также абсцессов после инъекций. Эти микроорганизмы чувствительны к пенициллинам , цефалоспоринам , макролидам , аминогликозидам , тетрациклину .
Описан токсический шокоподобный синдром, вызванный стрептококками гр. А [10]. Его клиника напоминает токсический шок, вызванный золотистым стафилококком, продуцирующим специфический экзотоксин. Шокоподобный синдром, вызванный стрептококками, характеризуется гипотензией, выраженной интоксикацией, быстрым прогрессированием поражения всех органов и высокой частотой смертности (30-60%) [10].
В последние годы в генезе послеродовой и перинатальной инфекции увеличилась роль стрептококков группы В. Эти микроорганизмы рассматриваются как нормальная микрофлора влагалища у здоровых беременных женщин. Следует отметить, что у беременных носительство обнаруживается чаще, чем у небеременных: у 20,4 и 9,4% соответственно [11]. Участились случаи их выделения при эндометрите после родов, при раневой инфекции, мастите и других ГВЗ. Наиболее опасны заболевания, вызываемые стрептококками гр. В у новорожденных, у которых описаны тяжелые вспышки инфекции с большим процентом летальности. Заражение новорожденных происходит при прохождении по родовым путям матери. Частота переноса стрептококков от матери к плоду во время родов составляет 50-70% В связи с этим существует мнение о целесообразности проведения превентивной антибиотикотерапии у беременных при обнаружении у них во влагалище стрептококков гр. В.
Рост инфекционных осложнений, вызванных стрептококками гр. В, в определенной степени связан с их природной устойчивостью к аминогликозидам, широко использующимся в лечебной практике. Стрептококки гр. В, так же как и другие разновидности стрептококков, чувствительны к пенициллинам, цефалоспоринам, макролидам, успешно применяющимся для лечения вызываемых ими инфекций.
Стрептококки группы D (энтерококки) выделяются из половых путей здоровых женщин в 10% случаев. Наиболее часто встречаются Streptococcus faecalis и S.faecium . В последние годы повысилась роль энтерококков при эндометрите, хориоамнионите , инфекциях мочевыводящих путей, послеоперационных осложнениях. Нередки случаи инфекций, вызванных энтерококками, у новорожденных. В определенной мере распространение инфекционных осложнений, вызванных энтерококками, связано с их природной устойчивостью к цефалоспоринам, все более часто использующимся в акушерской, гинекологической практике и при лечении новорожденных.
Энтерококки чувствительны к пенициллинам, макролидам, тетрациклину, ванкомицину . Более эффективны при лечении энтерококковых инфекций комбинации этих антибиотиков.
Стафилококки и микрококки
Коагулазоотрицательные стафилококки и микрококки составляют нормальную микрофлору влагалища и выделяются соответственно у 60 и 35% здоровых женщин. Они могут вызывать вторичные инфекционные процессы мочевой системы, воспалительные заболевания половых органов у беременных и родильниц с иммунодепрессией. Эти микроорганизмы нередко являются возбудителями ГВЗ у новорожденных, особенно у маловесных и гипотрофиков.
Коагулазоотрицательные стафилококки природно чувствительны к пенициллинам, но в настоящее время около 80% штаммов обладают устойчивостью к бензилпенициллину. Госпитальные штаммы коагулазоотрицательных стафилококков нередко обладают полирезистентностью к ряду антибиотиков, что существенно затрудняет лечение вызываемых ими инфекций.
Золотистый стафилококк не входит в состав нормальной микрофлоры нижних половых путей, однако он нередко в небольшом количестве выделяется из влагалища вполне здоровых женщин. Поэтому сам факт выделения золотистого стафилококка из нижних половых путей еще не свидетельствует о патологии. Для суждения о его этиологической значимости необходимы количественные исследования.
Золотистый стафилококк остается доминирующим возбудителем мастита (в 80-90%), в 10% случаев выделяется при раневой инфекции, абсцессах, сепсисе , может быть причиной инфекции у новорожденных.
Штаммы золотистого стафилококка, продуцирующие экзотоксин, могут вызывать синдром токсического шока, который может быть обусловлен накоплением возбудителя во влагалище на тампонах во время менструации, Штаммы золотистого стафилококка, выделяемые в условиях клиники, в 80-90% устойчивы к бензилпенициллину и ампициллину , так как они образуют бета-лактамазу , разрушающую эти антибиотики. Многие госпитальные штаммы обладают полирезистентностью к антибиотикам. Препаратами выбора при лечении инфекций вызванных стафилококками, являются бета-лактамазоустойчивые пенициллины, комбинированные препараты пенициллинов с ингибиторами бета-лактамаз, цефалоспорины I-II поколений, аминогликозиды, фузидин , ванкомицин.
Другие представители кокковой флоры - бранхамеллы , нейссерии (негонококковые) - сравнительно редко выделяются из половых путей здоровых женщин и их роль при ГВЗ сравнительно невелика.
Неспорообразующие анаэробные бактерии
В последние годы в этиологии инфекционных осложнений в акушерстве и гинекологии возросла роль неспорообразующих анаэробных бактерий. Эти микроорганизмы входят в состав нормальной микрофлоры нижних отделов генитального тракта женщин, который содержит в 10 раз больше анаэробных бактерий, чем аэробных. Из влагалища здоровых женщин выделяется до 40 видов различных видов анаэробов. Среди них преобладают лактобактерии, несколько реже встречаются эубактерии и бифидобактерии, грамположительные анаэробные кокки - пептострептококки, а также бактероиды. Bacteroides fragilis, одно время считавшийся основным возбудителем воспалительных процессов, по последним данным [12], встречается лишь в 5% случаев. Чаще выделяют Prevotella bivia и P. disiens.
Неспорообразующие анаэробы выделяют от больных акушерским перитонитом, сепсисом, при послеродовом эндометрите, при воспалительных процессах у гинекологических больных. Анаэробные бактерии вместе с гарднереллами принимают участие в бактериальном вагинозе .
Повышение роли анаэробных бактерий в инфекционной патологии в акушерстве и гинекологии в определенной мере связано с их устойчивостью к таким широко используемым в лечебной практике антибиотикам, как цефалоспорины и аминогликозиды. Использование этих антибиотиков привело к существенным изменениям в количественном соотношении аэробов и анаэробов в микробных биоценозах и соответственно к расширению ареала распространения анаэробов и повышению их роли в инфекционных процессах. Не последнюю роль в изменении наших представлений о значении анаэробов в этиологии ГВЗ сыграл прогресс в технике микробиологических исследований в этой области.
Неспорообразующие анаэробные бактерии чувствительны к клиндамицину , линкомицину , метронидазолу , хлорамфениколу , а также к цефокситину и цефотетану . Активны против этих микроорганизмов комбинированные препараты беталактамных антибиотиков с ингибиторами бета-лактамаз.
Среди спорообразующих анаэробных бактерий могут быть выделены из влагалища (5-10%) здоровых женщин в небольшом количестве Clostridium perfringens, что при отсутствии клинических появлений не указывает на наличие инфекции. Антибактериальная терапия при клостридиальной инфекции проводится большими дозами бензилпенициллина.
Грамотрицательные условно-патогенные бактерии
Эти бактерии обнаруживаются в нижних отделах половых органов и могут быть возбудителями гнойно-воспалительных процессов различной локализации. Наиболее часто из влагалища и цервикального канала выделяют эшерихии, являющиеся возбудителями инфекции мочевыводящих органов у беременных и родильниц, послеродового сепсиса , послеоперационного перитонита. В настоящие время до 50% штаммов E.coli устойчивы к ампициллину, нарастает и ее резистентность к цефалоспоринам I-II поколений. Наиболее активными являются комбинации ампициллина с ингибиторами бета-лактамазы, аминогликозиды и фторхинолоны .
Среди других грамотрицательных бактерий, встречающихся в половых путях здоровых женщин, следует отметить бактерии рода Klebsiella. Они могут быть возбудителями послеродовых и послеоперационных воспалительных процессов. Определенную роль они играют в гинекологии при воспалительных процессах внутренних половых органов (чаще в ассоциации с гонококком, хламидиями, анаэробами).
В качестве возбудителей указанных выше заболеваний могут встречаться и другие представители УП энтеробактерий: Enterobacter aerogenes, Serratia marcescens и др. Эти бактерии чувствительны к новым пенициллинам широкого спектра, цефалоспоринам II-III поколений, к аминогликозидам.
Proteus spp. выделяют при инфекциях генитального тракта в 10-15% случаев. Антибиотикочувствительность представителей этого рода микроорганизмов довольно типична для разных видов (за исключением P.mirabilis): они чувствительны к аминогликозидам, цефалоспоринам III поколения, новым пенициллинам.
Условно-патогенные энтеробактерии в настоящее время являются наиболее частыми возбудителями госпитальных инфекций у новорожденных детей. Эти инфекции могут протекать в виде вспышек и приводить к смертельным исходам. Наиболее часто вспышки инфекций возникают в результате распространения в стационарах множественноустойчивых штаммов этих бактерий. Наиболее активны против описанных энтеробактерий цефалоспорины, аминогликозиды, уреидопенициллины ( пиперациллин , мезлоциллин ), фторхинолоны и ингибирующе бета-лактамазу комбинированные антибиотики ( уназин , аугментин и др).
Pseudomenas aeruginosa сравнительно редко выделяется из половых путей здоровых женщин. Ее роль в этиологии акушерских и гинекологических инфекций невелика.
В половых путях здоровых женщин нередко встречается Gardnerella vaginalis. Само по себе выделение гарднереллы не свидетельствует о наличии инфекционного процесса. Гарднереллы совместно с анаэробами является возбудителями бактериального вагиноза, препаратами выбора при лечении этих заболеваний служит метронидазол, эффективны клиндамицин и тинидазол [13].
Эти микроорганизмы также обнаруживают в вагинальном содержимом здоровых женщин - в 30-50% случаев [12]. Вместе с тем они могут быть возбудителями послеродовых инфекций, воспалительных процессов урогенитального тракта. Наиболее частыми возбудителями являются Mycoplasma hominis и Ureaplasma urealyticum. Они могут быть причиной самопроизвольных выкидышей , преждевременных родов , мертворождений . У недоношенных новорожденных микоплазмы могут вызвать развитие пневмонии , менингита , генерализованной инфекции.
Микоплазмы чувствительны к тетрациклину, эритромицину, которые используются при лечении вызываемых ими инфекций.
Возбудителями заболеваний женских половых органов нередко являются грибы. Наиболее часто встречаются заболевания, вызванные Candida albicans (до 95% случаев). У беременных грибковые заболевания представляют опасность в связи с высоким риском инфицирования новорожденных: более чем у 10% детей, родившихся от матери с вагинальным кандидозом , обнаруживаются грибковые поражения. [14].
Штаммы C.albicans чувствительны к ряду противогрибковых препаратов: нистатину , гризеофульвину , леворину , амфотерицину В . В последнее время для лечения вагинального кандидоза применяют препараты имидазолового ряда: котримазол, миконазол и др. Эффективен препарат триазолового ряда - флуконазол .
В данной публикации мы не касались заболеваний, передаваемых половым путем - сифилиса , гонореи , хламидиоза , трихомониаза , так как это составляет предмет особых исследований.
Гнойно-воспалительные заболевания, вызванные УП бактериями, в акушерстве и гинекологии отличаются полиэтиологичностью. Это, с одной стороны, обуславливает многообразие клинических проявлений инфекционных осложнений у беременных, родильниц и гинекологических больных, с другой, - создает немалые трудности в их этиологической диагностике, а следовательно - в целенаправленном лечении.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1999-N3, стр. 42-45.
2. Марцишевская Р.Л., Шибалова И.П. Лаб. дело 1990; 6: 38-43.
3. Савичева А.М., Башмакова М.А. Дисбактериоз и антибиотики Тез. докл. науч. конф. 1996; 33.
4. Mardt P. Amer J Obstet Gynecol 1991; 165: 4: 1163-1168.
5. Муравьева А.В. Микробиологическая диагностика бактериального вагиноза у женщин репродуктивного возраста. Автореф. дис. канд. биол. наук. М.: 1997.
6. Кашковская Н.В. Экспериментально-клиническое обоснование применения биологических микробных препаратов в гинекологии. Автореф. дис. канд. мед. наук. М.: 1992.
7. Кира Е.Ф. Акуш гинек 1990; 8: 10-13.
8. Кира Е.Ф. Там же. 1993; 5: 39-42
9. Кира Е.Ф., Кочеровец В.И., Поспелова В.В., Ханина Г.И. Антибиотики и химиотер 1994; 39: 31-35.
10. Wood Т.F., Potter M.A., Gonasson О. Ann Surgery 1993; 217: 109-114.
11. Monga M.L., Oshiro B.T. In: Seminar in Perinatology. Philadelphia, 1993; 71: 426-431.
12. Sweet R.L., Gibbs R.S. Infec. Diseases of the Female Genital Tract. Baltimore, 1995.
13. Анкирская А.С., Муравьева В.В., Байрамова Г.Р. Пути развития современной гинекологии: Тез. докл. научн. конф. М.: 1995; 52. 14. Мирзабалаева А.К. Вестн дерматол и венерол 1994; 2: 20-22.
Здоровому человеку стафилококк не страшен!
В здоровом организме около 90% всех бактерий толстой кишки составляет бифидофлора. Остальное - лактобациллы, бактероиды, кишечная палочка, а также условно-патогенные микроорганизмы: стрептококки, энтерококки, стафилококки.
Стафилококки - распространенное семейство бактерий. Они присутствуют у большинства людей и являются частью нормальной микрофлоры кожных покровов, слизистых оболочек и нижнего отдела кишечника.
Кокки - это микробы овальной или сферической формы (греческое слово kokkos переводится как "зернышко"). Сотни самых различных кокков окружают человека в течение всей его жизни, но нет, пожалуй, микроба более популярного, чем стафилококк.
В настоящее время известно 27 видов стафилококка, при этом 14 видов обнаружены на коже и слизистых оболочках человека. Носительство стафилококка часто встречается и у медицинского персонала.
Существует три вида болезнетворных стафилококков:
- золотистый стафилококк (по-латыни - staphylococcus aureus);
- эпидермальный стафилококк (S. epidermidis);
- сапрофитный стафилококк (S. saprophyticus).
Сапрофитный стафилококк - чаще всего провоцирует у женщин воспаления мочевого пузыря (реже почек), так как основное место его обитания - кожа в районе гениталий и слизистая оболочка мочеиспускательного канала, крайне редко поражает детей.
Эпидермальный стафилококк - S. epidermidis живет на коже, но никаких кожных гнойничков не вызывает в сущности никогда. Абсолютное большинство инфекций возникают у людей со сниженным иммунитетом, послеоперационном периоде, у пациентов, находящихся в реанимационных отделениях. Микроб с поверхности кожи через раны, дренажи, сосудистые и мочевые катетеры проникает в организм. Может возникнуть и заражение крови, и эндокардит (воспаление внутренней оболочки сердца). Как раз эпидермальный стафилококк – подлинное наказание для хирургов, занимающихся внутренним протезированием: любые искусственные клапаны, сосуды, суставы если и заражаются, то почти всегда именно этим стафилококком.
Золотистый стафилококк - (Staphylococcus aureus) - возбудитель многих нагноительных процессов.
По пигментообразованию стафилококки делятся:
- стафилококк золотистый;
- стафилококк белый;
- стафилококк лимонно-желтый.
Стафилококки внедряются в организм через кожные покровы и слизистые оболочки воздушно-капельным и контактным путем. Заразиться можно через открытые раны, ожоги, глаза, кожу, кровь. Возможна передача инфекции с инструментами, катетерами, перевязочным материалом, предметами ухода, а также пищей.
Отличительной особенностью стафилококков является их способность вырабатывать токсины, которые оказывают сильнейшее воздействие на организм человека.
Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%.
Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются.
Повреждения кожи (травмы, занозы, трение об одежду, нарушение правил гигиены) - предпосылка к местным стафилококковым инфекциям, снижение иммунитета вследствие других болезней, расстройства питания, стрессы, гиповитаминозы - предпосылки к общим стафилококковым инфекциям.
Стафилококковая инфекция - это группа заболеваний, вызванных золотистыми стафилококками, которые могут проявляться как легкими формами (воспаление кожи), так и тяжелыми процессами (пневмония, сепсис).
Для стафилококковой инфекции характерны сильнейшие симптомы интоксикации (нарушение общего состояния человека под воздействием токсинов возбудителя):
- подъем температуры тела;
- слабость;
- снижение аппетита;
- сонливость, дети становятся капризными.
Выраженность этих проявлений зависит от тяжести инфекции.
В зависимости от локализации процесса можно выделить следующие проявления болезни:
- гнойные воспаления кожи и подкожной клетчатки: гнойнички, абсцессы, фурункулы, воспаления пупочной ранки у новорожденных;
- гнойное поражение костей: остеомиелит и суставов;
- стафилококковое поражение верхних дыхательных путей: ангина;
- воспаление оболочек сердца: эндокардит;
- поражение пищеварительного тракта: гастроэнтерит, энтероколит;
- поражение дыхательной системы: пневмония, плеврит;
- поражение головного мозга: менингит, абсцесс мозга;
- стафилококковая инфекция мочевых путей: цистит;
- стафилококковый сепсис - тяжелейшее состояние с поражением всех органов и систем.
Стафилококки характеризуются сравнительно высокой устойчивостью к выслушиванию, замораживанию, действию солнечного света и химических веществ. Золотистый стафилококк не теряет активности при высушивании. 12 часов живет под воздействием прямых солнечных лучей. В течение 10 минут выдерживает температуру в 150 °С! Не погибает в чистом этиловом спирте. Не боится перекиси водорода, мало того — вырабатывает особый фермент каталазу, которая разрушает перекись водорода, а сам микроб усваивает образующийся при этом кислород. Стафилококки очень чувствительны к некоторым анилиновым красителям, особенно к бриллиантовому зеленому, который успешно применяют при лечении поверхностных гнойных поражений кожи, вызываемых стафилококками.
Многие антибактериальные препараты оказывают губительное действие на стафилококки. При выборе препаратов для лечения резистентных стафилококков необходимо провести исследование чувствительности выделенных штаммов к антибиотикам.
У больных хирургического профиля необходимым условием успешной антимикробной терапии является адекватная хирургическая обработка ран с удалением нежизнеспособных тканей и инородных тел, эффективное дренирование очага.
При внебольничных инфекциях антибактериальная терапия может проводиться в виде монотерапии или комбинации антибиотиков, обладающих высокой антистафилококковой активностью.
Перенесенная стафилококковая инфекция не оставляет после себя длительного иммунитета.
К общим профилактическим мероприятиям относятся:
- устранение витаминной недостаточности;
- предупреждение травматизма;
- предупреждение потливости;
- соблюдение санитарно-гигиенических требований в родильных домах;
- хирургических отделениях;
- детских учреждениях;
- на производстве, особенно на консервных заводах;
- содержание в чистоте тела;
- частое мытье рук теплой водой с мылом.
Здоровье -
это бесценный дар, он дан увы не навечно, его надо беречь!
Помните: здоровому человеку стафилококк не страшен!
Подготовила:
инструктор-валеолог Лилия Цветкова
16 августа 2016
- 9970
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
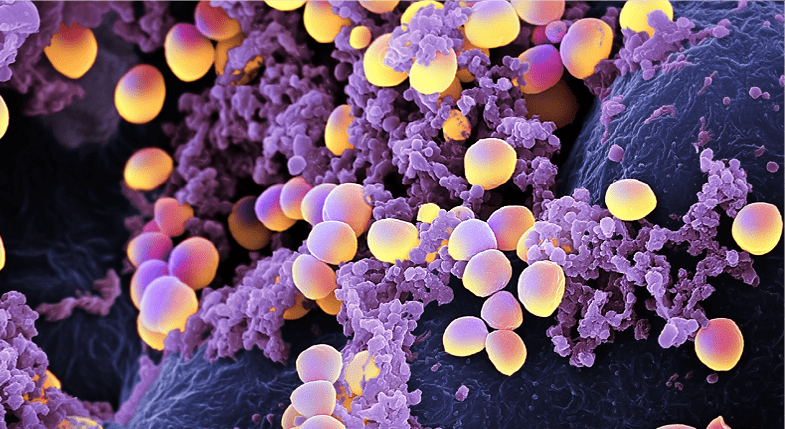
Рисунок 1. Staphylococcus aureus и лейкоциты.
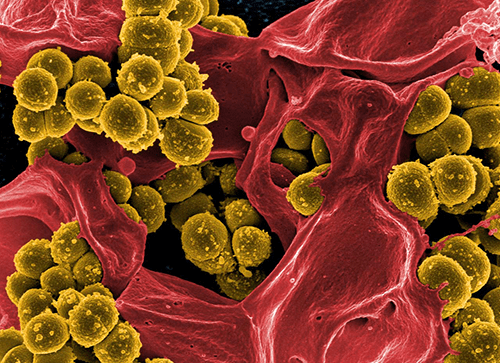
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
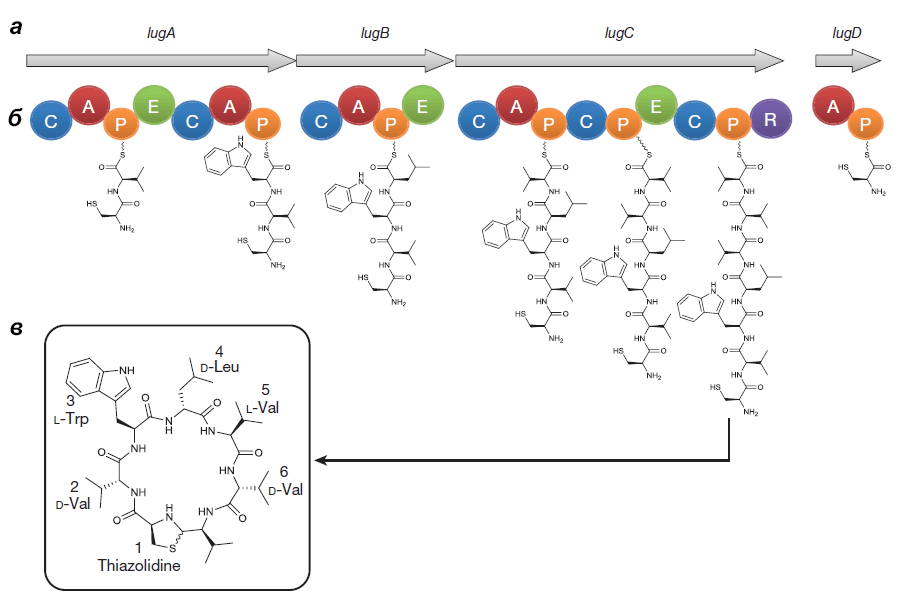
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
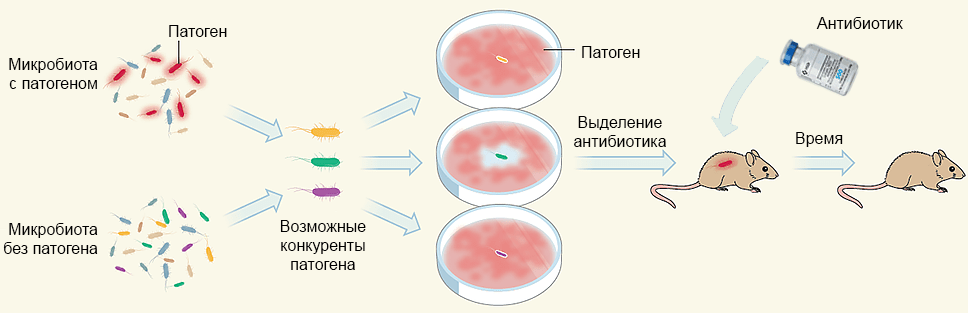
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Читайте также:


