Научные журналы по сальмонеллезу

Лечение внутрибольничного сальмонеллеза остается актуальной проблемой здравоохранения. Сложность решения проблемы связана с устойчивостью возбудителей к действию дезинфекционных средств и высокой лекарственной полирезистентностью [1, 2, 3].
В связи с этим наиболее значимым является изучение клинико-патогенетического течения внутрибольничного сальмонеллеза у детей и поиск эффективных этиопатогенетических методов лечения. Одной из трудных задач современной антибиотикотерапии является лечение инфекции с внутриклеточной локализацией возбудителей. Внутриклеточные бактерии, в частности сальмонеллы, в той или иной мере защищены от действия антибиотиков. В связи с этим представляется перспективным изучение действия антибактериальных препаратов, обладающих способностью проникать внутрь клеток, одним из таких препаратов являются фторхинолоны [4, 5, 6, 7].
Целью настоящей работы явилось клинико-биохимическое исследование детей первых трех лет жизни с тяжелой формой внутрибольничного сальмонеллеза, получивших комплексное антибактериальное и андиоксидантное лечение.
Материалы и методы исследования
Под наблюдением находились 65 больных внутрибольничным сальмонеллезом, госпитализированных на стационарное лечение в Карагандинскую Областную инфекционную клиническую больницу. У всех детей по клинико-эпидемиологическим данным был установлен внутрибольничный сальмонеллез. Контрольную группу составили 30 здоровых детей аналогичной возрастной группы. Диагноз сальмонеллеза у всех пациентов был подтвержден бактериологически, была выделена копрокультура Sal. typhimurium (100 %).
Ранее в эксперименте нами были изучены антибактериальные препараты с внутриклеточной активностью и установлено, что штаммы сальмонелл чувствительны к рифампицину, фторхинолонам, цефалоспоринам III поколения и достаточно устойчивы к ампициллину, гентамицину, канамицину.
Изучение показателей окислительного метаболизма при сальмонеллезе представляет практический интерес как критерий проводимой терапии. Из показателей липопероксидации нами были изучены: первичные – диеновые коньюгаты (ДК), вторичные – малоновый диальдегид (МДА), конечные продукты- основания Шиффа (ШО) в плазме крови и в эритроцитах, из ферментов антиоксидантной системы: каталаза (КТ) в плазме и в эритроцитах, церулоплазмин (ЦП) в плазме и супероксиддисмутаза (СОД) в эритроцитах.
Результаты исследования и их обсуждение
При тяжёлом течении внутрибольничного сальмонеллеза в сравниваемых группах лихорадка у детей была выраженной и достигала 38–40 °С, и держалась в среднем от 7 до 10 дней. Заболевание у всех детей с тяжёлой формой протекало с выраженной клиникой токсикоза, изменением со стороны сердечно-сосудистой системы (тахикардия, приглушенность тонов сердца). Рвота носила упорный характер (обычно она была нечастой 1–2 раза в день, связанная и не связанная с приёмом пищи) и держалась от 6 до 8 дней. Диарея имела место у всех больных – 60 (100 %), частота стула была от 7 до 10 раз и выше. В начале заболевания стул был жидким, водянистым, с незначительным количеством слизи, жёлто-зелёного цвета, через 3–4 дня у детей с тяжёлым течением присоединялись признаки дистального колита. Диарея у детей была продолжительной – от 10 до 15 дней и при бактериологическом исследовании сопровождалась длительным повторным выделением сальмонеллы тифимуриум из фекалий.
При тяжелом течении внутрибольничного сальмонеллеза был выявлен выраженный окислительный стресс, который характеризовался увеличением ДК в плазме и в эритроцитах соответственно в 11,8 и в 4 раза; МДА в 5 раз и в 11 раз, ШО в 15 раз и СМ в 6 раз. Изменение всех параметров перекисного каскада свидетельствует о глубоких метаболических нарушениях в организме ребенка.
В системе АОЗ крови больных обнаружены разнонаправленные активности. Установлено четкое повышение КТ в плазме (соответственно в 10 раз) и снижение ее в эритроцитах (в 5,8 раза), что свидетельствует о развитии мемебранодеструкции. Обнаружено значительное нарастание активности супероксидисмутазы (в 2,5 раза), и снижение активности церулоплазмина ключевых ферментов антирадикальной защиты, что является компенсаторной защитой клеточных мембран.
Во II подгруппе была выявлена позитивная динамика – полностью купировались симптомы интоксикации, температура тела нормализовалась, стул в сутки был 3–4 раза в отдельных порциях была прозрачная слизь. После окончания основного курса лечения и второго курса пробиотиками дети были выписаны из стационара в удовлетворительном состоянии.
На фоне терапии была так же выявлена позитивная динамика в показателях липопероксидации и ферментативного звена антиоксидантной защиты. Так, в анализах больных, получивших ципрофлоксацин + клафоран + линекс, отмечалась тенденция к снижению показателей липопероксидации, однако уровня контроля они не достигли. Показатели липероксидации остаются повышенными (табл. 1).
Динамика показателей липероксидации у детей с тяжелым течением внутрибольничного сальмонеллеза на фоне различной терапии

Ведущие производители диетической продукции в нашей стране – птицефабрики, поэтому контроль эпизоотической ситуации на них – основа стратегии по уменьшению рисков, связанных с пищей [4].
К основным видам продуктивной птицы относятся куры, утки, гуси, индейки, цесарки. Наибольшее значение имеет бройлерное производство цыплят и утят.
Птицеводческие и перерабатывающие предприятия различных форм собственности выпускают мясо птицы в виде тушек потрошеных, полупотрошеных и потрошеных с комплектом потрохов и шеей, частей, полученных при разделке тушек, обваленное (освобожденное от костного скелета) и измельченное. В продажу поступают также субпродукты (шея, крылья, головы, ноги) и птичьи потроха (печень, сердце, мышечный желудок).
Одно из наиболее распространенных заболеваний, передающихся через мясо птицы и продукты его переработки, — сальмонеллез. В РФ и странах СНГ за последние 15 лет заболеваемость сальмонеллезом людей и птицы возросла в 7 раз. В 2010 году по данным Росптицесоюза сальмонеллез составил 0,23% от всех регистрируемых болезней птиц [7]. На международном симпозиуме, посвященном пищевым зоонозам (1995 г.), особое внимание было уделено сальмонелла-энтеритидис-инфекции, существенными факторами передачи которой являются мясо птицы и яйца.
Мясо птицы обсеменяется микроорганизмами прижизненно, после убоя и обработки при ошпаривании, удалении оперения, потрошении и охлаждении. Содержание микрофлоры в воде шпарильных чанов увеличивается в десятки и сотни раз через 3-4 ч работы. Преобладают сапрофиты, но обнаруживаются сальмонеллы и С. perfringens. В процессе удаления оперения микроорганизмы через нарушенный кожный покров (порезы, ссадины) попадают в глубокие слои мышечной ткани. При потрошении в результате разрывов кишечника происходит обсеменение микрофлорой, наиболее часто представителями БГКП, протеем, сальмонеллами. Массивная контаминация тушек может происходить при холодильной обработке (в ваннах охлаждения) микроорганизмами родов Campylobacter, Salmonella, в частности S. enteritidis [2].
Цель – определить обсемененность сальмонеллами мяса птицы, продуктов его переработки и прочей птицеводческой продукции в Пермском крае, установить превалирующие в птицеводстве каря серотипы сальмонелл.
Материал исследований: мясо птицы, субпродукты и полуфабрикаты из мяса птицы, яйца, яичный порошок.
Результаты исследований
Непрерывность технологического процесса получения птицеводческой продукции, концентрация большого числа особей приводит к резкому возрастанию так называемого микробного давления, что является следствием создания благоприятных условий для возникновения болезней, в том числе и сальмонеллеза [8]. В 2010 году, по данным Росптицесоюза, сальмонеллез составил 0,23% от всех регистрируемых болезней птиц [7]. Объясняется данный факт в значительной мере тем, что кур разводят на крупных птицефабриках, где инфекция способна распространяться быстро, охватывая огромное количество птиц. Опасность распространения инфекции повышают межхозяйственные связи, использование возвратной тары [8].
Пермский край не является исключением, сальмонеллы регулярно высевают из органов и туш павших птиц, принадлежавших птицефабрикам региона, в последние годы (2010–1012 гг.) инфицированность держится на уровне от 3,15 до 5,49% (рис. 1), при этом основными факторами риска заражения птицы служат загрязненные сальмонеллами корм и вода.
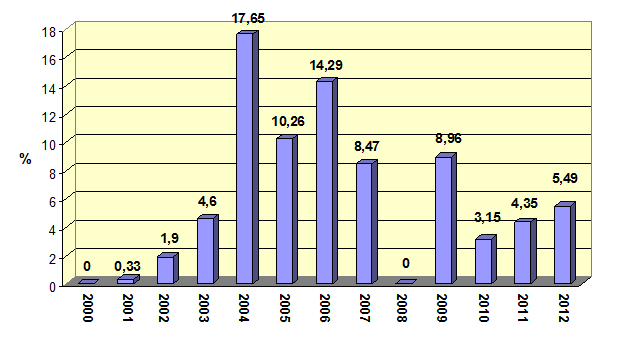
Рис. 1. Зараженность туш павших кур сальмонеллами, % (2000 – 2012 гг.).
В среднем инфицированность птицы сальмонеллезом за период наблюдений (2000–2012 гг.) установлена на уровне 6,11%, однако процент обсемененной сальмонеллами птицеводческой продукции в Пермском крае (тушки кур, полуфабрикаты, субпродукты, суповые наборы, яйца) составил 1,87 (рис. 2).
Существенными по значимости факторами передачи зоонозных сальмонеллезов являются яйца и яйцепродукты. С ними связывают от 2,5 до 61,1% случаев сальмонеллеза. Яйца могут инфицироваться при формировании в яйцеводе больных птиц (эндогенно) и через скорлупу (экзогенно). Экзогенному обсеменению яиц способствуют увлажнение, резкие изменения температуры, длительное хранение. По данным различных авторов, обсемененность яиц и яйцепродуктов варьирует от 2,04 до 57%. В процессе технологической и кулинарной обработки инфицированных яиц обсеменению сальмонеллами подвергаются большие партии яичного порошка, меланжа, крема и т.п., которые нередко становятся причинами заболеваний человека [5]. Лищук А.П. (2002) установил, что наибольшее возрастание обсемененности яйцепродуктов происходит на участке разбивания яичной скорлупы. Агрегаты разбивания скорлупы и руки работниц, занятых на операциях разбивания, могут способствовать перекрестному заражению яичной продукции.
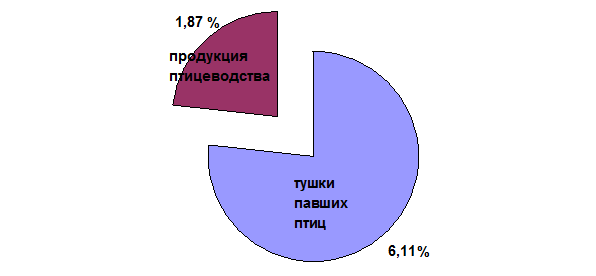
Рис. 2. Зараженность сальмонеллами птицы и птицеводческой продукции (2000-2012 гг.).
Кроме вышеперечисленных продуктов питания, в кондитерской и хлебопекарной промышленности широко применяют яичный порошок, следовательно, его санитарное благополучие играет значительную роль в эпидемиологии заболеваний.
Всего за 9 лет лабораториями края исследовано 5727 образцов яичного порошка, из которых в 370 (6,46%) идентифицировали S. enteritidis (рис. 3).
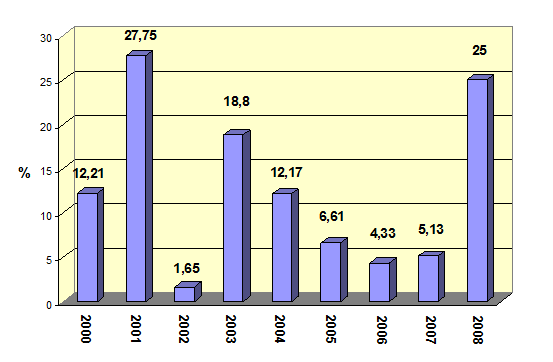
Рис. 3. Инфицированность яичного порошка сальмонеллами, % (2000 – 2008 гг.).
Таким образом, в Пермском крае, по результатам наших исследований, наибольшую опасность в возникновении пищевой сальмонеллезной инфекции людей представляет яичный порошок, который в 6,46% случаев дает рост сальмонелл на питательных средах. Далее следует птицеводческая продукция (тушки кур, куриные полуфабрикаты, субпродукты, суповые наборы, яйца) – 1,87%.
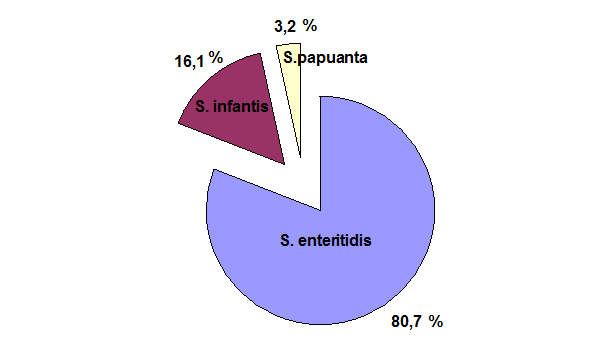
Рис. 4. Превалирующие серотипы сальмонелл в птицеводческой продукции (2000-2009 гг.).
Мезенцев С.В. (2010), анализируя подробные данные по эпидемической статистике сальмонеллеза и современным особенностям эпидемического процесса, сделал заключение, что инфекция, обусловленная S.enteritidis, поражает людей в большей степени, чем птицу, и именно человек – основное звено в эпидемиологии болезни, вызванной данным возбудителем [6].
Следует подчеркнуть, что в последние 20 лет во всем мире и в нашей стране, в том числе и в Пермском крае, широко распространилась Salmonella еntеritidis. Представители этого серотипа вызывают пищевые вспышки сальмонеллеза при низкой дозе указанных микроорганизмов в продукте, а заболевания отличаются, как правило, более манифестным клиническим течением [2].
В заключение считаем необходимым подчеркнуть важность процесса предубойной подготовки птиц, в том числе выдержки птиц без корма, выбраковке больной и ослабленной птицы. На этапе убоя необходимо обеспечить контроль за соблюдением ветеринарно-санитарных требований, технологического режима первичной переработки (оглушение, обескровливание, температура и продолжительность шпарки, качество туалета тушек). На этапе охлаждения и упаковывания - за соблюдением технологических режимов охлаждения (температура среды охлаждения, соответствие микробиологических показателей среды охлаждения установленным требованиям, проведение исследования произведенной продукции на сальмонеллез), за отсутствием перекрестной контаминации в процессе охлаждения и после него через оборудование, руки и одежду работников [9].
Анализ вспышек сальмонеллеза среди населения показывает, что причина кроется не в продукции, а в нарушении правил хранения, переработки и в несоблюдении технологии приготовления пищевых продуктов, ведь сальмонеллез у человека могут вызывать не только мясопродукты или яйца, а также пирожные, торты, компоты, фрукты и т.д. [6].
Выводы
Рецензенты:

Сальмонеллез – кишечное зооантропонозное заболевание, вызываемое микроорганизмами рода сальмонелл, характеризующееся при манифестном течении отчетливо выраженной интоксикационной и гастроинтестинальной симптоматикой, а также возможностью развития в некоторых случаях генерализованной формы [3].
Восприимчивость к сальмонеллезной инфекции повышается при подавлении нормальной флоры кишечника. Заражающей дозой для иммунокомпетентного человека является доза 107 бактерий. Для развития заболевания у иммунокомпрометированных лиц инфицирующая доза может быть значительно меньшей.
Если интенсивность бактериолиза недостаточна, специфический иммунитет отсутствует, а факторы неспецифической защиты желудочно-кишечного тракта несовершенны, сальмонеллы преодолевают эпителиальный барьер тонкой кишки и проникают в толщу тканей (в энтероциты и собственный слой слизистой оболочки кишечника), где захватываются (фагоцитируются) нейтрофилами и макрофагами. Возникает воспалительный процесс во всех отделах ЖКТ (гастроэнтероколитическая форма) [7].
Для развития манифестных форм болезни обязательно проникновение в ЖКТ не только токсинов сальмонелл, но и живых возбудителей. Массивное поступление живых бактерий (при алиментарном пути заражения) сопровождается разрушением их в верхних отделах ЖКТ (в желудке и преимущественно в кишечнике), в результате чего высвобождается большое количество эндотоксина, который, всасываясь в кровь, обусловливает возникновение эндотоксического синдрома, определяющего клиническую картину начального периода заболевания. Сальмонеллы, попадая с током крови в различные органы и ткани, размножаются с формированием септических очагов поражения (септическая форма) [6].
Токсины сальмонелл вызывают активацию синтеза простагландинов и циклических нуклеотидов, что приводит к резкому усилению секреции жидкости и ионов калия и натрия в просвет желудочно-кишечного тракта. Развивается диарея с последующими нарушениями водно-электронного баланса. Общая реакция организма на эндотоксины характеризуется нарушением функционально-адаптивных процессов во многих органах и системах [4; 5].
В связи со снижением эффективности антибиотиков и химиопрепаратов, а также невысокой эффективностью действия пробиотиков в настоящее время чрезвычайно актуальным является сочетанное применение антибиотических и пробиотических препаратов.
Исходя из выше перечисленного перед нами была поставлена следующая цель исследования: определение эффективности совместного применения пробиотиков на основе бактерий рода Bacillus с антибиотиками при экспериментальной инфекции.
Эксперимент выполнялся с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных. В качестве биологического тест-объекта использовали белых половозрелых крыс массой от 180 до 200 граммов. Длительность эксперимента составила 10 дней. В соответствии с поставленными задачами животные разбивались на 14 групп по 9 животных в каждой группе.
Были сформированы группы лабораторных животных: К0 - обычный рацион; К1 - заражение S. enteritidis; К2 - Ветом 2; К3 - Споробактерин; К4 - Бактисубтил; О1 - заражение + Хлорамфеникол; О2 - заражение + Цефотаксим; О3 - заражение + Пенициллин; О4 - заражение + Ветом 2; О5 - заражение + Споробактерин; О6 - заражение + Бактисубтил; О7 - заражение + Ветом 2 + Цефотаксим; О8 - заражение + Споробактерин + Хлорамфеникол; О9 - заражение + Бактисубтил + пенициллин.
Убой животных проводился в количестве трех голов на каждой точке исследований для определения эффективности применения исследуемых препаратов. В качестве точек исследования были установлены следующие сроки: фоновое исследование перед применением препаратов, на пятый и на десятый день после начала эксперимента. Заражение лабораторных животных проводилось однократно перорально по 0,2 мл смыва суточной агаровой культуры возбудителя сальмонеллеза Salmonella enteritidis, содержащей 1,5 × 106 микробных клеток. Введение пробиотиков и антибиотиков проводилось в соответствии с аннотацией к препарату. Введение препаратов в опытных группах проводилось через 12 часов с момента заражения, утром задавались антибиотики, вечером пробиотики.
От исследуемых лабораторных животных брали кровь на морфологический анализ и определение лизоцимной и β-литической активности; экскременты для выделения бацилл и сальмонелл, органы-мишени (кишечник и селезенка) на гистологическое исследование.
Для определения влияния комплексного применения антибиотиков и пробиотиков на основе бактерий рода Bacillus на течение сальмонеллезной инфекции in vivo нами использовались следующие методы: определение колониеобразующих единиц из фекалий экспериментальных животных Bacillus и S. enteritidis; методы общего морфологического и биохимического анализа крови [2]; гистологический метод исследования органов и тканей лабораторных крыс [1].
Для выделения Bacillus из экскрементов применялась среда МПА. Предварительно исследуемый материал подвергался термической обработке путем кипячения в течение 10 минут при 100 °C. Для выделения Salmonella enteritidis использовалась среда ВСА. Данные представлены в таблицах 1 и 2.
Результаты подсчета колониеобразующих единиц Bacillus в экскрементах лабораторных животных, КОЕ
Сроки исследования (2-10 день исследования от начала эксперимента)

Статья просмотрена: 888 раз
Пищевые токсикоинфекции, в том числе и сальмонеллезные, наблюдались с давних пор. Однако до конца ХІХ столетия считали, что в основе этих заболеваний лежит отравление химическими ядами: синильной кислотой, образующейся при известных условиях в мясе, рыбе, сыре; солями меди, поступающими в пищу при обработке продуктов в неподходящей посуде.
Более 120 лет назад Д. Е. Сальмон и Дж. Смит доказали бактериальную природу сальмонеллезов у людей и животных, изолировав от свиньи В. suipestifer. В честь первооткрывателя новая группа микроорганизмов была отнесена к роду Salmonella семейство Enterobacteriaceae.
За минувший период человечество многое прояснило и уточнило в вопросах биологии, патогенеза, лечения и профилактики сальмонеллеза, но, несмотря на это, инфекция продолжает оставаться актуальной как для животноводства, так и для медицинской практики. По данным ВОЗ, 24 страны расположенные в разных регионах, практически одновременно сообщили о резком увеличении числа случаев сальмонеллезной инфекции.
В животноводстве это широко распространенное инфекционное заболевание, которое не только наносит отрасли большие экономические потери, но и делает сельскохозяйственных животных и птицу важнейшим источником возбудителя инфекции для человека [1, 7, 10, 19].
Бактериальная клетка сальмонелл представляет собой прямую, небольшую грамотрицательную палочку с закругленными краями, обладающую дыхательным и бродильным типами метаболизма. Однако морфологические, культуральные, биохимичесие и патогенные свойства сальмонелл напрямую зависят от окружающих внешних условий. Описаны кардинальные изменения формы колоний, антилизоцимной активности, видоизменение клеточной стенки бактерий, способности приобретать или утрачивать те или иные биологические свойства в присутствии неблагоприятных факторов (антибиотики, химические вещества, физические факторы и т.д.). Кроме того, некоторые сероварианты сальмонелл способны перемещаться по поверхности агаровых сред посредством роения. Двигательная активность позволяет бактериям выбирать наиболее благоприятные условия для своей жизнедеятельности [5, 12, 14].
По мнению многих исследователей, борьба с сальмонеллезами и их профилактика значительно осложнена факторами, которые, в первую очередь, связаны с биологическими свойствами бактерии, нарушением технологии содержания животных.
Основные причины: широкая циркуляция многочисленных серовариантов сальмонелл в природе; полидетерминантность факторов патогенности возбудителей; полиэтиологичность заболевания и разнообразие путей внедрения в организм животного; необоснованно широкое применение антибактериальных средств и как следствие – селекция и циркуляция штаммов с множественной лекарственной устойчивостью; ухудшение качества кормов.
Одним из главных факторов затрудняющих профилактику, диагностику и лечение сальмонеллезной инфекции принято считать большую устойчивость и изменчивость сальмонелл во внешней среде, ее огромную адаптивную способность к неблагоприятным факторам. В литературе данные по поводу устойчивости сальмонелл весьма противоречивые, но они позволяют констатировать, что при высушивании погибает 99 % бактерий, остальные выживают. Низкие температуры сальмонеллы переносят хорошо и сохраняют жизнеспособность при температуре -76-100 С 0 , размножаются при 5-47 С 0 , оптимум роста составляет 35-37 С 0 . Большинство сальмонелл проявляют высокую терморезистентность и хорошо переносят присутствие высоких концентраций NaCl, солей висмута, магния. Необходимо учитывать, что наиболее эффективно и полно можно уничтожить сальмонелл во внешней среде, только применяя дезинфицирующие препараты. Наиболее распространенные из них это 0,3% раствор хлорной извести, фенол, формалин, 5% раствор ксилонафта-5. Несомненно, что на эффективность дезинфекции влияет температура активного вещества, концентрация и время контакта с патогенном.
К фактору, затрудняющему профилактику и лечение сальмонеллезов, прежде всего, следует отнести развитие лекарственной устойчивости у бактерий. Человечество, как известно, переживает период массового применения антибиотиков в медицине, ветеринарии и растениеводстве. То есть микроорганизмы практически живут в среде, содержащей антибиотики, которые становятся селективным фактором. Создаются условия для отбора устойчивых мутантов, которые получают селективные преимущества. Среди разных штаммов сальмонелл довольно часто выделяются устойчивые ко многим препаратам (до 10 и более), причем устойчивость сальмонелл выделенных от больных людей и животных намного выше, чем выделенных из внешней среды [2, 4, 13, 19].
Другой особенностью сальмонеллезов является то, что ранее существовало мнение об обязательно высокой (от 100 тыс. до 10 млн. микробных клеток) дозе возбудителя, вызывающей клинические признаки болезни у 20-100 % поголовья животных [7, 15, 17, 18]. Материалы исследования более поздних вспышек, при которых удавалось провести количественный бактериологический анализ, показали, что инфицирующая доза сальмонелл может быть намного меньше и составлять от нескольких сотен и даже десятков микробных клеток [5, 11, 13, 14].
Данные возрастной восприимчивости к сальмонеллезу позволяют говорить о значительном увеличении возраста заболевающих животных. Если раннее под сальмонеллезом понимали болезнь молодняка, то за последнее десятилетие большинство исследователей склонны определять его как заболевание, проявляющееся в любом возрасте. Однако, несомненно, молодые животные остаются в группе повышенного риска заражения, так как в силу анатомических, физиологических, технологических и других особенностей наиболее предрасположены для проникновения в организм патогенных бактерий [9, 16].
Немаловажным, а зачастую и решающим фактором постоянной (стационарной) очаговости сальмонеллеза в хозяйствах является способность длительно персистировать в организме хозяина (от 1 месяца до нескольких лет). Приводится множество данных определяющих сальмонеллезную инфекцию как склонную к внутриклеточному паразитированию [3, 4, 5, 6, 16, 20]. Как правило, сглаженное течение болезни протекает у взрослых животных, переходя в стадию длительного бессимптомного бактерионосительства. Возможно, эта особенность выступает в роли стратегии выживаемости вида. Однако она и способствует постоянной циркуляции патогенна среди поголовья животных.
Данные прошлых лет свидетельствуют о том, что для каждого вида животных типичен свой серовариант сальмонелл вызывающий развитие патологического процесса. Анализ современной литературы и собственные исследования позволяют сделать вывод о том, что в последнее время произошла взаимная приспособляемость серовариантов сальмонелл к другим видам животных. Так, в частности, у свиней основным считался серовариант S. choleraesuis, но все чаще при анализе вспышек сальмонеллеза в свиноводческих хозяйствах выделяют S. typhimurium, S. munhen. S. london и другие нетипичные и иногда редкие сероварианты.
В свете вышеизложенных данных неоспоримым является тот факт, что борьба с сальмонеллезом это трудный и долгий процесс, и, как правило, весьма дорогостоящий но, несмотря на это, имеется реальная возможность для оздоровления хозяйства.
Для этого, наряду с противоэпизоотическими и общесанитарными мероприятиями требуется осуществление строго координированной системы мер, включающей дополнительно широкий комплекс ветеринарно-санитарных и других мероприятий.
В первую очередь необходимо обеспечить: организацию постоянного эпизоотологического мониторинга в хозяйстве, при котором обращают внимание на нарастание частоты выделения сальмонелл от заболевших животных одного и того же сероварианта, появление новых или увеличение числа выделенных штаммов редких серовариантов, увеличение доли штаммов, устойчивых к действию антибиотиков; оптимальные условия содержания животных на всех технологических позициях; обязательную санацию помещений и прилегающей территории; своевременное удаление навоза; обезвреживание боенских отходов; полноценное кормление животных и регулярное контролирование кормов (особенно животного происхождения) на предмет обсеменения сальмонеллами; предупреждение стрессовых ситуаций; карантинирование ввозимых животных; обязательное определение чувствительности конкретного штамма сальмонелл к различным антибиотикам и обработка эффективными антибактериальными препаратами, оптимизация биоценоза кишечника, оптимальные схемы вакцинации и ревакцинации животных в конкретной эпизоотической обстановке.
Только комплексный подход позволит свести до минимума случаи возникновения инфекции и производить свободную от сальмонелл животноводческую продукцию, а значит безопасную для человека.
Список использованной литературы
В статье рассматриваются вопросы диагностики и профилактики сальмонеллезного аборта кобыл, который часто регистрируется на территории Казахстана. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят на 100 голов кобыломаток стабильно снижается. С целью выяснения причины снижения рождаемости жеребят, изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от абортплодов кобыл. Приводятся результаты исследований по изучению культурально – морфологических, биохимических и антигенных свойств эпизоотических штаммов сальмонелл, выделенных от абортированных плодов кобыломаток. Авторами описаны биологические свойства аттенуированного вакцинного штамма, на основе которого изготавливается безопасная, высокоиммуногенная вакцина против сальмонеллезного аборта кобыл. Вакцина прививается жеребым кобылам однократно, продолжительность иммунитета – один год.
Цель – выделение культур из абортированных плодов кобыл, их идентификация на основании изучения биологических свойств, разработка методов специфической профилактики сальмонеллезного аборта кобыл.
Сальмонеллезный аборт кобыл одна из распространенных инфекционных болезней лошадей, наносящая значительный экономический ущерб коневодству республики. Коневодство в Республике Казахстан является важнейшей отраслью животноводства в силу исторически сложившихся условий. В настоящее время по численности поголовья лошадей (1 700 000 гол.) республика занимает одно из первых мест в СНГ. Одной из важнейших мер и основным направлением экономического развития республики является повышение эффективности научных исследований, сокращение сроков внедрения достижений науки в производство. Возникновение, распространение и течение сальмонеллезного аборта кобыл зависят от состояния иммунологической реактивности животных, так как в табунном коневодстве жеребые кобылы являются наиболее зависимыми от факторов внешней среды. В литературе этот вопрос освещен слабо и имеются лишь единичные сообщения об изучении естественной резистентности лошадей [1]. Экономический ущерб складывается из потери воспроизводительной способности конематок, недополучения приплода, снижения продуктивности кобыл и выбраковки животных. Разработка эффективного и экономически обоснованного способа специфической профилактики сальмонеллезного аборта кобыл в республике остается актуальной проблемой ветеринарной науки и практики. Для профилактики сальмонеллезного аборта кобыл имеется аттенуированный коллекционный штамм Salmonella abortus – equi Е-841. Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 не способен вызывать болезнь, но сохранил свойство обусловливать выработку напряженного иммунитета к инфекции. Профилактика сальмонеллезного аборта кобыл основана на вакцинации жеребых кобыл.
Сальмонеллезный аборт кобыл – распространенная болезнь жеребых кобыл, сопровождающаяся преждевременными родами (абортами) и рождением нежизнеспособного плода. Возбудитель Salmonella abortus-equi открыт в 1893 году Smith и Kilborne в Америке, в 1901 году Д.В. Поляковым в России. В литературе иногда встречается под названием Salmonella abortiva-equina (синоним) [2]. Аборты могут принимать массовый характер, в табуне абортируют до 80 % кобыл. У больных сальмонеллезом кобыл изредка рождаются больные жеребята, у которых болезнь сопровождается бактериемией, тяжелым токсикозом, истощением, приводящим к гибели. Первые сведения по эпизоотологии болезни в республике были опубликованы в 1940 и 1950 годах, из которых вытекает, что инфекционные аборты среди кобыл в Казахской ССР регистрировались с начала 30-х годов прошлого века. В разные годы аборты кобыл достигали 6 – 30 %, из них свыше 50 % сальмонеллезной этиологии. В 1970 и 1971 годах в хозяйствах республики регистрировались массовые аборты сальмонеллезной этиологии: так в Енбекши-Казахском районе Алма-Атинской области аборты отмечены у 44 % конематок, Нарынколском районе – 20-40 %; Чиликском районе – 30 % конематок абортировало; Аксуском районе Талды-Курганской области – 43 %; Капальском и Каратальском районах отмечались аборты сальмонеллезной этиологии. В 1969 – 1974 годах аборты отмечались в хозяйствах Восточно-Казахстанской (около 40 %), Жамбылской (20 %), Кызылординской (до 25 %) областях. В 1981 году в хозяйствах Мангыстауской области из 1000 кобыл абортировало 384 (38, 4 %). В декабре 1985 года в Атырауской области из 260 жеребых кобыл абортировало 155 (59, 5 %).
В настоящее время в связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [3]. Мониторинговыми исследования установлено, что с 2010 по 2015 годы выход жеребят стабильно снижается – 59/100; 56/100; 53/100; 50/100; 45/100 голов кобыломаток соответственно. С целью выяснения причины такого снижения рождаемости жеребят нами изучена эпизоотическая ситуация по сальмонеллезному аборту кобыл в хозяйствах Алматинской области. При вспышках болезни проводили выделение возбудителя инфекции от плодов абортировавших кобыл.
В Алматинской области расположены 16 районов, во всех районах области разводятся лошади, в том числе племенные. На 10 июля 2015 г. в области содержатся 288592 головы лошадей. Наибольшее количество животных сосредоточено в частных подворьях населения (641 836 голов). В хозяйствах населения области находятся 150720 голов лошадей, в крестьянских и фермерских хозяйствах находятся 143404 головы, а в сельхозпредприятиях содержится 16 500 голов лошадей. Выход жеребят по области на 100 кобыломаток составляет не более 50. Ситуация осложняется тем, что наибольшее количество лошадей сосредоточено в хозяйствах и частных подворьях населения, где не ведется учет заболеваемости животных. Частные владельцы зачастую скрывают случаи абортов у кобыл.
В 2015 году в Алматинской области получено 64915 жеребят. Наибольшее количество лошадей находится в Кербулакском, Жамбылском и Райымбекском районах. Однако в них выход жеребят в среднем составляет 45 %. Например, в Енбекшиказахском районе в текущем году получено 2281 жеребенок, что составляет всего 34 %, в Кербулакском районе в текущем году получено 3978 жеребят, что составляет всего 41 %, в Жамбылском – 45 %, в Саркандском районе – 43 %, в Балхашском районе – 52 %, в Райымбекском – 56 %. В связи с тем, что основное поголовье лошадей от общего числа в республике сосредоточено в личных подворьях граждан и фермерских хозяйствах, возросла актуальность профилактики сальмонеллезного аборта кобыл, а также ведения статистического учета заболеваемости [4].
Материалы и методы исследования
Отбор проб из паренхиматозных органов абортплода кобылы приведен на рис 1.

Рис. 1. Отбор проб от абортплода кобылы для бактериологических исследований
Результаты исследования и их обсуждение
Диагностика заболевания осуществляется на основании клинико-эпизоотологических, патологоанатомических данных, а также результатов бактериологического и серологических исследований. Посевы из патологического материала делали на МПА, МПБ, среды Клиглера и Эндо, висмут – сульфитный агар из печени, сердца, селезенки, костного мозга из бедренной кости плода. От всех абортированных плодов выделили культуру сальмонелл, которую затем дифференцировали по культурально – морфологическим, биохимическим и антигенным свойствам [4]. На питательных средах отмечался обильный рост сальмонелл. На МПА росли круглые, блестящие, выпуклые влажные колонии с голубоватым оттенком, на среде Клиглера – ярко-желтые круглые колонии, на агаре Эндо – типичные колонии светло-розового цвета, на висмут-сульфитном агаре –бесцветные блестящие колонии. При микроскопии окрашенных по Граму мазков наблюдались полиморфные грамотрицательные мелкие палочки с закругленными концами. Культура агглютинировалась в РА (реакции агглютинации) на стекле с поливалентной и монорецепторными сыворотками производства Краснодарской биофабрики. Все выделенные культуры агглютинировались сыворотками О – IV (++++), ХII (+++), H – enx (++++) [5].
При посеве культур уколом на ПЖА наблюдалась характерная подвижность сальмонелл (подвижные палочки). Выделенные культуры идентифицировали методом изучения биохимических свойств путем культивирования на среде Гисса. Все культуры были идентичны и не изменяли инозит, глицерино – фуксиновый бульон, раффинозу, салицин; сероводород не образовывали (этот признак отличает Salmonella abortus-equi от других сальмонелл) и не продуцировали индола; ферментировали глюкозу, маннит, арабинозу, дульцит, ксилозу, рамнозу, галактозу. Для выявления протеолитической способности испытуемые штаммы засевали на МПЖ. В пробирках, где под действием ферментов бактерий проиcходил протеолиз желатина, среда разжижалась. При постановке биопробы на белых мышах гибель животных наступалв на 3-4 сутки после заражения.
На основании клинико-эпизоотологических данных, изучения культурально – морфологических, тинкториальных, биохимических и антигенных свойств выделенные эпизоотические штаммы сальмонелл отнесены к Salmonella abortus-equi. Во всех случаях возбудителем аборта у кобыл являлась Salmonella abortus-equi. По культурально – морфологическим, биохимическим и антигенным свойствам штаммы были идентичны выделенным эпизоотическим изолятам сальмонелл, выделенным ранее и эталонному коллекционному штамму Salmonella abortus-equi 7/1.
Проводили электронную микроскопию сальмонеллезной культуры, приготовленную из суточной агаровой культуры Salmonella abortus-equi. Бактериальную взвесь (концентрация 500 млн микробных клеток/см3 по оптическому стандарту ГИСК (Государственный институт стандартизации и контроля им. Л.А. Тарасевича) наносили пастеровской пипеткой на парафин в чашке Петри. При нанесении на парафин капля взвеси принимала округлую форму и не растекалась (всего 2–3 капли). Затем методом флотации погружали специальную золотистую сеточку в каплю суспензии сальмонелл на 1 минуту. Чашку Петри с сеточкой, на которой находилась бактериальная взвесь, закрывали на 24 часа и оставляли для высушивания. Через сутки капля микробной суспензии высыхала. Высохшую каплю контрастировали следующим образом: через сутки на парафин в чашке капали каплю контрастера – 2 % раствор фосфорно – вольфрамовой кислоты (ФВК) пастеровской пипеткой, сеточку топили в капле подложкой вверх. Контрастировали 1,5–2 минуты. Затем сеточку пинцетом аккуратно вынимали, удаляли лишнюю жидкость прикосновением фильтровальной бумаги. Сеточку промывали от контрастера дистиллированной водой из шприца (очень осторожно). Сеточку с бактериальной взвесью сушили в контейнере 7 суток. После высушивания препарат был готов для просмотра под электронным микроскопом.
Электронный снимок Salmonella abortus-equi представлен на рис. 2.
На рис. 2 представлена бактериальные клетка из одного клона (популяция из одной клетки без предварительной конъюгации). Стационарная фаза. На цельной клетке сальмонелл виден обрывок перитрихиально расположенного жгутика. Также видна трехслойная клеточная мембрана (наружный слой клеточной стенки). В центральной части клетки расположен нуклеоид большой величины. Зона нуклеоида заполнена фибриллярным компонентом. Вблизи нуклеоида локализованы клеточные включения округлой формы. Включения имеют мелкозернистое строение и ограничены от цитоплазмы мембраной. По всей цитоплазме расположены мелкие внутриклеточные включения. Увеличение х 80 000.
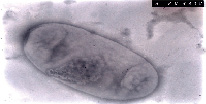
Рис. 2. Электроннограмма штамма Salmonella abortus-equi
Таким образом, выделенная культура сальмонелл была идентифицирована как Salmonella abortus-equi.
Профилактика Патентный поиск показал, что в Америке и в странах Европы не разработаны и не применяются вакцины против сальмонеллезного аборта кобыл. В Якутии применяется инактивированная формолквасцовая инактивированная вакцина против сальмонеллезного аборта кобыл с иммуномодулятором, адаптированная для местной породы лошадей [6, 7]. В Якутии также разработана и применяется ассоциированная убитая вакцина против ринопневмонии и сальмонеллезного аборта кобыл [8, 9]. Для повышения эффективности ассоциированной вакцины и повышения иммунобиологической реактивности организма к вакцине в качестве иммуномодулятора добавляют культуральную жидкость бульонной культуры штамма бактерий Bacillus subtilis ТНП-3 ДЕП, выделенного из мерзлото-переходной почвы [9]. Нами разработана и успешно апробирована на жеребых кобыломатках вакцина сухая живая против сальмонеллезного аборта кобыл из штамма Salmonella abortus – equi Е-841. Вакцинный штамм был получен методом отбора клонов, аттенуированных под влиянием химического мутагена- нитрофуранов с последующей селекцией мутантов. Штамм В-0147 Salmonella abortus – equi Е-841 утратил абортогенные свойства, имеет умеренную остаточную вирулентность (вирулентность штамма снижена в 20 раз по сравнению с природным прототипом), обладает высокой иммуногенностью. Вакцинный аттенуированный штамм обладает типичными для Salmonella abortus – equi культуральными, биохимическими и антигенными свойствами. Существенным отличием штамма В-0147 Salmonella abortus – equi Е-841 от вирулентного прототипа является ауксотрофность в отношении тиамина и никотиновой кислоты; штамм образует аргинин – декарбоксилазу и слабо – лизин–декарбоксилазу.
Вакцинный штамм В-0147 Salmonella abortus – equi Е-841 депонирован нами в Республиканской коллекции микроорганизмов (РКМ) в Национальном референтном центре по ветеринарии (коллекционный номер В-0088), г. Астана. В РКМ депонирован также контрольный (вирулентный) штамм Salmonella abortus – equi коллекционный номер В–0099), выделенный нами из абортированного плода – жеребенка в 2005 году в Алматинской области. Штамм применяется для контроля иммуногенной активности вакцины против сальмонеллезного аборта кобыл.
Вакцинный аттенуированный штамм сохраняет слабую остаточную вирулентность и не реверсирует при пассировании на восприимчивых животных (белые мыши, куриные эмбрионы). Утрата штаммом абортогенных свойств подтверждается опытами вакцинопрофилактики лиофилизированной культурой глубоко жеребых кобыл (за 2-3 месяца до выжеребки) в дозе 1,2–1,5 млрд живых м. к. (микробных клеток). Вакцинация жеребых кобыл в период 4-7 месячной жеребости проводится с профилактической целью однократно. Жеребята и молодняк прививаются по показаниям. Вакцина сообщает привитым животным иммунитет высокого напряжения. Поствакцинальная реакция у лошадей характеризуется образованием агглютининов в высоких титрах (1: 3200) и повышением количества лейкоцитов в крови.
Местная реакция проявляется в виде болезненного отека на месте введения вакцины, который рассасывается в течение 3-5 суток. Общая реакция у части кобыл характеризуется кратковременным повышением температуры и умеренным угнетением в течение первой половины суток. Аппетит у всех животных в период наблюдения сохраняется.
Вакцинальная культура высевается из органов и крови белых мышей в течение 20 суток, из селезенки и лимфатических узлов до 25 суток; от морских свинок в течение двух недель. Подкожная иммунизация морских свинок не вызывает микроскопических изменений. Сухая вакцина соответствует современным отечественным и международным стандартам: малые дозы, умеренная реактогенность, высокая иммунизирующая активность, экономичность, эффективность, удобство при транспортировке.
Отзывы специалистов опытных хозяйств свидетельствуют о безопасности и высокой эффективности вакцинации жеребых кобыл.
Заключение
На основании бактериологических, биохимических, серологических (антигенной структуры) исследований культур, выделенных из абортплодов кобыломаток, установлено, что причиной абортов у кобыл явился сальмонеллезный аборт кобыл, вызванный Salmonella abortus-equi. Систематические прививки живой вакциной из штамма В-0147 Salmonella abortus – equi Е-841 обеспечивают защиту животных от абортов сальмонеллезной этиологии, увеличивают выход жеребят, надои молока, в результате чего хозяйства получат большой экономический эффект. Вакцина в 100 % случаев защищает опытных кобыл от сальмонеллезного аборта. Иммунитет у привитых животных сохраняется в течение года.
Читайте также:


