Какая среда для стафилококков благоприятная
Роль стафилококков в возникновении пищевых отравлений впервые определил П. Н. Лащенков (1901). Он выделил стафилококки из тортов с кремом, послуживших причиной заболевания людей.
Наиболее благоприятной средой для развития стафилококков являются молочные продукты, кондитерские изделия с кремом, мясопродукты, паштеты, салаты и т.д.
Источниками заражения пищевых продуктов патогенными стафилококками являются человек и животные. Наиболее частый путь заражения продуктов - воздушно-капельный, поскольку больные стафилококковыми заболеваниями верхних дыхательных путей (ангины, риниты, фарингиты) активно выделяют их в окружающую среду при дыхании, кашле, чихании.
Одним из опасных источников обсеменения продуктов - больные со стафилококковыми поражениями кожи (нагноившиеся порезы, ожоги, ссадины, абсцессы и др.). В этом случае обсеменение продуктов происходит при непосредственном соприкосновении их с пораженными органами или через загрязненные стафилококками оборудование, инвентарь, посуду.
Большое эпидемиологическое значение в распространении стафилококковых пищевых заболеваний имеют люди - бактерионосители. В носоглотке почти каждого второго здорового человека обнаруживается патогенный стафилококк.
Инкубационный период при стафилококковых интоксикациях обычно составляет 2-4 ч. Внезапно наступают тошнота, рвота, появляются понос, боли в животе, слабость. Температура тела повышается редко. Продолжительность заболевания 1-2 дня.
Профилактика стафилококковых токсикозов сводится к проведению мероприятий, исключающих возможность попадания возбудителей в пищевые продукты, и созданию условий, задерживающих развитие стафилококков и накопление энтеротоксина в продуктах.
К мероприятиям, предупреждающим обсеменение патогенными стафилококками пищевых продуктов, относятся своевременное выявление лиц с гнойными воспалительными процессами кожи, верхних дыхательных путей и отстранение их от работы с готовой пищей. С этой целью на пищевых предприятиях проводятся осмотры рук, кожных покровов. Особое место в профилактике токсикозов принадлежит мероприятиям по улучшению санитарного режима предприятий и соблюдению правил личной гигиены (особенно лицами, занятыми изготовлением готовых кулинарных и кремовых изделий), а также систематическому повышению гигиенических знаний по вопросам профилактики пищевых отравлений.
Чрезвычайно важно создать условия, препятствующие образованию энтеротоксина в пищевых продуктах: хранить продукты и готовые изделия на холоде и соблюдать сроки их реализации.
Отравления стафилококком можно избежать, придерживаясь определённых правил:
- если покупаете продукты, срок хранения которых от нескольких часов до нескольких суток (кремовые кондитерские изделия, салаты, субпродукты, кисломолочные продукты), постарайтесь быстро их употребить в пределах соблюдения установленных сроков их реализации и предусмотрите временное хранение данных продуктов в холодильнике при температуре не выше +6 °С;
- при покупке продуктов обязательно проверте их внешний вид, свежесть, отсутствие первичных признаков порчи и дефектов;
- не рекомендуется употреблять в пищу блюда, не прошедшие полную термическую обработку; следует нагревать их очень тщательно;
- нельзя повторно замораживать продукты, так как у размороженных продуктов идёт бурное обсеменение с воздуха микробами, в том числе стафилококком, поэтому мясо и птицу размораживают только перед приготовлением блюда.
Программа производственного контроля распространяется на структурные подразделения организации и обязательна к применению в области производственного контроля за соблюдением санитарных правил и выполнением санитарно-противоэпидемических (профилактических) мероприятий. Должностные лица (начальники структурных подразделений организации) обязаны осуществлять общий контроль за выполнением санитарно-противоэпидемических (профилактических) мероприятий по обеспечению безопасных для человека условий труда и требований санитарных.
Адрес: 390046, Рязанская область, город Рязань, ул. Свободы, дом 89
федеральная служба по ветеринарному и фитосанитарному надзору
Стафилококк в йогурте
5 июня 2014 г. — ФГБУ Ставропольская МВЛ|
Staphylococcus aureus (золотистый стафилококк) - это весьма распространенный микроорганизм имеющий несколько видов, большинство из которых образует золотистый пигмент. Некоторые виды золотистого стафилококка могут служить причиной тяжелых пищевых отравлений, так как продуцируют опасное токсическое вещество – энтеротоксин, являющийся непосредственной причиной интоксикации. В настоящее время установлено шесть серологических типов стафилококковых энтеротоксинов: А, В, С, D, Е, F. Staphylococcus aureus – очень распространен, и его можно найти повсюду. Особенно благоприятны в качестве условий для его размножения пищевые продукты – молоко, мясо. Очень устойчив к любым условиям и способен выживать в замороженных продуктах в течение полугода. Стафилококк не боится кислой среды, высокой температуры, щелочей. Для того чтобы нейтрализовать заражение, нужен долгий процесс кипячения или прожаривания при температуре не ниже 75-80 градусов. Излюбленной средой для размножения Staphylococcus aureus является молоко и все молочные продукты, именно молоко чаще всего становится источником токсикоинфекции. Микроорганизмы могут размножиться при температуре от 16-18 до 37-40 градусов, для осеменения молочного продукта порой достаточно 4-5 часов. Энтеротоксин вырабатывается, как правило, в продуктах, изготовленных из некипяченого или непастеризованного молока. Источником заражения является свежая брынза, сырковая масса, сметана, сыры, изготовленные с помощью сычужного фермента. Также опасны все сладкие кондитерские изделия с кремовой прослойкой, особенно с заварным кремом на молоке. Сахар, влажная молочная среда, крахмал – это благоприятные условия для жизнедеятельности стафилококка. Образование энтеротоксина возможно также в кипяченом и пастеризованном молоке. Известны случаи отравлений мороженым, изготовленным из молока, содержащего энтеротоксин. Реже стафилококк осеменяет мясо и мясные продукты. Он поражает больных животных с ослабленной иммунной системой или размножается на мясной пище, хранящейся в ненадлежащих условиях. Органолептические свойства молочных, мясных или овощных блюд, осемененных стафилококком, не меняются, поэтому на вкус и запах пища абсолютно не отличается от здоровой, незараженной. Источником заражения пищевых продуктов патогенными стафилококками является человек. Наиболее частый путь заражения продуктов - воздушно-капельный, поскольку больные стафилококковыми заболеваниями верхних дыхательных путей активно выделяют их в окружающую среду при дыхании, кашле, чиханье. Опасным источником обсеменения продуктов являются работники со стафилококковыми поражениями кожи которые контактным путем загрязняют стафилококками оборудование, инвентарь, посуду. Источником стафилококковой инфекции являются также животные, больные маститом и другими воспалительными заболеваниями. Продукты животного происхождения могут заражаться стафилококками при жизни животных (молоко при мастите вымени) или при разделке туши. К профилактическим мероприятиям, предупреждающим обсеменение патогенными стафилококками пищевых продуктов, относятся своевременное выявление лиц с гнойными воспалительными процессами кожи, верхних дыхательных путей и отстранение их от контакта с пищевыми продуктами. Особое место принадлежит соблюдению правил личной гигиены работниками, занятыми изготовлением готовых кулинарных и кремовых изделий. Чрезвычайно важным является создание условий, препятствующих образованию энтеротоксина в пищевых продуктах. Для хранения оптимальной является температура 2-4 °С, при которой не происходят размножение и накопление энтеротоксина. Большое значение имеет также соблюдение установленных сроков реализации скоропортящихся продуктов. Не менее важно в профилактике стафилококковых токсикозов обеспечение высокого санитарного уровня, благоустройства и механизации производственных процессов, а также систематическое повышение гигиенических знаний по вопросам профилактики пищевых отравлений. Золотистый стафилококк (Staphylococcus aureus) является главной патогенной бактерией в клинической области и в пищевой промышленности. Внутрибольничные инфекции, вызванные S. aureus, создают увеличивающееся число проблем. Поэтому становится более важной задлачей обнаружение S. aureus, и в частности метициллин-резистентного S. aureus (MRSA). Обычные среды для обнаружения S. aureus являются маннито-солевым агаром (названный Агаром Чапмана в Европе). У этой среды, основанный на повышенной солености и брожении маннита, есть чрезмерное количество ложно-положительных и ложно-отрицательных результатов. CHROMagar Staphylococcus aureus является отборной хромогенной средой c высокой спецификой и высокой чувствительностью. Другой обычной средой для обнаружения S. aureus является Кровяной агар, который требует утомительной и дорогостоящей экспертизы с иммунологическими тестами 5-10 колоний на подозреваемом образце. С другой стороны, CHROMagar Staphylococcus aureus более удобен и более эффективен, чем обычные методы благодаря устранению ложно-положительных результатов. Используя CHROMagar Staphylococcus aureus, будет достаточно проверить единственную колонию с типичным цветом для дальнейшей идентификации и обнаружения S. aureus с высокой вероятностью. Артикул (Кат. №) TA670: банка, кол-во порошка для приготовления 1000 мл, Хранение Состав (г/л) Инокуляция Интерпретация ТОЛЬКО ДЛЯ ИН-ВИТРО ДИАГНОСТИКИ. Приготовление Рабочие характеристики и ограничения Примечание: для прямого выявления MRSA можно использовать селективную среду CHROMagar™ MRSA. Утилизация отходов
Основными источниками обсеменения стафилококками пищевых продуктов являются люди и животные с гнойно-воспалительными процессами (абсцессы, фурункулы, гнойные раны и др.), а также носители этих микроорганизмов. Перенос стафилококков от людей на пищевые продукты может происходить воздушно-капельным путем, при непосредственном контакте людей с продуктами, оборудованием, в процессе убоя скота и разделки туш. Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются [2]. Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%. Некоторые микроорганизмы (В. сеreus, дрожжи из рода Саndidа и др.) оказывают на стафилококки стимулирующий эффект (они усиливают образование энтеротоксина). Энтеротоксин стафилококков обладает высокой термоустойчивостью. Инактивирование (разрушение) токсина происходит только через 2,5–3 часа кипячения. При автоклавировании (120°С) токсин разрушается через 20 мин. При благоприятных температурных условиях энтеропатогенные стафилококки быстро размножаются в продуктах и продуцируют токсин. Пищевые токсикозы, вызванные энтеропатогенными стафилококками, протекают в форме острого гастроэнтерита, сопровождающегося рвотой, реже диареей, головной болью. Инкубационный период очень короткий – от 30 мин до 6 ч. Длится заболевание один, реже – два, три дня [1]. Выявление и определение количества этих микроорганизмов в пищевых продуктах проводят в соответствии с ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus. Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды [4]. Метод определения наиболее вероятного числа (НВЧ) коагулазоположительных стафилококков и S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см Метод определения количества коагулазоположительных стафилококков и S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus. При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам. Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду [6]. Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях. Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды [3]. Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого, яично-желточно-азидного, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок после 24 ч и все оставшееся пробирки после 48 ч. Чашки Петри с посевами инкубируют при температуре 37°С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности) [7]. На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма). Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы. Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены"[5]. Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus. Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670. Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus [4]. Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри. Аналогично проводят посев десятикратных разведений испытуемого продукта. Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч. Количество коагулазоположительных стафилококков в 1 см При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам. Количество S. aureus в 1 см При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред [6,7]. Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия. В 10 см модифицированного Жиолитти-Кантони бульона нормальной концентрации или сред вносят 1 см Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1 [3]. Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева. Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч [2]. Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Пересевы проводят также из пробирок, в которых нет видимых признаков роста. Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч. После 24 ч инкубирования чашек Петри по отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний [1]. На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию. Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях [5]. Определение образования ацетоина (реакция Фогес-Проскауера). Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. После инкубирования посевов к 1 см Определение ферментации мальтозы в аэробных условиях. Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus. Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется. S. aureus ферментирует мальтозу в аэробных условиях [4]. Оценка результатов подтверждения принадлежности коагулазоположительных стафилококков к S. aureus. Если коагулазоположительные стафилококки образуют ацетоин и сбраживают мальтозу в аэробных условиях, то считают, что выявленные коагулазоположительные стафилококки относятся к S. aureus. Для биохимической идентификации допускается использование тест-систем промышленного производства, зарегистрированных на территории государства, принявшего стандарт. Оценка результатов посевов в жидкие среды. При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus [6]. Результаты выявления коагулазоположительных стафилококков или S. aureus записывают: обнаружены (не обнаружены) в 1 г (см3) продукта; масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus.
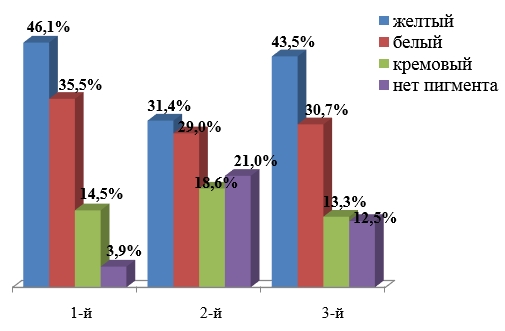
Цель. Изучение таксономической структуры микробиоценоза слизистой оболочки переднего отдела носа является одним из важнейших этапов его микроэкологической характеристики. Исходя из этого положения, представлялось важным изучение характера доминирования отдельных видов стафилококка в биотопе слизистых оболочек переднего отдела носа у детей, проживающих в районах с различной антропогенной нагрузкой. Известно, что в состав микробиоценоза слизистой оболочки переднего отдела носа входят популяции различных видов микроорганизмов, но у детей доминируют представители кокковой микрофлоры, в основном различные виды рода Staphylococcus. Слизистая оболочка носа является основным биотопом стафилококка, где его персистенция протекает в виде бактерионосительства [1,4]. По мнению Д.Г. Дерябина [1], основными источниками стафилококковой инфекции являются носители, рост числа которых прямо пропорционально зависит от подъема заболеваемости. Материалы и методы. Для анализа характеристики структуры стафилококка проводился отбор проб со слизистой оболочки переднего отдела носа у 521 ребенка в возрасте 8–12 лет. Обследуемые дети проживали в трех районах г. Красноярска с разной экологической обстановкой: 1 – Октябрьский (экологическая обстановка удовлетворительная), 2 – Кировский (экологическая обстановка неудовлетворительная), 3 – Советский (экологическая обстановка неудовлетворительная). Обсуждение результатов. Проведенные микробиологические исследования показали, что у 454 (87,1 %) из 521 обследованного ребенка со слизистой оболочки переднего отдела носа высевалась кокковая микрофлора – представители рода Staphylococcus, у 38 (7,3 %) обследованных – палочковидная микрофлора и 29 (5,6 %) ребенка при первичном посеве рост отсутствовал. У большинства обследованных детей, проживающих в Красноярске, со слизистой оболочки переднего отдела носа высевались коагулазоположительный золотистый стафилококк (58,6 %), коагулазоотрицательный эпидермальный стафилококк (16,5 %) и в 6,1 % случаях был идентифицирован коагулазоположительный S.intermedius. Распределение по районам проживания детей выглядело следующим образом. В первом районе золотистые стафилококки высевались в 37,6 % случаев, эпидермальный стафилококк – в 11,9 % и S.intermedius – в 8,4 %. Во втором и третьем районах превалировал S.aureus – 63,2 и 56,8 % соответственно; S. epidermidis встречался в 17,0 и 16,5 % случаев соответственно, S. intermedius регистрировался у 4,4 % обследованных из второго района и у 6,1 % из третьего. Другие коагулазоотрицательные представители рода Staphylococcus представлены следующими видами: S. hyicus, S. xylosus, S. saprophyticus, S. capitis, S. caprae, S. warneri, S. hemolyticus, S. cohnii, S. simulans и высевались в 13,4 % случаев. Соотношение штаммов данных видов стафилококка, выделенных со слизистой оболочки переднего отдела носа у детей города Красноярска, представлено в таблице 1. Из данных таблицы следует, что помимо коагулазоотрицательных S.epidermidis на слизистой оболочки переднего отдела носа у детей города Красноярска встречаются S. saprophyticus (7,3 %), S. hyicus (2,3 %), S. capitis (1,1 %) и в менее 1 % случаев S. xylosus, S. caprae, S. warneri, S. hemolyticus. Распространенность коагулазоотрицательных культур стафилококка в зависимости от района выделения выглядит следующим образом. Во всех трех исследуемых районах на слизистой оболочке носа у детей из КОС преобладал S. saprophyticus, в первом районе данный вид стафилококка встречался в 4,9 %, во втором высевался у 8 % обследуемых, и в третьем районе у 9,3 %. Кроме S. saprophyticus, в первом районе микробиоценоз верхних дыхательных путей у детей был представлен S. hyicus (4,9 %), S. capitis (3 %), S. xylosus (2 %), S. hemolyticus (1,5 %), S. caprae, S. simulans (1 %) и в менее 1 % случаев встречались S. warneri и S. cohnii. Микробиоценоз слизистой оболочки верхних дыхательных путей у детей, проживающих во втором исследуемом районе, был представлен S. hyicus (1,5 %) и S.warneri (0,7 %). В третьем исследуемом районе микробиоценоз слизистой оболочки носа у детей был менее разнообразен и помимо S. saprophyticus из КОС другие виды не регистрировались. Таким образом, микробиоценоз верхних дыхательных путей у детей, проживающих в первом исследуемом районе, более разнообразен и представлен 12 видами стафилококка, во втором и третьем районах количество встречаемых видов стафилококка значительно меньше – 6 и 4 соответственно. Соотношение штаммов разных видов коагулазоотрицательных стафилококков (КОС) в зависимости от района выделения Исследования последних лет свидетельствуют о том, что загрязнение окружающей среды приводит не только к широкому распространению экологически обусловленных заболеваний, угнетению иммунобиологической реактивности организма, нарушению репродуктивной функции и другим многочисленным негативным сдвигам в состоянии здоровья макроорганизма [1,2,4], но к качественному и количественному изменению микрофлоры организма человека [3,4]. В частности, по мнению Б.А. Шендорова (1998), различные поллютанты в порядке индукции защитных реакций у микробов могут вызывать существенные изменения в их патогенности. Поэтому изучение свойств патогенности у золотистых стафилококков, колонизирующих слизистые оболочки такого слабо адаптированного контингента, как младшие школьники, имеет важное научно-практическое значение [4]. Для более полной оценки микроэкологической характеристики биоценоза очень важно исследовать биологические свойства отдельных штаммов микроорганизмов, входящих в этот биоценоз. На первом этапе бактериологического исследования при индикации стафилококков обращали внимание на пигментообразование колоний. Большинство исследуемых штаммов S.aureus синтезируют пигмент: белый – 31,6 %, желтый – 41,0 %, кремовый – 14,6 % и только 12,8 % колоний стафилококка пигмента не имели. Распределение пигментообразования у культур золотистого стафилококка в зависимости от района выделения выглядело следующим образом: во всех трех исследуемых районах города Красноярска преобладали культуры стафилококка, продуцирующие желтый пигмент (46,1, 31,4 и 45,3 % соответственно), продукция белого пигмента была характерна для 35,5 % культур стафилококка, встречающихся в микробиоценозе слизистой оболочки носа у детей, проживающих в первом исследуемом районе, и в 29,0 и 30,7 % у культур, выделенных во втором и третьем районах соответственно. Наличие кремового пигмента или отсутствие пигментирования у культур золотистого стафилококка встречалось реже. Во втором исследуемом районе у 21,0 % изученных культур отсутствовало пигментообразование, в третьем районе таких культур было 12,5 %, а в первом только у 3,9 % выделенных культур золотистого стафилококка наличие пигмента не регистрировалось. Возможно, пигментообразование зависит от генотипа S.aureus, детерминирующего синтез различных реакций, а вместе с ним – цвет пигмента. Таким образом, большинство изученных культур золотистого стафилококка (87,2 %), входящих в состав микробиоценоза слизистой оболочки верхних дыхательных путей у детей города Красноярска, продуцировали тот или иной пигмент (рисунок).
Частота пигментообразования штаммов стафилококка, выделенных со слизистой оболочки носа детей, проживающих в районах с различной антропогенной нагрузкой, % Среди косвенных индикаторов патогенности большое значение имеют скорость и интенсивность биосинтетических и репродуктивных процессов. Частота появления дочерних клеток, характер их деления и накопления в пространстве отражается на размере и плотности грозди микроорганизмов. Для патогенных штаммов характерно быстрое деление и наличие мелких бактериальных клеток с одновременным формированием весьма массивных гроздей. По мнению авторов [1,4], подобное состояние микробного сообщества типично для микроорганизмов в неблагоприятных условиях, когда идет борьба за сохранения вида. В благоприятной обстановке, напротив, биосинтетические процессы в популяции протекают спокойно, полноценно, ускоренного преждевременного деления клеток нет, поэтому грозди малокомпонентны, микробные особи довольно крупные. Используя окуляр и объектив микрометра, были проведены замеры особей в гроздях, учитывая компонентность последних. Анализ полученных данных показал, что размеры клеток стафилококка и объемы гроздей варьируют в достаточно широких пределах в зависимости от района выделения. В первом исследуемом районе преобладали штаммы золотистого стафилококка, имеющие крупные клетки более 1,0 мкм в диаметре – 55,3 %; 36,8 % культур имели средние размеры микробных клеток (0,5–1,0 мкм в диаметре) и только у 7,9 % исследуемых культур S. aureus, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в первом исследуемом районе, имело клетки менее 0,5 мкм в диаметре, т.е. были мелкие. Во втором исследуемом районе со слизистой оболочки переднего отдела носа у детей выделялись культуры золотистого стафилококка среднего (60,4 %) и мелкого размера (24,5 %), 15,1 % исследуемых культур имели диаметр бактериальных клеток более 1,0 мкм. В третьем исследуемом районе более 50 % изученных культур золотистого стафилококка имели мелкие размеры (51 %), средними размерами обладали 40,3 % культур, и только 8,7 % бактериальных клеток имели крупные размеры (более 1,0 мкм). Изучив такой показатель, как объем формирующейся грозди стафилококковых культур, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в трех исследуемых районах города Красноярска, получили следующие результаты. В первых двух исследуемых районах преобладали грозди культур стафилококка средние (67,1 и 68,6 % соответственно), а в третьем районе – крупные (51, %). В первом исследуемом районе крупные бактериальные грозди регистрировались у 11,8 % изученных культур, а во втором районе у 18,6 %. В третьем районе в 40,3 % встречались клетки стафилококка, имеющие средние объемы, и в 8,7 % – мелкий. Заключение. Таким образом, со слизистой оболочки носа у детей, проживающих в первом исследуемом районе, выделялись культуры S. aureus, имеющие крупные размеры бактериальных клеток и средние объемы грозди. Во втором исследуемом районе преобладали культуры более мелкие в диаметре и имеющие средние объемы. В третьем же районе выделенные культуры стафилококка были мелкие и имели крупные объемы грозди, что характерно для патогенных штаммов. Анализ данных количественной характеристики стафилококкового сообщества слизистой оболочки переднего отдела носа у детей, проживающих в исследуемых районах, показал, что к числу свойств, влияющих на формирование микробного биоценоза, а также определяющих потенциальную эпидемиологическую опасность штаммов, относится показатель микробной обсемененности. Полученные данные свидетельствуют о высокой микробной обсемененности стафилококком слизистой оболочки переднего отдела носа у детей (103-104 КОЕ/мл), при которой происходит массивное выделение возбудителя во внешнюю среду, а носители являются основными источниками распространения стафилококков среди восприимчивых лиц в человеческой популяции. Высокая микробная обсемененность (более 50 %) наблюдалась в посевах со слизистой оболочки носа у детей, проживающих во втором и третьем исследуемых районах (63,2 и 56,8 % соответственно), тогда как в посевах со слизистой оболочки носа у детей, проживающих в первом районе, высокая микробная обсемененность составила лишь 37,6 %. В посевах со слизистой носа наблюдался у 29,2 % детей из первого района незначительный рост (101-102 КОЕ/мл), у 33,2 % обследуемых детей рост культуры стафилококка отсутствовал. Во втором исследуемом районе при первичном посеве со слизистой оболочки переднего отдела носа у детей незначительный рост наблюдался у 31,6 % и у 5,14 % обследованных рост отсутствовал. Исследования, проводимые в третьем районе, показали, что у 7,6 % обследованных рост при первичном посеве со слизистой носа отсутствовал, а у 35,5 % при посеве исследуемого материала обсемененность была незначительной. Результаты исследования представлены в таблице 2. Микробная обсемененность стафилококком слизистой оболочки переднего отдела носа у детей, проживающих в экологически неравнозначных районах, % Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|